
PRISMASOL


Come usare PRISMASOL
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
| mmol/l | mEq/l | |
| Calcio Ca2+ Magnesio Mg2+ Sodio Na+ Cloro Cl- Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 1,75 0,50 140,00 111,50 3,00 32,00 2,00 6,10 | 3,50 1,00 140,00 111,50 3,00 32,00 2,00 |
| Osmolarità teorica: | a 297 mOsm/l | |
,
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 2.
Prismasol 2 mmol/l Soluzione di potassio per emodialisi/emofiltrazione
Calcio cloruro diidrato/magnesio cloruro esaidrato/soluzione di acido lattico al 90% p/p/
glucosiomonoidrato/sodio cloruro/sodio bicarbonato/potassio cloruro
Legga attentamente questo foglio prima di cominciare ad usare questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Se si manifesta uno qualsiasi degli effetti indesiderati, si rivolga al suo medico, al farmacista o all’infermiere. Questo include qualsiasi effetto non elencato in questo foglio. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos'è Prismasol e a che cosa serve
- 2. Cosa deve sapere prima di usare Prismasol
- 3. Come usare Prismasol
- 4. Possibili effetti indesiderati
- 5. Come conservare Prismasol
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è Prismasol e a che cosa serve
Prismasol contiene i seguenti principi attivi: calcio cloruro diidrato, magnesio cloruro esaidrato,
glucosio monoidrato, soluzione di acido lattico al 90% p/p, sodio cloruro, potassio cloruro e
bicarbonato di sodio.
Prismasol è usato per il trattamento dell'insufficienza renale come soluzione per emofiltrazione
continua o emodiafiltrazione (come sostituto dei liquidi perduti dal sangue filtrato) e per
l'emodialisi continua o l'emodiafiltrazione (il sangue scorre da una parte di una membrana per
dialisi mentre una soluzione per emodialisi scorre dall'altra parte della membrana).
La soluzione Prismasol può essere utilizzata anche in caso di avvelenamento da farmaci con
sostanze dializzabili o filtrabili.
Prismasol 2 mmol/l potassio è indicato in particolare per i pazienti che hanno la tendenza all’
iperkalemia (un’alta concentrazione di potassio nel sangue).
2. Cosa deve sapere prima di usare Prismasol
Non usi Prismasol 2 mmol/l potassio in caso di:
- allergia a uno dei principi attivi o ad uno qualsiasi degli altri componenti (elencati alparagrafo 6)
- bassa concentrazione di potassio nel sangue (ipokalemia)
- alta concentrazione di bicarbonato nel plasma (alcalosi metabolica)
In Prismasol non può essere esclusa la presenza dell'antigene del mais.
Non ricorra all'emofiltrazione/dialisi nei seguenti casi:
- insufficienza renale con accentuato ipercatabolismo (aumento anomalo del catabolismo), se i sintomi uremici (sintomi dovuti ad alte concentrazioni di urea nel sangue) non possono essere corretti con l'emofiltrazione,
- pressione arteriosa insufficiente nell'accesso vascolare,
- anticoagulazione sistemica (ridotta coagulazione del sangue), se vi è il rischio di emorragia (sanguinamento).
Avvertenze e precauzioni
Si rivolga al suo medico, al farmacista o all’infermiere prima di usare Prismasol.
La soluzione deve essere utilizzata solo da, o sotto la diretta supervisione di, un medico
competente nei trattamenti per l'insufficienza renale usando emofiltrazione, emodiafiltrazione ed
emodialisi continua.
Prima e durante il trattamento, le saranno controllati i parametri del sangue, per esempio il
bilancio acido-basico e le saranno monitorate le concentrazioni di elettroliti (sali nel sangue)
inclusi tutti i liquidi somministrati (infusione endovenosa) ed escreti (produzione di urina), anche
quelli non direttamente correlati alla terapia .
Le concentrazioni di glucosio nel sangue devono essere monitorate attentamente, soprattutto se
lei è diabetico.
Altri medicinali e Prismasol
Informi il suo medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe
assumere qualsiasi altro medicinale.
La concentrazione ematica di alcuni medicinali può essere ridotta durante il trattamento. Sarà il
suo medico a stabilire se deve modificare la terapia.
In particolare informi il suo medico nei seguenti casi:
- Digitalici (per il trattamento di alcune condizioni cardiache), poiché il rischio di aritmia cardiaca (battito cardiaco irregolare o accelerato) causato dalla digitale aumenta durante l'ipokaliemia (scarsa concentrazione di potassio nel sangue).
- Vitamina D e prodotti medicinali contenenti calcio, poiché possono aumentare il rischio di ipercalcemia (elevata concentrazione del calcio nel sangue).
- Aggiunte di bicarbonato di sodio(o altre fonti di tamponi), poiché possono aumentare il rischio di alcalosi metabolica (eccesso di bicarbonato nel sangue).
- Quando il citrato viene usato come anticoagulante (come un additivo protettivo nelle macchine per dialisi), esso può ridurre i livelli plasmatici di calcio.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando
con latte materno chieda consiglio al suo medico o al farmacista prima di prendere questo
medicinale.
Il suo medico deciderà se può assumere Prismasol in caso di gravidanza o allattamento.
Guida di veicoli e utilizzo di macchinari
Non è noto che Prismasol influenzi la capacità di guidare o usare macchinari.
3. Come usare Prismasol
Usi questo medicinale seguendo sempre esattamente le istruzioni del suo medico o del
farmacista. Se ha dubbi consulti il suo medico o il farmacista.
Il volume di Prismasol dipenderà dalle sue condizioni cliniche e dal bilancio dei liquidi che si
intende raggiungere. Il volume del dosaggio è pertanto a discrezione del medico responsabile.
Via di somministrazione: per uso endovenoso e per emodialisi.
Se pensa di star prendendo più Prismasol di quanto dovrebbe
Il bilancio idrico, elettrolitico e l'equilibrio acido-base verranno attentamente monitorati.
Nel caso improbabile che si verifichi un sovradosaggio, il medico adotterà le necessarie misure
correttive e aggiusterà la dose.
Il sovradosaggio può causare:
- sovraccarico di liquidi nel sangue,
- aumento del livello ematico di bicarbonato (alcalosi metabolica),
- e / o riduzione dei livelli di sali nel sangue (ipofosfatemia, ipokaliemia). Il sovradosaggio può portare a gravi conseguenze, come insufficienza cardiaca congestizia, squilibrio elettrolitico o acido-base.
Per le istruzioni per l'uso, veda la sezione "Le seguenti informazioni sono intese solo per gli
operatori sanitari professionisti".
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al suo medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le
persone li manifestino.
Sono stati riportati i seguenti effetti indesiderati:
Non nota: la frequenza non può essere stimata dai dati disponibili
- Cambiamenti dei livelli di sali nel sangue (squilibri elettrolitici come ipofosfatemia, ipokalemia)
- Aumento della concentrazione di bicarbonato plasmatico (alcalosi metabolica) o riduzione della concentrazione di bicarbonato plasmatico (acidosi metabolica)
- Aumento o diminuzione anomali del volume di acqua nel corpo (iper o ipovolemia)
- Aumento anomalo della concentrazione di glucosio nel sangue (iperglicemia)
- Nausea
- Vomito
- Crampi muscolari
- Ipotensione (bassa pressione arteriosa).
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al suo medico, al farmacista o all’infermiere.
Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla
sicurezza di questo medicinale.
5. Come conservare Prismasol
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non conservare al di sotto di +4 °C.
Non utilizzare questo medicinale dopo la data di scadenza indicata sull'etichetta e sulla
confezione. La data di scadenza si riferisce all’ultimo giorno del mese.
È stato dimostrato che, a +22°C, la soluzione ricostituita conserva la stabilità fisico-chimica, per
24 ore. Qualora non sia usata immediatamente, tempo e modo di conservazione della soluzione,
ricostituita prima dell’uso, sono una responsabilità dell'utilizzatore e non devono normalmente
essere maggiori di 24 ore, compreso il periodo di trattamento.
Non smaltisca alcun medicinale nell'acqua di scarico e nei rifiuti domestici. Chieda al suo
farmacista come smaltire i medicinali inutilizzati. Queste misure aiuteranno a proteggere
l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Prismasol
I principi attivi sono:
Prima della ricostituzione:
1000 ml di soluzione elettrolitica (nel compartimento piccolo A) contengono
Calcio cloruro diidrato 5,145 g
Magnesio cloruro esaidrato 2,033 g
glucosio 22,000 g
acido-(S) lattico 5,400 g
1000 ml di soluzione tampone (nel compartimento grande B) contengono
sodio cloruro 6,450 g
sodio bicarbonato 3,090 g
potassio cloruro 0,157 g
Dopo la ricostituzione:
Le soluzioni nei compartimenti A (250 ml) e B (4750 ml) vengono miscelate per ottenere una
soluzione ricostituita (5000 ml) con la seguente composizione:
| mmol/l | mEq/l | |
| A Calcio Ca2+ Magnesio Mg2+ Sodio Na+ Cloro Cl- | 1,75 0,50 140,00 111,50 | 3,50 1,00 140,00 111,50 |
| Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 3,00 32,00 2,00 6,10 | 3,00 32,00 2,00 |
| Osmolarità teorica: | 297 mOsm/l | |
Gli eccipienti sono:Anidride carbonica (E 290), acqua per preparazioni iniettabili
pH della soluzione ricostituita: 7,0 – 8,5
Descrizione dell'aspetto di Prismasol e contenuto della confezione
Prismasol viene presentato in una sacca a due compartimenti, contenente nel compartimento A
piccolo, la soluzione elettrolitica, e nel compartimento B grande, la soluzione tampone. La
soluzione finale ricostituita si ottiene dopo aver rotto il cono fratturabile e miscelato le due
soluzioni.
La soluzione ricostituita è trasparente, leggermente giallognola. Ciascuna sacca (A+B) contiene
5000 ml di soluzione per emodialisi/emofiltrazione. La sacca è avvolta in una pellicola
trasparente.
Titolare dell'autorizzazione all’immissione in commercio:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Belgio
Produttore:
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), Italia
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 2.
--------------------------------------------------------------------------------------------------------------------------------
---
Le seguenti informazioni sonodestinate esclusivamente agli operatori sanitari:
Prismasol 2 mmol/l Potassio soluzione per emodialisi/emofiltrazione
Precauzioni per l’uso
Le istruzioni per l'uso/la manipolazione di Prismasol devono essere seguite scrupolosamente.
La soluzione a due comparti deve essere miscelataprima dell’uso.
L’uso di soluzioni contaminate in emofiltrazione ed emodialisi può causare sepsi, shock e
condizioni fatali.
Prismasol può essere riscaldato a 37 ° C per migliorare il comfort del paziente. Il riscaldamento
della soluzione prima dell'uso deve essere effettuato prima della ricostituzione solo con calore
secco. Le soluzioni non devono essere riscaldate in acqua o in un forno a microonde. La
soluzione deve essere ispezionata visivamente per verificare la presenza di particelle e
scolorimento prima della somministrazione, quando la soluzione e il contenitore lo consentono.
Non somministrare a meno che la soluzione non sia limpida e il sigillo sia intatto.
La soluzione contiene potassio. La concentrazione plasmatica di potassio deve essere
monitorata prima e durante l’emofiltrazione e/o l’emodialisi. A seconda della concentrazione
plasmatica di potassio prima del trattamento, si possono sviluppare ipo- o iperkaliemia.
In caso di ipokaliemia, può essere necessaria l'aggiunta di potassio e / o la somministrazione di
una soluzione di dialisi (dialisato) con una maggiore concentrazione di potassio.
In caso di iperkaliemia dopo l'inizio del trattamento, devono essere valutate ulteriori fonti di
potassio che possono avere influenza sulla concentrazione plasmatica. Quando la soluzione
viene utilizzata come soluzione di sostituzione, ridurre la velocità di infusione e assicurarsi che si
sia raggiunta la concentrazione di potassio desiderata. Se l'iperkaliemia non si risolve,
interrompere immediatamente l'infusione.
Se si sviluppa iperkaliemia quando la soluzione viene utilizzata come dialisato, può essere
necessaria la somministrazione di un dialisato privo di potassio per aumentare il tasso di
rimozione
Misurare regolarmente la concentrazione di fosfato inorganico. Sostituire il fosfato inorganico in
caso di basso tasso di fosfato nel sangue. Può essere aggiunto fosfato alla soluzione fino a 1,2
mmol/l. Se viene aggiunto fosfato di potassio, la concentrazione totale di potassio non deve
superare 4 mEq/l (4 mmol/l).
Nonostante non siano stati riportati casi di gravi reazioni di ipersensibilità al mais con Prismasol,
le soluzioni contenenti glucosio derivato dall'amido di mais idrolizzato non possono essere
utilizzate nei pazienti con allergia nota al mais e ai suoi prodotti derivati.
La somministrazione deve essere interrotta immediatamente se si sviluppano segni o sintomi di
una sospetta reazione di ipersensibilità. Appropriate contromisure terapeutiche devono essere
adottate come clinicamente indicato.
Poiché la soluzione contiene glucosio e lattato soprattutto nei pazienti diabetici può svilupparsi
iperglicemia. I livelli di glucosio nel sangue dovrebbero essere monitorati regolarmente. In caso
di iperglicemia, può essere necessaria la somministrazione di soluzione di sostituzione/dialisato
senza glucosio. Potrebbero essere necessarie altre misure correttive per mantenere il controllo
glicemico desiderato.
Prismasol contiene idrogeno carbonato (bicarbonato) e lattato (un precursore dell'idrogeno
carbonato) che può influenzare l'equilibrio acido-base del paziente. Se durante la terapia con la
soluzione si sviluppa o peggiora alcalosi metabolica, potrebbe essere necessario ridurre la
velocità di somministrazione o interrompere la somministrazione.
Prima e durante il trattamento, l'equilibrio elettrolitico e acido-base devono essere strettamente
monitorati durante l'intera procedura.
In caso di squilibrio dei liquidi, monitorare attentamente la situazione clinica e ripristinare il
bilancio dei liquidi se necessario.
Via di somministrazione:
Per uso endovenoso e per emodialisi. Usato come soluzione di sostituzione, Prismasol viene
somministrato nel circuito prima (pre-diluizione) o dopo l'emofiltro (post-diluizione).
Istruzioni per l’uso:
La soluzione elettrolitica (compartimento piccolo A) viene aggiunta alla soluzione tampone
(compartimento grande B) dopo la rottura del cono fratturabile ed immediatamente prima
dell’uso per ottenere la soluzione ricostituita.
Utilizzare solamente con apparecchiature dedicate al supporto extracorporeo della funzione
renale.
Adottare tecniche asettiche per tutta la durata del trattamento e della somministrazione al
paziente.
Usare solo se l'involucro esterno è integro, tutti i sigilli sono intatti, il cono fratturabile non è rotto
e la soluzione è trasparente. Premere con decisione la sacca per verificare la presenza di
perdite. Se si individuano delle perdite, smaltire immediatamente la soluzione in quanto non è
più garantita la sterilità.
Il compartimento B è dotato di un punto per iniezione per l'eventuale aggiunta di altri farmaci
necessari dopo la ricostituzione della soluzione. È responsabilità del medico giudicare la
compatibilità di un medicinale aggiuntivo alla soluzione Prismasol controllando eventuali
variazioni di colore e/o precipitazione, complessi insolubili o cristalli.
Prima di aggiungere un medicinale, verificare che sia solubile e stabile in acqua al pH di
Prismasol (il pH della soluzione ricostituita va da 7,0 a 8,5). I prodotti aggiuntivi potrebbero non
essere compatibili. Consultare le istruzioni per l’uso del medicinale da aggiungere.
Rimuovere qualunque liquido dalla bocchetta di iniezione, rovesciare la sacca, inserire il
farmaco attraverso la bocchetta di iniezione e mescolare a fondo. Somministrare la soluzione
immediatamente.L'introduzione e la miscelazione di additivi devono sempre essere eseguite
prima di collegare la sacca della soluzione al circuito extracorporeo.
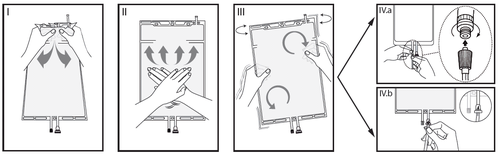
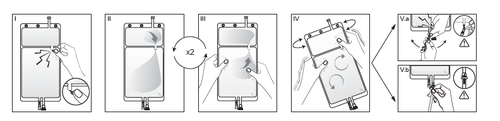
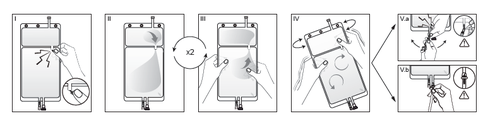
IRimuovere l'involucro esterno dalla sacca immediatamente prima dell'uso ed eliminare
qualsiasi altro materiale di confezionamento. Aprire il sigillo rompendo il cono fratturabile
tra i due comparti della sacca. Il cono fratturabile rimarrà all'interno della sacca (vedere la
figura I sotto).
IIAssicurarsi che tutto il liquido del comparto piccolo A sia trasferito nel comparto grande B
(vedere la figura II sotto).
IIIRisciacquare il comparto piccolo A due volte premendo la soluzione miscelata di nuovo
dentro il comparto piccolo A e quindi dentro il comparto grande B (vedere la figura III sotto).
IVUna volta svuotato il comparto piccolo A: agitare il comparto grande B in modo che il
contenuto sia completamente miscelato. Ora la soluzione è pronta per l'uso e la sacca può
essere appesa all'apparecchiatura (vedere la figura IV sotto).
VLa linea di dialisi o di sostituzione può essere collegata a una qualsiasi delle due bocchette
di accesso.
V.aSe si utilizza un accesso luer, adottando una tecnica asettica, rimuovere il cappuccio e
collegare il luer lock maschio della linea di dialisi o di sostituzione all'attacco luer femmina
posto sulla sacca, quindi serrare. Utilizzando entrambe le mani, rompere il cono fratturabile
blu alla base e muoverlo avanti e indietro. Non utilizzare alcun attrezzo. Verificare che il
cono si sia separato completamente e che il liquido fluisca liberamente. Durante il
trattamento il cono rimarrà nella bocchetta luer (vedere la figura V.a sotto).
V.bSe si utilizza la bocchetta per iniezione, rimuovere prima il cappuccio a scatto.La porta di
iniezione è disinfettabile. Quindi introdurre il perforatore attraverso il setto di gomma.
Verificare che il liquido fluisca liberamente (vedere la figura V.b sotto).
La soluzione deve essere utilizzata immediatamente dopo la rimozione dell'involucro. Se non
utilizzata immediatamente, la soluzione ricostituita deve essere utilizzata entro 24 ore, compresa
la durata del trattamento dopo l'aggiunta della soluzione elettrolitica alla soluzione tampone.
La soluzione ricostituita è monouso. Eliminare la soluzione non utilizzata immediatamente dopo
l'uso.
I medicinali non utilizzati o il materiale di scarto devono essere smaltiti in conformità con i
requisiti locali.
Prismasol 2 mmol/l Soluzione di potassio per emodialisi/emofiltrazione
Calcio cloruro diidrato/magnesio cloruro esaidrato/soluzione di acido lattico al 90% p/p/
glucosiomonoidrato/sodio cloruro/sodio bicarbonato/potassio cloruro
Legga attentamente questo foglio prima di cominciare ad usare questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Se si manifesta uno qualsiasi degli effetti indesiderati, si rivolga al suo medico, al farmacista o all’infermiere. Questo include qualsiasi effetto non elencato in questo foglio.Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos'è Prismasol e a che cosa serve
- 2. Cosa deve sapere prima di usare Prismasol
- 3. Come usare Prismasol
- 4. Possibili effetti indesiderati
- 5. Come conservare Prismasol
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è Prismasol e a che cosa serve
Prismasol contiene i seguenti principi attivi: calcio cloruro diidrato, magnesio cloruro esaidrato,
glucosio monoidrato, soluzione di acido lattico al 90% p/p, sodio cloruro, potassio cloruro e
bicarbonato di sodio.
Prismasol è usato per il trattamento dell'insufficienza renale come soluzione per emofiltrazione
continua o emodiafiltrazione (come sostituto dei liquidi perduti dal sangue filtrato) e per
l'emodialisi continua o l'emodiafiltrazione (il sangue scorre da una parte di una membrana per
dialisi mentre una soluzione per emodialisi scorre dall'altra parte della membrana).
La soluzione Prismasol può essere utilizzata anche in caso di avvelenamento da farmaci con
sostanze dializzabili o filtrabili.
Prismasol 2 mmol/l potassio è indicato in particolare per i pazienti che hanno la tendenza all’
iperkalemia (un’alta concentrazione di potassio nel sangue).
2. Cosa deve sapere prima di usare Prismasol
Non usi Prismasol 2 mmol/l potassio in caso di:
- allergia a uno dei principi attivi o ad uno qualsiasi degli altri componenti (elencati alparagrafo 6)
- bassa concentrazione di potassio nel sangue (ipokalemia)
- alta concentrazione di bicarbonato nel plasma (alcalosi metabolica)
In Prismasol non può essere esclusa la presenza dell'antigene del mais.
Non ricorra all'emofiltrazione/dialisi nei seguenti casi:
- insufficienza renale con accentuato ipercatabolismo (aumento anomalo del catabolismo), se i sintomi uremici (sintomi dovuti ad alte concentrazioni di urea nel sangue) non possono essere corretti con l'emofiltrazione,
- pressione arteriosa insufficiente nell'accesso vascolare,
- anticoagulazione sistemica (ridotta coagulazione del sangue), se vi è il rischio di emorragia (sanguinamento).
Avvertenze e precauzioni
Si rivolga al suo medico, al farmacista o all’infermiere prima di usare Prismasol.
La soluzione deve essere utilizzata solo da, o sotto la diretta supervisione di, un medico
competente nei trattamenti per l'insufficienza renale usando emofiltrazione, emodiafiltrazione ed
emodialisi continua.
Prima e durante il trattamento, le saranno controllati i parametri del sangue, per esempio il
bilancio acido-basico e le saranno monitorate le concentrazioni di elettroliti (sali nel sangue) ,
inclusi tutti i liquidi somministrati (infusione endovenosa) ed escreti (produzione di urina), anche
quelli non direttamente correlati alla terapia .
Le concentrazioni di glucosio nel sangue devono essere monitorate attentamente, soprattutto se
lei è diabetico.
Altri medicinali e Prismasol
Informi il suo medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe
assumere qualsiasi altro medicinale, compreso quelli senza prescrizione medica.
La concentrazione ematica di alcuni medicinali può essere ridotta durante il trattamento. Sarà il
suo medico a stabilire se deve modificare la terapia.
In particolare informi il suo medico nei seguenti casi:
- Digitalici (per il trattamento di alcune condizioni cardiache), poiché il rischio di aritmia cardiaca (battito cardiaco irregolare o accelerato) causato dalla digitale aumenta durante l'ipokaliemia (scarsa concentrazione di potassio nel sangue).
- Vitamina D e prodotti medicinali contenenti calcio, poiché possono aumentare il rischio di ipercalcemia (elevata concentrazione del calcio nel sangue).
- Aggiunte di bicarbonato di sodio(o altre fonti di tamponi), poiché possono aumentare il rischio di alcalosi metabolica (eccesso di bicarbonato nel sangue).
- Quando il citrato viene usato come anticoagulante (come un additivo protettivo nelle macchine per dialisi), esso può ridurre i livelli plasmatici di calcio.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando
con latte materno chieda consiglio al suo medico o al farmacista prima di prendere questo
medicinale.
Il suo medico deciderà se può assumere Prismasol in caso di gravidanza o allattamento.
Guida di veicoli e utilizzo di macchinari
Non è noto che Prismasol influenzi la capacità di guidare o usare macchinari.
3. Come usare Prismasol
Usi questo medicinale seguendo sempre esattamente le istruzioni del suo medico o del
farmacista. Se ha dubbi consulti il suo medico o il farmacista.
Il volume di Prismasol dipenderà dalle sue condizioni cliniche e dal bilancio dei liquidi che si
intende raggiungere. Il volume del dosaggio è pertanto a discrezione del medico responsabile.
Via di somministrazione: per uso endovenoso e per emodialisi.
Se pensa di star prendendo più Prismasol di quanto dovrebbe
Il bilancio idrico, elettrolitico e l'equilibrio acido-base verranno attentamente monitorati.
Nel caso improbabile che si verifichi un sovradosaggio, il medico adotterà le necessarie misure
correttive e aggiusterà la dose.
Il sovradosaggio può causare:
- sovraccarico di liquidi nel sangue,
- aumento del livello ematico di bicarbonato (alcalosi metabolica),
- e / o riduzione dei livelli di sali nel sangue (ipofosfatemia, ipokaliemia). Il sovradosaggio può portare a gravi conseguenze, come insufficienza cardiaca congestizia, squilibrio elettrolitico o acido-base.
Per le istruzioni per l'uso, veda la sezione "Le seguenti informazioni sono intese solo per gli
operatori sanitari professionisti".
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al suo medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le
persone li manifestino.
Sono stati riportati i seguenti effetti indesiderati:
Non nota: la frequenza non può essere stimata dai dati disponibili
- Cambiamenti dei livelli di sali nel sangue (squilibri elettrolitici come ipofosfatemia, ipokalemia)
- Aumento della concentrazione di bicarbonato plasmatico (alcalosi metabolica) o riduzione della concentrazione di bicarbonato plasmatico (acidosi metabolica)
- Aumento o diminuzione anomali del volume di acqua nel corpo (iper o ipovolemia)
- Aumento anomalo della concentrazione di glucosio nel sangue (iperglicemia)
- Nausea
- Vomito
- Crampi muscolari
- Ipotensione (bassa pressione arteriosa).
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al suo medico, al farmacista o all’infermiere.
Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla
sicurezza di questo medicinale.
5. Come conservare Prismasol
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non conservare al di sotto di +4 °C.
Non utilizzare questo medicinale dopo la data di scadenza indicata sull'etichetta e sulla
confezione. La data di scadenza si riferisce all’ultimo giorno del mese.
È stato dimostrato che, a +22°C, la soluzione ricostituita conserva la stabilità fisico-chimica, per
24 ore. Qualora non sia usata immediatamente, tempo e modo di conservazione della soluzione,
ricostituita prima dell’uso, sono una responsabilità dell'utilizzatore e non devono normalmente
essere maggiori di 24 ore, compreso il periodo di trattamento.
Non smaltisca alcun medicinale nell'acqua di scarico e nei rifiuti domestici. Chieda al suo
farmacista come smaltire i medicinali inutilizzati. Queste misure aiuteranno a proteggere
l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Prismasol
I principi attivi sono:
Prima della ricostituzione:
1000 ml di soluzione elettrolitica (nel compartimento piccolo A) contengono
Calcio cloruro diidrato 5,145 g
Magnesio cloruro esaidrato 2,033 g
glucosio 22,000 g
acido-(S) lattico 5,400 g
1000 ml di soluzione tampone (nel compartimento grande B) contengono
sodio cloruro 6,450 g
sodio bicarbonato 3,090 g
potassio cloruro 0,157 g
Dopo la ricostituzione:
Le soluzioni nei compartimenti A (250 ml) e B (4750 ml) vengono miscelate per ottenere una
soluzione ricostituita (5000 ml) con la seguente composizione:
| n | mmol/l | mEq/l |
| e Calcio Ca2+ g Magnesio Mg2+ Sodio Na+ A Cloro Cl- Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 1,75 0,50 140,00 111,50 3,00 32,00 2,00 6,10 | 3,50 1,00 140,00 111,50 3,00 32,00 2,00 |
| Osmolarità teorica: | 297 mOsm/l |
Gli eccipienti sono:Anidride carbonica (E 290), acqua per preparazioni iniettabili
pH della soluzione ricostituita: 7,0 – 8,5
Descrizione dell'aspetto di Prismasol e contenuto della confezione
Prismasol viene presentato in una sacca a due compartimenti, contenente nel compartimento A
piccolo, la soluzione elettrolitica, e nel compartimento B grande, la soluzione tampone. La
soluzione finale ricostituita si ottiene dopo aver rotto il cono fratturabile e miscelato le due
soluzioni.
La soluzione ricostituita è trasparente, leggermente giallognola. Ciascuna sacca (A+B) contiene
5000 ml di soluzione per emodialisi/emofiltrazione. La sacca è avvolta in una pellicola
trasparente.
Titolare dell'autorizzazione all’immissione in commercio:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Belgio
Produttore:
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), Italia
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 2.
--------------------------------------------------------------------------------------------------------------------------------
---
Le seguenti informazioni sonodestinate esclusivamente agli operatori sanitari:
Prismasol 2 mmol/l Potassio soluzione per emodialisi/emofiltrazione
Precauzioni per l’uso
Le istruzioni per l'uso/la manipolazione di Prismasol devono essere seguite scrupolosamente.
La soluzione a due comparti deve essere miscelataprima dell'uso.
L’uso di soluzioni contaminate in emofiltrazione ed emodialisi può causare sepsi, shock e
condizioni fatali.
Prismasol può essere riscaldato a 37 ° C per migliorare il comfort del paziente. Il riscaldamento
della soluzione prima dell'uso deve essere effettuato prima della ricostituzione solo con calore
secco. Le soluzioni non devono essere riscaldate in acqua o in un forno a microonde. La
soluzione deve essere ispezionata visivamente per verificare la presenza di particelle e
scolorimento prima della somministrazione, quando la soluzione e il contenitore lo consentono.
Non somministrare a meno che la soluzione non sia limpida e il sigillo sia intatto.
La soluzione contiene potassio. La concentrazione plasmatica di potassio deve essere
monitorata prima e durante l’emofiltrazione e/o l’emodialisi. A seconda della concentrazione
plasmatica di potassio prima del trattamento, si possono sviluppare ipo- o iperkaliemia.
In caso di ipokaliemia, può essere necessaria l'aggiunta di potassio e / o la somministrazione di
una soluzione di dialisi (dialisato) con una maggiore concentrazione di potassio.
In caso di iperkaliemia dopo l'inizio del trattamento, devono essere valutate ulteriori fonti di
potassio che possono avere influenza sulla concentrazione plasmatica. Quando la soluzione
viene utilizzata come soluzione di sostituzione, ridurre la velocità di infusione e assicurarsi che si
sia raggiunta la concentrazione di potassio desiderata. Se l'iperkaliemia non si risolve,
interrompere immediatamente l'infusione.
Se si sviluppa iperkaliemia quando la soluzione viene utilizzata come dialisato, può essere
necessaria la somministrazione di un dialisato privo di potassio per aumentare il tasso di
rimozione
Misurare regolarmente la concentrazione di fosfato inorganico. Sostituire il fosfato inorganico in
caso di basso tasso di fosfato nel sangue. Può essere aggiunto fosfato alla soluzione fino a 1,2
mmol/l. Se viene aggiunto fosfato di potassio, la concentrazione totale di potassio non deve
superare 4 mEq/l (4 mmol/l).
Nonostante non siano stati riportati casi di gravi reazioni di ipersensibilità al mais con Prismasol,
le soluzioni contenenti glucosio derivato dall'amido di mais idrolizzato non possono essere
utilizzate nei pazienti con allergia nota al mais e ai suoi prodotti derivati.
La somministrazione deve essere interrotta immediatamente se si sviluppano segni o sintomi di
una sospetta reazione di ipersensibilità. Appropriate contromisure terapeutiche devono essere
adottate come clinicamente indicato.
Poiché la soluzione contiene glucosio e lattato soprattutto nei pazienti diabetici può svilupparsi
iperglicemia. I livelli di glucosio nel sangue dovrebbero essere monitorati regolarmente. In caso
di iperglicemia, può essere necessaria la somministrazione di soluzione di sostituzione/dialisato
senza glucosio. Potrebbero essere necessarie altre misure correttive per mantenere il controllo
glicemico desiderato.
Prismasol contiene idrogeno carbonato (bicarbonato) e lattato (un precursore dell'idrogeno
carbonato) che può influenzare l'equilibrio acido-base del paziente. Se durante la terapia con la
soluzione si sviluppa o peggiora alcalosi metabolica, potrebbe essere necessario ridurre la
velocità di somministrazione o interrompere la somministrazione.
Prima e durante il trattamento, l'equilibrio elettrolitico e acido-base devono essere strettamente
monitorati durante l'intera procedura.
In caso di squilibrio dei liquidi, monitorare attentamente la situazione clinica e ripristinare il
bilancio dei liquidi se necessario.
Via di somministrazione:
Per uso endovenoso e per emodialisi. Usato come soluzione di sostituzione, Prismasol viene
somministrato nel circuito prima (pre-diluizione) o dopo l'emofiltro (post-diluizione).
Istruzioni per l’uso:
La soluzione elettrolitica (compartimento piccolo A) viene aggiunta alla soluzione tampone
(compartimento grande B) dopo la rottura del cono fratturabile immediatamente prima dell’uso
per ottenere la soluzione ricostituita.
Utilizzare solamente con apparecchiature dedicate al supporto extracorporeo della funzione
renale.
Adottare tecniche asettiche per tutta la durata del trattamento e della somministrazione al
paziente.
Usare solo se l'involucro esterno è integro, tutti i sigilli sono intatti, il cono fratturabile non è rotto
e la soluzione è trasparente. Premere con decisione la sacca per verificare la presenza di
perdite. Se si individuano delle perdite, smaltire immediatamente la soluzione in quanto non è
più garantita la sterilità.
Il compartimento B è dotato di un punto per iniezione per l'eventuale aggiunta di altri farmaci
necessari dopo la ricostituzione della soluzione. È responsabilità del medico giudicare la
compatibilità di un medicinale aggiuntivo alla soluzione Prismasol controllando eventuali
variazioni di colore e/o precipitazione, complessi insolubili o cristalli.
Prima di aggiungere un medicinale, verificare se sia solubile e stabile in acqua al pH di
Prismasol (il pH della soluzione ricostituita va da 7,0 a 8,5). I prodotti aggiuntivi potrebbero non
essere compatibili. Consultare le istruzioni per l’uso del medicinale da aggiungere.
Rimuovere qualunque liquido dalla bocchetta di iniezione, rovesciare la sacca, inserire il
farmaco attraverso la bocchetta di iniezione e mescolare a fondo. Somministrare la soluzione
immediatamente.L'introduzione e la miscelazione di additivi devono sempre essere eseguite
prima di collegare la sacca della soluzione al circuito extracorporeo.
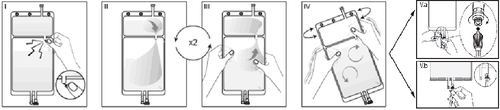
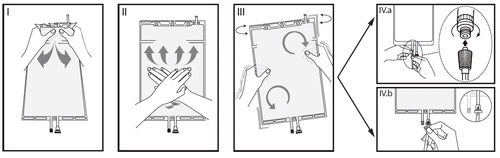
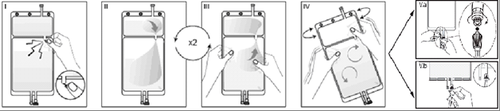
IRimuovere l'involucro esterno dalla sacca immediatamente prima dell'uso ed eliminare
qualsiasi altro materiale di confezionamento. Aprire il sigillo rompendo il cono fratturabile
tra i due comparti della sacca. Il cono fratturabile rimarrà all'interno della sacca (vedere la
figura I sotto).
IIAssicurarsi che tutto il liquido del comparto piccolo A sia trasferito nel comparto grande B
(vedere la figura II sotto).
IIIRisciacquare il comparto piccolo A due volte premendo la soluzione miscelata di nuovo
dentro il comparto piccolo A e quindi dentro il comparto grande B (vedere la figura III sotto).
IVUna volta svuotato il comparto piccolo A: agitare il comparto grande B in modo che il
contenuto sia completamente miscelato. Ora la soluzione è pronta per l'uso e la sacca può
essere appesa all'apparecchiatura (vedere la figura IV sotto).
VLa linea di dialisi o di sostituzione può essere collegata a una qualsiasi delle due bocchette
di accesso.
V.aSe si utilizza un accesso luer rimuovere il cappuccio con un movimento di rotazione e
trazione e collegare il luer lock maschio della linea di dialisi o di sostituzione all'attacco luer
femmina posto sulla sacca con un movimento di rotazione e trazione. Assicurarsi che il
collegamento sia corretto e saldo. Il connettore ora è aperto. Verificare che il liquido fluisca
liberamente (vedere la figura V.a sotto).
Quando la linea di dialisi o di sostituzione è scollegata dal connettore luer, il connettore si
chiude e il flusso della soluzione si interrompe. La porta luer è una porta pulibile, senza
ago.
V.bSe si utilizza la bocchetta per iniezione, rimuovere prima il cappuccio a scatto. La porta di
iniezione è disinfettabile. Quindi introdurre il perforatore attraverso il setto di gomma.
Verificare che il liquido fluisca liberamente (vedere la figura V.b sotto).
La soluzione deve essere utilizzata immediatamente dopo la rimozione dell'involucro. Se non
utilizzata immediatamente, la soluzione ricostituita deve essere utilizzata entro 24 ore, compresa
la durata del trattamento dopo l'aggiunta della soluzione elettrolitica alla soluzione tampone.
La soluzione ricostituita è monouso. Eliminare la soluzione non utilizzata immediatamente dopo
l'uso.
I medicinali non utilizzati o il materiale di scarto devono essere smaltiti in conformità con i
requisiti locali.
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 4.
| mmol/l | mEq/l | |
| Calcio Ca2+ Magnesio Mg2+ Sodio Na+ Cloro Cl- Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 1,75 0,50 140,00 113,50 3,00 32,00 4,00 6,10 | 3,50 1,00 140,00 113,50 3,00 a 32,00 4,00 |
| Osmolarità teorica: | 301 mOsm/l | |
| mmol/l | mEq/l | |
| Calcio Ca2+ | 1,75 | 3,50 |
| Magnesio Mg2+ Sodio Na+ Cloro Cl- Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 0,50 140,00 113,50 3,00 32,00 4,00 6,10 | 1,00 140,00 113,50 3,00 32,00 4,00 |
| Osmolarità teorica: | 301 mOsm/l | |
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 4.
o
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo e nel Regno Unito (Irlanda
del Nord) con le seguenti denominazioni:
Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia,
Ungheria, Islanda, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Norvegia, Polonia, Portogallo,
Romania, Slovacchia, Slovenia, Spagna, Svezia, Regno Unito (Irlanda del Nord): Prismasol 4.
| mmol/l | mEq/l | |
| Calcio Ca2+ Magnesio Mg2+ Sodio Na+ Cloro Cl- Lattato Bicarbonato HCO - 3 Potassio K+ Glucosio | 1,75 0,50 140,00 113,50 3,00 32,00 4,00 6,10 | 3,50 1,00 140,00 113,50 3,00 32,00 a 4,00 |
| Osmolarità teorica: | 301 mOsm/l | |
- Paese di registrazione
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a PRISMASOLForma farmaceutica: Soluzione per infusione, 5% (50G/L)Principio attivo: albuminProduttore: BIOTEST PHARMA GMBHPrescrizione richiestaForma farmaceutica: Soluzione per infusione, 250 G/LPrincipio attivo: albuminProduttore: KEDRION S.P.A.Prescrizione richiestaForma farmaceutica: Soluzione per infusione, 200 G/LPrincipio attivo: albuminProduttore: CSL BEHRING S.P.A.Prescrizione richiesta
Medici online per PRISMASOL
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di PRISMASOL — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














