
VENITAL

Come usare VENITAL
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
VENITAL 50 g/l Soluzione per infusione
Immunoglobulina umana normale (IVIg) per uso endovenoso
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos'è VENITAL e a che cosa serve
- 2. Cosa deve sapere prima di usare VENITAL
- 3. Come usare VENITAL
- 4. Possibili effetti indesiderati
- 5. Come conservare VENITAL
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è VENITAL e a che cosa serve
VENITAL è una soluzione di immunoglobulina umana normale per uso endovenoso. Le immunoglobuline
sono anticorpi umani che sono presenti anche nel sangue.
VENITAL viene usato per:
Trattamento di adulti, bambini e adolescenti (0-18 anni) che non hanno anticorpi sufficienti (terapia
sostitutiva) nei seguenti casi:
- 1. Pazienti con deficit congenito della produzione di anticorpi (sindromi da immunodeficienza primaria).
- 2. Pazienti con deficit acquisito della produzione di anticorpi (immunodeficienze secondarie) che soffrono di infezioni gravi o ricorrenti dovute a diverse condizioni mediche (per esempio malattie oncologiche o autoimmuni o per il conseguente trattamento di tali malattie). Questi pazienti sono stati sottoposti a trattamento con antibiotici dimostratosi inefficace e non hanno avuto un incremento sufficientemente positivo del titolo di anticorpi IgG dopo la vaccinazione (vaccini antipneumococcici con antigeni polisaccaridici e polipeptidici) o un livello di IgG nel loro sangue < 4 g/l.
Trattamento di adulti, bambini e adolescenti (0-18 anni) con alcune malattie infiammatorie
(immunomodulazione) nelle seguenti situazioni:
- 1. Pazienti che non hanno sufficienti piastrine (Trombocitopenia Immune Primaria, ITP) e che sono ad alto rischio di sanguinamenti o prima di interventi chirurgici per correggere la conta piastrinica.
- 2. Pazienti con sindrome di Guillain Barrè. Si tratta di una malattia acuta, caratterizzata dall’infiammazione dei nervi periferici, che causa una grave debolezza muscolare, in particolare alle gambe e agli arti superiori.
- 3. Pazienti con morbo di Kawasaki (in combinazione con acido acetilsalicilico). Si tratta di una malattia acuta che colpisce soprattutto i bambini piccoli, caratterizzata da un’infiammazione dei vasi sanguigni di tutto il corpo.
- 4. Pazienti affetti da Poliradicoloneuropatia Cronica Infiammatoria Demielinizzante (CIDP). Questa malattia cronica è un raro disturbo dei nervi periferici caratterizzato da un aumento graduale della debolezza delle gambe e, in misura minore, delle braccia.
- 5. Pazienti con Neuropatia Motoria Multifocale (MMN). Si tratta di una rara condizione che colpisce i nervi motori ed è caratterizzata da debolezza degli arti asimmetrica a progressione lenta senza perdita di sensibilità.
2. Cosa deve sapere prima di usareVENITAL
Non usi VENITAL
Se è allergico (ipersensibile) alle immunoglobuline umane o ad uno qualsiasi degli altri componenti di
questo medicinale (elencati al paragrafo 6).
Se nel sangue ha anticorpi diretti contro le immunoglobuline di tipo IgA, poiché la somministrazione di
un prodotto contenente IgA può provocare una grave reazione allergica.
Avvertenze e precauzioni
Si rivolga al medico o all’infermiere prima di usare VENITAL.
Il medico od un altro operatore sanitario la controllerà rigorosamente e la osserverà attentamente durante
l'intero periodo dell'infusione con VENITAL per verificare che non vi siano reazioni.
Alcune reazioni avverse possono manifestarsi più frequentemente:
- nel caso in cui la velocità dell’infusione sia troppo elevata;
- se ha sintomi incontrollati di infezioni non trattate (ad es. febbre) o sintomi di infiammazione cronica;
- se riceve immunoglobuline umane normali per la prima volta;
- nei rari casi in cui è stato cambiato il tipo di prodotto medicinale a base di immunoglobuline umane normali, o quando è trascorso un lungo intervallo dalla precedente infusione.
- In alcune condizioni, le immunoglobuline possono aumentare il rischio di infarto miocardico,ictus, embolia polmonare, o trombosi venosa profonda poiché aumentano la viscosità delsangue.Pertanto, il medico farà particolare attenzione nelle seguenti circostanze:
- se è in sovrappeso,
- se è anziano,
- se soffre di diabete,
- se ha la pressione sanguigna alta (ipertensione),
- se il volume del sangue è troppo basso (ipovolemia),
- se ha o ha avuto problemi ai vasi sanguigni (malattie vascolari),
- se ha un’aumentata tendenza alla coagulazione del sangue (disordini trombofilici ereditari o acquisiti),
- se soffre di episodi trombotici,
- se soffre di malattie che aumentano la densità del sangue (viscosità),
- se ha avuto un prolungato periodo di immobilità,
- se ha o ha avuto problemi ai reni o se assume medicinali che possono danneggiare i reni (medicinali nefrotossici), poiché sono stati riportati casi di insufficienza renale acuta. In caso di danno renale, il medico prenderà in considerazione l’interruzione del trattamento.
- Lei può essere allergico (ipersensibile) alle immunoglobuline (anticorpi) senza saperlo.Ciò può accadere anche se ha già ricevuto immunoglobuline umane normali in passato e ha tollerato precedenti somministrazioni. Questa eventualità può verificarsi in particolare se non ha abbastanza immunoglobuline di tipo IgA (deficienza di IgA con anticorpi anti-IgA). In questi rari casi possono verificarsi reazioni allergiche (di ipersensibilità) come un abbassamento della pressione del sangue o shock.
In caso di reazione avversa, il medico deciderà se ridurre la velocità di somministrazione o se interrompere
l’infusione. Inoltre il medico deciderà il trattamento necessario sulla base della natura e della gravità
dell’effetto indesiderato.
In caso di shock, il medico dovrà eseguire il trattamento standard per lo shock. Informi il medico se soffre di
una delle condizioni descritte sopra, il medico userà particolare cautela nel prescriverle e nel somministrarle
VENITAL.
Sicurezza virale
I medicinali che sono preparati da sangue o plasma umano vengono sottoposti ad un certo numero di misure
di sicurezza per prevenire la trasmissione di infezioni ai pazienti. Queste misure includono un’attenta
selezione dei donatori di sangue o di plasma per assicurarsi che i donatori potenzialmente infetti vengano
esclusi ed il controllo di ogni donazione e pool di plasma per evidenziare l’eventuale presenza di virus. I
produttori di questi medicinali inoltre introducono nella lavorazione del sangue o del plasma alcuni passaggi
capaci di inattivare o rimuovere i patogeni. Nonostante queste misure, quando si somministrano medicinali
preparati da sangue o plasma umano, la possibilità di trasmettere un’infezione non può essere totalmente
esclusa. Ciò vale anche per virus, o altri tipi di agenti infettivi, emergenti o sconosciuti.
Le misure adottate sono considerate efficaci per i virus con involucro lipidico come il virus
dell’immunodeficienza umana (HIV), il virus dell’epatite B (HBV), il virus dell’epatite C (HCV) ed il virus
senza involucro lipidico dell’epatite A (HAV). Le misure adottate hanno un valore limitato contro i virus
senza involucro lipidico come il parvovirus B19.
Le immunoglobuline non sono state associate con infezioni da epatite A o da parvovirus B19, ciò può essere
dovuto al fatto che gli anticorpi contro queste infezioni, che sono contenuti nel prodotto, hanno capacità
protettiva.
Si raccomanda fortemente di registrare il nome commerciale e il numero di lotto ogniqualvolta si riceva una
dose di VENITAL, in modo da avere una documentazione sui lotti utilizzati.
Bambini e adolescenti
Una leggera e transitoria glicosuria (presenza di glucosio nelle urine) senza segni clinici è stata osservata nei
pazienti pediatrici dopo somministrazione di Ig VENA, che ha la stessa forma farmaceutica e composizione
quali-quantitativa di VENITAL. Questo evento può essere correlato al maltosio contenuto in Ig VENA, così
come VENITAL (stessa forma farmaceutica e composizione quali-quantitativa), dal momento che, nei tubuli
renali, il maltosio è idrolizzato a glucosio, il quale viene riassorbito e escreto nelle urine generalmente solo
in piccola parte. Il riassorbimento del glucosio è un meccanismo dipendente dall’età. L’aumento transitorio
del maltosio nel plasma può superare la capacità del rene di riassorbire lo zucchero e risultare in un test
positivo per il glucosio nelle urine.
Altri medicinali e VENITAL
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale.
Le immunoglobuline umane normali per uso endovenoso non devono essere mescolate con altri prodotti
medicinali, né con altri prodotti a base di IVIg.
Vaccini a virus vivi attenuati
La somministrazione di immunoglobulina può alterare per un periodo di almeno 6 settimane e fino a 3 mesi
l'efficacia dei vaccini a virus vivi attenuati come quelli per morbillo, rosolia, parotite e varicella. Dopo la
somministrazione di questo prodotto, deve trascorrere un intervallo di tre mesi prima della vaccinazione con
vaccini a virus vivi attenuati. Nel caso del morbillo, questo indebolimento della risposta può durare anche
fino ad un anno. Quindi nei pazienti che ricevono il vaccino del morbillo deve essere controllato il livello
degli anticorpi.
Diuretici dell'ansa (un gruppo di medicinali che aumentano la produzione di urina)
Evitare l'uso concomitante di diuretici dell'ansa.
Esami del sangue
VENITAL può interferire con alcuni esami del sangue a causa dell’aumento temporaneo di vari anticorpi che
dopo l’infusione di immunoglobuline sono trasferiti passivamente nel suo sangue; questo aumento degli
anticorpi può far sì che alcuni esami del sangue abbiano un risultato che potrebbe non essere corretto. La
trasmissione passiva di anticorpi contro gli antigeni eritrocitari, es. A, B, D (determinanti il gruppo
sanguigno), può interferire con alcuni test sierologici per anticorpi dei globuli rossi, per esempio il test
diretto dell’antiglobulina (DAT, test di Coombs diretto).
Test della glicemia
Alcuni sistemi di misurazione della glicemia (per esempio, quelli basati sulla glucosio-deidrogenasi
pirrolochinolina chinone (GDH-PQQ) o sul metodo colorimetrico della glucosio-ossidoreduttasi)
riconoscono falsamente il maltosio (100 mg/ml) contenuto in VENITAL come glucosio. Questo può risultare
in una lettura di valori di glicemia falsamente elevati durante l’infusione e per un periodo di circa 15 ore
successivamente alla fine dell’infusione e, conseguentemente, in una inadeguata somministrazione di
insulina, causando un pericolo di vita o addirittura una ipoglicemia fatale. Inoltre, casi di reale ipoglicemia
possono non essere trattati se lo stato ipoglicemico è mascherato da valori di glucosio falsamente elevati. Di
conseguenza, durante la somministrazione di VENITAL o di altri prodotti parenterali contenenti maltosio, la
misurazione della glicemia deve essere fatta con metodi glucosio-specifici. Le istruzioni d’uso del sistema
per la misurazione della glicemia, incluse quelle delle strisce reattive, devono essere attentamente controllate
per stabilire se il sistema è appropriato per l’utilizzo nei pazienti trattati con prodotti parenterali contenenti
maltosio. Qualora ci fossero dubbi, contattare il produttore del sistema di misurazione per determinare
l’appropriatezza d’impiego in concomitanza d’uso di prodotti parenterali contenenti maltosio.
Bambini e adolescenti
Sebbene non siano stati condotti studi specifici d’interazione nella popolazione pediatrica, non si attendono
differenze rispetto ai pazienti adulti.
Gravidanza, allattamento e fertilità
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno chieda consiglio al medico prima di prendere questo medicinale. Il medico deciderà se è opportuno utilizzare VENITAL durante la gravidanza e l’allattamento.
- Non sono stati condotti studi clinici con VENITAL nelle donne in gravidanza. È stato dimostrato che i prodotti a base di immunoglobuline umane per uso endovenoso attraversano la placenta in modo crescente durante il terzo trimestre. Tuttavia, medicinali contenenti anticorpi vengono usati da anni in donne in gravidanza ed è stato dimostrato che non sono da aspettarsi effetti dannosi sul decorso della gravidanza, sul feto e sul neonato.
- Se sta allattando ed è in trattamento con VENITAL, gli anticorpi contenuti nel prodotto possono passare nel latte materno. Pertanto il suo bambino può essere protetto da alcune infezioni.
- L’esperienza clinica con le immunoglobuline suggerisce che non sono da attendersi effetti nocivi sulla fertilità.
Guida di veicoli e utilizzo di macchinari
La capacità di guidare veicoli o di usare macchinari può essere alterata da alcune reazioni avverse associate a
VENITAL. I pazienti che manifestano reazioni avverse durante il trattamento devono attendere la loro
risoluzione prima di guidare veicoli o usare macchinari.
VENITAL contiene maltosio e sodio
Il prodotto contiene 100 mg di maltosio per ml.
Questo prodotto medicinale contiene circa 69 mg di sodio per litro. Da tenere in considerazione per i pazienti
che seguono una dieta a regime sodico controllato.
3. Come usare VENITAL
VENITAL può essere utilizzato solo in ospedale o in cliniche e case di cura da parte di professionisti medici
o altri operatori sanitari.
La dose e lo schema di trattamento dipendono dall’indicazione; il medico stabilirà la dose e lo schema di
trattamento adatti a Lei.
All’inizio dell’infusione riceverà VENITAL con una bassa velocità di infusione. Se la tollera, il medico può
gradualmente aumentare la velocità di infusione.
Uso nei bambini e negli adolescenti
La posologia nei bambini e negli adolescenti (0-18 anni) non è differente da quella degli adulti poiché la
posologia per ciascuna indicazione è data per peso corporeo e aggiustata in base alla risposta clinica del
paziente.
Se usa più VENITAL di quanto deve
Se Le viene somministrato più VENITAL del dovuto, si può verificare un sovraccarico di liquidi ed il sangue
può diventare troppo denso (iperviscoso); questo si manifesta particolarmente nei pazienti a rischio,
soprattutto nei pazienti anziani o con alterata funzionalità cardiaca o renale.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Gli effetti indesiderati riportati di seguito possono in generale verificarsi dopo trattamento con
immunoglobuline:
- brividi, mal di testa, capogiro, febbre, vomito, nausea, reazioni allergiche, artralgie (dolori delle articolazioni), abbassamento della pressione del sangue e dolore lombare di moderata intensità sono stati riportati occasionalmente;
- casi isolati di riduzione temporanea dei globuli rossi (anemia emolitica reversibile/emolisi);
- un improvviso abbassamento della pressione del sangue è stato riportato raramente e, in alcuni casi isolati, possono verificarsi reazioni di ipersensibilità (shock anafilattico) anche quando il paziente non abbia mostrato reazioni a precedenti somministrazioni;
- sono stati osservati rari casi di reazioni cutanee transitorie;
- molto raramente sono state osservate reazioni tromboemboliche (formazione di coaguli nel sangue) che possono causare infarto miocardico, ictus, ostruzione delle vene polmonari (embolia polmonare) e trombosi delle vene profonde;
- casi di meningite non infettiva transitoria (meningite asettica reversibile);
- sono stati riportati un aumento del livello di creatinina nel sangue e/o casi di improvvisa insufficienza renale;
- casi di danno polmonare acuto associato a trasfusione (TRALI).
Gli effetti indesiderati riportati durante la somministrazione di Ig VENA, immunoglobulina che ha la stessa
forma farmaceutica e composizione quali-quantitativa di VENITAL, in studi clinici e quelli segnalati dopo
l’immissione in commercio del medicinale sono elencati di seguito in ordine di frequenza decrescente.
Comuni (può interessare fino a 1 paziente su 10)
- Dolore alla schiena
- Nausea
- Debolezza generalizzata, affaticamento, febbre
- Dolore muscolare
- Mal di testa, sonnolenza
Frequenza non nota (non può essere stimata dai dati disponibili)
- Meningite non infettiva
- Distruzione e conseguente mancanza di globuli rossi
- Reazioni allergiche e shock allergico che mette a rischio la vita
- Stato confusionale
- Ictus, capogiro, tremito involontario, intorpidimento e formicolio della pelle o di un arto
- Attacco cardiaco, colorazione bluastra o violacea della pelle, battito cardiaco rapido, battito cardiaco lento, battito cardiaco irregolare
- Coaguli di sangue nelle vene maggiori e nei vasi sanguigni, pressione del sangue bassa, pressione del sangue alta, pallore
- Coaguli di sangue in una arteria maggiore dei polmoni, volume anormale di fluidi nei polmoni, difficoltà a respirare con respiro affannoso e tosse
- Vomito, diarrea, dolore addominale
- Gonfiore rapido della pelle, orticaria, arrossamento ed infiammazione della pelle, eruzione cutanea, prurito, eczema, sudorazione eccessiva
- Dolore a muscoli ed articolazioni, dolore dorsale, dolore al collo, rigidità muscoloscheletrica
- Improvvisa insufficienza renale
- Infiammazione venosa al sito di iniezione, brividi, dolore o fastidio al torace, gonfiore del viso, sensazione di malessere generale
- Aumento del livello di creatinina nel sangue
Effetti indesiderati aggiuntivi nei bambini e negli adolescenti
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelle negli
adulti.
Una leggera e transitoria glicosuria (presenza di glucosio nelle urine) senza una significatività clinica è stata
osservata nei bambini dopo somministrazione di Ig VENA, che ha la stessa forma farmaceutica e
composizione quali-quantitativa di VENITAL.
Per informazioni sulla sicurezza virale vedere il paragrafo 2 “ Prima di usare VENITAL”.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
5. Come conservare VENITAL
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sull’imballaggio esterno
dopo “Scad.”. La data di scadenza si riferisce all’ultimo giorno del mese.
Conservare in frigorifero (2 C - 8 C).
Una volta che il contenitore per l’infusione è stato aperto, il contenuto deve essere usato immediatamente.
Tenere il flaconcino nell’imballaggio esterno.
Non congelare.
Non usi questo medicinale se nota che la soluzione è torbida o contiene depositi o presenta variazione di
colore.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare
i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene VENITAL
Il principio attivo di VENITAL è l’immunoglobulina umana normale.
Un ml di soluzione contiene 50 mg di immunoglobulina umana normale.
La soluzione contiene proteine umane in quantità di 50 g/l delle quali almeno il 95% è costituito da
immunoglobuline G (IgG).
Le sottoclassi di immunoglobuline di tipo G (IgG) hanno la seguente distribuzione:
IgG 62,1 %
IgG 34,8 %
IgG 2,5 %
IgG 0,6 %
Il contenuto massimo di IgA è di 50 microgrammi/ml.
Prodotto da plasma di donatori umani.
Gli altri componenti sono maltosio ed acqua per preparazioni iniettabili.
Descrizione dell’aspetto di VENITAL e contenuto della confezione
VENITAL è una soluzione per infusione, limpida o leggermente opalescente, incolore o giallo pallido.
VENITAL 1 g/20 ml soluzione per infusione, flaconcino da 20 ml
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio:
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca) - ITALIA.
Produttore: Kedrion S.p.A., 55027 Bolognana, Gallicano (Lucca) - ITALIA.
Le informazioni seguenti sono destinate esclusivamente ai medici o agli operatori sanitari:
Istruzioni per un uso corretto
- Prima della somministrazione portare il prodotto a temperatura ambiente o corporea.
- Prima della somministrazione ispezionare visivamente la soluzione per rilevare corpuscoli o alterazioni cromatiche. Non usare soluzioni torbide o che presentano depositi.
- L’immunoglobulina umana normale (VENITAL) deve essere infusa per via endovenosa ad una velocità iniziale di 0,46 - 0,92 ml/kg/h (10 - 20 gocce al minuto) per 20 - 30 minuti. In caso di reazione avversa, è necessario ridurre la velocità di somministrazione o interrompere l'infusione. Se ben tollerata, la velocità di somministrazione può essere gradualmente aumentata fino ad un massimo di 1,85 ml/kg/h (40 gocce/minuto).
- Nei pazienti affetti da PID che tollerano la velocità di infusione di 0,92 ml/kg/h, la velocità di somministrazione può essere aumentata gradualmente a 2 ml/kg/h, 4 ml/kg/h, fino ad un massimo di 6 ml/kg/h, ogni 20-30 minuti e solo se il paziente tollera bene l’infusione.
- In generale, il dosaggio e la velocità di infusione devono essere singolarmente adattati in base alle esigenze del paziente. A seconda del peso corporeo, del dosaggio e dell’insorgenza di reazioni avverse, il paziente può non raggiungere la massima velocità di infusione. In caso di reazione avversa, l’infusione deve essere interrotta immediatamente e deve essere ripresa applicando la velocità più appropriata per il paziente.
Popolazioni speciali
Nei pazienti pediatrici (0-18 anni) e negli anziani (> 64 anni), la velocità iniziale di somministrazione
deve essere di 0,46 – 0,92 ml/kg/h (10 - 20 gocce al minuto) per 20-30 minuti. Se ben tollerata e sulla
base delle condizioni cliniche del paziente, la velocità di infusione può essere gradualmente aumentata
fino ad un massimo di 1,85 ml/kg/h (40 gocce/minuto).
Particolari precauzioni
Alcune gravi reazioni avverse al prodotto possono essere dovute alla velocità di infusione.
Potenziali complicazioni spesso possono essere evitate assicurandosi:
- che i pazienti non siano sensibili all’immunoglobulina umana normale somministrando all’inizio il prodotto lentamente (con una velocità di infusione compresa tra 0,46 e 0,92 ml/kg/h);
- che i pazienti siano controllati attentamente per qualunque sintomo durante il periodo di infusione. In particolare, i pazienti che ricevono per la prima volta immunoglobulina umana normale, i pazienti che hanno cambiato tipo di prodotto a base di IVIg e i pazienti per i quali è trascorso un lungo intervallo di tempo dalla precedente infusione, devono essere controllati durante la prima infusione e per la prima ora dopo la prima infusione, per individuare potenziali segnali di reazioni avverse. Tutti gli altri pazienti devono essere osservati per almeno 20 minuti dopo la somministrazione. In tutti i pazienti la somministrazione di IVIg richiede:
- una adeguata idratazione prima dell’inizio dell’infusione di IVIg;
- il controllo del volume urinario;
- il controllo del livello di creatinina sierica;
- di evitare l’uso concomitante di diuretici dell’ansa. In caso di reazione avversa la velocità di somministrazione deve essere ridotta o l’infusione deve essere interrotta. Il trattamento necessario dipende dalla natura e dalla gravità dell’effetto indesiderato. In caso di shock, deve essere eseguito il trattamento medico standard per lo shock. Reazione all'infusione Alcune reazioni avverse (ad esempio mal di testa, vampate di calore, brividi, mialgia, respiro sibilante, tachicardia, dolore lombare, nausea e ipotensione) possono essere correlate alla velocità di infusione. La velocità di infusione raccomandata deve essere attentamente seguita. I pazienti devono essere strettamente monitorati e osservati attentamente per qualsiasi sintomo durante il periodo di infusione.
Le reazioni avverse possono verificarsi più frequentemente
- in pazienti che ricevono immunoglobulina umana normale per la prima volta o, in rari casi, quando il prodotto medicinale a base di immunoglobulina umana normale viene cambiato o nel caso di un lungo intervallo dall'infusione precedente
- in pazienti con infezione non trattata o infiammazione cronica
Bambini e adolescenti
Non sono richieste misure o monitoraggi specifici per la popolazione pediatrica.
Nessuna differenza è attesa nella popolazione pediatrica (0-18 anni).
Tromboembolismo
Esistono evidenze cliniche che dimostrano una relazione tra la somministrazione di IVIg ed eventi
tromboembolici come infarto miocardico,accidente cerebrovascolare (incluso l’ictus), embolia polmonare e
trombosi venosa profonda che si presume siano correlati ad un aumento relativo della viscosità del sangue
dovuto ad un elevato afflusso di immunoglobulina in pazienti a rischio. Bisogna essere cauti nella
prescrizione e nell’infusione di IVIg in pazienti obesi ed in pazienti con fattori di rischio pre-esistenti per
eventi trombotici (come età avanzata, ipertensione, diabete mellito e anamnesi di malattie vascolari o episodi
trombotici, pazienti con disordini trombofilici ereditari o acquisiti, pazienti immobilizzati per un periodo
prolungato, pazienti gravemente ipovolemici, pazienti con malattie che aumentano la viscosità del sangue).
In pazienti a rischio per reazioni avverse tromboemboliche, i prodotti a base di IVIg devono essere
somministrati alla minima velocità di infusione e dose praticabili.
Insufficienza renale acuta
In pazienti che hanno ricevuto IVIg sono stati riportati casi di insufficienza renale acuta. Nella maggior parte
dei casi, i fattori di rischio sono stati identificati ed includono insufficienza renale pre-esistente, diabete
mellito, ipovolemia, sovrappeso, somministrazione concomitante di medicinali nefrotossici o età superiore a
65 anni.
I parametri renali devono essere valutati prima dell'infusione di IVIg, in particolare nei pazienti ritenuti
potenzialmente a rischio di sviluppare insufficienza renale acuta, e di nuovo a intervalli appropriati. Nei
pazienti a rischio di insufficienza renale acuta, i prodotti a base di IVIg devono essere somministrati alla
minima velocità di infusione e dose praticabili. In caso di alterazioni della funzione renale deve essere presa
in considerazione l’interruzione del trattamento con IVIg.
Anche se casi di disfunzione renale ed insufficienza renale acuta sono stati messi in relazione con l’uso di
molti prodotti medicinali a base di IVIg contenenti vari eccipienti come il saccarosio, il glucosio e il
maltosio, quelli contenenti saccarosio come stabilizzante rappresentano un’altissima percentuale del numero
complessivo. Nei pazienti a rischio può essere preso in considerazione l’uso di prodotti medicinali a base di
IVIg che non contengono questi eccipienti.
Sindrome da meningite asettica (AMS)
La sindrome da meningite asettica può manifestarsi in combinazione con il trattamento con IVIg.
Generalmente la sindrome inizia dopo un periodo che varia da diverse ore a 2 giorni dal trattamento con
IVIg. Gli studi sul liquido cerebrospinale spesso sono positivi per pleiocitosi fino a diverse migliaia di cellule
per mm , soprattutto granulociti, e livelli di proteine elevati, fino a diverse centinaia di mg/dl.
L’AMS si può manifestare più frequentemente in associazione con alte dosi di IVIg (2 g/kg).
I pazienti che presentano tali segni e sintomi devono ricevere un esame neurologico completo, compresi gli
studi del liquido cefalorachidiano, per escludere altre cause di meningite.
L'interruzione del trattamento con IVIg ha portato alla remissione dell'AMS entro alcuni giorni, senza
conseguenze.
Anemia emolitica
I prodotti a base di IVIg possono contenere anticorpi gruppo sanguigno-specifici che possono agire come
emolisine e indurre il rivestimento in vivo dei globuli rossi con le immunoglobuline, causando una reazione
antiglobulinica diretta positiva (test di Coombs) e, raramente, l’emolisi. L’anemia emolitica può svilupparsi a
seguito della terapia con IVIg a causa dell’aumentato sequestro dei globuli rossi. I pazienti che ricevono IVIg
devono essere sottoposti a monitoraggio per la rilevazione di segni clinici e sintomi di emolisi.
Neutropenia/Leucopenia
Una diminuzione transitoria della conta dei neutrofili e/o episodi di neutropenia, a volte gravi, sono stati
riportati dopo il trattamento con IVIg. Questo si verifica in genere entro poche ore o giorni dopo la
somministrazione di IVIg e si risolve spontaneamente entro 7-14 giorni.
Danno polmonare acuto associato a trasfusione (TRALI)
Nei pazienti che ricevono IVIg sono stati riportati alcuni casi di edema polmonare acuto non cardiogeno
(danno polmonare acuto associato a trasfusione, TRALI). Il TRALI è caratterizzato da ipossia severa,
dispnea, tachipnea, cianosi, febbre ed ipotensione. I sintomi associati al TRALI tipicamente compaiono
durante la trasfusione o entro 6 ore dalla trasfusione, generalmente entro 1-2 ore. Pertanto, i pazienti che
ricevono IVIg devono essere monitorati e l’infusione con il prodotto deve essere immediatamente interrotta
in caso di comparsa di reazioni avverse polmonari. Il TRALI è una condizione che può mettere il paziente in
pericolo di vita richiedendone l’immediato ricovero in reparto di terapia intensiva.
Questo prodotto contiene 100 mg per ml di maltosio come eccipiente. L’interferenza del maltosio con i test
della glicemia può portare ad una sovrastima dei valori di glucosio e, di conseguenza, ad una non adeguata
somministrazione di insulina, che può causare uno stato di ipoglicemia con rischio di vita e la morte del
paziente. Inoltre, i casi di reale ipoglicemia possono non essere trattati se lo stato ipoglicemico è mascherato
da valori di glucosio falsamente elevati. Per ulteriori dettagli vedere il paragrafo “ Test della glicemia”.
Raccomandazioni per il dosaggio
La terapia sostitutiva deve essere iniziata e monitorata sotto la supervisione di un medico con esperienza nel
trattamento dell’immunodeficienza.
Posologia
La dose e lo schema posologico dipendono dall’indicazione. La dose deve essere personalizzata per ogni
paziente in base alla risposta clinica. La dose basata sul peso corporeo può richiedere un adattamento nei
pazienti sottopeso o sovrappeso.
I seguenti schemi posologici possono essere usati come riferimento.
Terapia sostitutiva nelle sindromi da immunodeficienza primaria
Il regime posologico deve indurre il raggiungimento di un livello base di IgG (misurato prima della
successiva infusione) di almeno 6 g/L o entro il normale intervallo di riferimento per l'età della popolazione.
Dall’inizio della terapia, sono necessari da 3 a 6 mesi per raggiungere un equilibrio (stato stazionario dei
livelli di IgG).
La dose iniziale raccomandata è di 0,4 – 0,8 g/kg in unica somministrazione, seguiti da almeno 0,2 g/kg
somministrati ogni 3-4 settimane.
La dose richiesta per raggiungere un livello base di 6 g/L è nell’ordine di 0,2 – 0,8 g/kg/mese. L’intervallo
tra le dosi varia da 3 a 4 settimane dopo che si è raggiunto lo stato stazionario. I livelli base di IgG devono
essere misurati e valutati insieme all’incidenza di infezioni. Può essere necessario aumentare la dose e
raggiungere livelli base più elevati per ridurre la frequenza di infezioni batteriche.
Immunodeficienze secondarie
La dose raccomandata è di 0,2 – 0,4 g/kg ogni 3 - 4 settimane.
I livelli base di IgG devono essere misurati e valutati insieme all'incidenza dell'infezione. La dose deve
essere aggiustata al bisogno per ottenere una protezione ottimale contro le infezioni, un aumento può essere
necessario in pazienti con infezione persistente; una diminuzione della dose può essere presa in
considerazione quando il paziente rimane privo di infezione.
Trombocitopenia immune primaria
Esistono due schemi di trattamento alternativi:
- 0,8 - 1g/kg somministrati il giorno 1; questa dose può essere ripetuta una volta entro 3 giorni;
- 0,4 g/kg al giorno per 2 - 5 giorni. Il trattamento può essere ripetuto in caso di ricadute.
Sindrome di Guillain Barré
0,4 g/kg/giorno per 5 giorni (possibile ripetizione del dosaggio in caso di recidiva).
Malattia di Kawasaki
2,0 g/kg devono essere somministrati in dose singola. I pazienti devono ricevere un trattamento concomitante
con acido acetilsalicilico.
Poliradicoloneuropatia cronica infiammatoria demielinizzante (CIDP)
Dose iniziale: 2 g/kg suddivisi in 2-5 giorni consecutivi.
Dosi di mantenimento:
1 g/kg in 1-2 giorni consecutivi ogni 3 settimane.
L'effetto del trattamento deve essere valutato dopo ogni ciclo; se non si osserva alcun effetto del trattamento
dopo 6 mesi, il trattamento deve essere interrotto.
Se la terapia è efficace, la sua somministrazione a lungo termine è a discrezione del medico in base
alla risposta del paziente e alla risposta di mantenimento. Il dosaggio e gli intervalli possono dover essere
adattati in base al decorso individuale della malattia.
Neuropatia Motoria Multifocale (MMN)
Dose iniziale: 2 g/kg somministrati in 2-5 giorni consecutivi.
Dosi di mantenimento: 1 g/kg ogni 2-4 settimane o 2 g/kg ogni 4-8 settimane.
L'effetto del trattamento deve essere valutato dopo ogni ciclo; se non si osserva alcun effetto del trattamento
dopo 6 mesi, il trattamento deve essere interrotto.
Se la terapia è efficace, la sua somministrazione a lungo termine è a discrezione del medico in base alla
risposta del paziente e alla risposta di mantenimento. Il dosaggio e gli intervalli possono dover essere adattati
in base al decorso individuale della malattia.
Le dosi raccomandate sono riassunte nella seguente tabella:
| Indicazione | Dose | Frequenza delle iniezioni |
| A Terapia sostitutiva | ||
| Sindromi da immunodeficienza primaria | Dose iniziale: |
| 0,4 - 0,8 g/kg Dose di mantenimento: 0,2 - 0,8 g/kg | ogni 3 – 4 settimane o | |
| Immunodeficienze Secondarie | 0,2 - 0,4 g/kg | c ogni 3 – 4 settimane |
| Immunomodulazione: | ||
| Trombocitopenia immune primaria | 0,8 - 1 g/kg Oppure 0,4 g/kg/die | a il giorno 1, possibilmente m ripetendo una volta entro 3 giorni r per 2 – 5 giorni |
| Sindrome di Guillain Barrè | 0,4 g/kg/die | a per 5 giorni |
| Malattia di Kawasaki | F 2 g/kg | in dose singola, in associazione con acido acetilsalicilico |
| Poliradiculoneuropatia cronica infiammatoria demielinizzante (CIDP) | l e Dose iniziale: 2 g/kg d Dose di mantenimento: a 1 g/kg | in dosi suddivise in 2 – 5 giorni ogni 3 settimane in 1 – 2 giorni |
| Neuropatia motoria multifocale (MMN) l a t I | n Dose iniziale: 2 g/kg a Dose di mantenimento: i 1 g/kg Oppure 2 g/kg | in 2-5 giorni consecutivi ogni 2-4 settimane Oppure ogni 4-8 settimane in 2-5 giorni |
Uso nei bambini e negli adolescenti
La posologia nei bambini e negli adolescenti (0-18 anni) non è diversa da quella degli adulti poichè la
posologia per ciascuna indicazione è data per peso corporeo e aggiustata in base all’esito clinico delle
suddette condizioni.
Insufficienza epatica
Non ci sono evidenze per richiedere un aggiustamento della dose.
Insufficienza renale
Nessun aggiustamento della dose se non clinicamente giustificato.
Anziani
Nessun aggiustamento della dose se non clinicamente giustificato.
CIDP
A causa della rarità della malattia e, conseguentemente, dell’esiguo numero complessivo di pazienti,
l’esperienza nell’utilizzo di immunoglobuline endovenose in bambini affetti da CIDP è limitata; pertanto,
sono disponibili solo dati di letteratura. Tuttavia, i dati pubblicati sono concordi nel dimostrare che il
trattamento con IVIg è ugualmente efficace nel bambino e nell’adulto, in linea con quanto avviene per le
indicazioni riconosciute per le IVIg.
VENITAL 50 g/l Soluzione per infusione
Immunoglobulina umana normale (IVIg) per uso endovenoso
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos'è VENITAL e a che cosa serve
- 2. Cosa deve sapere prima di usare VENITAL
- 3. Come usare VENITAL
- 4. Possibili effetti indesiderati
- 5. Come conservare VENITAL
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è VENITAL e a che cosa serve
VENITAL è una soluzione di immunoglobulina umana normale per uso endovenoso. Le immunoglobuline
sono anticorpi umani che sono presenti anche nel sangue.
VENITAL viene usato per:
Trattamento di adulti, bambini e adolescenti (0-18 anni) che non hanno anticorpi sufficienti (terapia
sostitutiva) nei seguenti casi:
- 1. Pazienti con deficit congenito della produzione di anticorpi (sindromi da immunodeficienza primaria).
- 2. Pazienti con deficit acquisito della produzione di anticorpi (immunodeficienze secondarie) che soffrono di infezioni gravi o ricorrenti dovute a diverse condizioni mediche (per esempio malattie oncologiche o autoimmuni o per il conseguente trattamento di tali malattie). Questi pazienti sono stati sottoposti a trattamento con antibiotici dimostratosi inefficace e non hanno avuto un incremento sufficientemente positivo del titolo di anticorpi IgG dopo la vaccinazione (vaccini antipneumococcici con antigeni polisaccaridici e polipeptidici) o un livello di IgG nel loro sangue < 4 g/l.
Trattamento di adulti, bambini e adolescenti (0-18 anni) con alcune malattie infiammatorie
(immunomodulazione) nelle seguenti situazioni:
- 1. Pazienti che non hanno sufficienti piastrine (Trombocitopenia Immune Primaria, ITP) e che sono ad alto rischio di sanguinamenti o prima di interventi chirurgici per correggere la conta piastrinica.
- 2. Pazienti con sindrome di Guillain Barrè. Si tratta di una malattia acuta, caratterizzata dall’infiammazione dei nervi periferici, che causa una grave debolezza muscolare, in particolare alle gambe e agli arti superiori.
- 3. Pazienti con morbo di Kawasaki (in combinazione con acido acetilsalicilico). Si tratta di una malattia acuta che colpisce soprattutto i bambini piccoli, caratterizzata da un’infiammazione dei vasi sanguigni di tutto il corpo.
- 4. Pazienti affetti da Poliradiculoneuropatia Cronica Infiammatoria Demielinizzante (CIDP). Questa malattia cronica è un raro disturbo dei nervi periferici caratterizzato da un aumento graduale della debolezza delle gambe e, in misura minore, delle braccia.
- 5. Pazienti con Neuropatia Motoria Multifocale (MMN). Si tratta di una rara condizione che colpisce i nervi motori ed è caratterizzata da debolezza degli arti asimmetrica a progressione lenta senza perdita di sensibilità.
2. Cosa deve sapere prima di usareVENITAL
Non usi VENITAL
Se è allergico (ipersensibile) alle immunoglobuline umane o ad uno qualsiasi degli altri componenti di
questo medicinale (elencati al paragrafo 6).
Se nel sangue ha anticorpi diretti contro le immunoglobuline di tipo IgA, poiché la somministrazione di
un prodotto contenente IgA può provocare una grave reazione allergica.
Avvertenze e precauzioni
Si rivolga al medico o all’infermiere prima di usare VENITAL.
Il medico od un altro operatore sanitario la controllerà rigorosamente e la osserverà attentamente durante
l'intero periodo dell'infusione con VENITAL per verificare che non vi siano reazioni.
Alcune reazioni avverse possono manifestarsi più frequentemente:
- nel caso in cui la velocità dell’infusione sia troppo elevata;
- se ha sintomi incontrollati di infezioni non trattate (ad es. febbre) o sintomi di infiammazione cronica;
- se riceve immunoglobuline umane normali per la prima volta;
- nei rari casi in cui è stato cambiato il tipo di prodotto medicinale a base di immunoglobuline umane normali, o quando è trascorso un lungo intervallo dalla precedente infusione.
- In alcune condizioni, le immunoglobuline possono aumentare il rischio di infarto miocardico, ictus,embolia polmonare, o trombosi venosa profonda poiché aumentano la viscosità del sangue.Pertanto, il medico farà particolare attenzione nelle seguenti circostanze:
- se è in sovrappeso,
- se è anziano,
- se soffre di diabete,
- se ha la pressione sanguigna alta (ipertensione),
- se il volume del sangue è troppo basso (ipovolemia),
- se ha o ha avuto problemi ai vasi sanguigni (malattie vascolari),
- se ha un’aumentata tendenza alla coagulazione del sangue (disordini trombofilici ereditari o acquisiti),
- se soffre di episodi trombotici,
- se soffre di malattie che aumentano la densità del sangue (viscosità),
- se ha avuto un prolungato periodo di immobilità,
- se ha o ha avuto problemi ai reni o se assume medicinali che possono danneggiare i reni (medicinali nefrotossici), poiché sono stati riportati casi di insufficienza renale acuta. In caso di danno renale, il medico prenderà in considerazione l’interruzione del trattamento.
- Lei può essere allergico (ipersensibile) alle immunoglobuline (anticorpi) senza saperlo.Ciò può accadere anche se ha già ricevuto immunoglobuline umane normali in passato e ha tollerato precedenti somministrazioni. Questa eventualità può verificarsi in particolare se non ha abbastanza immunoglobuline di tipo IgA (deficienza di IgA con anticorpi anti-IgA). In questi rari casi possono verificarsi reazioni allergiche (di ipersensibilità) come un abbassamento della pressione del sangue o shock. In caso di reazione avversa, il medico deciderà se ridurre la velocità di somministrazione o se interrompere l’infusione. Inoltre il medico deciderà il trattamento necessario sulla base della natura e della gravità dell’effetto indesiderato.
In caso di shock, il medico dovrà eseguire il trattamento standard per lo shock. Informi il medico se soffre di
una delle condizioni descritte sopra, il medico userà particolare cautela nel prescriverle e nel somministrarle
VENITAL.
Sicurezza virale
I medicinali che sono preparati da sangue o plasma umano vengono sottoposti ad un certo numero di misure
di sicurezza per prevenire la trasmissione di infezioni ai pazienti. Queste misure includono un’attenta
selezione dei donatori di sangue o di plasma per assicurarsi che i donatori potenzialmente infetti vengano
esclusi ed il controllo di ogni donazione e pool di plasma per evidenziare l’eventuale presenza di virus. I
produttori di questi medicinali inoltre introducono nella lavorazione del sangue o del plasma alcuni passaggi
capaci di inattivare o rimuovere i patogeni. Nonostante queste misure, quando si somministrano medicinali
preparati da sangue o plasma umano, la possibilità di trasmettere un’infezione non può essere totalmente
esclusa. Ciò vale anche per virus, o altri tipi di agenti infettivi, emergenti o sconosciuti.
Le misure adottate sono considerate efficaci per i virus con involucro lipidico come il virus
dell’immunodeficienza umana (HIV), il virus dell’epatite B (HBV), il virus dell’epatite C (HCV) ed il virus
senza involucro lipidico dell’epatite A (HAV). Le misure adottate hanno un valore limitato contro i virus
senza involucro lipidico come il parvovirus B19.
Le immunoglobuline non sono state associate con infezioni da epatite A o da parvovirus B19, ciò può essere
dovuto al fatto che gli anticorpi contro queste infezioni, che sono contenuti nel prodotto, hanno capacità
protettiva.
Si raccomanda fortemente di registrare il nome commerciale e il numero di lotto ogniqualvolta si riceva una
dose di VENITAL, in modo da avere una documentazione sui lotti utilizzati.
Bambini e adolescenti
Una leggera e transitoria glicosuria (presenza di glucosio nelle urine) senza segni clinici è stata osservata nei
pazienti pediatrici dopo somministrazione di Ig VENA, che ha la stessa forma farmaceutica e composizione
quali-quantitativa di VENITAL. Questo evento può essere correlato al maltosio contenuto in Ig VENA, così
come VENITAL (stessa forma farmaceutica e composizione quali-quantitativa), dal momento che, nei tubuli
renali, il maltosio è idrolizzato a glucosio, il quale viene riassorbito e escreto nelle urine generalmente solo
in piccola parte. Il riassorbimento del glucosio è un meccanismo dipendente dall’età. L’aumento transitorio
del maltosio nel plasma può superare la capacità del rene di riassorbire lo zucchero e risultare in un test
positivo per il glucosio nelle urine.
Altri medicinali e VENITAL
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale.
Le immunoglobuline umane normali per uso endovenoso non devono essere mescolate con altri prodotti
medicinali, né con altri prodotti a base di IVIg.
Vaccini a virus vivi attenuati
La somministrazione di immunoglobulina può alterare per un periodo di almeno 6 settimane e fino a 3 mesi
l'efficacia dei vaccini a virus vivi attenuati come quelli per morbillo, rosolia, parotite e varicella. Dopo la
somministrazione di questo prodotto, deve trascorrere un intervallo di tre mesi prima della vaccinazione con
vaccini a virus vivi attenuati. Nel caso del morbillo, questo indebolimento della risposta può durare anche
fino ad un anno. Quindi nei pazienti che ricevono il vaccino del morbillo deve essere controllato il livello
degli anticorpi.
Diuretici dell'ansa (un gruppo di medicinali che aumentano la produzione di urina)
Evitare l'uso concomitante di diuretici dell'ansa.
Esami del sangue
VENITAL può interferire con alcuni esami del sangue a causa dell’aumento temporaneo di vari anticorpi che
dopo l’infusione di immunoglobuline sono trasferiti passivamente nel suo sangue; questo aumento degli
anticorpi può far sì che alcuni esami del sangue abbiano un risultato che potrebbe non essere corretto. La
trasmissione passiva di anticorpi contro gli antigeni eritrocitari, es. A, B, D (determinanti il gruppo
sanguigno), può interferire con alcuni test sierologici per anticorpi dei globuli rossi, per esempio il test
diretto dell’antiglobulina (DAT, test di Coombs diretto).
Test della glicemia
Alcuni sistemi di misurazione della glicemia (per esempio, quelli basati sulla glucosio-deidrogenasi
pirrolochinolina chinone (GDH-PQQ) o sul metodo colorimetrico della glucosio-ossidoreduttasi)
riconoscono falsamente il maltosio (100 mg/ml) contenuto in VENITAL come glucosio. Questo può risultare
in una lettura di valori di glicemia falsamente elevati durante l’infusione e per un periodo di circa 15 ore
successivamente alla fine dell’infusione e, conseguentemente, in una inadeguata somministrazione di
insulina, causando un pericolo di vita o addirittura una ipoglicemia fatale. Inoltre, casi di reale ipoglicemia
possono non essere trattati se lo stato ipoglicemico è mascherato da valori di glucosio falsamente elevati. Di
conseguenza, durante la somministrazione di VENITAL o di altri prodotti parenterali contenenti maltosio, la
misurazione della glicemia deve essere fatta con metodi glucosio-specifici. Le istruzioni d’uso del sistema
per la misurazione della glicemia, incluse quelle delle strisce reattive, devono essere attentamente controllate
per stabilire se il sistema è appropriato per l’utilizzo nei pazienti trattati con prodotti parenterali contenenti
maltosio. Qualora ci fossero dubbi, contattare il produttore del sistema di misurazione per determinare
l’appropriatezza d’impiego in concomitanza d’uso di prodotti parenterali contenenti maltosio.
Bambini e adolescenti
Sebbene non siano stati condotti studi specifici d’interazione nella popolazione pediatrica, non si attendono
differenze rispetto ai pazienti adulti.
Gravidanza, allattamento e fertilità
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno chieda consiglio al medico prima di prendere questo medicinale. Il medico deciderà se è opportuno utilizzare VENITAL durante la gravidanza e l’allattamento.
- Non sono stati condotti studi clinici con VENITAL nelle donne in gravidanza. È stato dimostrato che i prodotti a base di immunoglobuline umane per uso endovenoso attraversano la placenta in modo crescente durante il terzo trimestre. Tuttavia, medicinali contenenti anticorpi vengono usati da anni in donne in gravidanza ed è stato dimostrato che non sono da aspettarsi effetti dannosi sul decorso della gravidanza, sul feto e sul neonato.
- Se sta allattando ed è in trattamento con VENITAL, gli anticorpi contenuti nel prodotto possono passare nel latte materno. Pertanto il suo bambino può essere protetto da alcune infezioni.
- L’esperienza clinica con le immunoglobuline suggerisce che non sono da attendersi effetti nocivi sulla fertilità.
Guida di veicoli e utilizzo di macchinari
La capacità di guidare veicoli o di usare macchinari può essere alterata da alcune reazioni avverse associate a
VENITAL. I pazienti che manifestano reazioni avverse durante il trattamento devono attendere la loro
risoluzione prima di guidare veicoli o usare macchinari.
VENITAL contiene maltosio e sodio
Il prodotto contiene 100 mg di maltosio per ml.
Questo prodotto medicinale contiene circa 69 mg di sodio per litro. Da tenere in considerazione per i pazienti
che seguono una dieta a regime sodico controllato.
3. Come usare VENITAL
VENITAL può essere utilizzato solo in ospedale o in cliniche e case di cura da parte di professionisti medici
o altri operatori sanitari.
La dose e lo schema di trattamento dipendono dall’indicazione; il medico stabilirà la dose e lo schema di
trattamento adatti a Lei.
All’inizio dell’infusione riceverà VENITAL con una bassa velocità di infusione. Se la tollera, il medico può
gradualmente aumentare la velocità di infusione.
Uso nei bambini e negli adolescenti
La posologia nei bambini e negli adolescenti (0-18 anni) non è differente da quella degli adulti poiché la
posologia per ciascuna indicazione è data per peso corporeo e aggiustata in base alla risposta clinica del
paziente.
Se usa più VENITAL di quanto deve
Se Le viene somministrato più VENITAL del dovuto, si può verificare un sovraccarico di liquidi ed il sangue
può diventare troppo denso (iperviscoso); questo si manifesta particolarmente nei pazienti a rischio,
soprattutto nei pazienti anziani o con alterata funzionalità cardiaca o renale.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Gli effetti indesiderati riportati di seguito possono in generale verificarsi dopo trattamento con
immunoglobuline:
- brividi, mal di testa, capogiro, febbre, vomito, nausea, reazioni allergiche, artralgie (dolori delle articolazioni), abbassamento della pressione del sangue e dolore lombare di moderata intensità sono stati riportati occasionalmente;
- casi isolati di riduzione temporanea dei globuli rossi (anemia emolitica reversibile/emolisi);
- un improvviso abbassamento della pressione del sangue è stato riportato raramente e, in alcuni casi isolati, possono verificarsi reazioni di ipersensibilità (shock anafilattico) anche quando il paziente non abbia mostrato reazioni a precedenti somministrazioni;
- sono stati osservati rari casi di reazioni cutanee transitorie;
- molto raramente sono state osservate reazioni tromboemboliche (formazione di coaguli nel sangue) che possono causare infarto miocardico, ictus, ostruzione delle vene polmonari (embolia polmonare) e trombosi delle vene profonde;
- casi di meningite non infettiva transitoria (meningite asettica reversibile);
- sono stati riportati un aumento del livello di creatinina nel sangue e/o casi di improvvisa insufficienza renale;
- casi di danno polmonare acuto associato a trasfusione (TRALI).
Gli effetti indesiderati riportati durante la somministrazione di Ig VENA, immunoglobulina che ha la stessa
forma farmaceutica e composizione quali-quantitativa di VENITAL, in studi clinici e quelli segnalati dopo
l’immissione in commercio del medicinale sono elencati di seguito in ordine di frequenza decrescente.
Comuni (può interessare fino a 1 paziente su 10)
- Dolore alla schiena
- Nausea
- Debolezza generalizzata, affaticamento, febbre
- Dolore muscolare
- Mal di testa, sonnolenza
Frequenza non nota (non può essere stimata dai dati disponibili)
- Meningite non infettiva
- Distruzione e conseguente mancanza di globuli rossi
- Reazioni allergiche e shock allergico che mette a rischio la vita
- Stato confusionale
- Ictus, capogiro, tremito involontario, intorpidimento e formicolio della pelle o di un arto
- Attacco cardiaco, colorazione bluastra o violacea della pelle, battito cardiaco rapido, battito cardiaco lento, battito cardiaco irregolare
- Coaguli di sangue nelle vene maggiori e nei vasi sanguigni, pressione del sangue bassa, pressione del sangue alta, pallore
- Coaguli di sangue in una arteria maggiore dei polmoni, volume anormale di fluidi nei polmoni, difficoltà a respirare con respiro affannoso e tosse
- Vomito, diarrea, dolore addominale
- Gonfiore rapido della pelle, orticaria, arrossamento ed infiammazione della pelle, eruzione cutanea, prurito, eczema, sudorazione eccessiva
- Dolore a muscoli ed articolazioni, dolore dorsale, dolore al collo, rigidità muscoloscheletrica
- Improvvisa insufficienza renale
- Infiammazione venosa al sito di iniezione, brividi, dolore o fastidio al torace, gonfiore del viso, sensazione di malessere generale
- Aumento del livello di creatinina nel sangue
Effetti indesiderati aggiuntivi nei bambini e negli adolescenti
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelle negli
adulti.
Una leggera e transitoria glicosuria (presenza di glucosio nelle urine) senza una significatività clinica è stata
osservata nei bambini dopo somministrazione di Ig VENA, che ha la stessa forma farmaceutica e
composizione quali-quantitativa di VENITAL.
Per informazioni sulla sicurezza virale vedere il paragrafo 2 “ Prima di usare VENITAL”.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
5. Come conservare VENITAL
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sull’imballaggio esterno
dopo “Scad.”. La data di scadenza si riferisce all’ultimo giorno del mese.
Conservare in frigorifero (2 C -8 C).
Prima dell’utilizzo ed entro la data di scadenza, il prodotto può essere conservato a temperatura ambiente,
non superiore ai 25°C, per un massimo di 6 mesi consecutivi. Dopo questo periodo, il prodotto deve essere
smaltito. In ogni caso, il prodotto non può più essere riposto in frigorifero se conservato a temperatura
ambiente. Registri la data di inizio della conservazione a temperatura ambiente sulla scatola esterna.
Una volta che il contenitore per l’infusione è stato aperto, il contenuto deve essere usato immediatamente.
Tenere il flaconcino nell’imballaggio esterno.
Non congelare.
Non usi questo medicinale se nota che la soluzione è torbida o contiene depositi o presenta variazione di
colore.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare
i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene VENITAL
Il principio attivo di VENITAL è l’immunoglobulina umana normale.
Un ml di soluzione contiene 50 mg di immunoglobulina umana normale.
La soluzione contiene proteine umane in quantità di 50 g/l delle quali almeno il 95% è costituito da
immunoglobuline G (IgG).
Le sottoclassi di immunoglobuline di tipo G (IgG) hanno la seguente distribuzione:
IgG 62,1 %
IgG 34,8 %
IgG 2,5 %
IgG 0,6 %
Il contenuto massimo di IgA è di 50 microgrammi/ml.
Prodotto da plasma di donatori umani.
Gli altri componenti sono maltosio ed acqua per preparazioni iniettabili.
Descrizione dell’aspetto di VENITAL e contenuto della confezione
VENITAL è una soluzione per infusione, limpida o leggermente opalescente, incolore o giallo pallido.
VENITAL 2,5 g/50 ml soluzione per infusione, flaconcino da 50 ml + appendino estendibile
VENITAL 5 g/100 ml soluzione per infusione, flaconcino da 100 ml + appendino estendibile
VENITAL 10 g/200 ml soluzione per infusione, flaconcino da 200 ml + appendino estendibile
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio:
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca) - ITALIA.
Produttore: Kedrion S.p.A., 55027 Bolognana, Gallicano (Lucca) - ITALIA.
Le informazioni seguenti sono destinate esclusivamente ai medici o agli operatori sanitari:
Istruzioni per un uso corretto
- Prima della somministrazione portare il prodotto a temperatura ambiente o corporea.
- Prima della somministrazione ispezionare visivamente la soluzione per rilevare corpuscoli o alterazioni cromatiche. Non usare soluzioni torbide o che presentano depositi.
- L’immunoglobulina umana normale (VENITAL) deve essere infusa per via endovenosa ad una velocità iniziale di 0,46 - 0,92 ml/kg/h (10 - 20 gocce al minuto) per 20 - 30 minuti. In caso di reazione avversa, è necessario ridurre la velocità di somministrazione o interrompere l'infusione. Se ben tollerata, la velocità di somministrazione può essere gradualmente aumentata fino ad un massimo di 1,85 ml/kg/h (40 gocce/minuto).
- Nei pazienti affetti da PID che tollerano la velocità di infusione di 0,92 ml/kg/h, la velocità di somministrazione può essere aumentata gradualmente a 2 ml/kg/h, 4 ml/kg/h, fino ad un massimo di 6 ml/kg/h, ogni 20-30 minuti e solo se il paziente tollera bene l’infusione.
- In generale, il dosaggio e la velocità di infusione devono essere singolarmente adattati in base alle esigenze del paziente. A seconda del peso corporeo, del dosaggio e dell’insorgenza di reazioni avverse, il paziente può non raggiungere la massima velocità di infusione. In caso di reazione avversa, l’infusione deve essere interrotta immediatamente e deve essere ripresa applicando la velocità più appropriata per il paziente.
Popolazioni speciali
Nei pazienti pediatrici (0-18 anni) e negli anziani (> 64 anni), la velocità iniziale di somministrazione
deve essere di 0,46 – 0,92 ml/kg/h (10 - 20 gocce al minuto) per 20-30 minuti. Se ben tollerata e sulla
base delle condizioni cliniche del paziente, la velocità di infusione può essere gradualmente aumentata
fino ad un massimo di 1,85 ml/kg/h (40 gocce/minuto).
Istruzioni d’uso dell’appendino estendibile
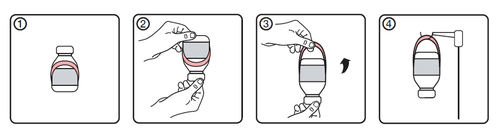
- 1. Condizione iniziale del flaconcino con l’etichetta appendi-flacone
- 2. Capovolgere il flaconcino
- 3. Ruotare verso l’alto il bordo inferiore dell’etichetta appendi-flacone, in modo da estenderla
- 4. Sospendere il flaconcino al sostegno
Particolari precauzioni
Alcune gravi reazioni avverse al prodotto possono essere dovute alla velocità di infusione.
Potenziali complicazioni spesso possono essere evitate assicurandosi:
- che i pazienti non siano sensibili all’immunoglobulina umana normale somministrando all’inizio il prodotto lentamente (con una velocità di infusione compresa tra 0,46 e 0,92 ml/kg/h);
- che i pazienti siano controllati attentamente per qualunque sintomo durante il periodo di infusione. In particolare, i pazienti che ricevono per la prima volta immunoglobulina umana normale, i pazienti che hanno cambiato tipo di prodotto a base di IVIg e i pazienti per i quali è trascorso un lungo intervallo di tempo dalla precedente infusione, devono essere controllati durante la prima infusione e per la prima ora dopo la prima infusione, per individuare potenziali segnali di reazioni avverse. Tutti gli altri pazienti devono essere osservati per almeno 20 minuti dopo la somministrazione. In tutti i pazienti la somministrazione di IVIg richiede:
- una adeguata idratazione prima dell’inizio dell’infusione di IVIg;
- il controllo del volume urinario;
- il controllo del livello di creatinina sierica;
- di evitare l’uso concomitante di diuretici dell’ansa. In caso di reazione avversa la velocità di somministrazione deve essere ridotta o l’infusione deve essere interrotta. Il trattamento necessario dipende dalla natura e dalla gravità dell’effetto indesiderato. In caso di shock, deve essere eseguito il trattamento medico standard per lo shock.
Reazione all'infusione
Alcune reazioni avverse (ad esempio mal di testa, vampate di calore, brividi, mialgia, respiro sibilante,
tachicardia, dolore lombare, nausea e ipotensione) possono essere correlate alla velocità di infusione. La
velocità di infusione raccomandata deve essere attentamente seguita. I pazienti devono essere strettamente
monitorati e osservati attentamente per qualsiasi sintomo durante il periodo di infusione.
Le reazioni avverse possono verificarsi più frequentemente
- in pazienti che ricevono immunoglobulina umana normale per la prima volta o, in rari casi, quando il prodotto medicinale a base di immunoglobulina umana normale viene cambiato o nel caso di un lungo intervallo dall'infusione precedente
- in pazienti con infezione non trattata o infiammazione cronica
Bambini e adolescenti
Non sono richieste misure o monitoraggi specifici per la popolazione pediatrica.
Nessuna differenza è attesa nella popolazione pediatrica (0-18 anni).
Tromboembolismo
Esistono evidenze cliniche che dimostrano una relazione tra la somministrazione di IVIg ed eventi
tromboembolici come infarto miocardico, accidente cerebrovascolare (incluso l’ictus), embolia polmonare e
trombosi venosa profonda che si presume siano correlati ad un aumento relativo della viscosità del sangue
dovuto ad un elevato afflusso di immunoglobulina in pazienti a rischio. Bisogna essere cauti nella
prescrizione e nell’infusione di IVIg in pazienti obesi ed in pazienti con fattori di rischio pre-esistenti per
eventi trombotici (come età avanzata, ipertensione, diabete mellito e anamnesi di malattie vascolari o episodi
trombotici, pazienti con disordini trombofilici ereditari o acquisiti, pazienti immobilizzati per un periodo
prolungato, pazienti gravemente ipovolemici, pazienti con malattie che aumentano la viscosità del sangue).
In pazienti a rischio per reazioni avverse tromboemboliche, i prodotti a base di IVIg devono essere
somministrati alla minima velocità di infusione e dose praticabili.
Insufficienza renale acuta
In pazienti che hanno ricevuto IVIg sono stati riportati casi di insufficienza renale acuta. Nella maggior parte
dei casi, i fattori di rischio sono stati identificati ed includono insufficienza renale pre-esistente, diabete
mellito, ipovolemia, sovrappeso, somministrazione concomitante di medicinali nefrotossici o età superiore a
65 anni.
I parametri renali devono essere valutati prima dell'infusione di IVIg, in particolare nei pazienti ritenuti
potenzialmente a rischio di sviluppare insufficienza renale acuta, e di nuovo a intervalli appropriati. Nei
pazienti a rischio di insufficienza renale acuta, i prodotti a base di IVIg devono essere somministrati alla
minima velocità di infusione e dose praticabile.
In caso di alterazioni della funzione renale deve essere presa in considerazione l’interruzione del trattamento
con IVIg. Anche se casi di disfunzione renale ed insufficienza renale acuta sono stati messi in relazione con
l’uso di molti prodotti medicinali a base di IVIg contenenti vari eccipienti come il saccarosio, il glucosio e il
maltosio, quelli contenenti saccarosio come stabilizzante rappresentano un’altissima percentuale del numero
complessivo. Nei pazienti a rischio può essere preso in considerazione l’uso di prodotti medicinali a base di
IVIg che non contengono questi eccipienti.
Sindrome da meningite asettica (AMS)
La sindrome da meningite asettica può manifestarsi in combinazione con il trattamento con IVIg.
Generalmente la sindrome inizia dopo un periodo che varia da diverse ore a 2 giorni dal trattamento con
IVIg. Gli studi sul liquido cerebrospinale spesso sono positivi per pleiocitosi fino a diverse migliaia di cellule
per mm , soprattutto granulociti, e livelli di proteine elevati, fino a diverse centinaia di mg/dl.
L’AMS si può manifestare più frequentemente in associazione con alte dosi di IVIg (2 g/kg).
I pazienti che presentano tali segni e sintomi devono ricevere un esame neurologico completo, compresi gli
studi del liquido cefalorachidiano, per escludere altre cause di meningite.
L'interruzione del trattamento con IVIg ha portato alla remissione dell'AMS entro alcuni giorni, senza
conseguenze.
Anemia emolitica
I prodotti a base di IVIg possono contenere anticorpi gruppo sanguigno-specifici che possono agire come
emolisine e indurre il rivestimento in vivo dei globuli rossi con le immunoglobuline, causando una reazione
antiglobulinica diretta positiva (test di Coombs) e, raramente, l’emolisi. L’anemia emolitica può svilupparsi a
seguito della terapia con IVIg a causa dell’aumentato sequestro dei globuli rossi. I pazienti che ricevono IVIg
devono essere sottoposti a monitoraggio per la rilevazione di segni clinici e sintomi di emolisi.
Neutropenia/Leucopenia
Una diminuzione transitoria della conta dei neutrofili e/o episodi di neutropenia, a volte gravi, sono stati
riportati dopo il trattamento con IVIg. Questo si verifica in genere entro poche ore o giorni dopo la
somministrazione di IVIg e si risolve spontaneamente entro 7-14 giorni.
Danno polmonare acuto associato a trasfusione (TRALI)
Nei pazienti che ricevono IVIg sono stati riportati alcuni casi di edema polmonare acuto non cardiogeno
(danno polmonare acuto associato a trasfusione, TRALI). Il TRALI è caratterizzato da ipossia severa,
dispnea, tachipnea, cianosi, febbre ed ipotensione. I sintomi associati al TRALI tipicamente compaiono
durante la trasfusione o entro 6 ore dalla trasfusione, generalmente entro 1-2 ore. Pertanto, i pazienti che
ricevono IVIg devono essere monitorati e l’infusione con IVIg deve essere immediatamente interrotta in caso
di comparsa di reazioni avverse polmonari. Il TRALI è una condizione che può mettere il paziente in
pericolo di vita richiedendone l’immediato ricovero in reparto di terapia intensiva.
Questo prodotto contiene 100 mg di maltosio per ml come eccipiente. L’interferenza del maltosio con i test
della glicemia può portare ad una sovrastima dei valori di glucosio e, di conseguenza, ad una non adeguata
somministrazione di insulina, che può causare uno stato di ipoglicemia con rischio di vita e la morte del
paziente. Inoltre, i casi di reale ipoglicemia possono non essere trattati se lo stato ipoglicemico è mascherato
da valori di glucosio falsamente elevati. Per ulteriori dettagli vedere il paragrafo “ Test della glicemia”.
Raccomandazioni per il dosaggio
La terapia sostitutiva deve essere iniziata e monitorata sotto la supervisione di un medico con esperienza nel
trattamento dell’immunodeficienza.
Posologia
La dose e lo schema posologico dipendono dall’indicazione. La dose deve essere personalizzata per ogni
paziente in base alla risposta clinica. La dose basata sul peso corporeo può richiedere un adattamento nei
pazienti sottopeso o sovrappeso.
I seguenti schemi posologici possono essere usati come riferimento.
Terapia sostitutiva nelle sindromi da immunodeficienza primaria
Il regime posologico deve indurre il raggiungimento di un livello base di IgG (misurato prima della
successiva infusione) di almeno 6 g/L o entro il normale intervallo di riferimento per l'età della popolazione.
Dall’inizio della terapia, sono necessari da 3 a 6 mesi per raggiungere un equilibrio (stato stazionario dei
livelli di IgG).
La dose iniziale raccomandata è di 0,4 – 0,8 g/kg in unica somministrazione, seguiti da almeno 0,2 g/kg
somministrati ogni 3-4 settimane.
La dose richiesta per raggiungere un livello base di 6 g/L di IgG è nell’ordine di 0,2 – 0,8 g/kg/mese.
L’intervallo tra le dosi varia da 3 a 4 settimane dopo che si è raggiunto lo stato stazionario. I livelli base di
IgG devono essere misurati e valutati insieme all’incidenza di infezioni. Può essere necessario aumentare la
dose e raggiungere livelli base più elevati per ridurre la frequenza di infezioni batteriche.
Immunodeficienze secondarie
La dose raccomandata è di 0,2 – 0,4 g/kg ogni 3 - 4 settimane.
I livelli base di IgG devono essere misurati e valutati insieme all'incidenza dell'infezione. La dose deve
essere aggiustata al bisogno per ottenere una protezione ottimale contro le infezioni, un aumento può essere
necessario in pazienti con infezione persistente; una diminuzione della dose può essere presa in
considerazione quando il paziente rimane privo di infezione.
Trombocitopenia immune primaria
Esistono due schemi di trattamento alternativi:
- 0,8 - 1g/kg somministrati il giorno 1; questa dose può essere ripetuta una volta entro 3 giorni;
- 0,4 g/kg al giorno per 2 - 5 giorni. Il trattamento può essere ripetuto in caso di ricadute.
Sindrome di Guillain Barré
0,4 g/kg/giorno per 5 giorni (possibile ripetizione del dosaggio in caso di recidiva).
Malattia di Kawasaki
2,0 g/kg devono essere somministrati in dose singola. I pazienti devono ricevere un trattamento concomitante
con acido acetilsalicilico.
Poliradicoloneuropatia cronica infiammatoria demielinizzante (CIDP)
Dose iniziale: 2 g/kg suddivisi in 2-5 giorni consecutivi.
Dose di mantenimento:
1 g/kg in 1-2 giorni consecutivi ogni 3 settimane.
L'effetto del trattamento deve essere valutato dopo ogni ciclo; se non si osserva alcun effetto del trattamento
dopo 6 mesi, il trattamento deve essere interrotto.
Se la terapia è efficace, la sua somministrazione a lungo termine è a discrezione del medico in base alla
risposta del paziente e alla risposta di mantenimento. Il dosaggio e gli intervalli possono dover essere adattati
in base al decorso individuale della malattia.
Neuropatia Motoria Multifocale (MMN)
Dose iniziale: 2 g/kg somministrati in 2-5 giorni consecutivi.
Dosi di mantenimento: 1 g/kg ogni 2-4 settimane o 2 g/kg ogni 4-8 settimane.
L'effetto del trattamento deve essere valutato dopo ogni ciclo; se non si osserva alcun effetto del trattamento
dopo 6 mesi, il trattamento deve essere interrotto.
Se la terapia è efficace, la sua somministrazione a lungo termine è a discrezione del medico in base alla
risposta del paziente e alla risposta di mantenimento. Il dosaggio e gli intervalli possono dover essere adattati
in base al decorso individuale della malattia.
Le dosi raccomandate sono riassunte nella seguente tabella:
| Indicazione | i Dose | Frequenza delle iniezioni |
| l Terapia sostitutiva | ||
| a Sindromi da immunodeficienza primaria t I | Dose iniziale: 0,4 - 0,8 g/kg Dose di mantenimento: 0,2 - 0,8 g/kg | ogni 3 – 4 settimane |
| a Immunodeficienze Secondarie | 0,2 - 0,4 g/kg | ogni 3 – 4 settimane |
| Immunomodulazione: | ||
| i z Trombocitopenia immune primaria n e | 0,8 - 1 g/kg Oppure 0,4 g/kg/die | il giorno 1, possibilmente ripetendo una volta entro 3 giorni per 2 – 5 giorni |
| g Sindrome di Guillain Barrè | 0,4 g/kg/die | per 5 giorni |
| A Malattia di Kawasaki | 2 g/kg | in dose singola, in associazione con acido acetilsalicilico |
| Poliradiculoneuropatia cronica infiammatoria demielinizzante (CIDP) | Dose iniziale: 2 g/kg Dose di mantenimento: 1 g/kg | in dosi suddivise in 2 – 5 o giorni c ogni 3 settimane in 1 – 2 a giorni |
| Neuropatia motoria multifocale (MMN) | Dose iniziale: 2 g/kg Dose di mantenimento: 1 g/kg Oppure F 2 g/kg | m in 2-5 giorni consecutivi r ogni 2-4 settimane a Oppure ogni 4-8 settimane in 2-5 giorni |
Uso nei bambini e negli adolescenti
La posologia nei bambini e negli adolescenti (0-18 anni) non è diversa da quella degli adulti poichè la
posologia per ciascuna indicazione è data per peso corporeo e aggiustata in base all’esito clinico delle
suddette condizioni.
Insufficienza epatica
Non ci sono evidenze per richiedere un aggiustamento della dose.
Insufficienza renale
Nessun aggiustamento della dose se non clinicamente giustificato.
Anziani
Nessun aggiustamento della dose se non clinicamente giustificato.
CIDP
A causa della rarità della malattia e, conseguentemente, dell’esiguo numero complessivo di pazienti,
l’esperienza nell’utilizzo di immunoglobuline endovenose in bambini affetti da CIDP è limitata; pertanto,
sono disponibili solo dati di letteratura. Tuttavia, i dati pubblicati sono concordi nel dimostrare che il
trattamento con IVIg è ugualmente efficace nel bambino e nell’adulto, in linea con quanto avviene per le
indicazioni riconosciute per le IVIg.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a VENITALForma farmaceutica: Soluzione per infusione, 100 mg/mlPrincipio attivo: immunoglobulins, normal human, for intravascular adm.Produttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Soluzione per infusione, 50 MG/MLPrincipio attivo: immunoglobulins, normal human, for intravascular adm.Produttore: INSTITUTO GRIFOLS S.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 50 MG/MLPrincipio attivo: immunoglobulins, normal human, for intravascular adm.Produttore: BAXALTA INNOVATIONS GMBHPrescrizione richiesta
Medici online per VENITAL
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di VENITAL — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.






