
BORTEZOMIB MEDAC

Come usare BORTEZOMIB MEDAC
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO
- ELENCO DEGLI ECCIPIENTI
- FORMA FARMACEUTICA E CONTENUTO
- MODO E VIA(E) DI SOMMINISTRAZIONE
- AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI DALLA
- ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
- DATA DI SCADENZA
- PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
- PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
- NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO DI LOTTO
- IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
- IDENTIFICATIVO UNICO - DATI LEGGIBILI
- DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
- NUMERO DI LOTTO
- CONTENUTO IN PESO, VOLUME O UNITÀ
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO
- ELENCO DEGLI ECCIPIENTI
- FORMA FARMACEUTICA E CONTENUTO
- MODO E VIA(E) DI SOMMINISTRAZIONE
- AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE
- ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
- DATA DI SCADENZA
- PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
- PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
- NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO DI LOTTO
- IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
- IDENTIFICATIVO UNICO - DATI LEGGIBILI
- DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
- NUMERO DI LOTTO
- CONTENUTO IN PESO, VOLUME O UNITÀ
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO
- ELENCO DEGLI ECCIPIENTI
- FORMA FARMACEUTICA E CONTENUTO
- MODO E VIA(E) DI SOMMINISTRAZIONE
- AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE
- ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
- DATA DI SCADENZA
- PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
- PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
- NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO DI LOTTO
- IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
- IDENTIFICATIVO UNICO - DATI LEGGIBILI
- DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
- NUMERO DI LOTTO
- CONTENUTO IN PESO, VOLUME O UNITÀ
INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO
SCATOLA ESTERNA
1. DENOMINAZIONE DEL MEDICINALE
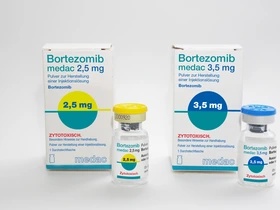
Bortezomib medac 2,5 mg polvere per soluzione iniettabile
bortezomib
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO
Ogni flaconcino contiene 2,5 mg di bortezomib (come estere boronico del mannitolo).
3. ELENCO DEGLI ECCIPIENTI
Mannitolo (E 421)
4. FORMA FARMACEUTICA E CONTENUTO
Polvere per soluzione iniettabile
1 flaconcino
5. MODO E VIA(E) DI SOMMINISTRAZIONE
Per solo uso sottocutaneo o endovenoso.
Prodotto monouso.
Non somministrare per altre vie.
Uso endovenoso:aggiungere 2,5 ml di Sodio Cloruro 0,9 % per ottenere la concentrazione
finale di 1 mg/ml.
Uso sottocutaneo:aggiungere 1 ml di Sodio Cloruro 0,9 % per ottenere la concentrazione
finale di 2,5 mg/ml.
6. AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI DALLA
VISTA E DALLA PORTATA DEI BAMBINI
Tenere fuori dalla vista e dalla portata dei bambini.
7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
Prodotto CITOTOSSICO. Istruzioni particolari per la manipolazione.
8. DATA DI SCADENZA
Scad.
Se non utilizzato immediatamente, Bortezomib medac ricostituito con soluzione di sodio
cloruro 0,9 % è stabile per 8 ore a 25 °C/60 % RH al buio, sia nel flaconcino sia in una siringa
di polipropilene.
9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
Tenere il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce.
10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE NECESSARIO
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in
conformità alla normativa locale vigente.
11. NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN
COMMERCIO
medac GmbH
Theaterstr. 6
22880 Wedel
Germany
12. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n° 046001032
13. NUMERO DI LOTTO
Lotto
14. CONDIZIONE GENERALE DI FORNITURA
15. ISTRUZIONI PER L’USO
16. INFORMAZIONI IN BRAILLE
17. IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
18. IDENTIFICATIVO UNICO - DATI LEGGIBILI
PC:
SN:
NN:
BLUE BOX
Medicinale equivalente
Prezzo €
Bollino
Uso riservato agli ospedali, alle cliniche e alle case di cura. Vietata la vendita al pubblico
Può alterare la capacità di guidare veicoli e di usare macchinari
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
FLACONCINO
1. DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
Bortezomib medac 2,5 mg polvere per soluzione iniettabile
bortezomib
Solo per uso sottocutaneo o endovenoso.
2. MODO DI SOMMINISTRAZIONE
3. DATA DI SCADENZA
Scad.
4. NUMERO DI LOTTO
Lotto
5. CONTENUTO IN PESO, VOLUME O UNITÀ
2,5 mg
ALTRO
Prodotto monouso.
Non somministrare per altre vie.
Uso endovenoso: aggiungere 2,5 ml di Sodio Cloruro 0,9 % per ottenere la concentrazione finale di
1 mg/ml.
Uso sottocutaneo: aggiungere 1 ml di Sodio Cloruro 0,9 % per ottenere la concentrazione finale di
2,5 mg/ml.
CITOTOSSICO.
Tenere il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce.
INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO
SCATOLA ESTERNA
1. DENOMINAZIONE DEL MEDICINALE
Bortezomib medac 1 mg polvere per soluzione iniettabile
bortezomib
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO
ATTIVO
Ogni flaconcino contiene 1 mg di bortezomib (come estere boronico del mannitolo).
3. ELENCO DEGLI ECCIPIENTI
Mannitolo (E 421)
4. FORMA FARMACEUTICA E CONTENUTO
Polvere per soluzione iniettabile
1 flaconcino
5. MODO E VIA(E) DI SOMMINISTRAZIONE
Solo per uso endovenoso.
Prodotto monouso.
Non somministrare per altre vie.
Uso endovenoso:aggiungere 1 ml di sodio cloruro 0,9 % per ottenere la concentrazione finale di
1 mg/ml.
6. AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE
FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI
Tenere fuori dalla vista e dalla portata dei bambini.
7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
Prodotto CITOTOSSICO. Istruzioni particolari per la manipolazione.
8. DATA DI SCADENZA
Scad.
Se non utilizzato immediatamente, Bortezomib medac ricostituito con soluzione di sodio cloruro
0,9 % è stabile per 8 ore a 25 °C/60 % RH al buio, sia nel flaconcino sia in una siringa di
polipropilene.
9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
Tenere il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce.
10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE
NECESSARIO
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
11. NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE
ALL’IMMISSIONE IN COMMERCIO
medac GmbH
Theaterstr. 6
22880 Wedel
Germania
12. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n. 046001018
13. NUMERO DI LOTTO
Lotto
14. CONDIZIONE GENERALE DI FORNITURA
15. ISTRUZIONI PER L’USO
16. INFORMAZIONI IN BRAILLE
17. IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
18. IDENTIFICATIVO UNICO - DATI LEGGIBILI
PC:
SN:
NN:
BLUE BOX REQUIREMENTS
Medicinale equivalente
Prezzo €
Bollino ottico
Uso riservato agli ospedali, alle cliniche e alle case di cura. Vietata la vendita al pubblico
Può alterare la capacità di guidare veicoli e di usare macchinari
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
FLACONCINO
1. DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
Bortezomib medac 1 mg polvere per soluzione iniettabile
bortezomib
Solo per uso endovenoso.
2. MODO DI SOMMINISTRAZIONE
3. DATA DI SCADENZA
Scad.
4. NUMERO DI LOTTO
Lotto
5. CONTENUTO IN PESO, VOLUME O UNITÀ
1 mg
ALTRO
INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO
SCATOLA ESTERNA
1. DENOMINAZIONE DEL MEDICINALE
Bortezomib medac 3,5 mg polvere per soluzione iniettabile
bortezomib
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO
ATTIVO
Ogni flaconcino contiene 3,5 mg di bortezomib (come estere boronico del mannitolo).
3. ELENCO DEGLI ECCIPIENTI
Mannitolo (E 421)
4. FORMA FARMACEUTICA E CONTENUTO
Polvere per soluzione iniettabile
1 flaconcino
5. MODO E VIA(E) DI SOMMINISTRAZIONE
Per solo uso sottocutaneo o endovenoso.
Prodotto monouso.
Non somministrare per altre vie.
Uso endovenoso:aggiungere 3,5 ml di sodio cloruro 0,9 % per ottenere la concentrazione finale di
1 mg/ml.
Uso sottocutaneo:aggiungere 1,4 ml di sodio cloruro 0,9 % per ottenere la concentrazione finale di
2,5 mg/ml.
6. AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE
FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI
Tenere fuori dalla vista e dalla portata dei bambini.
7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO
Prodotto CITOTOSSICO. Istruzioni particolari per la manipolazione.
8. DATA DI SCADENZA
Scad.
Se non utilizzato immediatamente, Bortezomib medac ricostituito con soluzione di sodio cloruro
0,9 % è stabile per 8 ore a 25 °C/60 % RH al buio, sia nel flaconcino sia in una siringa di
polipropilene.
9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
Tenere il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce.
10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON
UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE
NECESSARIO
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
11. NOME E INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE
ALL’IMMISSIONE IN COMMERCIO
medac GmbH
Theaterstr. 6
22880 Wedel
Germania
12. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n. 046001020
13. NUMERO DI LOTTO
Lotto
14. CONDIZIONE GENERALE DI FORNITURA
15. ISTRUZIONI PER L’USO
16. INFORMAZIONI IN BRAILLE
17. IDENTIFICATIVO UNICO - CODICE A BARRE BIDIMENSIONALE .
18. IDENTIFICATIVO UNICO - DATI LEGGIBILI
PC:
SN:
NN:
BLUE BOX REQUIREMENTS
Medicinale equivalente
Prezzo €
Bollino ottico
Uso riservato agli ospedali, alle cliniche e alle case di cura. Vietata la vendita al pubblico
Può alterare la capacità di guidare veicoli e di usare macchinari
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
FLACONCINO
1. DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE
Bortezomib medac 3,5 mg polvere per soluzione iniettabile
bortezomib
Solo per uso sottocutaneo o endovenoso.
2. MODO DI SOMMINISTRAZIONE
3. DATA DI SCADENZA
Scad.
4. NUMERO DI LOTTO
Lotto
5. CONTENUTO IN PESO, VOLUME O UNITÀ
3,5 mg
ALTRO
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a BORTEZOMIB MEDACForma farmaceutica: Polvere per soluzione iniettabile, 3,5 MGPrincipio attivo: bortezomibProduttore: ACCORD HEALTHCARE, S.L.U.Prescrizione richiestaForma farmaceutica: Polvere per soluzione iniettabile, 3,5 MGPrincipio attivo: bortezomibProduttore: DR. REDDY'S S.R.L.Prescrizione richiestaForma farmaceutica: Soluzione iniettabile, <2,5 mg/mlPrincipio attivo: bortezomibProduttore: EG S.P.A.Prescrizione richiesta
Medici online per BORTEZOMIB MEDAC
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di BORTEZOMIB MEDAC — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





