
DAPAGLIFLOZIN TECNIGEN

Come usare DAPAGLIFLOZIN TECNIGEN
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA
- FORMA FARMACEUTICA
- 2 Posologia e modo di somministrazione
- 3 Controindicazioni
- 4 Avvertenze speciali e precauzioni di impiego
- 5 Interazioni con altri medicinali ed altre forme di interazione
- 6 Fertilità, gravidanza e allattamento
- 7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
- 8 Effetti indesiderati
- 9 Sovradosaggio
- 2 Proprietà farmacocinetiche
- 3 Dati preclinici di sicurezza
- 2 Incompatibilità
- 3 Periodo di validità
- 4 Precauzioni particolari per la conservazione
- 5 Natura e contenuto del contenitore
- 6 Precauzioni particolari per lo smaltimento
- TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE
- DATA DI REVISIONE DEL TESTO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE
Dapaglifozin Tecnigen 5 mg compresse rivestite con film
Dapaglifozin Tecnigen 10 mg compresse rivestite con film
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Dapaglifozin Tecnigen 5 mg compresse rivestite con film
Ogni compressa contiene dapagliflozin propanediolo monoidrato equivalente a 5 mg di dapagliflozin.
Dapaglifozin Tecnigen 10 mg compresse rivestite con film
Ogni compressa contiene dapagliflozin propanediolo monoidrato equivalente a 10 mg di dapagliflozin.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Compressa rivestita con film (compressa).
Le compresse rivestite con film di Dapagliflozin 5 mg sono descritte come compresse rivestite con film
rotonde, gialle, con diametro di 7,0 mm±0,2 mm, con impresso "5" su un lato.
Le compresse rivestite con film di Dapagliflozin 10 mg sono descritte come compresse rivestite con film
ovali, gialle, con una lunghezza di 11,5 mm ± 0,2 mm e una larghezza di 7,0 mm ± 0,2 mm.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Diabete mellito di tipo 2
Dapaglifozin Tecnigen è indicato in pazienti adulti e bambini dai 10 anni di età in su, non adeguatamente
controllati per il trattamento del diabete mellito di tipo 2 in aggiunta alla dieta e all’esercizio:
- in monoterapia quando l’impiego di metformina è ritenuto inappropriato a causa di intolleranza.
- In aggiunta ad altri medicinali per il trattamento del diabete di tipo 2.
Per i risultati degli studi rispetto alle associazioni con altri medicinali, agli effetti sul controllo glicemico,
agli eventi cardiovascolari e renali, e alle popolazioni studiate, vedere paragrafi 4.4, 4.5 e 5.1.
Insufficienza cardiaca
Dapaglifozin Tecnigen è indicato negli adulti per il trattamento dell’insufficienza cardiaca cronica
sintomatica.
Malattia renale cronica
Dapaglifozin Tecnigen è indicato negli adulti per il trattamento della malattia renale cronica.
4.2 Posologia e modo di somministrazione
Posologia
Diabete mellito di tipo 2
La dose raccomandata è di 10 mg di dapagliflozin una volta al giorno.
Quando dapagliflozin è utilizzato in associazione con insulina o un medicinale insulino secretagogo, come
una sulfanilurea, per ridurre il rischio di ipoglicemia si può considerare la somministrazione di una dose più
bassa di insulina o del medicinale insulino segretagogo (vedere paragrafi 4.5 e 4.8).
Insufficienza cardiaca
La dose raccomandata è di 10 mg di dapagliflozin una volta al giorno.
Malattia renale cronica
La dose raccomandata è 10 mg di dapagliflozin una volta al giorno.
Popolazioni speciali
Compromissione renale
Non è richiesto alcun adeguamento della dose sulla base della funzionalità renale.
Nei pazienti con GFR < 25 mL/min, a causa della limitata esperienza, non è raccomandato iniziare il
trattamento con dapagliflozin.
Nei pazienti con diabete mellito di tipo 2, l'efficacia ipoglicemizzante di dapagliflozin è ridotta quando la
velocità di filtrazione glomerulare (GFR) è < 45 mL/min, ed è probabilmente assente nei pazienti con
insufficienza renale grave. Pertanto, nei pazienti con diabete mellito di tipo 2, se la GFR scende al di sotto
di 45 mL/min, se è necessario un ulteriore controllo glicemico, deve essere preso in considerazione un
ulteriore trattamento ipoglicemizzante (vedere paragrafi 4.4, 4.8, 5.1 e 5.2).
Compromissione epatica
Non è necessario alcun aggiustamento della dose in pazienti con compromissione epatica lieve o moderata.
In pazienti con compromissione epatica grave, è raccomandata una dose di partenza di 5 mg. Se ben tollerata,
la dose può essere aumentata a 10 mg (vedere paragrafi 4.4 e 5.2).
Anziani (≥ 65 anni)
Non è raccomandato alcun aggiustamento della dose in base all’età.
Popolazione pediatrica
Non è richiesto alcun aggiustamento della dose per il trattamento del diabete mellito di tipo 2 nei bambini
dai 10 anni di età in su (vedere paragrafi 5.1 e 5.2). Non sono disponibili dati per i bambini di età inferiore
ai 10 anni.
La sicurezza e l’efficacia di dapagliflozin per il trattamento dell'insufficienza cardiaca o per il trattamento
della malattia renale cronica nei bambini < 18 anni non sono state ancora stabilite. Non ci sono dati
disponibili.
Modo di somministrazione
Dapaglifozin Tecnigen può essere assunto per via orale una volta al giorno indipendentemente dai pasti in
ogni momento della giornata. Le compresse vanno deglutite intere.
4.3 Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
4.4 Avvertenze speciali e precauzioni di impiego
Generale
Dapagliflozin non deve essere usato in pazienti con diabete mellito di tipo 1 (vedere “Chetoacidosi
Diabetica” al paragrafo 4.4).
Compromissione renale
In pazienti con GFR < 25 mL/min, a causa dell’esperienza limitata, non è raccomandato iniziare il
trattamento con dapagliflozin.
L’efficacia ipoglicemizzante di dapagliflozin dipende dalla funzione renale, ed è ridotta in pazienti con GFR
< 45 mL/min ed è praticamente assente in pazienti con una compromissione renale severa
(vedere paragrafi 4.2, 5.1 e 5.2).
In uno studio condotto in pazienti con diabete mellito di tipo 2 con compromissione renale moderata (GFR
< 60 mL/min), una maggiore proporzione di pazienti trattati con dapagliflozin ha avuto reazioni avverse
quali aumento di creatinina, fosforo, ormone paratiroideo (PTH) e ipotensione, rispetto al placebo.
Compromissione epatica
C’è un’esperienza limitata in studi clinici in pazienti con compromissione epatica. L’esposizione a
dapagliflozin è aumentata in pazienti con compromissione epatica grave (vedere paragrafi 4.2 e 5.2).
Uso nei pazienti a rischio di deplezione di volume, e/o ipotensione
Grazie al suo meccanismo d’azione, dapagliflozin aumenta la diuresi che può portare ad una modesta
riduzione della pressione sanguigna osservata negli studi clinici (vedere paragrafo 5.1). Quest’ultima può
essere più pronunciata in pazienti con concentrazioni molto elevate di glucosio nel sangue.
Deve essere usata cautela nei pazienti per i quali un calo della pressione sanguigna indotto da dapagliflozin
può rappresentare un rischio, come pazienti in terapia antipertensiva con una storia di ipotensione o pazienti
anziani.
In caso di condizioni intercorrenti che possono portare a deplezione di volume (ad esempio malattie
gastrointestinali), è raccomandato un attento monitoraggio dello stato di volume (ad esempio visita medica,
misurazioni della pressione sanguigna, esami di laboratorio che includono l’ematocrito e degli elettroliti). È
raccomandata la temporanea interruzione del trattamento con dapagliflozin per i pazienti che sviluppano
deplezione di volume finchè la deplezione non viene corretta (vedere paragrafo 4.8).
Chetoacidosi Diabetica
Sono stati riportati rari casi, inclusi casi potenzialmente letali e fatali, di chetoacidosi diabetica (CAD) in
pazienti in trattamento con inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2), incluso
dapagliflozin. In un certo numero di segnalazioni, la condizione clinica si è presentata in maniera atipica,
con solo un moderato aumento dei livelli ematici di glucosio, inferiori a 14 mmol/L (250 mg/dL).
Il rischio di chetoacidosi diabetica deve essere considerato in caso di sintomi non specifici come nausea,
vomito, anoressia, dolore addominale, sete eccessiva, difficoltà a respirare, confusione, insolita fatica o
sonnolenza. Se si verificano questi sintomi, i pazienti devono essere valutati immediatamente per la
chetoacidosi, indipendentemente dai livelli ematici di glucosio.
Nei pazienti in cui si sospetta o viene diagnosticata la CAD, il trattamento con dapagliflozin deve essere
interrotto immediatamente.
Il trattamento deve essere interrotto nei pazienti ricoverati in ospedale per procedure chirurgiche maggiori o
malattie gravi in fase acuta. In questi pazienti è raccomandato il monitoraggio dei chetoni. La misurazione
dei livelli di chetoni nel sangue è preferibile rispetto a quella nelle urine.
Il trattamento con dapagliflozin può essere ripreso quando i valori dei chetoni sono normali e le condizioni
del paziente si sono stabilizzate.
Prima di iniziare il trattamento con dapagliflozin, devono essere presi in considerazione i fattori
nell’anamnesi del paziente che possano predisporre alla chetoacidosi.
I pazienti che possono essere a più alto rischio di CAD comprendono pazienti con una bassa riserva
funzionale delle beta cellule (ad es. pazienti con diabete di tipo 2 con peptide C basso o diabete autoimmune
latente dell’adulto (LADA, latent autoimmune diabetes in adults) oppure pazienti con storia di pancreatite),
pazienti con condizioni che comportano una ridotta assunzione di cibo o una severa disidratazione, pazienti
per i quali le dosi di insulina sono ridotte e pazienti con un aumentato fabbisogno insulinico a causa di
patologia acuta, intervento chirurgico o abuso di alcool. Gli inibitori SGLT2 devono essere usati con cautela
in questi pazienti.
La ripresa del trattamento con inibitori di SGLT2 in pazienti con precedente CAD non è raccomandata, a
meno che non sia stato identificato un altro fattore scatenante e questo sia stato risolto.
Negli studi sul diabete mellito di tipo 1 con dapagliflozin, la CAD è stata riportata con una frequenza comune.
Dapagliflozin non deve essere utilizzato per il trattamento in pazienti con diabete di tipo 1.
Fascite necrotizzante del perineo (gangrena di Fournier)
Successivamente all’immissione in commercio sono stati segnalati casi di fascite necrotizzante del perineo
(nota anche come gangrena di Fournier) in pazienti di sesso femminile e maschile trattati con inibitori del
SGLT2 (vedere paragrafo 4.8). Si tratta di un evento raro ma grave e potenzialmente letale che richiede
interventi chirurgici e terapie antibiotiche urgenti.
I pazienti devono essere invitati a contattare il medico se manifestano una combinazione di sintomi di dolore,
dolorabilità, eritema o tumefazione nella zona genitale o perineale, in associazione a febbre o malessere. Va
ricordato che la fascite necrotizzante può essere preceduta da un’infezione urogenitale o un ascesso
perineale. Qualora si sospetti la gangrena di Fournier, è opportuno interrompere Dapaglifozin Tecnigen e
avviare un trattamento immediato (comprendente antibiotici e rimozione chirurgica dei tessuti).
Infezioni delle vie urinarie
L’escrezione urinaria di glucosio può essere associata ad un aumentato rischio di infezione delle vie urinarie;
pertanto, si deve considerare la temporanea interruzione di dapagliflozin durante il trattamento della
pielonefrite o della sepsi urinaria.
Anziani (≥ 65anni)
I pazienti anziani possono essere maggiormente a rischio di deplezione di volume e hanno più probabilità di
essere trattati con diuretici.
I pazienti anziani hanno più probabilità di avere una funzione renale ridotta e/o di essere trattati con
medicinali antipertensivi che possono causare modifiche della funzione renale come gli inibitori dell’enzima
di conversione dell’angiotensina I (ACE, angiotensin converting enzyme) ed i bloccanti del recettore
dell’angiotensina II tipo 1 (ARB, angiotensin receptor blockers). Le stesse raccomandazioni per la funzione
renale valgono per i pazienti anziani come per tutti i pazienti (vedere paragrafi 4.2, 4.4, 4.8 e 5.1).
Insufficienza cardiaca
L’esperienza con dapagliflozin nelle classi NYHA IV è limitata.
Cardiomiopatia infiltrativa
I pazienti con cardiomiopatia infiltrativa non sono stati studiati.
Malattia renale cronica
Per il trattamento della malattia renale cronica in pazienti senza diabete che non hanno albuminuria, non c'è
esperienza con dapagliflozin. I pazienti con albuminuria possono trarre maggiori benefici dal trattamento
con dapagliflozin.
Amputazioni a carico degli arti inferiori
È stato osservato un aumento dei casi di amputazione a carico degli arti inferiori (principalmente delle dita
dei piedi) in studi clinici a lungo termine con diabete mellito di tipo 2 condotti con degli inibitori di SGLT2.
Non è noto se ciò costituisca un effetto di classe. È importante consigliare i pazienti con diabete di eseguire
regolarmente in maniera preventiva la cura dei piedi.
Esami delle urine
A causa del suo meccanismo d’azione, i pazienti che assumono Dapaglifozin Tecnigen, risulteranno positivi
al test del glucosio nelle urine.
4.5 Interazioni con altri medicinali ed altre forme di interazione
Interazioni farmacodinamiche
Diuretici
Dapagliflozin può aumentare l’effetto diuretico dei diuretici tiazidici e dell’ansa e può incrementare il rischio
di disidratazione e ipotensione (vedere paragrafo 4.4).
Insulina e medicinali secretagoghi dell’insulina
L’insulina e i medicinali secretagoghi dell’insulina, come le sulfaniluree, causano ipoglicemia. Pertanto, può
essere richiesta una dose più bassa di insulina o di un medicinale insulino secretagogo per ridurre il rischio
di ipoglicemia quando vengono utilizzati in associazione con dapagliflozin nei pazienti con diabete di tipo 2
(vedere paragrafi 4.2 e 4.8).
Interazioni farmacocinetiche
Dapagliflozin viene metabolizzato principalmente attraverso la coniugazione con glucuronide mediata dalla
UDP glucuronosiltransferasi 1A9 (UGT1A9).
In studi in vitro,dapagliflozin non ha inibito né il citocromo P450 (CYP) 1A2, CYP2A6, CYP2B6, CYP2C8,
CYP2C9, CYP2C19, CYP2D6, CYP3A4, né ha indotto il CYP1A2, CYP2B6 o CYP3A4.
Pertanto, non ci si aspetta che dapagliflozin alteri la clearance metabolica di medicinali co- somministrati
che sono metabolizzati da questi enzimi.
Effetto di altri medicinali su dapagliflozin
Studi di interazione condotti in soggetti sani, utilizzando principalmente un disegno a dose singola,
suggeriscono che il profilo farmacocinetico di dapagliflozin non è alterato da metformina, pioglitazone,
sitagliptin, glimepiride, voglibose, idroclorotiazide, bumetanide, valsartan o simvastatina.
In seguito alla co-somministrazione di dapagliflozin con rifampicina (un induttore di diversi trasportatori
attivi e di enzimi che metabolizzano medicinali) è stata osservata una riduzione del 22% nell’esposizione
sistemica di dapagliflozin (AUC), ma senza alcun effetto clinicamente significativo sull’escrezione urinaria
di glucosio nelle 24 ore. Non è raccomandato alcun aggiustamento della dose. Non è atteso un effetto
clinicamente rilevante con altri induttori (ad es. carbamazepina, fenitoina, fenobarbital).
In seguito alla co-somministrazione di dapagliflozin con acido mefenamico (un inibitore del UGT1A9), è
stato osservato un incremento del 55% nell’esposizione sistemica di dapagliflozin, ma senza alcun effetto
clinicamente significativo sull’escrezione urinaria di glucosio nelle 24 ore. Non è raccomandato alcun
aggiustamento della dose.
Effetto di dapagliflozin su altri medicinali
Dapagliflozin può aumentare l'escrezione renale di litio e i livelli ematici di litio possono diminuire. Dopo
l'inizio di dapagliflozin e le modifiche della dose, la concentrazione sierica di litio deve essere monitorata
più frequentemente. Si prega di indirizzare il paziente al medico che ha prescritto il litio per monitorare la
concentrazione sierica del litio.
In studi di interazione condotti in soggetti sani, utilizzando principalmente un disegno a dose singola,
dapagliflozin non ha alterato i profili farmacocinetici di metformina, pioglitazone, sitagliptin, glimepiride,
idroclorotiazide, bumetanide, valsartan, digossina (un substrato della glicoproteina P,
P-gp) o warfarin (S-warfarin, un substrato del CYP2C9) né gli effetti anticoagulanti di warfarin misurati
attraverso l’INR. L’associazione di una dose singola di dapagliflozin 20 mg e simvastatina (un substrato del
CYP3A4) ha determinato un aumento del 19% dell’AUC di simvastatina e un incremento del 31% dell’AUC
di simvastatina acida. L’aumento delle esposizioni a simvastatina e simvastatina acida non è considerato
clinicamente rilevante.
Interferenza con l’analisi del 1,5-anidro-glucitolo (1,5 AG)
Il monitoraggio del controllo glicemico attraverso l’analisi del 1,5 AG non è raccomandato in quanto le
misurazioni del 1,5 AG non sono attendibili nella valutazione del controllo glicemico nei pazienti che
assumono inibitori del SGLT2. Si consiglia l'uso di metodi alternativi per monitorare il controllo glicemico.
Popolazione pediatrica
Sono stati effettuati studi di interazione solo negli adulti.
4.6 Fertilità, gravidanza e allattamento
Gravidanza
Non esistono dati relativi all’uso di dapagliflozin in donne in gravidanza. Studi su ratti hanno mostrato
tossicità durante la fase di sviluppo dei reni che corrisponde al secondo e al terzo trimestre di gravidanza
nell’essere umano (vedere paragrafo 5.3). Di conseguenza, l’uso di dapagliflozin non è raccomandato
durante il secondo e il terzo trimestre di gravidanza.
Quando la gravidanza è accertata, il trattamento con dapagliflozin deve essere interrotto.
Allattamento
Non è noto se dapagliflozin e/o i suoi metaboliti siano escreti nel latte materno. I dati
farmacodinamici/tossicologici disponibili in animali hanno mostrato l’escrezione di dapagliflozin/metaboliti
nel latte, nonché effetti farmacologicamente mediati nella progenie allattata (vedere paragrafo 5.3). Il rischio
per i neonati/lattanti non può essere escluso. Dapagliflozin non deve essere usato durante l’allattamento.
Fertilità
L’effetto di dapagliflozin sulla fertilità non è stato studiato nell’uomo. In ratti maschi e femmine,
dapagliflozin non ha mostrato effetti sulla fertilità a qualsiasi dose testata.
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Dapaglifozin Tecnigen non altera o altera in modo trascurabile la capacità di guidare veicoli e di usare
macchinari. I pazienti devono essere avvertiti del rischio di ipoglicemia quando dapagliflozin è usato in
associazione con una sulfanilurea o l’insulina.
4.8 Effetti indesiderati
Riassunto del profilo di sicurezza
Diabete mellito di tipo 2
Negli studi clinici nel diabete di tipo 2, più di 15.000 pazienti sono stati trattati con dapagliflozin.
La valutazione primaria di sicurezza e tollerabilità è stata condotta in un’analisi aggregata predefinita di 13
studi a breve termine (fino a 24 settimane) controllati con placebo, con 2.360 soggetti trattati con
dapagliflozin 10 mg e 2.295 trattati con placebo.
Nello studio di dapagliflozin sugli esiti cardiovascolari nel diabete mellito di tipo 2 (studio DECLARE,
vedere paragrafo 5.1), 8.574 pazienti hanno ricevuto dapagliflozin 10 mg e 8.569 hanno ricevuto placebo
per un tempo medio di esposizione di 48 mesi. In totale, ci sono stati 30.623 pazienti- anno di esposizione a
dapagliflozin.
Le reazioni avverse più frequentemente segnalate attraverso gli studi clinici sono state le infezioni genitali.
Insufficienza cardiaca
Nello studio sui risultati cardiovascolari di dapagliflozin in pazienti con insufficienza cardiaca con frazione
di eiezione ridotta (studio DAPA-HF), 2.368 pazienti sono stati trattati con dapagliflozin 10 mg e 2.368
pazienti con placebo per un tempo di esposizione mediano di 18 mesi. La popolazione dei pazienti
comprendeva pazienti con diabete mellito di tipo 2 e pazienti senza diabete, e pazienti con eGFR ≥ 30
mL/min/1,73 m . Nello studio sui risultati cardiovascolari di dapagliflozin in pazienti con insufficienza
cardiaca con frazione di eiezione ventricolare sinistra > 40% (DELIVER), 3.126 pazienti sono stati trattati
con dapagliflozin 10 mg e 3.127 pazienti con placebo per un tempo di esposizione
mediano di 27 mesi. La popolazione dei pazienti comprendeva pazienti con diabete mellito di tipo 2 e
pazienti senza diabete, e pazienti con eGFR ≥ 25 mL/min/1,73 m .
Il profilo di sicurezza complessivo di dapagliflozin nei pazienti con insufficienza cardiaca è stato coerente
con il noto profilo di sicurezza di dapagliflozin.
Malattia renale cronica
I risultati dello studio renale di dapagliflozin (DAPA-CKD), condotto in pazienti con malattia renale
cronica, 2.149 pazienti sono stati trattati con dapagliflozin 10 mg e 2.149 pazienti con placebo per un
tempo di esposizione mediano di 27 mesi. La popolazione di pazienti includeva pazienti con diabete
mellito di tipo 2 e senza diabete, con eGFR da ≥ 25 a ≤ 75 mL/min/1,73 m e albuminuria (rapporto
creatinina albumina urinaria [ACR] ≥ 200 e ≤ 5000 mg/g). Il trattamento veniva continuato se l'eGFR
scendeva a livelli inferiori a 25 mL/min/1,73 m .
Nei pazienti con malattia renale cronica, il profilo di sicurezza complessivo di dapagliflozin era coerente
con il profilo di sicurezza noto di dapagliflozin.
Tabella delle reazioni avverse
Le seguenti reazioni avverse sono state identificate in studi clinici controllati con placebo e sorveglianza
successiva all’immissione in commercio. Nessuna è risultata correlata alla dose. Le reazioni avverse
elencate di seguito sono classificate secondo la frequenza e la classificazione per sistemi e organi (SOC).
Le categorie di frequenza sono definite in base alla seguente convenzione: molto comune (≥ 1/10), comune
(≥ 1/100, < 1/10), non comune (≥ 1/1.000, < 1/100), raro (≥ 1/10.000,
< 1/1.000), molto raro (< 1/10.000), e non nota (la frequenza non può essere definita sulla base dei dati
disponibili).
Tabella 1. Reazioni avverse osservate in studi clinici controllati con placeboae nell’esperienza
successiva all’immissione in commercio
| Classificazione per sistemi e organi | t Molto comune I | a Comune* | Non comune** | Raro | Molto raro |
| Infezioni ed infestazioni n e | z i a | Vulvovaginite, balanite e infezioni genitali correlate*,b,c Infezione delle vie urinarie*,b,d | Infezione micotica** | Fascite necrotizzant e del perineo (gangrena di Fournier)b,i | |
| g Disturbi del metabolismo e A della nutrizione | Ipoglicemi a (quando usato con SU o insulina)b | Deplezione di volumeb,e Sete** | Chetoacidosi diabetica (quando usata nel diabete mellito di tipo 2)b,i,k | ||
| Patologie del sistema nervoso | Capogiro |
| Patologie gastrointestinali | Stipsi** Bocca secca** | ||||
| Patologie della cute e del tessuto sottocutaneo | Eruzione cutaneaj | o c Angioedema | |||
| Patologie del sistema muscoloscheletrico e del tessuto connettivo | Dolore dorsale* | m a | |||
| Patologie renali e urinarie | Disuria Poliuria*,f | Nicturia** | r | Nefrite tubulo- interstiziale | |
| Patologie dell’apparato riproduttivo e della mammella | F Prurito Vulvovaginale** Prurito Genitale** | a | |||
| Esami diagnostici | Ematocrito aumentatog Clearance renale della creatinina ridotta durante il trattamento n inizialeb Dislipidemiah | l Creatinina e ematica aumentata d durante il trattamento iniziale**,b a Urea ematica aumentata** Peso diminuito** |
Descrizione delle reazioni avverse selezionate
Vulvovaginite, balanite ed infezioni genitali correlate
Nel pool dei 13 studi di sicurezza aggregati, vulvovaginiti, balaniti ed infezioni genitali correlate sono state
riportate nel 5,5% e nello 0,6% dei soggetti che hanno ricevuto dapagliflozin 10 mg e placebo,
rispettivamente. La maggior parte delle infezioni sono state da lievi a moderate, e i soggetti hanno risposto
ad un iniziale ciclo di trattamento e raramente si sono risolte con l’interruzione dal trattamento di
dapagliflozin. Queste infezioni sono state più frequenti nelle donne (8,4% e 1,2% per dapagliflozin e
placebo, rispettivamente), e i soggetti con una storia pregressa avevano più probabilità di avere
un’infezione ricorrente.
Nello studio DECLARE il numero di pazienti con eventi avversi seri di infezioni genitali sono stati pochi
e bilanciati: 2 pazienti in ciascun gruppo di dapagliflozin e placebo.
Nello studio DAPA-HF, nessun paziente ha segnalato eventi avversi gravi di infezioni genitali nel gruppo
dapagliflozin e uno nel gruppo placebo. Ci sono stati 7 (0,3%) pazienti con eventi avversi che hanno portato
alla sospensione del trattamento a causa di infezioni genitali nel gruppo dapagliflozin e nessuno nel gruppo
placebo. Nello studio DELIVER, un paziente (<0,1%) in ciascun gruppo di trattamento ha riportato un
evento avverso grave di infezioni genitali. Ci sono stati 3 (0,1%) pazienti con eventi avversi che hanno
portato alla sospensione del trattamento a causa di infezioni genitali nel gruppo dapagliflozin e nessuno
nel gruppo placebo.
Nello studio DAPA-CKD, ci sono stati 3 (0,1%) pazienti con eventi avversi di infezioni genitali gravi, nel
gruppo dapagliflozin e nessuno nel gruppo placebo. Ci sono stati 3 (0,1%) pazienti con eventi avversi che
hanno portato all'interruzione a causa di infezioni genitali nel gruppo dapagliflozin e nessuno nel gruppo
placebo. Non sono stati segnalati eventi avversi gravi di infezioni genitali o eventi avversi che hanno
portato all'interruzione a causa di infezioni genitali per nessun paziente senza diabete.
Sono stati segnalati casi di fimosi/fimosi acquisita in concomitanza con infezioni genitali e in alcuni casi è
stata necessaria la circoncisione.
Fascite necrotizzante del perineo (gangrena di Fournier)
Successivamente all’immissione in commercio, sono stati segnalati casi di gangrena di Fournier in pazienti
trattati con inibitori del SGLT2, incluso dapagliflozin (vedere paragrafo 4.4).
Nello studio DECLARE con 17.160 pazienti con diabete mellito di tipo 2 e un tempo di esposizione
mediana di 48 mesi, sono stati riportati un totale di 6 casi di gangrena di Fournier, uno nel gruppo trattato
con dapagliflozin e 5 nel gruppo con placebo.
Ipoglicemia
La frequenza di ipoglicemia dipendeva dal tipo di terapia di base impiegata negli studi clinici con diabete
mellito.
Negli studi di dapagliflozin in monoterapia, come associazione aggiuntiva a metformina o come
associazione aggiuntiva a sitagliptin (con o senza metformina), la frequenza degli episodi minori di
ipoglicemia è stata simile (< 5%) tra i gruppi di trattamento, compreso il placebo fino a 102 settimane di
trattamento. In tutti gli studi, gli eventi maggiori di ipoglicemia sono stati non comuni e comparabili tra i
gruppi trattati con dapagliflozin o placebo. Studi sulle terapie aggiuntive con sulfanilurea e insulina hanno
riscontrato tassi più alti di ipoglicemia (vedere paragrafo 4.5).
In uno studio di associazione aggiuntiva alla glimepiride, alle settimane 24 e 48 sono stati segnalati episodi
minori di ipoglicemia più frequentemente nel gruppo trattato con dapagliflozin 10 mg più glimepiride
(6,0% e 7,9%, rispettivamente), rispetto al gruppo trattato con placebo più glimepiride (2,1% e 2,1%,
rispettivamente).
In uno studio di associazione aggiuntiva all’insulina, sono stati segnalati episodi di ipoglicemia maggiore
nello 0,5% e 1,0% dei soggetti trattati con dapagliflozin 10 mg più insulina rispettivamente alle settimane
24 e 104, e nello 0,5% dei soggetti del gruppo trattato con placebo più insulina alle settimane 24 e 104.
Sono stati segnalati episodi di ipoglicemia minore alle settimane 24 e 104, rispettivamente nel 40,3% e
53,1% dei soggetti che avevano ricevuto dapagliflozin 10 mg più insulina e nel 34,0% e 41,6% dei soggetti
che avevano ricevuto placebo più insulina.
In uno studio di associazione aggiuntiva alla metformina e a una sulfanilurea fino a 24 settimane, non sono
stati segnalati episodi di ipoglicemia maggiore. Episodi di ipoglicemia minore sono stati riportati nel 12,8%
dei soggetti che avevano ricevuto dapagliflozin 10 mg più metformina e una sulfanilurea e nel 3,7% dei
soggetti che avevano ricevuto placebo più metformina e una sulfanilurea.
Nello studio DECLARE, non è stato osservato alcun aumento del rischio di ipoglicemia severa con terapia
di dapagliflozin in confronto al placebo. Eventi di ipoglicemia severa sono stati riportati in 58 (0,7%)
pazienti trattati con dapagliflozin e 83 (1,0%) pazienti trattati con placebo.
Nello studio DAPA-HF, gli eventi di ipoglicemia maggiore sono stati segnalati in 4 (0,2%) pazienti in
entrambi i gruppi di trattamento con dapagliflozin e placebo. Nello studio DELIVER, gli eventi maggiori
di ipoglicemia sono stati segnalati in 6 (0,2%) pazienti nel gruppo dapagliflozin e in 7 (0,2%) nel gruppo
placebo. Gli eventi maggiori di ipoglicemia sono stati osservati solo in pazienti con diabete mellito di tipo
- 2.
Nello studio DAPA-CKD, sono stati osservati eventi maggiori di ipoglicemia in 14 (0,7%) pazienti nel
gruppo dapagliflozin e 28 (1,3%) pazienti nel gruppo placebo e osservati solo in pazienti con diabete
mellito di tipo 2.
Deplezione di volume
Nel pool dei 13 studi di sicurezza aggregati sono state segnalate reazioni indicative di deplezione di volume
(inclusi casi di disidratazione, ipovolemia o ipotensione) nell’1,1% e nello 0,7% dei soggetti trattati
rispettivamente con dapagliflozin 10 mg e placebo. Si sono verificate reazioni gravi nel < 0,2% dei soggetti
bilanciate tra dapagliflozin 10 mg e placebo (vedere paragrafo 4.4).
Nello studio DECLARE, il numero di pazienti con eventi indicativi di deplezione di volume sono stati
bilanciati tra i gruppi di trattamento: 213 (2,5%) e 207 (2,4%) nei gruppi di dapagliflozin e placebo,
rispettivamente. Sono stati riportati 81 (0,9%) e 70 (0,8%) eventi avversi seri nel gruppo di dapagliflozin
e placebo, rispettivamente. Gli eventi sono stati generalmente bilanciati tra i gruppi di trattamento nei
diversi sottogruppi di età, uso di diuretici, pressione sanguigna e uso di inibitori dell'enzima di conversione
dell'angiotensina (ACE-I)/ bloccanti del recettore dell’angiotensina II di tipo 1 (ARB). Nei pazienti con
eGFR < 60 mL/min/1,73 m al basale, ci sono stati 19 eventi avversi seri indicativi di deplezione di
volume nel gruppo con dapagliflozin e 13 nel gruppo con placebo.
Nello studio DAPA-HF, il numero di pazienti con eventi indicativi di deplezione di volume sono stati 170
(7,2%) nel gruppo dapagliflozin e 153 (6,5%) nel gruppo placebo. Vi era un minor numero di pazienti con
gravi eventi di sintomi indicativi di deplezione di volume nel gruppo dapagliflozin (23 [1,0%]) rispetto al
gruppo placebo (38 [1,6%]). I risultati sono stati simili indipendentemente dalla presenza di diabete al
basale e al eGFR al basale. Nello studio DELIVER, il numero di pazienti con eventi gravi con sintomi
indicativi di deplezione di volume sono stati 35 (1,1%) nel gruppo dapagliflozin e 31 (1,0%) nel gruppo
placebo.
Nello studio DAPA-CKD, il numero di pazienti con eventi indicativi di deplezione di volume è stato 120
(5,6%) nel gruppo dapagliflozin e 84 (3,9%) nel gruppo placebo. Ci sono stati 16 (0,7%) pazienti con
eventi gravi di sintomi indicativi di deplezione di volume nel gruppo dapagliflozin e 15 (0,7%) pazienti
nel gruppo placebo.
Chetoacidosi diabetica nel diabete mellito di tipo 2
Nello studio DECLARE, con un tempo medio di esposizione di 48 mesi, sono stati riportati eventi di CAD
in 27 pazienti nel gruppo con 10 mg di dapagliflozin e in 12 pazienti nel gruppo con placebo. Gli eventi si
sono verificati uniformemente durante il periodo dello studio. Dei 27 pazienti con eventi di CAD, 22
ricevevano un concomitante trattamento di insulina al momento dell’evento. I fattori precipitanti per la
CAD sono stati come previsto in una popolazione di diabete mellito di tipo 2
(vedere sezione 4.4).
Nello studio DAPA-HF, sono stati riportati eventi di CAD in 3 pazienti con diabete mellito di tipo 2 nel
gruppo dapagliflozin e nessuno nel gruppo placebo. Nello studio DELIVER, sono stati riportati
eventi di DKA in 2 pazienti con diabete mellito di tipo 2 nel gruppo dapagliflozin e nessuno nel gruppo
placebo.
Nello studio DAPA-CKD, non sono stati osservati eventi di CAD in nessun paziente nel gruppo
dapagliflozin e in 2 pazienti con diabete mellito di tipo 2 nel gruppo placebo.
Infezioni delle vie urinarie
Nel pool di 13 studi di sicurezza aggregati, sono state segnalate più frequentemente infezioni delle vie
urinarie per dapagliflozin 10 mg in confronto al placebo (rispettivamente, 4,7% vs 3,5%; vedere paragrafo
- 4.4). La maggior parte delle infezioni sono state da lievi a moderate, e i soggetti hanno risposto ad un ciclo iniziale di trattamento standard, e raramente hanno portato all’interruzione del trattamento con dapagliflozin. Tali infezioni sono state segnalate più frequentemente nelle donne e i soggetti con una storia pregressa avevano più probabilità di avere un’infezione ricorrente.
Nello studio DECLARE, sono stati riportati eventi avversi seri di infezioni del tratto urinario meno
frequentemente con dapagliflozin 10 mg in confronto al placebo, 79 (0,9%) eventi versus 109 (1,3%)
eventi, rispettivamente.
Nello studio DAPA-HF, il numero di pazienti con eventi avversi gravi di infezioni del tratto urinario sono
stati 14 (0,6%) nel gruppo dapagliflozin e 17 (0,7%) nel gruppo placebo. Ci sono stati 5 (0,2%) pazienti
con eventi avversi che hanno portato alla sospensione del trattamento a causa di infezioni del tratto
urinario sia nel gruppo dapagliflozin che placebo. Nello studio DELIVER il numero di pazienti con eventi
avversi gravi di infezioni del tratto urinario sono stati 41 (1,3%) nel gruppo dapagliflozin e 37 (1,2%) nel
gruppo placebo. Ci sono stati 13 (0,4%) pazienti con eventi avversi che hanno portato alla sospensione
del trattamento a causa di infezioni del tratto urinario nel gruppo dapagliflozin e 9 (0,3%) nel gruppo
placebo.
Nello studio DAPA-CKD, il numero di pazienti con eventi avversi gravi di infezioni del tratto urinario è
stato di 29 (1,3%) nel gruppo dapagliflozin e 18 (0,8%) nel gruppo placebo. Ci sono stati 8 (0,4%) pazienti
con eventi avversi che hanno portato a interruzioni dovute a infezioni del tratto urinario nel gruppo
dapagliflozin e 3 (0,1%) nel gruppo placebo. Il numero di pazienti senza diabete che hanno manifestato
eventi avversi gravi di infezioni del tratto urinario o eventi avversi che hanno portato all'interruzione a
causa di infezioni del tratto urinario era simile tra i gruppi di trattamento (6 [0,9%] versus 4 [0,6%] per
eventi avversi gravi e 1 [0,1%] versus 0 per gli eventi avversi che hanno portato all'interruzione,
rispettivamente nei gruppi dapagliflozin e placebo).
Creatinina aumentata
Reazioni avverse al farmaco correlate all’aumento della creatinina sono state raggruppate (ad es. ridotta
clearance renale della creatinina, compromissione renale, aumento della creatinina plasmatica e ridotta
velocità di filtrazione glomerulare). Nel pool di 13 studi di sicurezza, questo gruppo di reazioni è stato
riportato nel 3,2% e nell’1,8% dei pazienti che hanno ricevuto dapagliflozin 10 mg e placebo,
rispettivamente. Nei pazienti con funzionalità renale normale o compromissione renale
moderata (eGFR al basale ≥ 60 mL/min/1,73m ) questo gruppo di reazioni è stato riportato nell’1,3% e
nello 0,8% dei pazienti che hanno ricevuto dapagliflozin 10 mg e placebo, rispettivamente. Queste reazioni
sono state più comuni nei pazienti con eGFR al basale ≥ 30 e < 60 mL/min/1,73 m (18,5%
nei pazienti trattati con dapagliflozin 10 mg e 9,3% in quelli trattati con placebo).
Un’ulteriore valutazione dei pazienti che avevano avuto reazioni avverse correlate ai reni ha mostrato che
la maggior parte ha avuto cambiamenti nei livelli di creatinina nel siero di ≤ 44 micromoli/L (≤ 0,5 mg/dL)
dal basale. Gli aumenti nei livelli di creatinina sono stati generalmente transitori durante il trattamento
continuo o reversibili dopo l’interruzione del trattamento.
Nello studio DECLARE, comprendente pazienti anziani e pazienti con compromissione renale (eGFR
inferiore a 60 mL/min/1,73 m ), l’eGFR è diminuito nel tempo in entrambi i gruppi di trattamento. A 1
anno, la media di eGFR era leggermente inferiore, e a 4 anni, l’eGFR medio era leggermente superiore
nel gruppo dapagliflozin rispetto al gruppo placebo.
Negli studi DAPA-HF e DELIVER, eGFR è diminuito nel tempo sia nel gruppo dapagliflozin che nel
gruppo placebo. Nello studio DAPA-HF, la diminuzione iniziale dell'eGFR medio è stata di -4,3
mL/min/1,73 m nel gruppo dapagliflozin e di -1,1 mL/min/1,73 m nel gruppo placebo. A 20 mesi, la
variazione rispetto al basale di eGFR era simile tra i gruppi di trattamento: -5,3 mL/min/1,73 m per
dapagliflozin e -4,5 mL/min/1,73 m per placebo. Nello studio DELIVER, la diminuzione dell'eGFR
medio a un mese è stata di -3,7 mL/min/1,73 m nel gruppo dapagliflozin e di -0,4 mL/min/1,73 m nel
gruppo placebo. A 24 mesi, la variazione rispetto al basale di eGFR era simile tra i gruppi di trattamento:
- 4,2 ml/min/1,73 m nel gruppo dapagliflozin e -3,2 ml/min/1,73 m nel gruppo placebo.
Nello studio DAPA-CKD, l'eGFR è diminuito nel tempo sia nel gruppo dapagliflozin che nel gruppo
placebo. La diminuzione iniziale (giorno 14) dell'eGFR medio è stata di -4,0 mL/min/1,73 m nel gruppo
dapagliflozin e di -0,8 mL/min/1,73 m nel gruppo placebo. A 28 mesi, la variazione rispetto al basale
dell'eGFR è stata di -7,4 mL/min/1,73 m nel gruppo dapagliflozin e di -8,6 mL/min/1,73 m
nel gruppo placebo.
Popolazione pediatrica
Il profilo di sicurezza di dapagliflozin osservato in uno studio clinico in bambini dai 10 anni di età in su
con diabete mellito di tipo 2 (vedere paragrafo 5.1) era simile a quello osservato negli studi sugli adulti.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è
importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale.
Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema
nazionale di segnalazione all’indirizzo https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
4.9 Sovradosaggio
Dapagliflozin somministrato a dosi orali singole fino a 500 mg (50 volte la dose massima raccomandata
nell’uomo) non ha mostrato alcuna forma di tossicità in soggetti sani. Questi soggetti avevano livelli
rilevabili di glucosio nelle urine per un periodo di tempo dose correlato (almeno 5 giorni per 500 mg di
dose), senza casi di disidratazione, ipotensione o squilibrio elettrolitico, e senza un effetto clinicamente
rilevante sull’intervallo QTc. L’incidenza di ipoglicemia è risultata simile al placebo. Negli studi clinici
in cui sono state somministrate singole dosi giornaliere fino a 100 mg
(10 volte la dose massima raccomandata nell’uomo) per 2 settimane in soggetti sani e con diabete mellito
di tipo 2, l’incidenza dell’ipoglicemia è risultata leggermente superiore al placebo e non era dose correlata.
I tassi di frequenza degli eventi avversi inclusa la disidratazione o l’ipotensione sono risultati simili al
placebo, e non ci sono state alterazioni dose correlate clinicamente rilevanti dei parametri di laboratorio,
inclusi i livelli sierici degli elettroliti e i marcatori di funzionalità renale.
In caso di sovradosaggio, si deve attuare un trattamento appropriato di sostegno secondo quanto richiesto
dalle condizioni cliniche del paziente. L’eliminazione di dapagliflozin attraverso l’emodialisi non è stata
studiata.
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: Farmaci usati nel diabete, inibitori del co-trasportatore sodio-glucosio di
tipo 2 (SGLT2), codice ATC: A10BK01
Meccanismo d’azione
Dapagliflozin è un inibitore molto potente (Ki: 0,55 nM), selettivo e reversibile dell’SGLT2.
L'inibizione di SGLT2 da parte di dapagliflozin riduce il riassorbimento del glucosio dal filtrato
glomerulare nel tubulo renale prossimale con una concomitante riduzione del riassorbimento del sodio che
porta all'escrezione urinaria del glucosio e alla diuresi osmotica. Dapagliflozin aumenta inoltre il rilascio
di sodio a livello del tubulo distale, che aumenta il feedback tubuloglomerulare e riduce la pressione
intraglomerulare. Tutto ciò associato alla diuresi osmotica, porta ad una riduzione del sovraccarico di
volume, riduzione della pressione sanguigna, riduzione del pre-carico e post-carico, che possono avere
effetti benefici sul rimodellamento cardiaco e sulla funzione diastolica e preservare la funzione renale. I
benefici cardiaci e renali di dapagliflozin non dipendono esclusivamente dall'effetto di riduzione della
glicemia e non sono limitati ai pazienti con diabete, come dimostrato negli studi DAPA-HF, DELIVER e
DAPA-CKD. Altri effetti includono un aumento dell'ematocrito e la riduzione del peso corporeo.
Dapagliflozin migliora sia la glicemia a digiuno sia postprandiale riducendo il riassorbimento renale di
glucosio che porta all’escrezione urinaria di glucosio. Tale escrezione di glucosio (effetto glicosurico) è
osservata dopo la prima dose, è continua per un intervallo di somministrazione di 24 ore ed è mantenuta
per la durata del trattamento. La quantità di glucosio rimossa dal rene attraverso questo meccanismo
dipende dalla concentrazione ematica di glucosio e dal GFR. Quindi, nei soggetti con normali livelli di
glucosio nel sangue, dapagliflozin ha una bassa propensione a causare ipoglicemia. Dapagliflozin non
compromette la produzione endogena normale di glucosio in risposta all’ipoglicemia. Dapagliflozin agisce
indipendentemente dalla secrezione di insulina e dall’azione dell’insulina. In studi clinici con
dapagliflozin, è stato osservato un miglioramento nel modello di valutazione dell’omeostasi della
funzionalità delle cellule beta (HOMA beta-cell).
L’SGLT2 è espresso selettivamente nel rene. Dapagliflozin non inibisce altri trasportatori del glucosio
importanti per il trasporto del glucosio nei tessuti periferici ed è > 1.400 volte più selettivo per SGLT2
rispetto a SGLT1, il trasportatore principale nell’intestino responsabile dell’assorbimento di glucosio.
Effetti farmacodinamici
Sono stati osservati incrementi della quantità di glucosio escreto nelle urine di soggetti sani e con diabete
mellito di tipo 2 in seguito alla somministrazione di dapagliflozin. All’incirca 70 g di glucosio al giorno
sono stati escreti nelle urine (corrispondenti a 280 kcal/giorno) a una dose di dapagliflozin pari a 10 mg/die
in soggetti con diabete mellito di tipo 2 per 12 settimane. Sono emerse evidenze a conferma di
un’escrezione prolungata di glucosio nei soggetti con diabete mellito di tipo 2 che hanno ricevuto una dose
di 10 mg/die di dapagliflozin fino a 2 anni.
Questa escrezione urinaria di glucosio, indotta da dapagliflozin, determina anche una diuresi osmotica e
incrementi del volume urinario in soggetti con diabete mellito di tipo 2. Gli aumenti del volume urinario
in soggetti con diabete mellito di tipo 2 trattati con 10 mg di dapagliflozin sono perdurati fino a 12
settimane e corrispondevano approssimativamente a 375 mL/giorno. L’incremento del volume urinario è
stato correlato a un aumento esiguo e transitorio dell’escrezione urinaria di sodio, che non è stato associato
ad alterazioni delle concentrazioni sieriche di sodio.
Anche l’escrezione urinaria di acido urico è aumentata temporaneamente (per 3-7 giorni) ed era associata
a una diminuzione prolungata della concentrazione sierica di acido urico. A 24 settimane, le riduzioni delle
concentrazioni sieriche di acido urico variavano da -48,3 a -18,3 micromoli/L (da -0,87 a -0,33 mg/dL).
Efficacia e sicurezza clinica
Diabete mellito di tipo 2
Il miglioramento del controllo glicemico e la riduzione della comorbidità cardiovascolare e renale e della
mortalità sono parti integranti del trattamento del diabete di tipo 2.
Sono stati condotti quattordici studi clinici randomizzati, controllati, in doppio cieco su 7.056 soggetti
adulti con diabete mellito di tipo 2 per valutare l’efficacia glicemica e la sicurezza di Dapaglifozin
Tecnigen; in questi studi 4.737 soggetti sono stati trattati con dapagliflozin. Dodici studi prevedevano un
periodo di trattamento di 24 settimane, 8 studi avevano fasi di estensione a lungo termine da 24 a 80
settimane (fino a una durata massima totale dello studio di 104 settimane), uno studio aveva un periodo di
trattamento di 28 settimane, e uno studio aveva una durata pari a 52 settimane con estensione a lungo
termine di 52 e 104 settimane (durata totale dello studio di 208 settimane). La durata media del diabete
andava da 1,4 a 16,9 anni. Il 50% dei soggetti soffriva di compromissione renale lieve ed l’11% di
compromissione renale moderata. Il 51% dei soggetti era di sesso maschile, l’84% era di razza bianca,
l’8% era asiatico, il 4% era di razza nera e il 4% apparteneva ad altri gruppi razziali. L’81% dei soggetti
aveva un indice di massa corporea (BMI, body mass index) 27. Due studi di 12 settimane controllati
verso placebo sono inoltre stati condotti in pazienti con diabete di tipo 2 non adeguatamente controllato e
ipertensione.
Uno studio sugli esiti cardiovascolari (DECLARE) è stato condotto con dapagliflozin 10 mg rispetto al
placebo in 17.160 pazienti con diabete mellito di tipo 2 con o senza malattia cardiovascolare accertata per
valutare l'effetto sugli eventi cardiovascolari e renali.
Controllo glicemico
Monoterapia
È stato realizzato uno studio clinico in doppio cieco, controllato vs placebo, della durata di
24 settimane (con un periodo di estensione supplementare) per valutare la sicurezza e l’efficacia della
monoterapia con Dapaglifozin Tecnigen in soggetti con diabete mellito di tipo 2 non adeguatamente
controllato. Il trattamento con dapagliflozin una volta al giorno ha prodotto riduzioni statisticamente
significative (p < 0,0001) di emoglobina glicata (HbA1c) rispetto al placebo (Tabella 2).
Nella fase di estensione, le riduzioni di HbA1c sono perdurate fino alla settimana 102 (una variazione
media aggiustata dal basale pari rispettivamente a -0,61% e -0,17% con dapagliflozin 10 mg e con
placebo).
Tabella 2. Risultati rilevati alla settimana 24 (LOCFa) in uno studio clinico con dapagliflozin in
monoterapia controllato con placebo
Monoterapia
Dapagliflozin
10 mg
Placebo
N 70 75
HbA1c (%)
Basale (media)
Variazione rispetto al basalec
Differenza rispetto al placeboc
(IC 95%)
8,01
- 0,89
- 0,66* (-0,96; -0,36) 7,79
- 0,23
Soggetti (%) che hanno ottenuto:
HbA1c < 7%
Aggiustato per i valori basali 50,8§ 31,6
Peso corporeo (kg)
Basale (medio)
Variazione rispetto al basalec
Differenza rispetto al placeboc
(IC 95%)
94,13
- 3,16
- 0,97 (-2,20; 0,25) 88,77
- 2,19
Terapia di associazione aggiuntiva (add-on)
In uno studio di non inferiorità con controllo attivo, della durata di 52 settimane (con periodi di
estensione di 52 e 104 settimane), Dapaglifozin Tecnigen è stato valutato come terapia aggiuntiva
a metformina in confronto a una sulfanilurea (glipizide) come terapia aggiuntiva a metformina, in
soggetti con un controllo glicemico non adeguato (HbA1c > 6,5% e ≤ 10%). I risultati hanno
mostrato una riduzione media simile di HbA1c dal basale alla settimana 52, rispetto a glipizide,
dimostrando così la non inferiorità del trattamento (Tabella 3). Alla settimana 104, la variazione
rispetto al basale della media di HbA1c era –0,32% per dapagliflozin e –0,14% per glipizide. Alla
settimana 208, la variazione rispetto al basale della media di HbA1c era –0,10% per dapagliflozin
e 0,20% per glipizide. Alle settimane 52, 104 e 208, una percentuale significativamente più bassa
di soggetti nel gruppo trattato con dapagliflozin (3,5%, 4,3% e 5,0% rispettivamente) ha
manifestato almeno un evento ipoglicemico rispetto al gruppo trattato con glipizide (40,8%, 47,0%
e 50,0% rispettivamente). La percentuale dei soggetti presenti nello studio alla settimana 104 e alla
settimana 208 era 56,2% e 39,7% per il gruppo trattato con dapagliflozin e 50,0% e 34,6% per il
gruppo trattato con glipizide.
Tabella 3. Risultati rilevati alla settimana 52 (LOCFa) in uno studio con controllo attivo
che haconfrontato dapagliflozin rispetto glipizide come terapia aggiuntiva alla metformina
Parametro
Dapagliflozin
+ metformina
Glipizide
+ metformina
N400 401
HbA1c (%)
Basale (media)
Variazione rispetto al basale
Differenza rispetto a
glipizide + metformina
(IC 95%)
7,69
- 0,52 0,00 (-0,11; 0,11) 7,74
- 0,52
88,44
- 3,22
- 4,65* (-5,14; -4,17) 87,60 1,44 Peso corporeo (kg)Basale (medio) Variazione rispetto al basale Differenza rispetto a glipizide + metformina (IC 95%)
Dapagliflozin in aggiunta a metformina, glimepiride, metformina e una sulfanilurea, sitagliptin
(con o senza metformina) o insulina ha prodotto riduzioni statisticamente significative di HbA1c
alla settimana 24, in confronto a quanto osservato nei soggetti che hanno ricevuto il placebo (p <
0,0001; Tabelle 4, 5 e 6).
Le riduzioni di HbA1c rilevate alla settimana 24 permanevano negli studi sulla terapia di
associazione (glimepiride e insulina) in base ai dati alla settimana 48 (glimepiride) e fino alla
settimana 104 (insulina). Alla settimana 48, quando aggiunto a sitagliptin (con o senza
metformina), le variazioni medie aggiustate rispetto al basale per dapagliflozin 10 mg e per il
placebo erano rispettivamente - 0,30% e 0,38%. Secondo lo studio sulla terapia aggiuntiva a
metformina, le riduzioni di HbA1c si sono mantenute fino alla settimana 102 (variazione media
aggiustata dal basale, pari rispettivamente
a -0,78% e 0,02% per 10 mg e placebo). Alla settimana 104 per insulina (con o senza l’associazione
di ipoglicemizzanti orali), le riduzioni medie di HbA1c rispetto al basale erano -0,71% e -0,06%
rispettivamente per dapagliflozin 10 mg e placebo. Alle settimane 48 e 104 la dose di insulina è
rimasta stabile rispetto al basale in soggetti trattati con dapagliflozin 10 mg ad una dose media di
76 UI/die. Nel gruppo con placebo c’era un incremento medio dal basale rispettivamente di 10,5
UI/die e 18,3 UI/die (media della dose media di 84 e 92 UI/die) alle settimane 48 e 104. La
percentuale di soggetti presenti nello studio alla settimana 104 era del 72,4% per il gruppo trattato
con dapagliflozin 10 mg e del 54,8% per il gruppo placebo.
Tabella 4. Risultati rilevati alla settimana 24 (LOCFa) degli studi clinici di dapagliflozin
controllati con placebo in terapia di associazione aggiuntiva con metformina, o sitagliptin
(con o senza metformina)
Terapia di associazione aggiuntiva
MetforminaInibtori di DPP-4
(sitagliptin) ±
metformina
DapagliflozinPlaceboDapagliflozinPlacebo
10 mg10 mg
Nb135 137 223 224
HbA1c (%)
Basale (media) 7.92 8.11 7.90 7.97
Variazione rispetto al
basale -0.84 -0.30 -0.45 0.04
Differenza rispetto al
placebo -0.54 -0.48
(95% CI) (-0.74, -0.34) (-0.62, -0.34)
Soggetti(%)che
hannoottenuto:
HbA1c < 7%
Aggiustato per i valori
basali
- 40.6 25.9
Peso corporeo (kg)
Basale (medio) 86.28 87.74 91.02 89.23
Variazione rispetto al
basale -2.86 -0.89 -2.14 -0.26
Differenza rispetto al
placebo -1.97 -1.89
(95% CI) (-2.63, -1.31) (-2.37, -1.40)
Tabella 5. Risultati rilevati alla settimana 24 in uno studio clinico controllato con placebo riguardante
l’impiego di dapagliflozin in associazione aggiuntiva con sulfanilurea (glimepiride) o metformina e una
sulfanilurea
Terapia di associazione aggiuntiva
Sulfanilurea (glimepiride)Sulfanilurea + metformina2
Dapagliflozin
10 mg
PlaceboDapagliflozin
10 mg
Placebo
N 151 145 108 108
HbA1c (%)
Basale (media)
Variazione rispetto
al basale
Differenza rispetto
al placebo
(IC 95%)
8,08
- 0,86
- 0,69*
(−0,89; −0,49)
8,15
- 0,13 8,24
- 0,17 8,07
- 0,82
- 0,68*
(-0,86; -0,51)
Soggetti (%) che
hanno ottenuto:
HbA1c < 7%
(LOCF)
Aggiustato per i
valori basali 31,7* 13,0 31,8* 11,1
Peso corporeo (kg)
(LOCF)
Basale (medio)
Variazione rispetto
al basale
Differenza rispetto al
placebo
80,56
- 2,26
- 1,54*
(-2,17; -0,92)
88,57
- 2,65
- 2,07*
(−2,79; −1,35)
80,94
- 0,72 90,07
- 0,58
(IC 95%)
Tabella 6. Risultati rilevati alla settimana 24 (LOCFa) in uno studio clinico controllato con
placebo riguardante l’impiego di dapagliflozin in associazione con l’insulina (da sola o con
farmaci ipoglicemizzanti orali)
Placebo
+ insulina
± farmaci ipoglicemizzanti
orali
N194 193
HbA1c (%)
Basale (media)
Variazione rispetto al
basale
Differenza rispetto al
placebo
(IC 95%)
Dapagliflozin 10 mg
+ insulina
± farmaci ipoglicemizzanti orali
Parametro
8,46
- 0,30 8,58
- 0,90
- 0,60* (-0,74; -0,45)
94,21
0,02
8,58
- 0,90
- 0,60* (-0,74; -0,45) Peso corporeo (kg)Basale (medio) Variazione rispetto al basale Differenza rispetto al placebo (IC 95%)
77,96
- 1,16
- 6,23* (-8,84; -3,63)
19,7**
73,96
5,08
11,0
Dose giornaliera media
di
insulina (UI)
Basale (media)
Variazione rispetto al
basale
Differenza rispetto al
placebo
(IC 95%)
Soggetti con riduzione
della
dose giornaliera media di
insulina almeno del 10%
(%)
In associazione con metformina in pazienti naïve alla terapia
Un totale di 1236 pazienti naïve alla terapia con diabete di tipo 2 non adeguatamente controllato
(HbA1c ≥ 7,5% e ≤ 12%) hanno partecipato a due studi controllati in attivo della durata di 24
settimane per valutare l’efficacia e la sicurezza di dapagliflozin (5 mg o 10 mg) in associazione a
metformina in pazienti naïve alla terapia rispetto alla terapia con i monocomponenti.
Il trattamento con dapagliflozin 10 mg in associazione a metformina (fino a 2000 mg al giorno) ha fornito
miglioramenti significativi in HbA1c rispetto ai singoli componenti (Tabella 7) e ha portato a una maggiore
riduzione della glicemia a digiuno (FPG, fasting plasma glucose) (rispetto ai singoli componenti) e del peso
corporeo (rispetto a metformina).
Tabella 7. Risultati rilevati alla settimana 24 (LOCFa) in uno studio clinico controllato con attivo
riguardante la terapia di combinazione di dapagliflozin e metformina in pazienti naïve alla
terapia
Parametro
Dapagliflozin 10 mgDapagliflozin 10 mgMetformina
+
metformina
N 211 219 208
HbA1c (%)
Basale (media)
Variazione rispetto al
basalec
Differenza rispetto a
dapagliflozin
(IC 95%)
Differenza rispetto a
metformina
(IC 95%)
9,03
- 1,44 9,03
- 1,45
- 0,01 (-0,22; 0,20) 9,10
- 1,98
- 0,53* (-0,74; -0,32)
- 0,54* (-0,75; -0,33)
Terapia di combinazione con exenatide a rilascio prolungato
In uno studio controllato, a 28 settimane, in doppio cieco, con farmaco di confronto, la combinazione di
dapagliflozin e exenatide a rilascio prolungato (un agonista del recettore GPL-1) è stata confrontata con
dapagliflozin da sola e con exenatide a rilascio prolungato da sola nei pazienti con un inadeguato controllo
glicemico con metformina da sola (HbA1c ≥ 8% e ≤ 12%). Tutti i gruppi di trattamento hanno mostrato una
riduzione dell’HbA1c rispetto al basale.
Il trattamento in combinazione con dapagliflozin 10 mg e exenatide a rilascio prolungato ha mostrato una
riduzione superiore dell’HbA1c dal basale rispetto a dapagliflozin da sola e a exenatide a rilascio prolungato
da sola (Tabella 8).
Tabella 8: Risultati di uno studio a 28 settimane di dapagliflozin e exenatide a rilascio
prolungato versus dapagliflozin da solo e exenatide a rilascio prolungato da sola, in associazione
con metformina (pazienti “intent to treat”)
Exenatide a
rilascio
prolungato 2 mg
QW
+
placebo QD
N228230227
HbA1c (%)
Basale (medio)
Variazione rispetto al
basale
Differenza media della
variazione dal basale tra
combinazione e singolo
farmaco (IC 95%)
Dapagliflozin 10 mg
QD
+
placebo QW
Dapagliflozin 10 mg
QD
+
exenatide a rilascio
prolungato 2 mg
ParametroQW
9,29
- 1,98 9,26
- 1,60
- 0,38** (-0,63; -0,13) Pazienti (%) chehanno ottenuto unHbA1c < 7%44,7 19,1 26,9 9,25
- 1,39
- 0,59* (-0,84; -0,34)
92,13
- 3,55 90,87
- 2,22
- 1,33* (-2,12; -0,55) 89,12
- 1,56
- 2,00* (-2,79; -1,20)
Glicemia a digiuno
Il trattamento con dapagliflozin 10 mg come monoterapia o come terapia aggiuntiva a metformina,
glimepiride, metformina e una sulfanilurea, sitagliptin (con o senza metformina) o insulina ha prodotto
riduzioni statisticamente significative della FPG (da -1,90 a -1,20 mmol/L [da -34,2 a -21,7 mg/dL])
rispetto al placebo (da -0,33 a 0,21 mmol/L [da -6,0 a 3,8 mg/dL]). Questo effetto è stato osservato
alla settimana 1 di trattamento ed è persistito negli studi di estensione fino alla settimana 104.
La terapia di combinazione di dapagliflozin 10 mg e exenatide a rilascio prolungato ha determinato
riduzioni significativamente più grandi della FPG alla settimana 28: -3,66 mmol/L (-65,8 mg/dL),
rispetto a -2,73 mmol/L (-49,2 mg/dL) per dapagliflozin da sola (p < 0,001) e -2,54 mmol/L
(-45,8 mg/dL) per exanatide da sola (p < 0,001).
In uno studio dedicato, in pazienti diabetici con una eGFR da ≥ 45 a < 60 mL/min/1,73 m , il
trattamento con dapagliflozin ha dimostrato una riduzione della FPG alla settimana 24: -1,19 mmol/L
(-21,46 mg/dL) rispetto a -0,27 mmol/L (-4,87 mg/dL) per il placebo (p=0,001).
Glicemia postprandiale
Il trattamento con dapagliflozin 10 mg come terapia di associazione aggiuntiva a glimepiride ha prodotto
alla settimana 24 riduzioni statisticamente significative della glicemia postprandiale misurata a distanza
Peso corporeo (kg)
Basale (medio)
Variazione dal basale
Differenza media della
variazione dal basale tra
combinazione e singolo
farmaco (IC 95%)
di 2 ore, che sono persistite fino alla settimana 48.
Il trattamento con dapagliflozin 10 mg come terapia di associazione aggiuntiva a sitagliptin (con o
senza metformina) ha prodotto alla settimana 24 riduzioni della glicemia postprandiale misurata a
distanza di 2 ore che sono persistite fino alla settimana 48.
La terapia di combinazione di dapagliflozin 10 mg e exenatide a rilascio prolungato ha determinato
riduzioni significativamente più grandi della glicemia postprandiale a 2 ore dal pasto alla settimana 28
rispetto ad un altro farmaco da solo.
Peso corporeo
Dapagliflozin 10 mg come terapia di associazione aggiuntiva a metformina, glimepiride, metformina e
una sulfanilurea, sitagliptin (con o senza metformina) o insulina ha prodotto una diminuzione
statisticamente significativa del peso corporeo alla settimana 24 (p < 0,0001, Tabelle 4 e 5). Questi effetti
sono persistiti negli studi clinici a lungo termine. A 48 settimane la differenza per dapagliflozin in
associazione a sitagliptin (con o senza metformina) rispetto al placebo era -2,22 kg. A 102 settimane la
differenza per dapagliflozin in associazione a metformina rispetto al placebo, o in associazione a insulina
rispetto al placebo era rispettivamente di –2,14 e –2,88 kg.
Come terapia aggiuntiva a metformina in uno studio di non inferiorità con controllo attivo, dapagliflozin
ha prodotto una diminuzione statisticamente significativa del peso corporeo rispetto a glipizide di – 4,65
kg alla settimana 52 (p < 0,0001, Tabella 3) che persisteva alle settimane 104 e 208 (– 5,06 kg e – 4,38
kg, rispettivamente).
La combinazione di dapagliflozin 10 mg e exenatide a rilascio prolungato ha mostrato riduzioni di peso
corporeo significativamente più grandi rispetto ad un altro farmaco da solo (Tabella 8).
Uno studio clinico a 24 settimane in 182 soggetti diabetici utilizzando l’assorbimetria a raggi X a
doppia energia (DXA, X-ray absorptiometry) per valutare la composizione della massa corporea ha
mostrato una riduzione con dapagliflozin 10 mg più metformina in confronto al placebo più
metformina, rispettivamente del peso corporeo e della massa grassa corporea, secondo quanto misurato
mediante DXA, piuttosto che della massa magra o della perdita di liquidi. Il trattamento con
Dapaglifozin Tecnigen più metformina ha prodotto una riduzione numerica nel tessuto adiposo
viscerale rispetto al placebo più metformina in un sottostudio mediante immagini di risonanza
magnetica.
Pressione sanguigna
In un’analisi aggregata predefinita di 13 studi controllati con placebo, il trattamento con dapagliflozin
10 mg ha prodotto una variazione dal basale della pressione arteriosa sistolica di -3,7 mmHg e della
pressione arteriosa diastolica di -1,8 mmHg vs -0,5 mmHg (pressione arteriosa sistolica) e -0,5 mmHg
(pressione arteriosa diastolica) per il gruppo placebo alla settimana 24. Riduzioni simili sono state
osservate fino alla settimana 104.
La terapia di combinazione di dapagliflozin 10 mg e exenatide a rilascio prolungato ha determinato una
riduzione nella pressione sanguigna sistolica alla settimana 28 significativamente più grande
(-4,3 mmHg) rispetto a dapagliflozin da sola (-1,8 mmHg, p < 0,05) e exenatide a rilascio prolungato
da sola (-1,2 mmHg, p < 0,01).
In due studi di 12 settimane controllati verso placebo, un totale di 1.062 pazienti con diabete di tipo 2 non
adeguatamente controllato e ipertensione (nonostante il preesistente trattamento stabile con ACE-I o ARB
in uno studio e ACE-I o ARB più un altro trattamento antipertensivo nell’altro studio) sono stati trattati con
dapagliflozin 10 mg o placebo. Alla settimana 12 in entrambi gli studi, dapagliflozin 10 mg più un
trattamento antidiabetico usuale ha prodotto un miglioramento di HbA1c e ha ridotto la pressione sanguigna
sistolica corretta per il placebo in media di 3,1 e 4,3 mmHg, rispettivamente.
In uno studio dedicato, in pazienti diabetici con una eGFR da ≥ 45 a < 60 mL/min/1,73 m , il trattamento
con dapagliflozin ha dimostrato una riduzione della pressione arteriosa sistolica alla settimana 24: -4,8
mmHg rispetto a -1,7 mmHg per il placebo (p < 0,05).
Controllo glicemico in pazienti con compromissione renale moderata CKD 3A
(eGFR da ≥ 45 a < 60 mL/min/1,73 m)
L’efficacia di dapagliflozin è stata valutata in uno studio dedicato con pazienti diabetici con eGFR
≥ 45 a < 60 mL/min/1,73 m che hanno un controllo inadeguato della glicemia con un trattamento
abituale. Il trattamento con dapaglifozin ha portato a una diminuzione dell’HbA1c e del peso corporeo
rispetto al placebo (Tabella 9).
Tabella 9. Risultati alla settimana 24 di uno studio con dapaglifozin controllato verso placebo in
pazienti diabetici con una eGFR ≥ 45 a < 60 mL/min/1.73 m
Dapagliflozin
10 mg
Placebo
N159 161
HbA1c (%)
Valore basale (medio)
Variazione dal basale
Differenza rispetto al placebo
(95% IC)
8,03
- 0,03 8,35
- 0,37
- 0,34* (-0,53; -0,15)
88,30
- 2,02 92,51
- 3,42
- 1,43* (-2,15; -0,69) Peso corporeo (kg)Valore basale (medio) Percentuale di variazione rispetto al basale Differenza in percentuale rispetto al placebo (95% IC)
Pazienti con HbA1c al basale ≥ 9%
In un’analisi predefinita di soggetti con HbA1c al basale ≥ 9,0% il trattamento con dapagliflozin 10 mg
come monoterapia ha portato a riduzioni statisticamente significative di HbA1c alla settimana 24
(variazione media dal basale aggiustata: -2,04% e 0,19% per dapagliflozin 10 mg e placebo,
rispettivamente) e in associazione aggiuntiva alla metformina (variazione media aggiustata dal basale:
- 1,32% e -0,53% per dapagliflozin e placebo, rispettivamente).
Risultati cardiovascolari e renali
Effetti di dapagliflozin sugli eventi cardiovascolari (DECLARE) è uno studio internazionale,
multicentrico, randomizzato, in doppio cieco, controllato con placebo condotto per determinare
l’effetto di dapagliflozin rispetto al placebo sugli esiti cardiovascolari quando aggiunto alla terapia in
atto. Tutti i pazienti avevano diabete mellito di tipo 2 ed almeno altri due fattori di rischio
cardiovascolare aggiuntivi (età ≥ di 55 anni negli uomini o ≥ di 60 anni nelle donne e uno o più di
dislipidemia, ipertensione o consumo di tabacco) o patologia cardiovascolare accertata.
Dei 17.160 pazienti randomizzati, 6.974 (40,6%) avevano patologia cardiovascolare accertata e
- 10.186 (59,4%) non avevano patologia cardiovascolare nota. 8.582 pazienti sono stati randomizzati a dapagliflozin 10 mg e 8.578 a placebo, e sono stati seguiti per una media di 4,2 anni.
L’età media della popolazione dello studio era di 63,9 anni, il 37,4% erano donne. In totale, 22,4 %
avevano ricevuto diagnosi di diabete da ≤ 5 anni, la durata media del diabete era di 11,9 anni. La media
di HbA1c era di 8,3% e la media di IMC era di 32,1 kg/m .
Al basale, il 10,0% dei pazienti aveva una storia di insufficienza cardiaca. La media di eGFR era di
85,2 mL/min/1,73 m , il 7,4% dei pazienti aveva un eGFR < 60 mL/min/1,73 m , e il 30,3% dei pazienti
aveva micro- o macroalbuminuria (ACR ≥ 30 a ≤ 300 mg/g o > 300 mg/g, rispettivamente).
Molti dei pazienti (98%) utilizzavano uno o più medicinali per il diabete al basale, inclusa metformina
(82%), insulina (41%) e sulfonilurea (43%).
Gli endpoints primari sono stati il tempo del primo evento del composito di morte cardiovascolare,
infarto miocardico o ictus ischemico (MACE) e del tempo del primo evento di ospedalizzazione per
insufficienza cardiaca o morte cardiovascolare. Gli endpoints secondari sono stati un endpoint renale
composito e mortalità per tutte le cause.
Eventi avversi cardiovascolari maggiori
Dapagliflozin 10 mg ha dimostrato la non inferiorità versus il placebo per il composito di morte
cardiovascolare, infarto del miocardio e ictus ischemico (p ad una coda < 0,001).
Insufficienza cardiaca e morte cardiovascolare
Dapagliflozin 10 mg ha dimostrato superiorità versus il placebo nella prevenzione del composito di
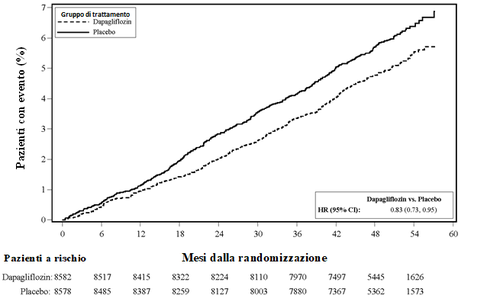
ospedalizzazione per insufficienza cardiaca o morte cardiovascolare (Figura 1). La differenza
nell’effetto terapeutico è stata guidata dall’ospedalizzazione per insufficienza cardiaca, senza nessuna
differenza nella morte cardiovascolare (Figura 2).
Il beneficio del trattamento di dapagliflozin rispetto al placebo è stato osservato per i pazienti con o
senza una patologia cardiovascolare accertata e con o senza insufficienza cardiaca al basale, ed è stata
consistente attraverso i sottogruppi inclusi età, genere, funzionalità renale (eGFR) e regione.
Figura 1: Tempo del primo evento di ospedalizzazione per insufficienza cardiaca o per morte
cardiovascolare.
Pazienti a rischio è il numero di pazienti a rischio all’inizio del periodo.
HR=Hazard ratio IC=Intervallo di confidenza.
I risultati degli endpoints primari e secondari sono illustrati nella Figura 2. La superiorità di
dapagliflozin rispetto al placebo non è stata dimostrata per MACE (p=0,172). L’endpoint composito
renale e mortalità per tutte le cause non sono stati, pertanto, testati nell’ambito della procedura di test
di conferma.
Figura 2: Effetti del trattamento per gli endpoints compositi primari e dei loro componenti, ed
endpoints secondari
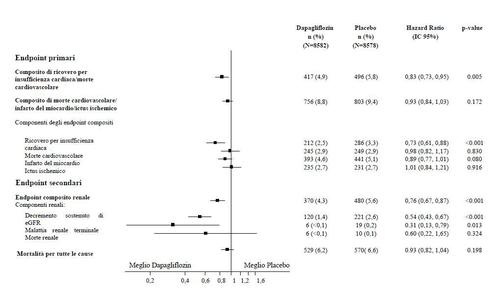
L’endpoint composito renale è stato definito come: decremento sostenuto e confermato ≥ 40%
dell’eGFR a eGFR <60 mL/min/1,73 m e/o stadio finale malattia renale (dialisi ≥ 90 giorni o trapianto
di rene, eGFR sostenuto e confermato < 15 mL/min/1,73 m ) e/o morte renale o cardiovascolare.
I valori di p erano a due code. I valori di p degli endpoints secondari e per i singoli componenti sono
nominali. Il tempo del primo evento è stato analizzato nel modello dei rischi proporzionali di Cox. Il
numero dei primi eventi avversi per i singoli componenti è il numero attuale dei primi eventi per ciascun
componente e non si somma al numero di eventi nell'endpoint composito.
IC=intervallo di confidenza.
Nefropatia
Dapagliflozin ha ridotto l’incidenza degli eventi del composito di decremento del eGFR sostenuto e
confermato, dello stadio finale della malattia renale, della morte renale o cardiovascolare. La differenza
tra i gruppi è stata guidata dalle riduzioni degli eventi dei componenti renali; dal decremento sostenuto
di eGFR, stadio finale della malattia renale e morte renale (Figura 2).
L’hazard ratio (HR) per il tempo di nefropatia (decremento sostenuto di eGFR, stadio finale della
malattia renale e morte renale) è stato di 0,53 (95% IC 0,43; 0,66) per dapagliflozin versus il placebo.
In aggiunta, dapaglifozin ha ridotto la nuova insorgenza dell'albuminuria sostenuta (HR 0,79 [95%
IC 0,72; 0,87]) e ha portato ad una maggiore regressione di macroalbuminuria (HR 1,82 [95% IC
1,51; 2,20]) confrontato con placebo.
Insufficienza cardiaca
Studio DAPA-HF: Insufficienza cardiaca con frazione di eiezione ridotta (LVEF ≤ 40%)
Dapagliflozin e la prevenzione degli esiti avversi nell’insufficienza cardiaca (DAPA-HF) è stato uno
studio internazionale, multicentrico, randomizzato, in doppio cieco, controllato con placebo in pazienti
con insufficienza cardiaca (New York Heart Association [NYHA] classe funzionale II-IV) con frazione
di eiezione ridotta (frazione di eiezione ventricolare sinistra [LVEF] ≤ 40%) per determinare l'effetto di
dapagliflozin rispetto al placebo, quando aggiunto alla terapia di base secondo lo standard di
cura, sull'incidenza della morte cardiovascolare e peggioramento dell'insufficienza cardiaca.
Dei 4.744 pazienti, 2.373 sono stati randomizzati con dapagliflozin 10 mg e 2.371 con placebo e seguiti
per un tempo mediano di 18 mesi. L'età media della popolazione studiata era di 66 anni, il 77% era di
genere maschile.
Al basale, il 67,5% dei pazienti sono stati classificati come NYHA classe II, il 31,6% nella classe III e
lo 0,9% nella classe IV, LVEF mediana era 32%, il 56% delle insufficienze cardiache erano di origine
ischemica, il 36% erano di origine non-ischemica e l’8% erano di eziologia sconosciuta. In ogni gruppo
di trattamento, il 42% dei pazienti aveva una storia di diabete mellito di tipo 2, e un ulteriore 3% dei
pazienti in ciascun gruppo sono stati classificati come aventi diabete mellito di tipo 2 sulla
base di un HbA1c ≥ 6,5% misurato sia all'arruolamento che alla randomizzazione. I pazienti erano in
terapia secondo lo standard di cura per insufficienza cardiaca; il 94% dei pazienti erano in trattamento
con ACE-I, ARB o inibitore del recettore dell'angiotensina-neprilisina (ARNI, 11%), il 96% con beta-
bloccante, il 71% con un antagonista recettore mineralcorticoide (MRA), il 93% con diuretico e il 26%
aveva un dispositivo impiantabile (con funzione di defibrillatore).
I pazienti con eGFR ≥ 30 mL/min/1,73 m sono stati inclusi nello studio al momento dell'arruolamento.
L'eGFR medio era di 66 mL/min/1,73 m , il 41% dei pazienti aveva eGFR< 60 mL/min/1,73 m e il
15% aveva eGFR < 45 mL/min/1,73 m .
Morte cardiovascolare e peggioramento dell'insufficienza cardiaca
Dapagliflozin è stato superiore al placebo nella prevenzione dell'endpoint composito primario di morte
cardiovascolare, ospedalizzazione per insufficienza cardiaca o visita urgente per insufficienza cardiaca
(HR 0,74 [95% CI 0,65; 0,85], p < 0,0001). L'effetto è stato osservato precocemente ed è stato mantenuto
per tutta la durata dello studio (Figura 3).
Figura 3: Tempo dal primo evento dell’endpoint composito di morte cardiovascolare,
ospedalizzazione per insufficienza cardiaca o visita urgente per insufficienza cardiaca
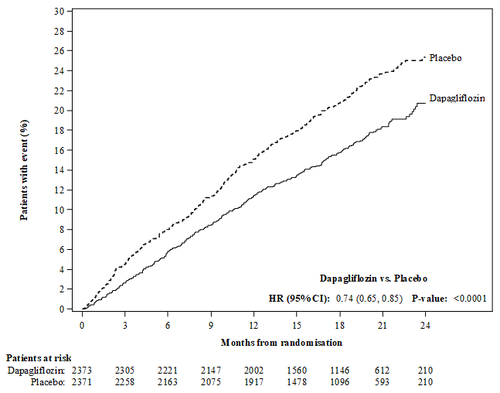
Pazienti con evento (%)
Mesi dalla randomizzazione
Tutti e tre i componenti dell'endpoint composito primario hanno contribuito individualmente all'effetto
del trattamento (Figura 4). Ci sono state poche visite urgenti per insufficienza cardiaca.
Figura 4: Effetti del trattamento per l'endpoint composito primario, i suoi componenti e la
mortalità per tutte le cause
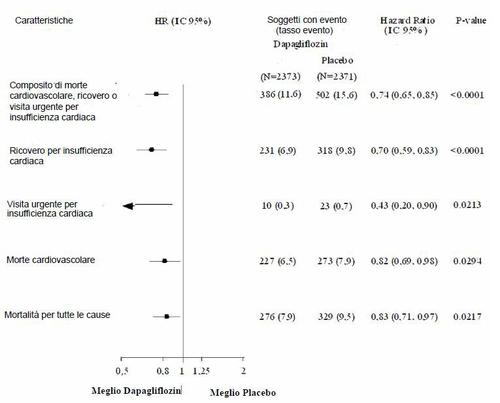
Dapagliflozin ha anche ridotto il numero totale di eventi di ospedalizzazione per insufficienza cardiaca
(primo e ricorrente) e morte cardiovascolare; ci sono stati 567 eventi nel gruppo dapagliflozin contro
742 eventi nel gruppo placebo (Rate Ratio 0,75 [95% IC 0,65;0,88]; p=0,0002).
Il beneficio del trattamento di dapagliflozin è stato osservato nei pazienti con insufficienza cardiaca sia
con diabete mellito di tipo 2 che senza diabete. Dapagliflozin ha ridotto l'endpoint composito primario
di incidenza di morte cardiovascolare e peggioramento dell'insufficienza cardiaca con un HR di 0,75
(95% IC 0,63; 0,90) in pazienti con diabete e 0,73 (95% IC 0,60; 0,88) in pazienti senza diabete.
Il beneficio del trattamento di dapagliflozin rispetto al placebo sull'endpoint primario è stato coerente
anche in altri sottogruppi chiave, tra cui quelli con concomitante terapia per insufficienza cardiaca,
funzione renale (eGFR), età, genere e regione.
Esito segnalato dal paziente - sintomi di insufficienza cardiaca
L'effetto del trattamento di dapagliflozin sui sintomi di insufficienza cardiaca è stato valutato mediante
il Total Symptom Score del Kansas City Cardiomyopathy Questionnaire (KCCQ-TSS), che quantifica
la frequenza e la severità dei sintomi di insufficienza cardiaca, tra cui stanchezza, edema periferico,
dispnea e ortopnea. Il punteggio varia da 0 a 100, con punteggi più alti che rappresentano un migliore
stato di salute.
Il trattamento con dapagliflozin ha portato ad un beneficio statisticamente significativo e clinicamente
significativo rispetto al placebo nei sintomi dell’insufficienza cardiaca, come misurato dal
cambiamento dal basale al mese 8 nel KCCQ-TSS, (Win Ratio 1,18 [95% CI 1,11; 1,26]; p < 0,0001).
Sia la frequenza che la severità dei sintomi hanno contribuito ai risultati. Il beneficio è stato visto sia
nel miglioramento dei sintomi dell’insufficienza cardiaca che nel prevenire il peggioramento dei
sintomi dell’insufficienza cardiaca.
Nell’analisi dei pazienti con risposta al trattamento, la proporzione dei pazienti con un miglioramento
clinicamente significativo sul KCCQ-TSS rispetto al basale a 8 mesi, definito come un aumento di 5
punti o più, era più alta per il gruppo di trattamento con dapagliflozin rispetto al placebo. La
proporzione di pazienti con un peggioramento clinicamente significativo, definito come una riduzione
di 5 punti o più, era inferiore per il gruppo di trattamento con dapagliflozin rispetto al placebo. I
benefici osservati con dapagliflozin rimanevano quando si applicavano limiti più conservativi per un
cambiamento clinicamente più significativo (Tabella 10).
Tabella 10. Numero e percentuale di pazienti con miglioramento clinicamente significativo e
deterioramento sul KCCQ-TSS a 8 mesi
| Variazione rispetto al basale a 8 mesi: | Dapagliflozin 10 mg na=2086 | Placebo l na=2062 | ||
| Miglioramento | n (%) miglioratib | e n (%) d miglioratib | Rapporto OddsC (95% CI) | p-valuef |
| ≥ 5 punti | 933 (44,7) | 794 (38,5) | 1,14 (1,06; 1,22) | 0,0002 |
| ≥ 10 punti | 689 (33,0) | a 579 (28,1) | 1,13 (1.05; 1.22) | 0,0018 |
| ≥ 15 punti | 474 (22,7) | n 406 (19,7) | 1,10 (1,01; 1,19) | 0,0300 |
| Deterioramento | a n (%) i deterioratid | n (%) deterioratid | Rapporto Oddse (95% CI) | p-valuef |
| ≥ 5 punti | l 537 (25,7) | 693 (33,6) | 0,84 (0,78; 0,89) | <0,0001 |
| ≥ 10 punti | a t 395 (18,9) | 506 (24,5) | 0,85 (0,79; 0,92) | <0,0001 |
Nefropatia
Ci sono stati pochi eventi dell'endpoint composito renale (una diminuzione confermata e sostenuta di
eGFR ≥ 50%, ESKD, o morte renale); l'incidenza è stata dell'1,2% nel gruppo dapagliflozin e dell'1,6%
nel gruppo placebo.
Studio DELIVER: insufficienza cardiaca con frazione di eiezione ventricolare sinistra > 40%
Dapagliflozin Evaluation to Improve the LIVEs of Patients with PReserved Ejection Fraction Heart
Failure (DELIVER) è stato uno studio internazionale, multicentrico, randomizzato, in doppio cieco,
controllato con placebo condotto in pazienti di età ≥ 40 anni con insufficienza cardiaca (classe NYHA
II-IV) con LVEF > 40% ed evidenza di cardiopatia strutturale, per determinare l'effetto di dapagliflozin
rispetto al placebo sull'incidenza di morte cardiovascolare e peggioramento dell'insufficienza cardiaca.
Dei 6.263 pazienti, 3.131 sono stati randomizzati con dapagliflozin 10 mg e 3.132 con placebo e
seguiti per una mediana di 28 mesi. Lo studio ha incluso 654 (10%) pazienti con insufficienza cardiaca
subacuta (definiti come randomizzati durante il ricovero per insufficienza cardiaca o entro 30 giorni
dalla dimissione). L'età media della popolazione in studio era di 72 anni e il 56% era di sesso
maschile.
Al basale, il 75% dei pazienti era classificato come classe NYHA II, il 24% classe III e lo 0,3% classe
IV. La LVEF mediana era del 54%, il 34% dei pazienti aveva LVEF ≤ 49%, il 36% aveva LVEF 50-
59% e il 30% aveva LVEF ≥ 60%. In ciascun gruppo di trattamento, il 45% aveva una storia di diabete
mellito di tipo 2. La terapia di base includeva ACEi/ARB/ARNI (77%), beta-bloccanti (83%), diuretici
(98%) e MRA (43%).
L'eGFR medio era di 61 mL/min/1,73 m2, il 49% dei pazienti aveva eGFR < 60 mL/min/1,73 m2, il
23% aveva eGFR < 45 mL/min/1,73 m2 e il 3% aveva eGFR < 30 mL/min/ 1,73 mq.
Dapagliflozin è risultato superiore al placebo nel ridurre l'incidenza dell'endpoint composito primario di
morte cardiovascolare, ospedalizzazione per insufficienza cardiaca o visita urgente per insufficienza
cardiaca (HR 0,82 [IC 95% 0,73, 0,92]; p=0,0008) (Figura 5).
Figura 5: Tempo alla prima occorrenza del composito di morte cardiovascolare, ricovero per
insufficienza cardiaca o visita urgente per insufficienza cardiaca
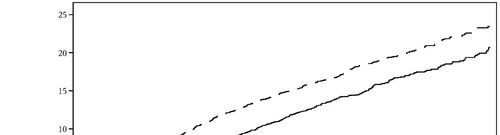

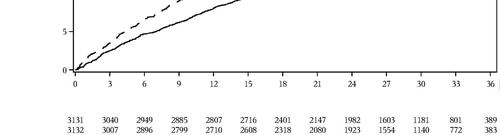
Una visita urgente per insufficienza cardiaca è stata definita come una valutazione urgente e non
pianificata da parte di un medico, ad es. in un pronto soccorso, che richiedesse un trattamento per il
| cienza cardiaca (d | Miveesir dsaoll ad raan udnom siezzmazpiolniece | aumento dei diuretici orali). |
| Pazienti a rischio Dapagliflozin: | |
| a |
Una visita urgente per insufficienza cardiaca è stata definita come una valutazione urgente e non pianificata
da parte di un medico, ad es. in un pronto soccorso, che richiedesse un trattamento per il peggioramento
dell'insufficienza cardiaca (diverso da un semplice aumento dei diuretici orali).
Pazienti a rischio: numero di pazienti a rischio all'inizio del periodo.
La Figura 6 presenta il contributo delle tre componenti dell'endpoint composito primario all'effetto del
trattamento.
Figura 6: Effetti del trattamento per l'endpoint composito primario e per i suoi componenti
Una visita urgente per insufficienza cardiaca è stata definita come una valutazione urgente e non
pianificata da parte di un medico, ad es. in un pronto soccorso, che richiedesse un trattamento per il
peggioramento dell'insufficienza cardiaca (diverso da un semplice aumento dei diuretici orali).
Il numero di primi eventi per i singoli componenti è il numero effettivo di primi eventi per ciascun
componente e non si somma al numero di eventi nell'endpoint composito.
I tassi di eventi sono presentati come il numero di soggetti con evento per 100 pazienti anno di
osservazione ( follow-up). La morte cardiovascolare, qui presentata come componente dell'endpoint
primario, è stata testata sotto il controllo formale dell'errore di tipo 1 anche come endpoint secondario.
Dapagliflozin è risultato superiore al placebo nel ridurre il numero totale di eventi di insufficienza
cardiaca (definiti come ricovero, primo e ricorrente, per insufficienza cardiaca o visite urgenti per
insufficienza cardiaca) e morte cardiovascolare; si sono verificati 815 eventi nel gruppo dapagliflozin
rispetto a 1057 eventi nel gruppo placebo (Rate Ratio 0,77 [95% CI 0,67, 0,89]; p=0,0003).
Il beneficio del trattamento di dapagliflozin rispetto al placebo sull'endpoint primario è stato osservato
nei sottogruppi di pazienti con LVEF ≤ 49%, 50-59% e ≥ 60%. Gli effetti erano coerenti anche in altri
sottogruppi chiave classificati ad es. per età, sesso, classe NYHA, livello di NT-proBNP, stato subacuto
e stato di diabete mellito di tipo 2.
Esito riferito dal paziente - sintomi di insufficienza cardiaca
Il trattamento con dapagliflozin ha determinato un beneficio statisticamente significativo rispetto al
placebo nei sintomi di insufficienza cardiaca, come misurato dalla variazione nel KCCQ-TSS al mese
8 rispetto al basale, (Win Ratio 1,11 [95% CI 1,03, 1,21]; p=0,0086). Sia la frequenza dei sintomi che
il carico dei sintomi hanno contribuito ai risultati.
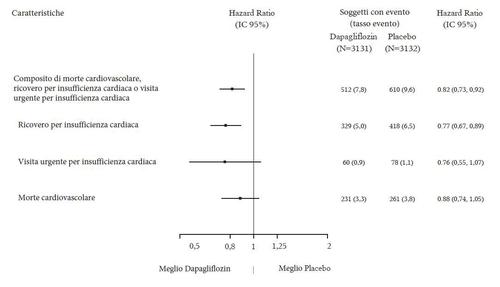
Nelle analisi dei responder, la percentuale di pazienti che hanno manifestato un deterioramento
moderato (≥ 5 punti) o ampio (≥ 14 punti) del KCCQ-TSS al mese 8 rispetto al basale era inferiore nel
gruppo di trattamento con dapagliflozin; Il 24,1% dei pazienti trattati con dapagliflozin rispetto al 29,1%
con placebo ha manifestato un deterioramento moderato (Odds Ratio 0,78 [95% CI 0,64, 0,95]) e il
13,5% dei pazienti trattati con dapagliflozin rispetto al 18,4% con placebo ha registrato un ampio
deterioramento (Odds Ratio 0,70 [95 %CI 0,55, 0,88]). La proporzione di pazienti con un miglioramento
da piccolo a moderato (≥ 13 punti) o un miglioramento ampio (≥ 17 punti) non differiva tra i gruppi di
trattamento.
Insufficienza cardiaca negli studi DAPA-HF e DELIVER
In un'analisi aggregata di DAPA-HF e DELIVER, l'HR per dapagliflozin rispetto al placebo
sull'endpoint composito di morte cardiovascolare, ricovero per insufficienza cardiaca o visita urgente
per insufficienza cardiaca era 0,78 (95% CI 0,72, 0,85), p < 0,0001. L'effetto del trattamento è stato
coerente in tutto il range della LVEF, senza attenuazione dell'effetto in funzione della LVEF.
In un'analisi aggregata pre-specificata a livello di soggetto degli studi DAPA-HF e DELIVER,
dapagliflozin rispetto al placebo ha ridotto il rischio di morte cardiovascolare (HR 0,85 [IC 95% 0,75,
0,96], p=0,0115). Entrambi gli studi hanno contribuito all'effetto.
Malattia renale cronica
Lo studio per valutare l'effetto di Dapagliflozin sugli esiti renali e sulla mortalità cardiovascolare nei
pazienti con malattia renale cronica (DAPA-CKD) è stato uno studio internazionale, multicentrico,
randomizzato, in doppio cieco, controllato con placebo in pazienti con malattia renale cronica (CKD)
con eGFR da ≥ 25 a 75 mL/min/1,73 m e albuminuria (ACR ≥ 200 e ≤ 5000 mg/g) per determinare,
rispetto al placebo, l'effetto di dapagliflozin, quando aggiunto alla terapia standard di base, sull'incidenza
dell’obiettivo ( endpoint) composito di declino sostenuto ≥ 50% di eGFR, malattia renale allo stadio
terminale (ESKD) (definito come eGFR sostenuto < 15 mL/min/1,73 m , trattamento cronico di dialisi
o trapianto renale), morte cardiovascolare o renale.
Dei 4.304 pazienti, 2.152 sono stati randomizzati con dapagliflozin 10 mg e 2.152 con placebo e seguiti
per una mediana di 28,5 mesi. Il trattamento è stato continuato se, durante lo studio, l'eGFR era sceso a
livelli inferiori a 25 mL/min/1,73 m e poteva continuare nei casi in cui era necessaria la dialisi.
L'età media della popolazione in studio era di 61,8 anni, il 66,9% era di sesso maschile. Al basale, l'eGFR
medio era 43,1 mL/min/1,73 m e l'ACR mediano era 949,3 mg/g, il 44,1% dei pazienti aveva eGFR da
30 a < 45 mL/min/1,73 m e il 14,5% aveva eGFR < 30 mL/min/1,73 m . Il 67,5% dei pazienti aveva il
diabete mellito di tipo 2. I pazienti erano in terapia standard (SOC); il 97,0% dei pazienti è stato trattato
con un inibitore dell'enzima di conversione dell'angiotensina (ACEi) o un bloccante del recettore
dell'angiotensina (ARB).
Lo studio è stato interrotto anticipatamente per efficacia prima dell'analisi pianificata sulla base di una
raccomandazione del Comitato Indipendente di monitoraggio dei dati. Dapagliflozin è risultato
superiore al placebo nel prevenire l'obiettivo ( endpoint) composito primario di un calo sostenuto ≥ 50%
dell'eGFR, raggiungimento dello stadio terminale della malattia renale, morte cardiovascolare o renale.
Sulla base della curva di Kaplan-Meier, il tempo per il primo raggiungimento dell'obiettivo ( endpoint)
composito primario, l'effetto del trattamento è stato evidente a partire dai 4 mesi ed è stato mantenuto
fino alla fine dello studio (Figura 7).
Figura 7: Tempo per il raggiungimento dell'obiettivo (endpoint) composito primario, di un calo
sostenuto ≥ 50% dell'eGFR, malattia renale allo stadio terminale, morte cardiovascolare o
renale
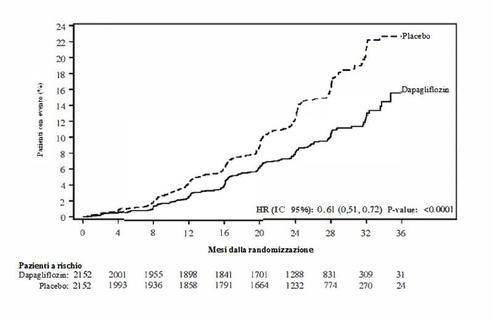
Tutti e quattro i componenti dell'obiettivo ( endpoint) composito primario hanno, individualmente,
contribuito all'effetto del trattamento. Dapagliflozin ha anche ridotto l'incidenza dell'obiettivo
( endpoint) composito di un calo sostenuto ≥ 50% dell'eGFR, malattia renale allo stadio terminale o
morte renale e l'obiettivo ( endpoint) composito di morte cardiovascolare e ospedalizzazione per
insufficienza cardiaca. Nei pazienti con malattia renale cronica, il trattamento con dapagliflozin ha
migliorato la sopravvivenza globale, con una significativa riduzione della mortalità per tutte le cause
(Figura 8).
Figura 8: Effetti del trattamento per gli obiettivi (endpoints) compositi primari e secondari, i
loro singoli componenti e la mortalità per tutte le cause
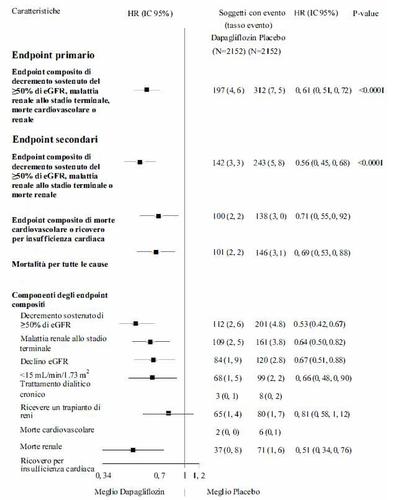
Il beneficio del trattamento di dapagliflozin è stato coerente nei pazienti con malattia renale cronica con
diabete mellito di tipo 2 e senza diabete. Dapagliflozin ha ridotto l'obiettivo ( endpoint) composito
primario di un calo sostenuto ≥ 50% dell'eGFR, malattia renale allo stadio terminale, morte
cardiovascolare o renale con un HR di 0,64 (95% IC 0,52; 0,79) in pazienti con diabete mellito di tipo
2 e 0,50 (95% IC 0,35; 0,72) in pazienti senza diabete.
Il beneficio del trattamento di dapagliflozin rispetto al placebo sull'obiettivo ( endpoint) primario è stato
coerente anche in altri sottogruppi chiave, che includevano livelli di eGFR, età, sesso e regione.
Popolazione pediatrica
Diabete mellito di tipo 2
In uno studio clinico su bambini e adolescenti di età compresa tra 10 e 24 anni con diabete mellito di
tipo 2, 39 pazienti sono stati randomizzati a dapagliflozin 10 mg e 33 a placebo, in aggiunta a
metformina, insulina o una combinazione di metformina e insulina. Al momento della
randomizzazione, il 74% dei pazienti aveva <18 anni di età. La variazione media aggiustata di HbA1c
per dapagliflozin rispetto al placebo dal basale alla settimana 24 è stata di -0,75% (95% IC -1,65, 0,15).
Nel gruppo di età < 18 anni la variazione media aggiustata di HbA1c per dapagliflozin rispetto al
placebo è stata di -0,59% (95% IC -1,66, 0,48). Nel gruppo di età ≥ 18 anni, la variazione media rispetto
al basale di HbA1c è stata -1,52% nel gruppo trattato con dapagliflozin (n=9) e 0,17% nel gruppo
trattato con placebo (n=6). L'efficacia e la sicurezza sono state simili a quelle osservate nella
popolazione adulta trattata con dapagliflozin. La sicurezza e la tollerabilità sono state ulteriormente
confermate in un'estensione di sicurezza dello studio di 28 settimane.
Insufficienza cardiaca e malattia renale cronica
L'Agenzia europea per i medicinali ha previsto l‘esonero all’obbligo di presentare i risultati di studi con
dapagliflozin in tutti i sottogruppi di popolazione pediatrica per la prevenzione di eventi cardiovascolari
in pazienti con insufficienza cardiaca cronica e nel trattamento della malattia renale cronica (vedere
paragrafo 4.2 per informazioni sull'uso pediatrico).
5.2 Proprietà farmacocinetiche
Assorbimento
Dapagliflozin è assorbito in modo rapido ed efficace dopo somministrazione orale. Le concentrazioni
plasmatiche massime (Cmax) di dapagliflozin vengono raggiunte generalmente entro 2 ore dalla
somministrazione in condizioni di digiuno. La media geometrica dei valori di Cmax e AUCτ di
dapagliflozin allo stato stazionario, rilevati in seguito alla somministrazione in singola dose giornaliera
di dapagliflozin 10 mg, sono rispettivamente di 158 ng/mL e di 628 ng ora/mL. La biodisponibilità orale
assoluta di dapagliflozin in seguito alla somministrazione di una dose di 10 mg è del 78%. La
somministrazione in concomitanza con un pasto ad alto contenuto di grassi ha ridotto la Cmax di
dapagliflozin fino ad un massimo del 50% e ha prolungato il Tmax di circa 1 ora, ma non ha alterato
l’AUC in confronto a quanto osservato in condizioni di digiuno. Queste variazioni non sono considerate
clinicamente significative. Pertanto, Dapaglifozin Tecnigen può essere assunto in concomitanza o meno
dei pasti.
Distribuzione
Dapagliflozin è legato alle proteine per circa il 91%. Il legame con le proteine non è risultato alterato
in presenza di vari stati di malattia (es. compromissione renale o compromissione epatica). Il volume
medio di distribuzione di dapagliflozin allo stato stazionario è risultato pari a 118 litri.
Biotrasformazione
Dapagliflozin viene ampiamente metabolizzato, principalmente a dapagliflozin 3-O-glucuronide, che è
un metabolita inattivo. Dapagliflozin 3-O-glucuronide o gli altri metaboliti non contribuiscono a
produrre gli effetti ipoglicemizzanti. La formazione di dapagliflozin 3-O-glucuronide è mediata da
UGT1A9, un enzima presente nel fegato e nel rene, e il processo metabolico mediato da CYP
rappresentava una via secondaria di clearance nell’uomo.
Eliminazione
L’emivita plasmatica terminale media (t1/2) di dapagliflozin è risultata di 12,9 ore in seguito alla
somministrazione di una dose orale singola di dapagliflozin 10 mg in soggetti sani. La clearance
sistemica media totale di dapagliflozin, somministrato per via endovenosa era pari a 207 mL/min.
Dapagliflozin e i relativi metaboliti sono eliminati principalmente attraverso l’escrezione urinaria, con
meno del 2% come dapagliflozin in forma immodificata. Dopo la somministrazione di una dose di
[ 14C]-dapagliflozin 50 mg, è stato recuperato il 96%, il 75% nelle urine e il 21% nelle feci. Nelle feci,
il 15% circa della dose è stata escreta sotto forma di farmaco progenitore.
Linearità
L’esposizione a dapagliflozin è aumentata in modo proporzionale rispetto all’incremento della dose di
dapagliflozin nell’intervallo di 0,1-500 mg e il suo profilo farmacocinetico non è mutato nel tempo in
seguito a somministrazioni giornaliere ripetute fino a un massimo di 24 settimane.
Popolazioni speciali
Compromissione renale
Allo stato stazionario (20 mg di dapagliflozin somministrati una volta al giorno per 7 giorni), i soggetti
con diabete mellito di tipo 2 e compromissione renale lieve, moderata o severa (secondo quanto stabilito
in base alla clearance plasmatica dello ioexolo) evidenziavano esposizioni sistemiche medie a
dapagliflozin rispettivamente del 32%, del 60% e più dell’87%, rispetto a quelle dei pazienti con diabete
mellito di tipo 2 e una funzione renale normale. L’escrezione urinaria di glucosio nelle 24 ore allo stato
stazionario è risultata altamente dipendente dalla funzione renale e nei soggetti con diabete mellito di
tipo 2 e una funzione renale normale o compromissione renale lieve, moderata o severa sono stati escreti
rispettivamente 85, 52, 18 e 11 g di glucosio/giorno. Non è noto l’impatto dell’emodialisi
sull’esposizione a dapagliflozin. L'effetto della ridotta funzionalità renale sull'esposizione sistemica è
stato valutato in un modello farmacocinetico di popolazione. In linea con i risultati precedenti, l'AUC
prevista dal modello era più alta nei pazienti con malattia renale cronica rispetto ai pazienti con funzione
renale normale e non era significativamente diversa nei pazienti con malattia renale cronica con diabete
mellito di tipo 2 e senza diabete.
Compromissione epatica
Nei soggetti con compromissione epatica lieve o moderata (classi Child-Pugh A e B), valori medi di
Cmax e AUC di dapagliflozin erano rispettivamente fino al 12% e 36% maggiori, in confronto a quelli
rilevati nei soggetti sani di controllo appaiati. Queste differenze non sono state considerate clinicamente
significative. Nei soggetti con compromissione epatica grave (classe Child-Pugh C), i valori medi di
Cmax e AUC di dapagliflozin erano rispettivamente del 40% e del 67% superiori rispetto ai controlli
sani appaiati.
Anziani (≥ 65 anni)
Non si mostra alcun incremento clinicamente rilevante nell’esposizione in base unicamente all’età nei
soggetti fino a 70 anni. Tuttavia, si può prevedere un aumento dell’esposizione dovuto a una
diminuzione della funzione renale correlata all’età. Non sono disponibili dati sufficienti per poter trarre
conclusioni in merito all’esposizione nei pazienti di età > 70 anni.
Popolazione pediatrica
Il profilo farmacocinetico e farmacodinamico (glicosuria) nei bambini con diabete mellito di tipo 2 di
10-17 anni di età erano simili a quelle osservate negli adulti con diabete mellito di tipo 2.
Sesso
L’AUCss media di dapagliflozin nelle donne è stata stimata superiore del 22% circa rispetto a quella
rilevata negli uomini.
Etnia
Non sono state riscontrate differenze clinicamente rilevanti nelle esposizioni sistemiche tra i soggetti
di Etnia Bianca, Nera o Asiatica.
Peso corporeo
È stato riscontrato che l’esposizione a dapagliflozin diminuisce con l’aumentare del peso corporeo. Di
conseguenza, i pazienti con un peso corporeo ridotto possono avere talvolta un’esposizione aumentata
e i soggetti con un peso corporeo elevato possono avere talvolta un’esposizione ridotta. Tuttavia, le
differenze relative all’esposizione non sono state considerate clinicamente significative.
5.3 Dati preclinici di sicurezza
I dati preclinici non rivelano rischi particolari per l’uomo sulla base di studi convenzionali farmacologia
di sicurezza, tossicità a dosi ripetute, genotossicità, potenziale cancerogeno e fertilità. Dapagliflozin
non induce tumori nei topi o nei ratti a qualsiasi delle dosi valutate in studi di carcinogenicità a due
anni.
Tossicità riproduttiva e dello sviluppo
La somministrazione diretta di dapagliflozin in ratti giovani appena svezzati e l’esposizione indiretta nel
corso dell’ultima fase della gravidanza (periodi di tempo corrispondenti al secondo e al terzo trimestre
di gravidanza rispetto allo sviluppo renale nell’uomo) e durante l’allattamento sono associate ciascuna
a un aumento dell’incidenza e/o della gravità delle dilatazioni tubulari e pelviche renali nella progenie.
Nell’ambito di uno studio di tossicità condotto su animali giovani, quando dapagliflozin è stato
somministrato direttamente a ratti giovani a partire dal 21° giorno fino al 90° giorno successivo alla
nascita, sono state rilevate dilatazioni tubulari e pelviche renali a tutti i livelli di dose; le esposizioni dei
cuccioli alla dose più bassa testata erano ≥ 15 volte la dose massima raccomandata nell’uomo. Questi
risultati sono stati associati ad incrementi dose-correlati del peso del rene e all’ingrossamento
macroscopico del rene rilevato a tutti i dosaggi. Le dilatazioni della pelvi renale e tubulari, osservate negli
animali giovani, non sono completamente scomparse entro il periodo approssimativo di recupero pari a 1
mese.
In uno studio isolato sullo sviluppo prenatale e postnatale, alcune madri di ratti sono state trattate a
partire dal 6° giorno di gestazione fino al 21° giorno dopo la nascita, mentre la progenie è stata esposta
indirettamente in uteroe durante l’intero periodo di allattamento (è stato condotto uno studio satellite
per valutare le esposizioni a dapagliflozin nel latte e nella progenie). È stato osservato un aumento
dell’incidenza o della gravità della dilatazione della pelvi renale nella progenie adulta delle madri
trattate, benché soltanto alla dose massima testata (le esposizioni delle madri associate e della progenie
a dapagliflozin erano rispettivamente 1.415 volte e 137 volte i valori osservati nell’uomo alla dose
massima raccomandata). L’ulteriore tossicità inerente allo sviluppo era limitata alle riduzioni dose-
correlata del peso corporeo della progenie ed è stata osservata soltanto a dosaggi ≥ 15 mg/kg/ die
(associati ad esposizioni della progenie che sono ≥ 29 volte i valori osservati nell’uomo alla dose
massima raccomandata). La tossicità nelle madri è risultata evidente soltanto alla dose massima
testata, ed era limitata a riduzioni transitorie del peso corporeo e del consumo di cibo alla
somministrazione della dose. Il livello senza effetti avversi osservabili (NOAEL) per la tossicità sullo
sviluppo, alla dose minima testata, è associato a un’esposizione sistemica materna multipla che è circa
19 volte il valore umano alla dose massima raccomandata nell’uomo.
In ulteriori studi sullo sviluppo embrio-fetale condotti su ratti e conigli, dapagliflozin è stato
somministrato ad intervalli coincidenti con le fasi più importanti dell’organogenesi in ogni specie. Non
è stata osservata nei conigli alcuna forma di tossicità nelle madri o nello sviluppo a qualsiasi dose testata;
il dosaggio massimo testato è associato a un’esposizione sistemica multipla di circa
- 1.191 volte la dose massima raccomandata nell’uomo. Nei ratti, dapagliflozin non è risultato embrioletale né teratogeno ad esposizioni fino a 1.441 volte la dose massima raccomandata nell’uomo.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Nucleo della compressa
Cellulosa silicizzata microcristallina (tipo SMCC 50)
Crospovidone
Mannitolo (tipo M 100)
Talco
Magnesio stearato
Film di rivestimento
Alcool polivinilico
Biossido di titanio (E171)
Macrogol/ polietilene glicole
Talco
Ossido di ferro giallo (E172).
6.2 Incompatibilità
Non pertinente.
6.3 Periodo di validità
2 anni
6.4 Precauzioni particolari per la conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.
6.5 Natura e contenuto del contenitore
Blister complesso OPA grigio opaco (Poliammide da 25 µm + Alluminio da 45 µm + PVC da 60 µm)
sigillato con foglio di alluminio da 20 µm.
Dapaglifozin Tecnigen 5 mg compresse rivestite con film
Confezioni da 14 e 28 compresse rivestite con film.
Dapaglifozin Tecnigen 10 mg compresse rivestite con film
Confezioni da 14 e 28 compresse rivestite con film.
E’ possibile che non tutte le confezioni siano commercializzate.
6.6 Precauzioni particolari per lo smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Tecnigen S.r.l.
Via Galileo Galilei 40
Cinisello Balamo 20092 MI - Italia
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- 051232015 - "5 mg compresse rivestite con film" 14 compresse in blister OPA/AL/PVC
- 051232027 - "5 mg compresse rivestite con film" 28 compresse in blister OPA/AL/PVC
- 051232039 - "10 mg compresse rivestite con film" 14 compresse in blister OPA/AL/PVC
- 051232041 - "10 mg compresse rivestite con film" 28 compresse in blister OPA/AL/PVC
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE
Data della prima autorizzazione:
10. DATA DI REVISIONE DEL TESTO
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a DAPAGLIFLOZIN TECNIGENForma farmaceutica: Compressa rivestita con film, 5 MGPrincipio attivo: dapagliflozinProduttore: AUROBINDO PHARMA (ITALIA) S.R.L.Prescrizione non richiestaForma farmaceutica: Compressa rivestita con film, 5 MGPrincipio attivo: dapagliflozinProduttore: DOC GENERICI SRLPrescrizione richiestaForma farmaceutica: Compressa rivestita con film, 5 mgPrincipio attivo: dapagliflozinProduttore: TEVA B.V.Prescrizione non richiesta
Medici online per DAPAGLIFLOZIN TECNIGEN
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di DAPAGLIFLOZIN TECNIGEN — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.










