
FULVESTRANT ZENTIVA


Come usare FULVESTRANT ZENTIVA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
Fulvestrant Zentiva 250 mg soluzione iniettabile in siringa preriempita
Medicinale equivalente
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i loro sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos’è Fulvestrant Zentiva e a cosa serve
- 2. Cosa deve sapere prima di usare Fulvestrant Zentiva
- 3. Come usare Fulvestrant Zentiva
- 4. Possibili effetti indesiderati
- 5. Come conservare Fulvestrant Zentiva
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Fulvestrant Zentiva e a cosa serve
Fulvestrant Zentiva contiene il principio attivo fulvestrant, che appartiene al gruppo dei bloccanti degli
estrogeni. Gli estrogeni, un tipo di ormoni sessuali femminili, possono in alcuni casi essere coinvolti
nella crescita del tumore della mammella.
Fulvestrant Zentiva è utilizzato sia:
- Da solo, per il trattamento delle donne in postmenopausa con un tipo di tumore alla mammella chiamato tumore alla mammella positivo per il recettore degli estrogeni localmente avanzato o diffuso in altre parti del corpo (metastatico), o
- In associazione con palbociclib per il trattamento delle donne con un tipo di tumore alla mammella chiamato positivo ai recettori ormonali, negativo al recettore 2 del fattore di crescita epidermico umano, che è localmente avanzato o diffuso in altre parti del corpo (metastatico). Le donne non ancora in menopausa saranno trattate con un medicinale chiamato agonista dell'ormone di rilascio dell'ormone luteinizzante (LHRH).
Quando Fulvestrant Zentiva è somministrato in associazione a palbociclib, è importante leggere anche
- 2.Cosa deve sapere prima di usare Fulvestrant Zentiva
NON usi Fulvestrant Zentiva
- se è allergica a fulvestrant o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6)
- se è in gravidanza o sta allattando
- - se soffre di malattie gravi del fegato
Avvertenze e precauzioni
Si rivolga al medico o al farmacista o all’infermiere prima di usare Fulvestrant Zentiva se si trova in una
delle seguenti condizioni:
- Problemi ai reni o al fegato
- basso numero di piastrine (che aiutano la coagulazione del sangue) o problemi di sanguinamento
- precedenti problemi di coaguli nel sangue
- osteoporosi (perdita di densità ossea)
- alcolismo
Bambini e adolescenti
Fulvestrant Zentiva non è indicato nei bambini e negli adolescenti di età inferiore a 18 anni.
Altri medicinali e Fulvestrant Zentiva
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi
altro medicinale.In particolare, deve informare il medico se sta utilizzando anticoagulanti (medicinali che
prevengono i coaguli del sangue).
Gravidanza e allattamento
Non deve usare Fulvestrant Zentiva se è in gravidanza. Le donne in età fertile devono usare un metodo
contraccettivo efficace durante il trattamento con Fulvestrant Zentiva e per 2 anni dopo l’ultima dose.
Non deve allattare durante il trattamento con Fulvestrant Zentiva.
Guida di veicoli e utilizzo di macchinari
Non ci si aspetta che Fulvestrant Zentiva influisca sulla capacità di guidare o di usare macchinari. Tuttavia,
se si sente stanca dopo il trattamento non guidi o usi macchinari.
Fulvestrant Zentiva contiene 500 mg di alcol (etanolo)in ciascuna iniezione, che è equivalente a 100
mg/ml (10% p/v). La quantità in ciascuna iniezione di questo medicinale è equivalente a 13 ml di birra o 5
ml di vino.
È improbabile che la quantità di alcol in questo medicinale abbia effetto negli adulti e negli adolescenti.
L'alcol contenuto in questo medicinale può alterare gli effetti di altri medicinali. Parli con il medico o il
farmacista se sta assumendo altri medicinali.
Se è incinta o sta allattando al seno, parli con il medico o il farmacista prima di prendere questo medicinale.
Se ha una dipendenza da alcol, parli con il medico o il farmacista prima di usare questo medicinale.
Fulvestrant Zentiva contiene 500 mg di alcol benzilico per iniezione,equivalenti a 100 mg/ml.
L’alcol benzilico può causare reazioni allergiche.
Fulvestrant Zentiva contiene 750 mg di benzile benzoato per iniezione, equivalenti a 150 mg /ml.
Per chi svolge attività sportiva: l’uso del farmaco senza necessità terapeutica costituisce doping e può
determinare comunque positività ai test anti-doping.
3. Come usare Fulvestrant Zentiva
Il medico o l’infermiere somministreranno Fulvestrant Zentiva con una iniezione intramuscolare lenta, una in
ciascun gluteo.
La dose raccomandata è 500 mg di fulvestrant (due iniezioni da 250 mg/5 ml) somministrata una volta al
mese con una dose addizionale di 500 mg somministrata 2 settimane dopo la dose iniziale.
Se ha qualsiasi sull’uso di questo medicinale, si rivolga al medico o al farmacista o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Effetti indesiderati gravi
Può rendersi necessario l’immediato intervento medico in caso di comparsa di uno qualsiasi dei
seguenti effetti indesiderati
- Reazioni allergiche (ipersensibilità), incluso gonfiore del viso, labbra, lingua e/o gola che possono essere segni di reazioni anafilattiche
- Tromboembolismo (aumento del rischio di coaguli nel sangue)*
- Infiammazione del fegato (epatite)
- Insufficienza epatica
In caso di comparsa di uno qualsiasi dei seguenti effetti indesiderati, avvisi il medico, il farmacista o
l’infermiere:
Effetti indesiderati molto comuni(possono interessare più di 1 persona su 10)
- Reazioni al sito di iniezione, quali dolore e/o infiammazione
- Livelli anormali degli enzimi del fegato (negli esami del sangue)*
- Nausea (sensazione di malessere)
- Debolezza, stanchezza*
- Dolore muscoloscheletrico ed articolare
- Vampate di calore
- Eruzione cutanea
- Reazioni allergiche (ipersensibilità), incluso gonfiore del viso, labbra, lingua e/o gola
Tutti gli altri effetti indesiderati:
Effetti indesiderati comuni(possono interessare fino a 1 persona su 10)
- Mal di testa
- Vomito, diarrea o perdita dell’appetito*
- Infezioni delle vie urinarie
- Dolore alla schiena*
- Aumento dei livelli di bilirubina (un pigmento della bile prodotto dal fegato)
- Tromboembolismo (aumentato rischio di coaguli nel sangue)*
- Ridotti livelli di piastrine (trombocitopenia)
- Sanguinamento vaginale
- Dolore nella parte bassa della schiena che si irradia verso una gamba (sciatica)
- Debolezza improvvisa, intorpidimento, formicolio, o perdita di movimento della gamba, in particolare su un solo lato del corpo, problemi improvvisi nella camminata o con l’equilibrio (neuropatia periferica)
Effetti indesiderati non comuni(possono interessare fino a 1 persona su 100)
- Secrezioni vaginali biancastre e dense e candidiasi (infezione)
- Lividi e sanguinamenti al sito di iniezione
- Aumento dei livelli di gamma-GT, un enzima epatico rilevato mediante analisi del sangue
- Infiammazione del fegato (epatite)
- Insufficienza epatica
- Intorpidimento, formicolio e dolore
- Reazioni anafilattiche
* Include reazioni avverse al farmaco per le quali l’esatto contributo di Fulvestrant Zentiva non può essere
valutato a causa della malattia sottostante .
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione all’indirizzo https://www.aifa.gov.it/content/segnalazioni-
reazioni-avverse. Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare Fulvestrant Zentiva
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola o sull’etichetta della siringa
dopo “SCAD”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Questo medicinale non richiede alcuna temperatura particolare di conservazione
Conservare la siringa preriempita nella confezione originale per proteggere il medicinale dalla luce.
Il personale sanitario sarà responsabile della corretta conservazione, dell’uso e dello smaltimento di
Fulvestrant Zentiva.
Questo medicinale può rappresentare un rischio per l’ambiente acquatico. Non getti alcun medicinale
nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non
utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Fulvestrant Zentiva
- Il principio attivo è fulvestrant. Ciascuna siringa preriempita (5 ml) contiene 250 mg di fulvestrant.
- Gli altri componenti (eccipienti) sono etanolo (96 per cento), alcol benzilico (E1519), benzile benzoato e olio di ricino raffinato.
Descrizione dell’aspetto di Fulvestrant Zentiva e contenuto della confezione
Fulvestrant Zentiva è una soluzione limpida, da incolore a gialla viscosa in una siringa preriempita
contenente 5 ml di soluzione per iniezione. Per ricevere la dose mensile raccomandata di 500 mg devono
essere somministrate due siringhe.
Fulvestrant Zentiva è disponibile in 5 confezioni, una confezione contenente 1 siringa preriempita in vetro,
una confezione contenente 2 siringhe preriempite in vetro, una confezione contenente 2 x 2 siringhe
preriempite in vetro, una confezione contenente 4 siringhe preriempite in vetro e una confezione contenente
6 siringhe preriempite in vetro. Sono inoltre forniti uno, due o sei aghi di sicurezza provvisti di dispositivo
(BD SafetyGlide) per la connessione a ciascun corpo della siringa.
É possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Zentiva Italia S.r.l. Via P. Paleocapa 7, 20121 Milano – Italia
Produttore
Laboratorios Farmalán, S.A.
Calle La Vallina s/n, Edificio 2,
Polígono Industrial Navatejera,
Villaquilambre, León, 24193, Spagna
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
Olanda /Germania/ Estonia/ Francia/ Italia/ Latvia/ Polonia Regno Unito: Fulvestrant Zentiva
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari
Fulvestrant Zentiva 500 mg (2 x 250 mg/5 ml soluzione iniettabile) deve essere somministrato utilizzando
due siringhe preriempite, vedere paragrafo 3.
Istruzioni per la somministrazione
Avvertenze - Non sterilizzare in autoclave l’ago con il dispositivo di protezione (Ago Ipodermico con
protezione BD SafetyGlide) prima dell’uso. Le mani devono rimanere dietro l’ago per tutto il tempo dell’uso
e dello smaltimento.
Per ciascuna delle due siringhe:
- Rimuovere il corpo della siringa di vetro dal vassoio e verificare che non sia danneggiato.
- Togliere l’ago di sicurezza (SafetyGlide) dal confezionamento esterno.
- Prima della somministrazione le soluzioni parenterali devono essere ispezionate visivamente per la contaminazione particellare e per lo scolorimento.
- Tenere la siringa in posizione verticale sulla parte zigrinata (C). Con l'altra mano, afferrare il cappuccio (A) e ruotare con attenzione il cappuccio in plastica rigida in senso antiorario (vedere Figura 1).
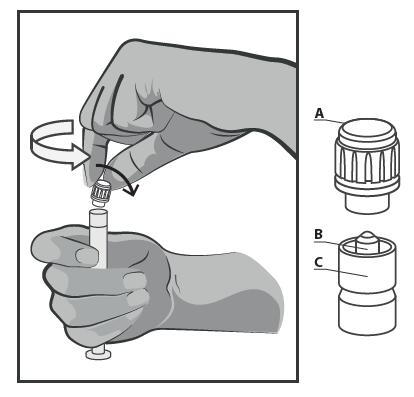
Figura 1
- Rimuovere il cappuccio in plastica rigida (A) tirandolo dritto verso l’alto. Per assicurare la sterilità non toccare la punta della siringa (B) (vedere Figura 2).
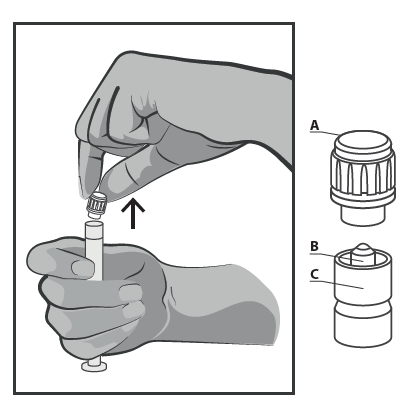
Figura 2
- Attaccare l’ago di sicurezza al Luer-Lock e ruotare per bloccare saldamente (vedere Figura 3).
- Controllare che l’ago sia fissato sul connettore Luer prima di rimuoverlo al di fuori del piano verticale
- Togliere la protezione dell’ago rapidamente per evitare danni alla punta dell’ago.
- Portare la siringa riempita al sito di somministrazione.
- Rimuovere la guaina dell’ago.
- Espellere l’eccesso di gas dalla siringa.
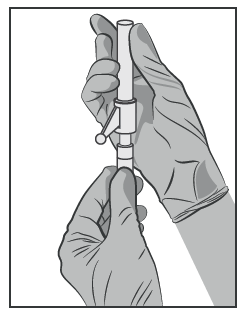
Figura 3
- - Somministrare lentamente (1 o 2 minuti/iniezione) per via intramuscolare nel gluteo (area glutea). Per comodità dell’utilizzatore la punta dell’ago “smussata” è allineata al braccio della leva (vedere Figura 4).
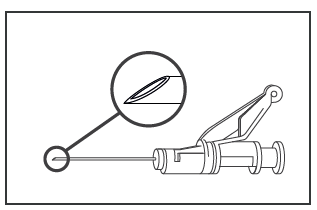
Figura 4
Dopo l’iniezione applicare immediatamente la forza di un singolo dito sul braccio della leva con attivazione
assistita per attivare il meccanismo di protezione (vedere Figura 5).
NOTA: attivarlo lontano da sé e dagli altri. Udire il click e confermare visivamente che la punta dell’ago sia
completamente coperta.
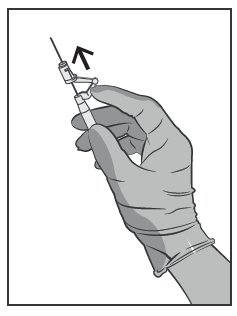
Figura 5
Smaltimento
Le siringhe preriempite sono soloper uso singolo.
Questo medicinale può rappresentare un rischio per l’ambiente acquatico. Il medicinale non utilizzato e i
rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a FULVESTRANT ZENTIVAForma farmaceutica: Soluzione iniettabile, 250 MG/5 MLPrincipio attivo: fulvestrantProduttore: ASTRAZENECA ABPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 250 MGPrincipio attivo: fulvestrantProduttore: ACCORD HEALTHCARE, S.L.U.Prescrizione richiestaForma farmaceutica: Soluzione iniettabile, 250 MGPrincipio attivo: fulvestrantProduttore: DR. REDDY'S S.R.L.Prescrizione richiesta
Medici online per FULVESTRANT ZENTIVA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di FULVESTRANT ZENTIVA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.












