
GADOVIST

Come usare GADOVIST
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Gadovist 1,0mmol/ml soluzione iniettabile
Gadobutrolo
Legga attentamente questo foglio prima di ricevere questo medicinale,perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o alla persona che le somministra Gadovist (il radiologo) o al personale sanitario dell’ospedale/del centro RM.
- Se si manifesta uno qualsiasi degli effetti indesiderati, compresi quelli non elencati in questo foglio, si rivolga al medico o al radiologo. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos'è Gadovist e a cosa serve
- 2. Cosa deve sapere prima di ricevere Gadovist
- 3. Come riceverà Gadovist
- 4. Possibili effetti indesiderati
- 5. Come conservare Gadovist
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Gadovist e a cosa serve
Gadovist è un mezzo di contrasto per la Risonanza Magnetica (RM) usato per la diagnostica del cervello,
della colonna vertebrale e dei vasi sanguigni.
Gadovist può anche aiutare il medico a evidenziare il tipo di anomalia (benigna o maligna) nota o sospetta
nel fegato e nei reni.
Gadovist può essere utilizzato anche per la risonanza magnetica (RM) di anomalie di altre parti del corpo.
Gadovist facilita la visualizzazione di strutture anomale o di lesioni e contribuisce alla differenziazione tra
tessuto sano e malato. È indicato per gli adulti ed i bambini di tutte le età (compresi i neonati a termine).
Come funziona Gadovist
La RM è una metodica diagnostica per immagini, che utilizza il comportamento delle molecole d’acqua nei
tessuti normali e non. Questa tecnica si basa su un complesso sistema di magneti e onde radio. I computer
registrano l’attività, trasformandola in immagini.
Gadovist è somministrato mediante un’iniezione in vena. Questo medicinale è solo per uso diagnostico e
verrà somministrato solo da operatori sanitari con esperienza nel campo della pratica clinica RM.
2. Cosa deve sapere prima di ricevere Gadovist
NON usi Gadovist se
- è allergico al gadobutrolo o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico prima che le venga somministrato Gadovist se
- soffre o ha sofferto di un’allergia (per es. febbre da fieno, orticaria) o asma
- ha avuto reazioni precedenti a qualunque mezzo di contrasto
- ha la funzionalità renale molto compromessa
- soffre di stati cerebrali con attacchi convulsivi (crisi epilettiche) o di altre malattie del sistema nervoso
- ha un pacemaker o se ci sono impianti o clips contenenti ferro nel suo corpo
Il medico deciderà se è possibile sottoporla o meno all’esame previsto.
- Possono verificarsi, dopo l’uso di Gadovist, reazioni di tipo allergico o altri tipi di reazioni che portano problemi al cuore, difficoltà respiratorie e reazioni cutanee. Sono possibili reazioni gravi. Molte di queste reazioni avvengono entro mezz’ora dopo la somministrazione di Gadovist, pertanto, dopo la procedura, verrà tenuto in osservazione. Sono state osservate reazioni ritardate (dopo ore o giorni) (vedere paragrafo 4).
Reni/fegato
Informi il medico se
- i suoi reni non funzionano correttamente
- ha recentemente avuto, o prevede di avere a breve un trapianto di fegato.
Il medico può decidere di sottoporla ad un esame del sangue per valutare se i suoi reni stanno funzionando
correttamente, prima di decidere di usare Gadovist, soprattutto se ha 65 anni o più.
Neonati ed infanti
Essendo la funzione renale non ancora matura nei bambini fino a 4 settimane di età e negli infanti fino ad 1
anno di età, Gadovist verrà utilizzato in questi pazienti solo dopo un’attenta valutazione del medico.
Altri medicinali e Gadovist
Informi il medico se sta assumendo o ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza e allattamento
Chieda consiglio al medico prima di assumere qualsiasi medicinale
- GravidanzaIl gadobutrolo può attraversare la placenta. Non è noto se ciò influisce sul bambino. Informi il medico se pensa di essere in gravidanza o se sta pianificando una gravidanza. Gadovist non deve essere utilizzato in gravidanza a meno che non sia strettamente necessario.
- AllattamentoInformi il medico se allatta o se intende iniziare ad allattare. Il medico valuterà se può continuare o se deve interrompere l’allattamento al seno per un periodo di 24 ore dopo la somministrazione di Gadovist.
Gadovist contiene sodio
Questo medicinale contiene meno di 23 mg di sodio per dose (sulla base della quantità media somministrata
a una persona di 70 kg), cioè essenzialmente ‘senza sodio’.
3. Come viene somministrato Gadovist
Gadovist viene iniettato in vena mediante un piccolo ago da un operatore sanitario. L’esame di RM può
iniziare immediatamente.
Dopo l’iniezione, sarà tenuto sotto osservazione per almeno 30 minuti.
Dose abituale
La dose effettiva adatta a lei dipende dal suo peso corporeo e dal distretto da esaminare mediante RM:
negli adultiè raccomandata un‘unica iniezione di 0,1 millilitri di Gadovist per kg di peso corporeo (ciò
significa che per una persona di 70 kg la dose sarebbe di 7 millilitri), comunque è consentita un’ulteriore
iniezione fino a 0,2 millilitri per kg di peso corporeo entro 30 minuti dalla prima iniezione. È consentita la
somministrazione di una quantità totale di 0,3 millilitri di Gadovist per kg di peso corporeo come dose
massima (ciò significa che per una persona di 70 kg la dose sarebbe di 21 millilitri) per l'imaging del sistema
nervoso centrale (SNC) e CE-MRA. E’ consentita la somministrazione di una dose di 0,075 millilitri di
Gadovist per kg di peso corporeo come dose minima (ciò significa che per una persona di 70 kg la dose
sarebbe di 5,25 millilitri) per l'imaging del SNC.
Ulteriori informazioni sulla somministrazione e la manipolazione di Gadovist sono riportate in fondo al foglio
illustrativo.
Dosaggio in popolazioni speciali di pazienti
L’uso di Gadovist non è raccomandato nei pazienti con gravi problemi ai reni e nei pazienti che hanno
recentemente avuto o sono in procinto di avere un trapianto di fegato. Comunque, se l’uso è richiesto deve
ricevere solo una dose di Gadovist durante l’esame e non deve ricevere una seconda somministrazione per
almeno 7 giorni.
Neonati, infanti, bambini e adolescenti
- Nei bambini di tutte le età (inclusi i neonati a termine) è raccomandata un’unica dose di 0,1 millilitri di Gadovist per kg di peso corporeo per tutte le tipologie di indagine diagnostica (vedere paragrafo 1)
- Dato che la funzione renale non è ancora matura nei bambini fino a 4 settimane di età e negli infanti fino ad 1 anno di età, Gadovist verrà utilizzato in questi pazienti solo dopo un’attenta valutazione del medico. I neonati e gli infanti devono ricevere solo una dose di Gadovist durante l’esame e non devono ricevere una seconda iniezione per almeno 7 giorni.
Anziani
Non è necessario alcun aggiustamento della dose se ha 65 anni di età o più ma può essere sottoposto ad un
esame del sangue per valutare se i suoi reni stanno funzionando correttamente.
Se riceve più Gadovist di quanto deve
È improbabile un sovradosaggio. Se ciò dovesse effettivamente accadere, il medico tratterà gli eventuali
sintomi e potrà usare la dialisi renale per rimuovere Gadovist dall’organismo. Non ci sono prove che questa
sia in grado di prevenire lo sviluppo della Fibrosi Sistemica Nefrogenica (NSF; vedere paragrafo 4). Pertanto,
la dialisi renale non deve essere utilizzata come trattamento per tale condizione. In alcuni casi verrà controllato
il suo cuore.
Se ha qualsiasi dubbio sull’uso di questo medicinale si rivolga al medico o al radiologo.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino. La maggior parte di queste reazioni si verificano entro mezz'ora dalla somministrazione di
Gadovist. In rari casi sono state osservate reazioni avverse ritardate di tipo allergico o di altro tipo, che si
verificano da ore a diversi giorni dopo la somministrazione di Gadovist. Se ciò dovesse accaderle, informi
immediatamente il medico o il radiologo.
Gli effetti indesiderati più gravi(che sono stati fatali o pericolosi per la vita in alcuni casi) sono:
- Il cuore smette di battere ( arresto cardiaco), una grave malattia polmonare ( sindrome da distressrespiratorio acuto) / liquido nei polmoni ( edema polmonare) e una grave reazione simil-allergica ( anafilattoide) (inclusi arresto respiratorio e shock)
Inoltre, per i seguenti effetti indesideratisono stati osservati in alcuni casi esiti fatali o pericolosi per la
vita:
- respiro corto ( dispnea), perdita di coscienza, reazione simil-allergica grave, grave riduzione della pressione del sangue che può portare al collasso, arresto respiratorio, liquido nei polmoni, rigonfiamento della bocca e della gola e bassa pressione del sangue.
In rari casi:
- reazioni di tipo allergico(ipersensibilità e anafilassi), incluse gravi reazioni (shock), tali da richiedere un intervento medico immediato.
Se nota:
- gonfiore del viso, delle labbra, della lingua o della gola,
- tosse e starnuti
- difficoltà respiratoria
- prurito
- naso che cola
- orticaria
informi immediatamente il personale del reparto RM. Questi possono essere i primi segni di una grave
reazioneimminente. Potrebbe essere necessario interrompere l’esame e praticarle altri trattamenti.
La maggior parte degli effetti indesiderati osservati(può riguardare 5 o più soggetti su 1.000) sono:
- mal di testa, avere la sensazione di star male (nausea) e capogiri.
Molti degli effetti indesiderati sono da lievi a moderati
I possibili effetti indesideratiosservati negli studi cliniciprima dell’approvazione di Gadovist sono elencati
di seguito in base alla probabilità di comparsa:
Comune:(può riguardare fino ad 1 soggetto su 10)
- mal di testa
- avere la sensazione di star male ( nausea)
Non comune:(può riguardare fino ad 1 soggetto su 100)
- Reazioni simil allergiche, ad esempio:
- bassa pressione del sangue
- orticaria
- rigonfiamento del viso
- rigonfiamento (edema) della palpebra
- rossore La frequenza delle seguenti reazioni simil-allergiche non è nota:
- una grave reazione simil-allergica (shock anafilattoide)
- marcato abbassamento della pressione del sangue che può portare al collasso (shock)
- arresto respiratorio
- difficoltà respiratorie (broncospasmo)
- labbra blu
- gonfiore della bocca e della gola
- gonfiore della gola
- aumento della pressione sanguigna
- dolore al torace
- gonfiore del viso, della gola, della bocca, delle labbra e/o della lingua (angioedema)
- congiuntivite
- aumento della sudorazione
- tosse
- starnuti
- sensazione di bruciore
- cute pallida (pallore)
- capogiro, alterato senso del gusto, intorpidimento e formicolio
- respiro corto ( dispnea)
- vomito
- rossore della pelle ( eritema)
- prurito incluso il prurito generalizzato ( prurito)
- eruzione cutanea (incluse l’eruzione cutanea generalizzata, piccole macchie rosse piatte [l’ eruzionemaculare], lesioni piccole, circoscritte, rilevate [ eruzione papulare] ed eruzione cutanea pruriginosa [esantema pruriginoso]).
- vari tipi di reazione nella sede di iniezione (ad es. stravaso nei tessuti circostanti, bruciore, sensazione di freddo, sensazione di calore, arrossamento, eruzione cutanea, dolore o ecchimosi)
- sensazione di calore
Raro:(può riguardare fino ad 1 soggetto su 1000)
- svenimento
- convulsione
- alterazione dell’olfatto
- battito cardiaco accelerato
- palpitazioni
- bocca secca
- sensazione di malessere generale ( malessere)
- sensazione di freddo
Altri effetti indesiderati riportati dopo l’approvazione di Gadovist con frequenza non nota(la
frequenza non può essere definita sulla base dei dati disponibili) :
- il cuore smette di battere ( arresto cardiaco)
- una grave malattia polmonare ( sindrome da distress respiratorio acuto)
- liquido nei polmoni ( edema polmonare)
- sono stati segnalati casi di fibrosi sistemica nefrogenica - NSF (che causa indurimento della pelle e può colpire anche i tessuti molli e gli organi interni).
Dopo la somministrazione di Gadovist, sono state osservate variazioni della funzionalità renale negli esami
del sangue (per esempio aumento della creatinina sierica).
Segnalazione di effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio si rivolga al
medico o al radiologo. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione all’indirizzo: http://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
5. Come conservare Gadovist
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza riportata sull’etichetta e sulla scatola dopo Scad. La data
di scadenza si riferisce all'ultimo giorno di quel mese. Questo medicinale non richiede alcuna condizione
particolare di conservazione.
La stabilità chimica, fisica e microbiologica del prodotto dopo apertura è stata dimostrata per 24 ore a 20-
25°C.
Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente dopo l’apertura.
Questo medicinale è una soluzione limpida, da incolore a giallo pallido. Non utilizzare questo medicinale in
caso di evidente alterazione del colore, in presenza di particelle o se il contenitore appare difettoso.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. L’operatore sanitario
eliminerà questo medicinale quando non è più utilizzato. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Gadovist
- Il principio attivo è il gadobutrolo.
1 ml di soluzione iniettabile contiene 604,72 mg di gadobutrolo (equivalenti a 1,0 mmol di gadobutrolo,
contenenti 157,25 mg di gadolinio)
1 flaconcino da 2 ml contiene 1209,44 mg di gadobutrolo
1 flaconcino da 7,5 ml contiene 4.535,4 mg di gadobutrolo.
1 flaconcino da 15 ml contiene 9.070,8 mg di gadobutrolo.
1 flaconcino da 30 ml contiene 18.141,6 mg di gadobutrolo.
1 flacone da 65 ml contiene 39.306,8 mg di gadobutrolo.
- Gli altri componenti sono calcobutrolo sodico (vedere la fine del paragrafo 2), trometamolo, acido cloridrico 1 N e acqua per preparazioni iniettabili.
Descrizione dell'aspetto di Gadovist e contenuto della confezione
Gadovist è una soluzione iniettabile limpida, da incolore a giallo pallido. Le confezioni contengono:
- 1 o 3 flaconcini contenenti 2 ml di soluzione iniettabile
- 1 o 10 flaconcini contenenti 7,5, 15 o 30 ml di soluzione iniettabile
- 1 o 10 flaconi contenenti 65 ml di soluzione iniettabile (in flacone per infusione da 100 ml)
Confezione ospedaliera:
- 3 flaconcini da 2 ml di soluzione iniettabile
- 10 flaconcini da 7,5, 15 o 30 ml di soluzione iniettabile
- 10 flaconi da 65 ml di soluzione iniettabile
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell'Autorizzazione all'Immissione in Commercio:
Bayer S.p.A.
Viale Certosa, 130
20156 Milano
Produttore:
Bayer AG
Müllerstrasse 178 13353 Berlino
Germania
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
| Austria, Germania | n Gadovist 1,0 mmol/ml Injektionslösung |
| Croazia | Gadovist 1,0 mmol/ml otopina za injekciju |
| Belgio, Bulgaria, Cipro, Danimarca, Estonia, Finlandia, Grecia, Italia, Lussemburgo, Norvegia, Portogallo, Svezia | a Gadovist i l a |
| Francia | GADOVIST 1,0 mmol/mL, solution injectable |
| Irlanda | t Gadovist 1.0 mmol/ml solution for injection |
| Islanda | I Gadovist 1,0 mmól/ml, stungulyf, lausn |
| Olanda | Gadovist 1,0 mmol/ml, oplossing voor injectie |
| Slovenia | a Gadovist 1,0 mmol/ml raztopina za injiciranje |
| i Slovacchia | Gadovist 1,0 mmol/ ml injekčný roztok |
| z Spagna | Gadovist 1 mmol/ml solución inyectable en vial |
| Malta | Gadovist 1.0 mmol/ml solution for injection |
Questo foglio è stato aggiornato il
-----------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Compromissione renale
Prima della somministrazione di Gadovist, si raccomanda che tutti i pazienti siano sottoposti a
screening delle disfunzioni renali, con test di laboratorio
Sono stati riportati casi di fibrosi sistemica nefrogenica (NSF) associati all’uso di alcuni mezzi di contrasto
contenenti gadolinio, in pazienti con compromissione renale severa acuta o cronica (GFR <30ml/min/1,73
m ). I pazienti che si sottopongono a trapianto di fegato sono esposti ad un rischio particolare dal momento
che l’incidenza di insufficienza renale acuta è elevata in questo gruppo di pazienti. Poiché potrebbe
manifestarsi NSF con Gadovist, il medicinale deve essere usato nei pazienti con compromissione renale
severa e nei pazienti nel periodo perioperatorio del trapianto di fegato solo dopo un’attenta valutazione del
rapporto rischio/beneficio e se le informazioni diagnostiche siano essenziali e non ottenibili con RM senza
mezzo di contrasto.
Se è necessario l’uso di Gadovist, la dose non deve essere superiore a 0,1 mmol/kg di peso corporeo. Non
deve essere utilizzata più di una dose durante ogni esame. Data la mancanza di informazioni sulle
somministrazioni ripetute, le iniezioni di Gadovist non devono essere ripetute senza che l’intervallo tra
queste sia di almeno 7 giorni.
Dato che negli anziani la clearance renale di Gadovist può essere compromessa, è particolarmente importante
sottoporre a screening della funzionalità renale i pazienti a partire dai 65 anni d’età.
L’emodialisi subito dopo la somministrazione di Gadovist può essere utile per rimuovere Gadovist
dall’organismo. Non ci sono prove a supporto dell’uso dell’emodialisi nella prevenzione o nel trattamento
della NSF in pazienti non ancora sottoposti a emodialisi.
- Gravidanza e allattamentoGadovist non deve essere usato durante la gravidanza, se non quando le condizioni cliniche della donna richiedano l’uso di Gadovist.
Il medico e la madre che allatta devono decidere se continuare o sospendere l’allattamento al seno per 24 ore
dopo la somministrazione di Gadovist.
- Reazioni di ipersensibilità
Come per altri mezzi di contrasto endovenoso, Gadovist può essere associato a reazioni di tipo anafilattoide/di
ipersensibilità od altre reazioni idiosincrasiche, caratterizzate da manifestazioni cardiovascolari, respiratorie e
cutanee anche gravi fino allo shock. In generale, i pazienti con disturbi cardiovascolari sono più sensibili agli
esiti gravi o anche fatali di severe reazioni d’ipersensibilità.
Il rischio di reazioni d’ipersensibilità è superiore nei seguenti casi:
- precedenti reazioni a mezzo di contrasto
- storia di asma bronchiale
- storia di disturbi allergici
Nei pazienti con una predisposizione allergica, la decisione di usare Gadovist dev’essere presa dopo un’attenta
valutazione del rapporto rischio/beneficio.
Molte di queste reazioni si manifestano dopo mezz’ora dalla somministrazione, pertanto, si raccomanda
l’osservazione del paziente dopo la procedura.
È necessaria l’immediata disponibilità per il trattamento delle reazioni d’ipersensibilità, così come è necessario
essere preparati per l’istituzione di misure di emergenza.
In rari casi si sono verificate reazioni ritardate (dopo ore fino a diversi giorni).
- Disturbi convulsivi
Come per tutti gli altri mezzi di contrasto contenenti gadolinio, è necessaria particolare cautela nei pazienti
con una bassa soglia convulsiva
- Sovradosaggio
In caso di sovradosaggio accidentale, si raccomanda il monitoraggio cardiovascolare (incluso l’ECG) ed il
controllo della funzione renale come misure precauzionali.
In caso di sovradosaggio in pazienti con insufficienza renale, Gadovist può essere rimosso mediante
emodialisi. Dopo 3 sessioni di emodialisi, circa il 98% del prodotto è eliminato dall’organismo. Tuttavia, non
ci sono prove che l’emodialisi sia efficace per la prevenzione della fibrosi sistemica nefrogenica (NSF).
- Prima dell’iniezioneQuesto medicinale è esclusivamente monouso. Questo medicinale è una soluzione limpida, da incolore a giallo chiaro. Deve essere ispezionato visivamente prima dell’uso. Si raccomanda di non utilizzare Gadovist in caso di evidente alterazione del colore, in presenza di materiale particolato o se il contenitore risulta difettoso.
- Istruzioni per l’usoGadovist deve essere aspirato dal flaconcino nella siringa solo subito prima dell’uso. Il tappo di gomma non deve essere forato più di una volta. Il mezzo di contrasto non utilizzato durante l’esame deve essere eliminato.
Se si intende somministrare questo medicinale tramite iniettore automatico, l’idoneità del sistema per tale
utilizzo deve essere dimostrata dal produttore del dispositivo medico.
Devono essere rispettate inoltre eventuali istruzioni supplementari fornite dal produttore del rispettivo
apparecchio.
La soluzione non utilizzata durante l’esame deve essere smaltita in conformità alla normativa locale vigente.
Validità dopo apertura del contenitore
L’eventuale soluzione iniettabile non utilizzata per l’indagine deve essere scartata. La stabilità chimica, fisica
e microbiologica del prodotto dopo apertura è stata dimostrata per 24 ore a 20-25°C.
Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente. In caso contrario la
durata e le condizioni di conservazione del prodotto ricadono sotto la responsabilità dell’utilizzatore.
L’etichetta adesiva di tracciabilità sui flaconcini/flaconi va staccata e applicata sulla documentazione del
paziente, per consentire l’accurata registrazione del mezzo di contrasto contenente gadolinio usato. Anche la
dose utilizzata deve essere registrata.
Se si utilizza documentazione elettronica, il nome del prodotto, il numero di lotto e la dose devono essere
inseriti nella documentazione elettronica del paziente
Posologia
Usare la dose più bassa che consente di ottenere un miglioramento sufficiente ai fini diagnostici. La dose va
calcolata in base al peso corporeo del paziente e non deve superare la dose raccomandata per chilogrammo di
peso corporeo riportata in questo paragrafo.
- Adulti
Indicazioni per il sistema nervoso centrale:
La dose raccomandata per gli adulti è 0,1 mmol per chilogrammo di peso corporeo (mmol/kg di peso corporeo).
Questo equivale a 0,1 ml/kg di peso corporeo della soluzione 1,0 M.
Se persiste il forte sospetto clinico di una lesione nonostante l’esame RM risulti non significativo, oppure nel
caso in cui informazioni più precise potrebbero influenzare la terapia del paziente, può essere somministrata
una ulteriore iniezione fino a 0,2 ml/kg di peso corporeo entro 30 minuti dalla precedente. Può essere
somministrata una dose di 0,075 mmol di gadobutrolo per kg di peso corporeo (equivalente a 0,075 ml di
Gadovist per kg di peso corporeo) per l’imaging del SNC.
RM dell’intero corpo (esclusa MRA):
In generale, la somministrazione di 0,1 ml di Gadovist per kg di peso corporeo è sufficiente per risolvere i
quesiti diagnostici.
Intensificazione del contrasto nella Risonanza Magnetica Angiografica:
Immagini con 1 campo di vista (field of view=FOV): 7,5 ml per pazienti con peso corporeo inferiore a 75 kg,
10 ml per pazienti con peso corporeo di 75 kg o superiore (corrispondenti a 0,1-0,15 mmol/kg di peso
corporeo).
Immagini con FOV >1: 15 ml per pazienti con peso corporeo inferiore a 75 kg, 20 ml per pazienti con peso
corporeo di 75 kg o superiore (corrispondenti a 0,2-0,3 mmol/kg di peso corporeo).
- Popolazione pediatrica
Per i bambini di tutte le età (compresi i neonati a termine) la dose raccomandata è di 0,1 mmol di gadobutrolo
per kg di peso corporeo (corrispondenti a 0,1 ml di Gadovist per kg di peso corporeo) per tutte le indicazioni
(vedere paragrafo 1).
A causa della funzione renale non ancora matura nei neonati fino a 4 settimane di età e negli infanti fino ad 1
anno di età, Gadovist deve essere usato in questi pazienti solo dopo attenta considerazione ad una dose non
superiore ad 0.1 mmol/kg di peso corporeo. Non deve essere usata più di una dose durante l’esame. Data la
mancanza di informazioni sulle somministrazioni ripetute, le iniezioni di Gadovist non devono essere ripetute,
a meno che l’intervallo tra le somministrazioni sia almeno di 7 giorni.
Contrasto
La dose necessaria viene somministrata per via endovenosa con iniezione in bolo. La RM con mezzo di
contrasto può iniziare immediatamente dopo l’iniezione (o poco dopo, a seconda delle sequenze di impulsi
usate e del protocollo d’esame).
L’intensificazione ottimale del segnale si osserva durante il primo passaggio arterioso del mezzo di contrasto
per la Risonanza Magnetica Angiografica ed entro circa 15 minuti dall’iniezione di Gadovist per le indicazioni
per l’SNC (il tempo dipende dal tipo di lesione/tessuto).
Le sequenze T pesate risultano particolarmente adatte per indagini con intensificazione di contrasto.
Gadovist 1,0 mmol/ml soluzione iniettabile, siringa preriempita/cartuccia
Gadobutrolo
Legga attentamente questo foglio prima di ricevere questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o alla persona che le somministra Gadovist (il radiologo) o al personale sanitario dell’ospedale/del centro RM. Se si manifesta uno qualsiasi degli effetti indesiderati, compresi quelli non elencati in questo foglio, informi il medico o il radiologo. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos'è Gadovist e a cosa serve
- 2. Cosa deve sapere prima di ricevere Gadovist
- 3. Come riceverà Gadovist
- 4. Possibili effetti indesiderati
- 6. Come conservare Gadovist
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Gadovist e a cosa serve
Gadovist è un mezzo di contrasto per la Risonanza Magnetica (RM) usato per la diagnostica del cervello,
della colonna vertebrale e dei vasi sanguigni.
Gadovist può anche aiutare il medico a evidenziare il tipo di anomalia (benigna o maligna) nota o sospetta
nel fegato e nei reni.
Gadovist può essere utilizzato anche per la risonanza magnetica di anomalie di altre parti del corpo.
Gadovist facilita la visualizzazione di strutture anomale o di lesioni e contribuisce alla differenziazione tra il
tessuto sano e malato. È indicato per gli adulti ed i bambini di tutte le età (compresi i neonati a termine).
Come funziona Gadovist
La RM è una metodica diagnostica per immagini, che utilizza il comportamento delle molecole d’acqua nei
tessuti normali e non. Questa tecnica si basa su un complesso sistema di magneti e onde radio. I computer
registrano l’attività, trasformandola in immagini.
Gadovist è somministrato mediante un’iniezione in vena. Questo medicinale è solo per uso diagnostico e
verrà somministrato solo da operatori sanitari con esperienza nel campo della pratica clinica RM.
2. Cosa deve sapere prima di ricevere Gadovist
NON usi Gadovist se
- è allergico al gadobutrolo o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico prima che le venga somministrato Gadovist se
- soffre o ha sofferto di un’allergia (per es. febbre da fieno, orticaria) o asma
- ha avuto reazioni precedenti a qualunque mezzo di contrasto
- ha la funzionalità renale molto compromessa
- soffre di stati cerebrali con attacchi convulsivi (crisi epilettiche) o di altre malattie del sistema nervoso
- ha un pacemaker o se ci sono impianti o clips contenenti ferro nel suo corpo
Il medico deciderà se è possibile sottoporla o meno all’esame previsto.
- Possono verificarsi, dopo l’uso di Gadovist, reazioni di tipo allergico o altri tipi di reazioni che portano problemi al cuore, difficoltà respiratorie e reazioni cutanee. Sono possibili reazioni gravi. Molte di queste reazioni avvengono entro mezz’ora dopo la somministrazione di Gadovist, pertanto, dopo la procedura, verrà tenuto in osservazione. Sono state osservate reazioni ritardate (dopo ore o giorni) (vedere paragrafo 4).
Reni/fegato
Informi il medico se
- i suoi reni non funzionano correttamente
- ha recentemente avuto, o prevede di avere a breve un trapianto di fegato.
Il medico può decidere di sottoporla ad un esame del sangue per valutare se i suoi reni stanno funzionando
correttamente, prima di decidere di usare Gadovist, soprattutto se ha 65 anni o più.
Neonati ed infanti
Essendo la funzione renale non ancora matura nei bambini fino a 4 settimane di età e negli infanti fino ad 1
anno di età, Gadovist verrà utilizzato in questi pazienti solo dopo un’attenta valutazione del medico.
Altri medicinali e Gadovist
Informi il medico se sta assumendo o ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza e allattamento
Chieda consiglio al medico prima di assumere qualsiasi medicinale
- GravidanzaIl gadobutrolo può attraversare la placenta. Non è noto se ciò influisce sul bambino. Informi il medico se pensa di essere in gravidanza o se sta pianificando una gravidanza. Gadovist non deve essere utilizzato in gravidanza a meno che non sia strettamente necessario.
- AllattamentoInformi il medico se allatta o se intende iniziare ad allattare. Il medico valuterà se può continuare od interrompere l’allattamento al seno per un periodo di 24 ore dopo la somministrazione di Gadovist.
Gadovist contiene sodio
Questo medicinale contiene meno di 23 mg di sodio per dose (sulla base della quantità media somministrata
a una persona di 70 kg), cioè essenzialmente ‘senza sodio’.
3. Come viene somministrato Gadovist
Gadovist viene iniettato in vena mediante un piccolo ago da un operatore sanitario. L’esame di RM può
iniziare immediatamente.
Dopo l’iniezione, sarà tenuto sotto osservazione per almeno 30 minuti.
Dose abituale
La dose effettiva adatta a lei dipende dal suo peso corporeo e dal distretto da esaminare mediante RM:
negli adultiè raccomandata un’unica iniezione di 0,1 millilitri di Gadovist per kg di peso corporeo (ciò
significa che per una persona di 70 kg la dose sarebbe di 7 millilitri), comunque è consentita un’ulteriore
iniezione fino a 0,2 millilitri per kg di peso corporeo entro 30 minuti dalla prima iniezione. È consentita la
somministrazione di una quantità totale di 0,3 millilitri di Gadovist per kg di peso corporeo come dose
massima (ciò significa che per una persona di 70 kg la dose sarebbe di 21 millilitri) per l'imaging del sistema
nervoso centrale (SNC) e CE-MRA. E’ consentita la somministrazione di una dose di 0,075 millilitri di
Gadovist per kg di peso corporeo come dose minima (ciò significa che per una persona di 70 kg la dose
sarebbe di 5,25 millilitri) per l'imaging del SNC.
Ulteriori informazioni sulla somministrazione e la manipolazione di Gadovist sono riportate in fondo al
Dosaggio in popolazioni speciali di pazienti
L’uso di Gadovist non è raccomandato nei pazienti con gravi problemi ai reni e nei pazienti che hanno
recentemente avuto o sono in procinto di avere un trapianto di fegato. Comunque, se l’uso è richiesto deve
ricevere solo una dose di Gadovist durante l’esame e non deve ricevere una seconda somministrazione per
almeno 7 giorni.
Neonati, infanti, bambini e adolescenti
- Nei bambini di tutte le età (inclusi i neonati a termine) è raccomandata un’unica dose di 0,1 millilitri di Gadovist per kg di peso corporeo per tutte le tipologie di indagine diagnostica (vedere paragrafo 1).
- Dato che la funzione renale non è ancora matura nei bambini fino a 4 settimane di età e negli infanti fino ad 1 anno di età, Gadovist verrà utilizzato in questi pazienti solo dopo un’attenta valutazione del medico. I neonati e gli infanti devono ricevere solo una dose di Gadovist durante l’esame e non devono ricevere una seconda iniezione per almeno 7 giorni.
Anziani
Non è necessario alcun aggiustamento della dose se ha 65 anni di età o più ma può essere sottoposto ad un
esame del sangue per valutare se i suoi reni stanno funzionando correttamente.
Se riceve più Gadovist di quanto deve
È improbabile un sovradosaggio. Se ciò dovesse effettivamente accadere, il medico tratterà gli eventuali
sintomi e potrà usare la dialisi renale per rimuovere Gadovist dall’organismo. Non ci sono prove che questa
sia in grado di prevenire lo sviluppo della Fibrosi Sistemica Nefrogenica (NSF; vedere paragrafo 4). Pertanto,
la dialisi renale non deve essere utilizzata come trattamento per tale condizione. In alcuni casi verrà controllato
il suo cuore.
Se ha qualsiasi dubbio sull’uso di questo medicinale si rivolga al medico o al radiologo.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino. La maggior parte di queste reazioni si verificano entro mezz'ora dalla somministrazione di
Gadovist. In rari casi sono state osservate reazioni avverse ritardate di tipo allergico o di altro tipo, che si
verificano da ore a diversi giorni dopo la somministrazione di Gadovist. Se ciò dovesse accaderle, informi
immediatamente il medico o il radiologo.
Gli effetti indesiderati più gravi(che sono stati fatali o pericolosi per la vita in alcuni casi) sono:
- il cuore smette di battere ( arresto cardiaco), una grave malattia polmonare ( sindrome da distressrespiratorio acuto) / liquido nei polmoni ( edema polmonare) e una grave reazione simil-allergica ( anafilattoide) (inclusi arresto respiratorio e shock).
Inoltre per i seguenti effetti indesideratisono stati osservati in alcuni casi esiti fatali o pericolosi per la
vita:
- Respiro corto ( dispnea), perdita di coscienza, reazione simil-allergica grave, grave riduzione della pressione del sangue che può portare al collasso, arresto respiratorio, liquido nei polmoni, rigonfiamento della bocca e della gola e bassa pressione del sangue.
In rari casi:
- possono verificarsi reazioni di tipo allergico(ipersensibilità e anafilassi), incluse gravi reazioni (shock), tali da richiedere un intervento medico immediato.
Se nota:
- gonfiore del viso, delle labbra, della lingua o della gola,
- tosse e starnuti
- difficoltà respiratoria
- prurito
- naso che cola
- orticaria
Informi immediatamente il personale del reparto RM. Questi possono essere i primi segni di una grave
reazioneimminente. Potrebbe essere necessario interrompere l’esame e praticarle altri trattamenti.
La maggior parte degli effetti indesiderati osservati(può riguardare 5 o più soggetti su 1.000) sono:
- mal di testa, avere la sensazione di star male ( nausea) e capogiri.
Molti degli effetti indesiderati sono da lievi a moderati.
I possibili effetti indesideratiosservati negli studi cliniciprima dell’approvazione di Gadovist sono elencati
di seguito in base alla probabilità di comparsa:
Comune:(può riguardare fino a 1 soggetto su 10)
- mal di testa
- avere la sensazione di star male ( nausea)
Non comune:(può riguardare fino a 1 soggetto su 100)
- Reazioni simil allergiche, ad esempio:
- bassa pressione del sangue
- orticaria
- rigonfiamento del viso
- rigonfiamento ( edema) della palpebra
- rossore La frequenza delle seguenti reazioni simil-allergiche non è nota:
- una grave reazione simil-allergica ( shock anafilattoide)
- marcato abbassamento della pressione del sangue che può portare al collasso ( shock)
- arresto respiratorio
- difficoltà respiratorie ( broncospasmo)
- labbra blu
- gonfiore della bocca e della gola
- gonfiore della gola
- aumento della pressione sanguigna
- dolore al torace
- gonfiore del viso, della gola, della bocca, delle labbra e/o della lingua ( angioedema)
- congiuntivite
- aumento della sudorazione
- tosse
- starnuti
- sensazione di bruciore
- cute pallida (pallore)
- capogiro, alterato senso del gusto, intorpidimento e formicolio
- respiro corto ( dispnea)
- vomito
- rossore della pelle ( eritema)
- prurito incluso il prurito generalizzato ( prurito)
- eruzione cutanea (incluse l’eruzione cutanea generalizzata, piccole macchie rosse piatte [l’ eruzionemaculare], lesioni piccole, circoscritte, rilevate [ eruzione papulare] ed eruzione cutanea pruriginosa [esantema pruriginoso])
- vari tipi di reazione nella sede di iniezione (ad es. stravaso nei tessuti circostanti, bruciore, sensazione di freddo, sensazione di calore, arrossamento, eruzione cutanea, dolore o ecchimosi)
- sensazione di calore
Raro:(può riguardare fino a 1 soggetto su 1.000)
- svenimento
- convulsione
- alterazione dell’olfatto
- battito cardiaco accelerato
- palpitazioni
- bocca secca
- sensazione di malessere generale ( malessere)
- sensazione di freddo
Altri effetti indesiderati riportati dopo l’approvazione di Gadovist con frequenza non nota(la
frequenza non può essere definita sulla base dei dati disponibili):
- il cuore smette di battere ( arresto cardiaco)
- una grave malattia polmonare ( sindrome da distress respiratorio acuto)
- liquido nei polmoni ( edema polmonare)
- sono stati segnalati casi di fibrosi sistemica nefrogenica - NSF (che causa indurimento della pelle e può colpire anche i tessuti molli e gli organi interni).
Dopo la somministrazione di Gadovist, sono state osservate variazioni della funzionalità renale negli esami
del sangue (per esempio aumento della creatinina sierica).
Segnalazione di effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio si rivolga al
medico o al radiologo. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione all’indirizzo: http://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
5. Come conservare Gadovist
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza riportata sull’etichetta e sul cartone dopo Scad. La data
di scadenza si riferisce all'ultimo giorno di quel mese. Questo medicinale non richiede alcuna condizione
particolare di conservazione.
La stabilità chimica, fisica e microbiologica del prodotto dopo apertura è stata dimostrata per 24 ore a 20-
25°C.
Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente dopo l’apertura.
Questo medicinale è una soluzione limpida, da incolore a giallo pallido. Non utilizzare questo medicinale in
caso di evidente alterazione del colore, in presenza di particelle o se il contenitore appare difettoso.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. L’operatore sanitario
eliminerà questo medicinale quando non è più utilizzato. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Gadovist
- Il principio attivo è il gadobutrolo.
1 ml di soluzione iniettabile contiene 604,72 mg di gadobutrolo (equivalenti a 1,0 mmol di gadobutrolo,
contenenti 157,25 mg di gadolinio).
1 siringa preriempita da 5 ml contiene 3.023,6 mg di gadobutrolo
1 siringa preriempita da7,5 ml contiene 4.535,4 mg di gadobutrolo
1 siringa preriempita da 10 ml contiene 6.047,2 mg di gadobutrolo
1 siringa preriempita da 15 ml contiene 9.070,8 mg di gadobutrolo
1 siringa preriempita da 20 ml contiene 12.094,4 mg di gadobutrolo
1 cartuccia da 15 ml contiene 9.070,8 mg di gadobutrolo
1 cartuccia da 20 ml contiene 12.094,4 mg di gadobutrolo
1 cartuccia da 30 ml contiene 18.141,6 mg di gadobutrolo
- Gli altri componenti sono calcobutrolo sodico (vedere la fine del paragrafo 2), trometamolo, acido cloridrico 1 N e acqua per preparazioni iniettabili
Descrizione dell'aspetto di Gadovist e contenuto della confezione
Gadovist è una soluzione iniettabile limpida, da incolore a giallo pallido. Le confezioni contengono:
- 1 o 5 siringhe preriempite contenenti 5, 7,5, 10 ml di soluzione iniettabile (in siringa preriempita in vetro o in plastica da 10 ml)
- 1 o 5 siringhe preriempite contenenti 15 ml di soluzione iniettabile (in siringa preriempita in vetro da 17 ml o siringa preriempita in plastica da 20 ml)
- 1 o 5 siringhe preriempite contenenti 20 ml di soluzione iniettabile (in siringa preriempita in vetro o in plastica da 20 ml)
- 1 o 5 cartucce contenenti 15, 20, 30 ml di soluzione iniettabile (in cartuccia da 65 ml)
Confezione ospedaliera:
- 5 siringhe preriempite da 5, 7,5, 10, 15, 20 ml di soluzione iniettabile
- 5 cartucce da 15, 20, 30 ml di soluzione iniettabile
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell'Autorizzazione all'Immissione in Commercio:
Bayer S.p.A.
Viale Certosa, 130
20156 Milano
Produttore:
Bayer AG
Müllerstrasse 178
13353 Berlino
Germania
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
| Austria, Germania | I Gadovist 1,0 mmol/ml Injektionslösung in Fertigspritzen/Patronen |
| Croazia | Gadovist 1,0 mmol/ml otopina za injekciju u napunjenoj štrcaljki/ulošku |
| Belgio, Bulgaria, Cipro, i Danimarca, Estonia, z Finlandia, Grecia, Italia, Lussemburgo, Norvegia, Portogallo, Svezia | a Gadovist |
| n Francia | GADOVIST 1,0 mmol/mL, solution injectable en seringue préremplie |
| e Irlanda | Gadovist 1.0 mmol/ml solution for injection in prefilled syringe Gadovist 1.0 mmol/ml solution for injection in prefilled cartridge |
| g Islanda | Gadovist 1,0 mmól/ml, stungulyf, lausn í áfylltum sprautum/rörlykjum |
| Paesi Bassi | Gadovist 1,0 mmol/ml, oplossing voor injectie in voorgevulde spuit/ patroon |
| A Slovenia | Gadovist 1,0 mmol/ml raztopina za injiciranje v napolnjeni injekcijski brizgi/vložku |
| Slovacchia | Gadovist 1,0 mmol/ ml |
Questo foglio è stato aggiornato il.
-----------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Compromissione renale
Prima della somministrazione di Gadovist, si raccomanda che tutti i pazienti siano sottoposti a
screening delle disfunzioni renali, con test di laboratorio.
Sono stati riportati casi di fibrosi sistemica nefrogenica (NSF) associati all’uso di alcuni mezzi di contrasto
contenenti gadolinio, in pazienti con compromissione renale severa acuta o cronica (GFR <30ml/min/1,73
m ). I pazienti che si sottopongono a trapianto di fegato sono esposti ad un rischio particolare dal momento
che l’incidenza di insufficienza renale acuta è elevata in questo gruppo di pazienti. Poiché potrebbe
manifestarsi NSF con Gadovist il medicinale deve essere usato nei pazienti con compromissione renale
severa e nei pazienti nel periodo perioperatorio del trapianto di fegato solo dopo un’attenta valutazione del
rapporto rischio/beneficio e se le informazioni diagnostiche siano essenziali e non ottenibili con RM senza
mezzo di contrasto.
Se è necessario l’uso di Gadovist la dose non deve essere superiore a 0,1 mmol/kg di peso corporeo. Non
deve essere utilizzata più di una dose durante ogni esame. Data la mancanza di informazioni sulle
somministrazioni ripetute, le iniezioni di Gadovist non devono essere ripetute senza che l’intervallo tra
queste sia di almeno 7 giorni.
Dato che negli anziani la clearance renale di Gadovist può essere compromessa, è particolarmente importante
sottoporre a screening della funzionalità renale i pazienti a partire dai 65 anni d’età.
L’emodialisi subito dopo la somministrazione di Gadovist può essere utile per rimuovere Gadovist
dall’organismo. Non ci sono prove a supporto dell’uso dell’emodialisi nella prevenzione o nel trattamento
della NSF in pazienti non ancora sottoposti a emodialisi.
- Gravidanza e allattamentoGadovist non deve essere usato durante la gravidanza, se non quando le condizioni cliniche della donna richiedano l’uso di Gadovist.
Il medico e la madre che allatta devono decidere se continuare o sospendere l’allattamento al seno per 24 ore
dopo la somministrazione di Gadovist.
- Reazioni di ipersensibilità
Come per altri mezzi di contrasto endovenoso, Gadovist può essere associato a reazioni di tipo anafilattoide/di
ipersensibilità od altre reazioni idiosincratiche, caratterizzate da manifestazioni cardiovascolari, respiratorie e
cutanee anche gravi fino allo shock. In generale, i pazienti con disturbi cardiovascolari sono più sensibili agli
esiti gravi o anche fatali di severe reazioni d’ipersensibilità.
Il rischio di reazioni d’ipersensibilità è superiore nei seguenti casi:
- precedenti reazioni a mezzo di contrasto
- storia di asma bronchiale
- storia di disturbi allergici
Nei pazienti con una predisposizione allergica, la decisione di usare Gadovist dev’essere presa dopo un’attenta
valutazione del rapporto rischio/beneficio.
| Spagna | Gadovist 1 mmol/ml solución inyectable en jeringa precargada / cartucho precargado |
| Malta | o Gadovist 1.0 mmol/ml solution for injection pre-filled syringe / cartridge |
Molte di queste reazioni si manifestano dopo mezz’ora dalla somministrazione, pertanto, si raccomanda
l’osservazione del paziente dopo la procedura.
È necessaria l’immediata disponibilità di farmaci per il trattamento delle reazioni d’ipersensibilità, così come
è necessario essere pronti ad adottare tutte le contromisure in caso d’emergenza.
In rari casi si sono verificate reazioni ritardate (dopo ore fino a diversi giorni).
- Disturbi convulsivi
Come per tutti gli altri mezzi di contrasto contenenti gadolinio, è necessaria particolare cautela nei pazienti
con una bassa soglia convulsiva.
- Sovradosaggio
In caso di sovradosaggio accidentale, si raccomanda il monitoraggio cardiovascolare (incluso l’ECG) ed il
controllo della funzione renale come misure precauzionali.
In caso di sovradosaggio in pazienti con insufficienza renale, Gadovist può essere rimosso mediante
emodialisi. Dopo 3 sessioni di emodialisi, circa il 98% del prodotto è eliminato dall’organismo. Tuttavia, non
ci sono prove che l’emodialisi sia efficace per la prevenzione della fibrosi sistemica nefrogenica (NSF).
- Prima dell’iniezione
Questo medicinale è esclusivamente monouso.
Questo medicinale è una soluzione limpida, da incolore a giallo chiaro. Deve essere ispezionato visivamente
prima dell’uso.
Si raccomanda di non utilizzare Gadovist in caso di evidente alterazione del colore, in presenza di materiale
particolato o se il contenitore risulta difettoso.
- Istruzione per l’uso
Siringhe preriempite
La siringa preriempita deve essere estratta dalla confezione e preparata per l’iniezione immediatamente prima
della somministrazione.
Il cappuccio protettivo deve essere rimosso dalla siringa preriempita immediatamente prima dell’uso.
Siringa in vetro:
INIEZIONE MANUALE
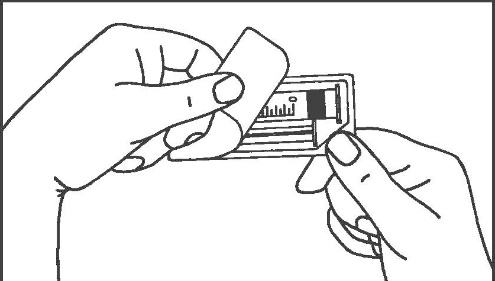
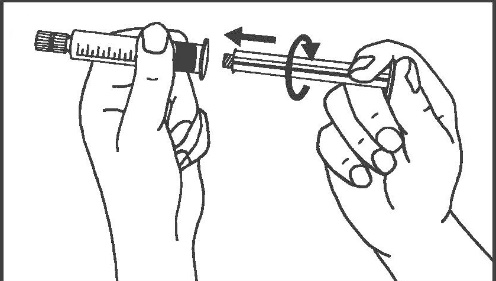
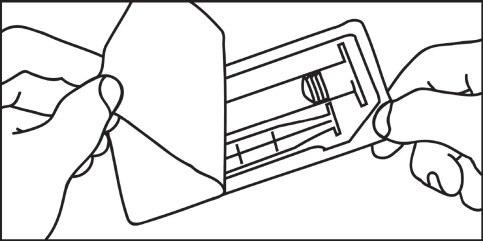
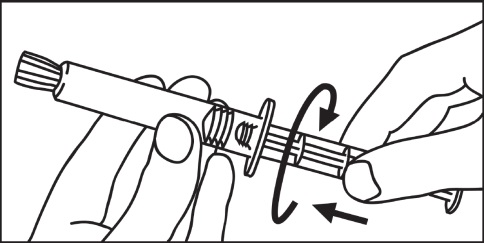
- 1. Aprire la confezione 2. Avvitare lo stantuffo nella siringa
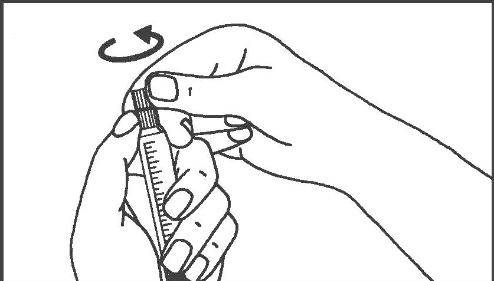
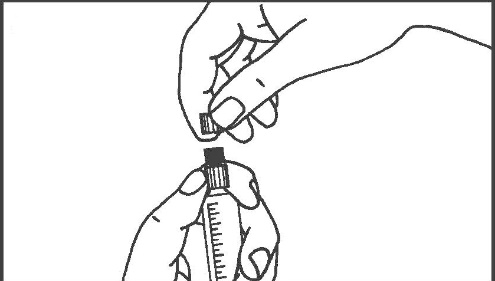
- 3. Rompere la copertura protettiva 4. Rimuovere la copertura protettiva
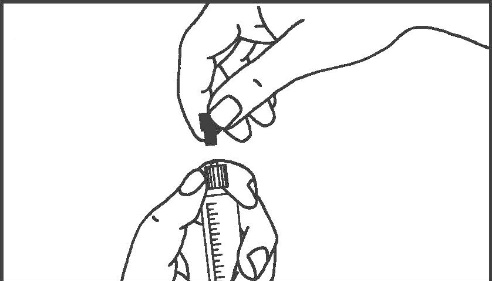
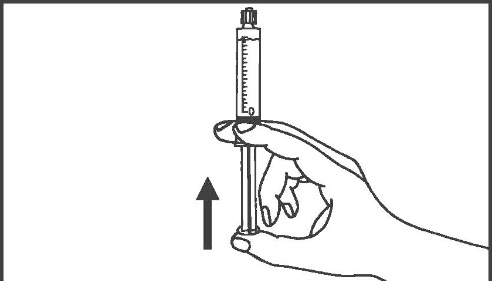
- 5. Rimuovere il tappo di gomma 6. Rimuovere l’aria dalla siringa
Siringa in plastica:
INIEZIONE MANUALE INIEZIONE CON INIETTORE
“POWER”
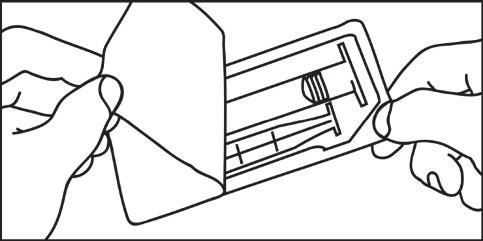
- 1. Aprire la confezione 1. Aprire la confezione
- 2. Estrarre la siringa e lo stantuffo dalla confezione
- 2. Estrarre la siringa dalla confezione
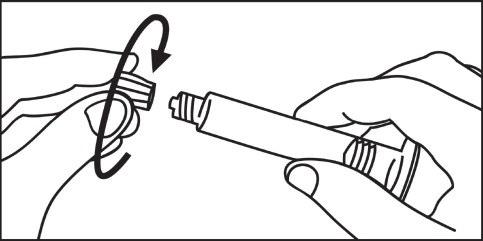
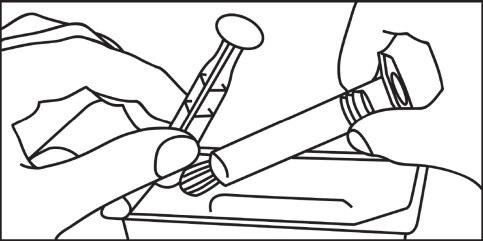
- 3. Ruotare in senso orario lo stantuffo nella siringa
- 3. Aprire il cappuccio ruotandolo
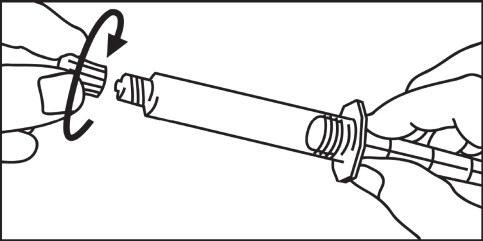
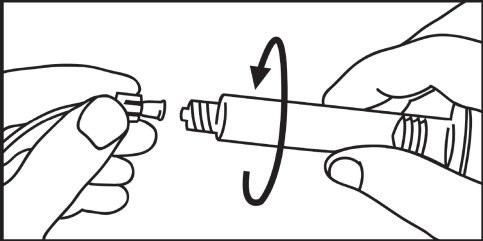
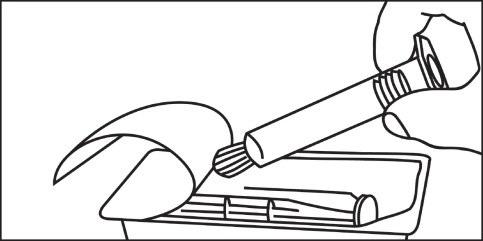
- 4. Aprire il cappuccio ruotandolo 4. Collegare la punta della siringa o del sistema di tubi in senso orario e proseguire secondo le istruzioni del produttore del dispositivo
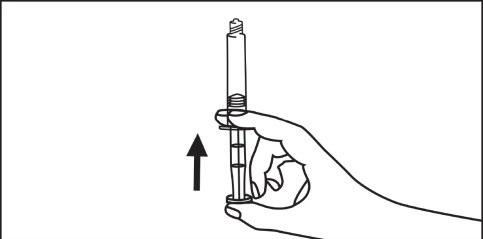
- 5. Rimuovere l’aria dalla siringa
Cartucce
La somministrazione di mezzi di contrasto deve essere effettuata da personale qualificato con procedure e
attrezzature adeguate.
In tutte le iniezioni che coinvolgono mezzi di contrasto deve essere utilizzata una tecnica sterile.
Il mezzo di contrasto deve essere somministrato con l’impiego di un iniettore tipo MEDRAD Spectris.
Rispettare le istruzioni del produttore del dispositivo.
La soluzione non utilizzata durante l’esame deve essere smaltita in conformità alla normativa locale vigente.
Validità dopo apertura del contenitore
L’eventuale soluzione iniettabile non utilizzata per l’indagine deve essere scartata. La stabilità chimica, fisica
e microbiologica del prodotto dopo apertura è stata dimostrata per 24 ore a 20-25°C.
Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente. In caso contrario la
durata e le condizioni di conservazione del prodotto ricadono sotto la responsabilità dell’utilizzatore.
L’etichetta adesiva di tracciabilità sulle siringhe/cartucce va staccata e applicata sulla documentazione del
paziente, per consentire l’accurata registrazione del mezzo di contrasto contenente gadolinio usato. Anche la
dose utilizzata deve essere registrata.
Se si utilizza documentazione elettronica, il nome del prodotto, il numero di lotto e la dose devono essere
inseriti nella documentazione elettronica del paziente.
Posologia
Usare la dose più bassa che consente di ottenere un miglioramento sufficiente ai fini diagnostici. La dose va
calcolata in base al peso corporeo del paziente e non deve superare la dose raccomandata per chilogrammo di
peso corporeo riportata in questo paragrafo.
- Adulti
Indicazioni per il sistema nervoso centrale:
La dose raccomandata per gli adulti è 0,1 mmol per chilogrammo di peso corporeo (mmol/kg di peso corporeo).
Questo equivale a 0,1 ml/kg di peso corporeo della soluzione 1,0 M.
Se persiste il forte sospetto clinico di una lesione nonostante l’esame RM risulti non significativo, oppure nel
caso in cui informazioni più precise potrebbero influenzare la terapia del paziente, può essere somministrata
una ulteriore iniezione fino a 0,2 ml/kg di peso corporeo entro 30 minuti dalla precedente. Può essere
somministrata una dose di 0,075 mmol di gadobutrolo per kg di peso corporeo (equivalente a 0,075 ml di
Gadovist per kg di peso corporeo) per l’imaging del SNC.
RM del corpo intero (esclusa MRA)
In generale, la somministrazione di 0,1 ml di Gadovist per kg di peso corporeo è sufficiente per risolvere i
quesiti diagnostici.
Intensificazione del contrasto nella Risonanza Magnetica Angiografica:
Immagini con 1 campo di vista (field of view=FOV): 7,5 ml per pazienti con peso corporeo inferiore a 75 kg,
10 ml per pazienti con peso corporeo di 75 kg o superiore (corrispondenti a 0,1-0,15 mmol/kg di peso
corporeo).
Immagini con FOV >1: 15 ml per pazienti con peso corporeo inferiore a 75 kg, 20 ml per pazienti con peso
corporeo di 75 kg o superiore (corrispondenti a 0,2-0,3 mmol/kg di peso corporeo).
- Popolazione pediatrica
Per i bambini di tutte le età (compresi i neonati a termine) la dose raccomandata è di 0,1 mmol di gadobutrolo
per kg di peso corporeo (corrispondenti a 0,1 ml di Gadovist per kg di peso corporeo) per tutte le indicazioni
(vedere paragrafo 1).
A causa della funzione renale non ancora matura nei bambini fino a 4 settimane di età e negli infanti fino ad 1
anno di età, Gadovist deve essere usato in questi pazienti solo dopo attenta considerazione ad una dose non
superiore ad 0.1 mmol/kg di peso corporeo. Non deve essere usata più di una dose durante l’esame. Data la
mancanza di informazioni sulle somministrazioni ripetute, le iniezioni di Gadovist non devono essere ripetute,
a meno che l’intervallo tra le somministrazioni sia almeno di 7 giorni.
Contrasto
La dose necessaria viene somministrata per via endovenosa con iniezione in bolo. La RM con mezzo di
contrasto può iniziare immediatamente dopo l’iniezione (o poco dopo, a seconda delle sequenze di impulsi
usate e del protocollo d’esame).
L’intensificazione ottimale del segnale si osserva durante il primo passaggio arterioso del mezzo di contrasto
per la Risonanza Magnetica Angiografica ed entro circa 15 minuti dall’iniezione di Gadovist per le indicazioni
per l’SNC (il tempo dipende dal tipo di lesione/tessuto).
Le sequenze T pesate risultano particolarmente adatte per indagini con intensificazione di contrasto.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a GADOVISTForma farmaceutica: Soluzione iniettabile, 0,5 MMOL/MLPrincipio attivo: gadoteric acidProduttore: GE HEALTHCARE ASPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 0,5 MMOL/MLPrincipio attivo: gadoteric acidProduttore: BAYER S.P.A.Prescrizione richiestaForma farmaceutica: Soluzione iniettabile, 0,5 mmol / mLPrincipio attivo: gadopiclenolProduttore: GUERBETPrescrizione richiesta
Medici online per GADOVIST
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di GADOVIST — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














