
NUCEIVA

Come usare NUCEIVA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
NUCEIVA 50 unità polvere per soluzione iniettabile
tossina botulinica di tipo A
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è NUCEIVA e a cosa serve
- 2. Cosa deve sapere prima di usare NUCEIVA
- 3. Come usare NUCEIVA
- 4. Possibili effetti indesiderati
- 5. Come conservare NUCEIVA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è NUCEIVA e a cosa serve
NUCEIVA contiene il principio attivo tossina botulinica di tipo A.
Impedisce ai muscoli di contrarsi, portando a una paralisi temporanea. Agisce bloccando gli impulsi
nervosi ai muscoli in cui è stato iniettato.
NUCEIVA viene utilizzato per il miglioramento temporaneo nei casi di comparsa di rughe verticali tra
le sopracciglia. È utilizzato negli adulti di età inferiore a 65 anni in cui tali rughe facciali abbiano un
importante impatto psicologico.
2. Cosa deve sapere prima di usare NUCEIVA
Non usi NUCEIVA
- se è allergico alla tossina botulinica di tipo A o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6);
- se presenta miastenia gravis o sindrome di Eaton-Lambert (malattie croniche che colpiscono i muscoli);
- se presenta infezione o infiammazione nelle sedi di iniezione proposte tra le sopracciglia e sopra le sopracciglia (come illustrato nella Figura 1).
Avvertenze e precauzioni
Gli effetti indesiderati eventualmente correlati alla diffusione della tossina botulinica dalla sede di
iniezione (ad es. debolezza muscolare, difficoltà nella deglutizione o introduzione di cibo o liquidi
nelle vie respiratorie) possono verificarsi molto raramente. I pazienti cui vengono somministrate le
dosi raccomandate possono manifestare una debolezza muscolare eccessiva.
L’iniezione è risultata associata a dolore localizzato, infiammazione/gonfiore, sensibilità alterata
(parestesia), sensibilità ridotta (ipoestesia), dolorabilità, eruzione cutanea (eritema), infezione
localizzata, sanguinamento e/o lividi. Il dolore e/o l’ansia correlati all’ago hanno determinato risposte
vasovagali quali pallore, nausea, sudorazione, visione offuscata, battito cardiaco accelerato,
stordimento mentale e/o un calo temporaneo della pressione sanguigna causa di capogiri o svenimento.
Si rivolga immediatamente al medico se dopo il trattamento le risulta difficile deglutire, parlare o
respirare.
- Questo medicinale non è raccomandato nei pazienti che, recentemente o in passato, hanno avuto problemi di deglutizione (disfagia) e respirazione che secondo il parere del medico, precluderebbero la somministrazione sicura del prodotto.
- Una somministrazione troppo frequente o eccessiva può determinare la formazione di anticorpi, che può impedire alla tossina botulinica di tipo A di agire anche per altri usi.
- Molto raramente può verificarsi una reazione allergica in seguito all’iniezione di tossina botulinica. I sintomi possono includere reazioni cutanee, tra cui orticaria e prurito e pelle arrossata o pallida, gonfiore degli occhi, delle labbra, della bocca o della gola, un polso debole e accelerato, capogiri e respiro sibilante o affannoso.
- Dopo il trattamento può verificarsi un abbassamento della palpebra.
Informi il medico se:
- ha avuto problemi con precedenti iniezioni di tossina botulinica;
- non riscontra alcun miglioramento significativo delle rughe a un mese di distanza dal primo ciclo di trattamento;
- è affetto da determinate malattie del sistema nervoso (quali la sclerosi laterale amiotrofica o la neuropatia motoria);
- presenta infiammazione nella(e) sede(i) di iniezione proposta(e);
- i muscoli da iniettare sono deboli o atrofizzati;
- è affetto da un disturbo di sanguinamento, poiché l’iniezione può indurre lividi.
Bambini e adolescenti
L’uso di questo medicinale non è raccomandato in soggetti di età inferiore a 18 anni.
Altri medicinali e NUCEIVA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
L’uso della tossina botulinica non è raccomandato in associazione ad antibiotici aminoglicosidici,
spectinomicina o altri medicinali che interferiscono con gli impulsi nervosi al muscolo.
Informi il medico se le è stato recentemente iniettato un medicinale contenente tossina botulinica (il
principio attivo di NUCEIVA), poiché questo può aumentare eccessivamente l’effetto di questo
medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
L’uso di questo medicinale non è raccomandato durante la gravidanza e in donne in età fertile che non
usano misure contraccettive.
Questo medicinale non è raccomandato durante l’allattamento.
Guida di veicoli e utilizzo di macchinari
Debolezza muscolare, capogiro e disturbi visivi causati da questo medicinale possono rendere
pericolosi la guida e l’utilizzo di macchinari. Non guidare o utilizzare macchinari finché tali effetti non
siano scomparsi.
NUCEIVA contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente “senza
sodio”.
3. Come usare NUCEIVA
Le dosi unitarie di NUCEIVA non sono intercambiabili con quelle utilizzate per altri preparati a base
di tossina botulinica.
Questo medicinale deve essere iniettato esclusivamente da medici con adeguate qualifiche ed
esperienza nel trattamento delle rughe glabellari al massimo livello di increspamento della fronte.
La dose abituale di NUCEIVA è di 20 unità. Verrà iniettato il volume raccomandato di 0,1 millilitri
(mL) (4 unità) di questo medicinale in ciascuna delle 5 sedi di iniezione.
Il miglioramento della gravità delle rughe tra le sopracciglia avviene generalmente entro pochi giorni
dal trattamento.
L’intervallo tra i trattamenti verrà deciso dal medico.
Come viene iniettato NUCEIVA
Questo medicinale viene iniettato nei muscoli (per via intramuscolare), direttamente nella zona
interessata sopra e tra le sopracciglia.
Una volta ricostituito, NUCEIVA deve essere usato esclusivamente per trattare un solo paziente, nel
corso di una singola seduta.
Se ha qualsiasi dubbio sull’uso di questo medicinale consulti il medico o il farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
In generale, gli effetti indesiderati si verificano nei primi giorni successivi all’iniezione e sono
temporanei. La maggior parte degli effetti indesiderati è di gravità da lieve a moderata.
In caso di difficoltà a respirare, deglutire o parlare dopo la somministrazione di questo medicinale,
contatti immediatamente il medico.
In caso di orticaria, gonfiore, compreso quello del viso o della gola, respiro sibilante, sensazione di
svenimento e respiro corto, contatti immediatamente il medico, perché possono essere sintomi di una
reazione allergica.
La possibilità di manifestare un effetto indesiderato è descritta dalle seguenti categorie:
| g Comune A (può riguardare fino a 1 persona su 10) | Mal di testa, squilibrio muscolare con conseguente innalzamento o asimmetria delle sopracciglia, abbassamento delle palpebre, lividi nella sede di iniezione |
| Non comune (può riguardare fino a 1 persona su 100) | Disturbo sensoriale, fastidio al capo, occhi secchi, palpebre gonfie, occhi gonfi, contrazioni muscolari, sede di iniezione: arrossamento, dolore, formicolio o c |
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’allegato V. Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare NUCEIVA
Conservare in frigorifero (2 C – 8 C).
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Flaconcino integro
Non usi questo medicinale dopo la data di scadenza che è riportata sul flaconcino e sulla scatola dopo
Scad.
6. Contenuto della confezione e altre informazioni
Cosa contiene NUCEIVA
- Il principio attivo è: 50 unità di tossina botulinica di tipo A.
- Gli eccipienti sono albumina umana e sodio cloruro.
Descrizione dell’aspetto di NUCEIVA e contenuto della confezione
NUCEIVA si presenta sotto forma di polvere bianca per soluzione iniettabile in un flaconcino di vetro
trasparente.
Ogni confezione contiene 1 flaconcino oppure 4 flaconcini (4 x 1) oppure 10 flaconcini (10 x 1).
È possibile che non tutte le confezioni siano commercializzate.
Titolare e produttore dell’autorizzazione all’immissione in commercio
Evolus Pharma B.V.
Apollolaan 151
1077 AR Amsterdam
Paesi Bassi
Per ulteriori informazioni su questo medicinale, contatti il titolare dell’autorizzazione all’immissione
in commercio.
------------------------------------------------------------------------------------------------------------------------
LE INFORMAZIONI SEGUENTI SONO DESTINATE ESCLUSIVAMENTE AGLI OPERATORI
SANITARI:
Le unità di tossina botulinica non sono intercambiabili da un prodotto all’altro. Le dosi raccomandate
in unità sono diverse da altri preparati a base di tossina botulinica.
La ricostituzione deve essere eseguita secondo la buona pratica clinica, in particolare per quanto
riguarda la tecnica asettica. NUCEIVA viene ricostituito con soluzione iniettabile di sodio cloruro
9 mg/mL (0,9 %). Vengono prelevati in una siringa 1,25 mL di soluzione iniettabile di sodio cloruro
9 mg/mL (0,9 %) per ottenere una soluzione iniettabile ricostituita ad una concentrazione di
4 unità/0,1 mL.
La parte centrale del tappo in gomma deve essere pulita con alcool. Iniettare lentamente il diluente nel
flaconcino con un ago attraverso il tappo in gomma e ruotare delicatamente il flaconcino, evitando la
formazione di bolle. Il flaconcino deve essere eliminato se il vuoto non aspira il diluente all’interno
del flaconcino stesso. Una volta ricostituita, la soluzione iniettabile deve essere ispezionata
visivamente prima dell’uso per verificare che risulti limpida, incolore e priva di particolato.
NUCEIVA ricostituito (50 unità/1,25 mL) viene iniettato con un ago sterile da 30 gauge. Vengono
somministrate quattro unità (4 U/0,1 mL) in ciascuna delle 5 sedi di iniezione (vedere figura 1): 2
iniezioni in ciascun muscolo corrugatore (profilo mediale inferiore e mediale superiore) e 1 iniezione
nel muscolo procero per una dose totale di 20 unità.
| Quantità di solvente aggiunto a un flaconcino da 50 unità [soluzione iniettabile di sodio cloruro 9 mg/mL (0,9 %)] | r Dose risultante (Unità per 0,1 mL) |
| 1,25 mL | a 4,0 U |
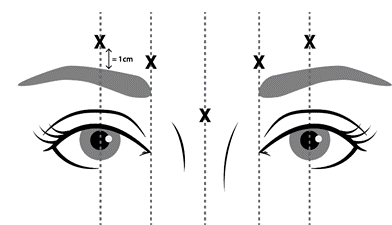
Al fine di ridurre le complicanze della ptosi palpebrale, è necessario adottare le seguenti misure:
- evitare l’iniezione in prossimità del muscolo elevatore della palpebra superiore, in particolare nei pazienti con complessi del depressore del sopracciglio più ampi;
- eseguire le iniezioni nel muscolo corrugatore laterale almeno 1 cm sopra la cresta ossea sopraorbitale;
- assicurarsi che il volume/la dose iniettato/a sia accurato/a e, ove possibile, mantenuto/a al minimo.
Procedura da seguire per uno smaltimento sicuro di flaconcini, siringhe e materiali utilizzati
Immediatamente dopo l’uso, la soluzione iniettabile di NUCEIVA ricostituita non utilizzata rimasta
nel flaconcino e/o nella siringa deve essere inattivata, prima dello smaltimento, con 2 mL di soluzione
diluita di sodio ipoclorito 0,5 % o 1 %. A seguito dell’inattivazione, smaltire in conformità alla
normativa locale vigente.
I flaconcini, le siringhe e i materiali utilizzati non devono essere svuotati e vanno eliminati in appositi
contenitori e smaltiti in conformità alla normativa locale vigente.
Raccomandazioni in caso di incidente durante la manipolazione della tossina botulinica
In caso di incidente durante la manipolazione del prodotto, sia in stato essiccato sottovuoto o
ricostituito, devono essere immediatamente adottate le misure adeguate descritte di seguito.
- La tossina è molto sensibile al calore e ad alcuni agenti chimici.
- Eventuali perdite devono essere eliminate: utilizzare un materiale assorbente imbevuto in una soluzione di sodio ipoclorito (soluzione di candeggina) nel caso di prodotto essiccato sottovuoto o un materiale assorbente asciutto nel caso di prodotto ricostituito.
- Le superfici contaminate devono essere pulite con un materiale assorbente imbevuto in una soluzione di sodio ipoclorito (soluzione di candeggina) e quindi asciugate.
- In caso di rottura di un flaconcino, raccogliere accuratamente i pezzi di vetro e asciugare il prodotto come sopra indicato, evitando tagli sulla pelle.
- In caso di schizzi, lavare con una soluzione di ipoclorito di sodio e sciacquare accuratamente con acqua abbondante.
- In caso di schizzi negli occhi, sciacquare accuratamente gli occhi con acqua abbondante o con una soluzione per il lavaggio oculare.
- Se la persona che pratica l’iniezione si ferisce (si taglia, si punge), procedere come sopra e adottare le adeguate misure mediche, in funzione della dose iniettata.
Le presenti istruzioni per l’uso, la manipolazione e lo smaltimento devono essere rigorosamente
seguite.
NUCEIVA 100 unità polvere per soluzione iniettabile
tossina botulinica di tipo A
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è NUCEIVA e a cosa serve
- 2. Cosa deve sapere prima di usare NUCEIVA
- 3. Come usare NUCEIVA
- 4. Possibili effetti indesiderati
- 5. Come conservare NUCEIVA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è NUCEIVA e a cosa serve
NUCEIVA contiene il principio attivo tossina botulinica di tipo A.
Impedisce ai muscoli di contrarsi, portando a una paralisi temporanea. Agisce bloccando gli impulsi
nervosi ai muscoli in cui è stato iniettato.
NUCEIVA viene utilizzato per il miglioramento temporaneo nei casi di comparsa di rughe verticali tra
le sopracciglia. È utilizzato negli adulti di età inferiore a 65 anni in cui tali rughe facciali abbiano un
importante impatto psicologico.
2. Cosa deve sapere prima di usare NUCEIVA
Non usi NUCEIVA
- se è allergico alla tossina botulinica di tipo A o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6);
- se presenta miastenia gravis o sindrome di Eaton-Lambert (malattie croniche che colpiscono i muscoli);
- se presenta infezione o infiammazione nelle sedi di iniezione proposte tra le sopracciglia e sopra le sopracciglia (come illustrato nella Figura 1).
Avvertenze e precauzioni
Gli effetti indesiderati eventualmente correlati alla diffusione della tossina botulinica dalla sede di
iniezione (ad es. debolezza muscolare, difficoltà nella deglutizione o introduzione di cibo o liquidi
nelle vie respiratorie) possono verificarsi molto raramente. I pazienti cui vengono somministrate le
dosi raccomandate possono manifestare una debolezza muscolare eccessiva.
L’iniezione è risultata associata a dolore localizzato, infiammazione/gonfiore, sensibilità alterata
(parestesia), sensibilità ridotta (ipoestesia), dolorabilità, eruzione cutanea (eritema), infezione
localizzata, sanguinamento e/o lividi. Il dolore e/o l’ansia correlati all’ago hanno determinato risposte
vasovagali quali pallore, nausea, sudorazione, visione offuscata, battito cardiaco accelerato,
stordimento mentale e/o un calo temporaneo della pressione sanguigna causa di capogiri o svenimento.
Si rivolga immediatamente al medico se dopo il trattamento le risulta difficile deglutire, parlare o
respirare.
- Questo medicinale non è raccomandato nei pazienti che, recentemente o in passato, hanno avuto problemi di deglutizione (disfagia) e respirazione che secondo il parere del medico, precluderebbero la somministrazione sicura del prodotto.
- Una somministrazione troppo frequente o eccessiva può determinare la formazione di anticorpi, che può impedire alla tossina botulinica di tipo A di agire anche per altri usi. Per evitare che ciò avvenga, è necessario attendere almeno tre mesi tra una dose e l’altra.
- Molto raramente può verificarsi una reazione allergica in seguito all’iniezione di tossina botulinica. I sintomi possono includere reazioni cutanee, tra cui orticaria e prurito e pelle arrossata o pallida, gonfiore degli occhi, delle labbra, della bocca o della gola, un polso debole e accelerato, capogiri e respiro sibilante o affannoso.
- Dopo il trattamento può verificarsi un abbassamento della palpebra.
Informi il medico se:
- ha avuto problemi con precedenti iniezioni di tossina botulinica;
- non riscontra alcun miglioramento significativo delle rughe a un mese di distanza dal primo ciclo di trattamento;
- è affetto da determinate malattie del sistema nervoso (quali la sclerosi laterale amiotrofica o la neuropatia motoria);
- presenta infiammazione nella(e) sede(i) di iniezione proposta(e);
- i muscoli da iniettare sono deboli o atrofizzati;
- è affetto da un disturbo di sanguinamento, poiché l’iniezione può indurre lividi.
Bambini e adolescenti
L’uso di questo medicinale non è raccomandato in soggetti di età inferiore a 18 anni.
Altri medicinali e NUCEIVA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
L’uso della tossina botulinica non è raccomandato in associazione ad antibiotici aminoglicosidici,
spectinomicina o altri medicinali che interferiscono con gli impulsi nervosi al muscolo.
Informi il medico se le è stato recentemente iniettato un medicinale contenente tossina botulinica (il
principio attivo di NUCEIVA), poiché questo può aumentare eccessivamente l’effetto di questo
medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
L’uso di questo medicinale non è raccomandato durante la gravidanza e in donne in età fertile che non
usano misure contraccettive.
Questo medicinale non è raccomandato durante l’allattamento.
Guida di veicoli e utilizzo di macchinari
Debolezza muscolare, capogiro e disturbi visivi causati da questo medicinale possono rendere
pericolosi la guida e l’utilizzo di macchinari. Non guidare o utilizzare macchinari finché tali effetti non
siano scomparsi.
NUCEIVA contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, ovvero essenzialmente “privo
di sodio”.
3. Come usare NUCEIVA
Le dosi unitarie di NUCEIVA non sono intercambiabili con quelle utilizzate per altri preparati a base
di tossina botulinica.
Questo medicinale deve essere iniettato esclusivamente da medici con adeguate qualifiche ed
esperienza nel trattamento delle rughe glabellari al massimo livello di increspamento della fronte.
La dose abituale di NUCEIVA è di 20 unità. Verrà iniettato il volume raccomandato di 0,1 millilitri
(mL) (4 unità) di questo medicinale in ciascuna delle 5 sedi di iniezione.
Il miglioramento della gravità delle rughe tra le sopracciglia avviene generalmente entro pochi giorni
dal trattamento.
L’intervallo tra i trattamenti verrà deciso dal medico.
Come viene iniettato NUCEIVA
Questo medicinale viene iniettato nei muscoli (per via intramuscolare), direttamente nella zona
interessata sopra e tra le sopracciglia.
Una volta ricostituito, NUCEIVA deve essere usato esclusivamente per trattare un solo paziente, nel
corso di una singola seduta.
Se ha qualsiasi dubbio sull’uso di questo medicinale consulti il medico o il farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
In generale, gli effetti indesiderati si verificano nei primi giorni successivi all’iniezione e sono
temporanei. La maggior parte degli effetti indesiderati è di gravità da lieve a moderata.
In caso di difficoltà a respirare, deglutire o parlare dopo la somministrazione di questo medicinale,
contatti immediatamente il medico.
In caso di orticaria, gonfiore, compreso quello del viso o della gola, respiro sibilante, sensazione di
svenimento e respiro corto, contatti immediatamente il medico, perché possono essere sintomi di una
reazione allergica.
La possibilità di manifestare un effetto indesiderato è descritta dalle seguenti categorie:
| g Comune A (può riguardare fino a 1 persona su 10) | Mal di testa, squilibrio muscolare con conseguente innalzamento o asimmetria delle sopracciglia, abbassamento delle palpebre, lividi nella sede di iniezione |
| Non comune (può riguardare fino a 1 persona su 100) | Disturbo sensoriale, fastidio al capo, occhi secchi, palpebre gonfie, occhi gonfi, contrazioni muscolari, sede di iniezione: arrossamento, dolore, formicolio o c |
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’allegato V. Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare NUCEIVA
Conservare in frigorifero (2 C – 8 C).
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Flaconcino integro
Non usi questo medicinale dopo la data di scadenza che è riportata sul flaconcino e sulla scatola dopo
Scad.
6. Contenuto della confezione e altre informazioni
Cosa contiene NUCEIVA
- Il principio attivo è: 100 unità di tossina botulinica di tipo A.
- Gli eccipienti sono albumina umana e sodio cloruro.
Descrizione dell’aspetto di NUCEIVA e contenuto della confezione
NUCEIVA si presenta sotto forma di polvere bianca per soluzione iniettabile in un flaconcino di vetro
trasparente.
Ogni confezione contiene 1 flaconcino.
Titolare e produttore dell’autorizzazione all’immissione in commercio
Evolus Pharma B.V.
Apollolaan 151
1077 AR Amsterdam
Paesi Bassi
Per ulteriori informazioni su questo medicinale, contatti il titolare dell’autorizzazione all’immissione
in commercio.
------------------------------------------------------------------------------------------------------------------------
LE INFORMAZIONI SEGUENTI SONO DESTINATE ESCLUSIVAMENTE AGLI OPERATORI
SANITARI:
Le unità di tossina botulinica non sono intercambiabili da un prodotto all’altro. Le dosi raccomandate
in unità sono diverse da altri preparati a base di tossina botulinica.
La ricostituzione deve essere eseguita secondo la buona pratica clinica, in particolare per quanto
riguarda la tecnica asettica. NUCEIVA viene ricostituito con soluzione iniettabile di sodio cloruro
9 mg/mL (0,9 %). Vengono prelevati in una siringa 2,5 mL di soluzione iniettabile di sodio cloruro
9 mg/mL (0,9 %) per ottenere una soluzione iniettabile ricostituita ad una concentrazione di
4 unità/0,1 mL.
Quantità di solvente aggiunto a un flaconcino da 100 unità
[soluzione iniettabile di sodio cloruro 9 mg/mL (0,9 %)]
Dose risultante
(Unità per 0,1 mL)
2,5 mL 4,0 U
La parte centrale del tappo in gomma deve essere pulita con alcool. Iniettare lentamente il diluente nel
flaconcino con un ago attraverso il tappo in gomma e ruotare delicatamente il flaconcino, evitando la
formazione di bolle. Il flaconcino deve essere eliminato se il vuoto non aspira il diluente all’interno
del flaconcino stesso. Una volta ricostituita, la soluzione iniettabile deve essere ispezionata
visivamente prima dell’uso per verificare che risulti limpida, incolore e priva di particolato.
NUCEIVA ricostituito (100 unità/2,5 mL) viene iniettato con un ago sterile da 30 gauge. Vengono
somministrate quattro unità (4 U/0,1 mL) in ciascuna delle 5 sedi di iniezione (vedere figura 1): 2
iniezioni in ciascun muscolo corrugatore (profilo mediale inferiore e mediale superiore) e 1 iniezione
nel muscolo procero per una dose totale di 20 unità.
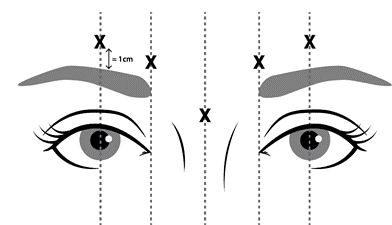
Al fine di ridurre le complicanze della ptosi palpebrale, è necessario adottare le seguenti misure:
- evitare l’iniezione in prossimità del muscolo elevatore della palpebra superiore, in particolare nei pazienti con complessi del depressore del sopracciglio più ampi;
- eseguire le iniezioni nel muscolo corrugatore laterale almeno 1 cm sopra la cresta ossea sopraorbitale;
- assicurarsi che il volume/la dose iniettato/a sia accurato/a e, ove possibile, mantenuto/a al minimo.
Procedura da seguire per uno smaltimento sicuro di flaconcini, siringhe e materiali utilizzati
Immediatamente dopo l’uso, la soluzione iniettabile di NUCEIVA ricostituita non utilizzata rimasta
nel flaconcino e/o nella siringa deve essere inattivata, prima dello smaltimento, con 2 mL di soluzione
diluita di sodio ipoclorito 0,5 % o 1 %. A seguito dell’inattivazione, smaltire in conformità alla
normativa locale vigente.
I flaconcini, le siringhe e i materiali utilizzati non devono essere svuotati e vanno eliminati in appositi
contenitori e smaltiti in conformità alla normativa locale vigente.
Raccomandazioni in caso di incidente durante la manipolazione della tossina botulinica
In caso di incidente durante la manipolazione del prodotto, sia in stato essiccato sottovuoto o
ricostituito, devono essere immediatamente adottate le misure adeguate descritte di seguito.
- La tossina è molto sensibile al calore e ad alcuni agenti chimici.
- Eventuali perdite devono essere eliminate: utilizzare un materiale assorbente imbevuto in una soluzione di sodio ipoclorito (soluzione di candeggina) nel caso di prodotto essiccato sottovuoto o un materiale assorbente asciutto nel caso di prodotto ricostituito.
- Le superfici contaminate devono essere pulite con un materiale assorbente imbevuto in una soluzione di sodio ipoclorito (soluzione di candeggina) e quindi asciugate.
- In caso di rottura di un flaconcino, raccogliere accuratamente i pezzi di vetro e asciugare il prodotto come sopra indicato, evitando tagli sulla pelle.
- In caso di schizzi, lavare con una soluzione di ipoclorito di sodio e sciacquare accuratamente con acqua abbondante.
- In caso di schizzi negli occhi, sciacquare accuratamente gli occhi con acqua abbondante o con una soluzione per il lavaggio oculare.
- Se la persona che pratica l’iniezione si ferisce (si taglia, si punge), procedere come sopra e adottare le adeguate misure mediche, in funzione della dose iniettata.
Le presenti istruzioni per l’uso, la manipolazione e lo smaltimento devono essere rigorosamente
seguite.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a NUCEIVAForma farmaceutica: Soluzione iniettabile, 200 UNITA' SPEYWOOD/MLPrincipio attivo: botulinum toxinProduttore: IPSEN PHARMAPrescrizione richiestaForma farmaceutica: Polvere per soluzione iniettabile, 125 UNITA SPEYWOODPrincipio attivo: botulinum toxinProduttore: IPSEN PHARMAPrescrizione richiestaForma farmaceutica: Polvere per sospensione iniettabile, 50 UNITA'Principio attivo: botulinum toxinProduttore: MERZ PHARMACEUTICALS GMBHPrescrizione non richiesta
Medici online per NUCEIVA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di NUCEIVA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














