
RIXUBIS


Come usare RIXUBIS
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
RIXUBIS 250 UI polvere e solvente per soluzione iniettabile, 500 UI polvere e solvente per soluzione iniettabile, 1000 UI polvere e solvente per soluzione iniettabile, 2000 UI polvere e solvente per soluzione iniettabile, 3000 UI polvere e solvente per soluzione iniettabile
nonacog gamma (fattore IX della coagulazione umano ricombinante)
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Che cos’è RIXUBIS e cosa serve
- 2. Cosa deve sapere prima di usare RIXUBIS
- 3. Come usare RIXUBIS
- 4. Possibili effetti indesiderati
- 5. Come conservare RIXUBIS
- 6. Contenuto della confezione e altre informazioni
1. Che cos’è RIXUBIS e a cosa serve
RIXUBIS contiene il principio attivo nonacog gamma ed è un fattore IX della coagulazione. Il fattore
IX è un normale componente del sangue umano necessario per un'efficace coagulazione sanguigna.
RIXUBIS viene utilizzato in pazienti affetti da emofilia B (malattia di Christmas, un disturbo
ereditario della coagulazione causato da una mancanza di fattore IX). Agisce da sostitutivo del fattore
IX mancante per permettere al sangue del paziente di coagulare.
RIXUBIS viene utilizzato per il trattamento e la prevenzione del sanguinamento in pazienti affetti da
emofilia B di tutte le fasce di età.
2. Cosa deve sapere prima di usare RIXUBIS
Non usi RIXUBIS
- se è allergico a nonacog gamma o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6)
- se è allergico alle proteine di criceto
Avvertenze e precauzioni
Con RIXUBIS sono possibili reazioni da ipersensibilità di tipo allergico. Interrompa l’infusione e si
rivolga immediatamente al medico o a un reparto di pronto soccorso se manifesta segni precoci di
reazioni da ipersensibilità/allergiche come orticaria, eruzione cutanea, sensazione di costrizione al
torace, sibilo, pressione del sangue bassa o anafilassi (grave reazione allergica che può causare
difficoltà a deglutire e/o a respirare, arrossamento o gonfiore del viso e/o delle mani). Il medico
potrebbe doverla trattare tempestivamente per queste reazioni. Il medico potrebbe anche eseguire un
esame del sangue per controllare se lei ha sviluppato anticorpi che neutralizzano l’attività (inibitori) di
questo medicinale perché con gli inibitori si possono sviluppare allergie. I pazienti con inibitori
di fattore IX possono essere a maggior rischio di anafilassi durante il trattamento futuro con il
fattore IX.
Si rivolga immediatamente al medico se il sanguinamento non si arresta come previsto o se è
necessaria una quantità significativamente maggiore di RIXUBIS per controllare un sanguinamento.
Il medico eseguirà un esame del sangue per controllare se lei ha sviluppato anticorpi che neutralizzano
l’attività (inibitori) di RIXUBIS. Il rischio di sviluppare inibitori è massimo nei pazienti che non sono
stati trattati in passato con un medicinale sostitutivo del fattore IX oppure nelle fasi iniziali del
trattamento, ovvero nei bambini piccoli.
La produzione di fattore IX nell’organismo è controllata dal gene del fattore IX. I pazienti che
presentano mutazioni specifiche del gene del fattore IX, come una delezione maggiore, possono avere
una probabilità più elevata di sviluppare inibitori del fattore IX e una reazione allergica nel periodo
iniziale di somministrazione di qualsiasi concentrato di fattore IX. Pertanto, se è nota la presenza di
tale mutazione, il medico eseguirà un monitoraggio più attento per individuare i segni di una reazione
allergica.
Se soffre di una malattia del fegato o del cuore oppure se ha recentemente subito un intervento
chirurgico maggiore, informi il medico perché vi è un rischio più elevato di complicazioni della
coagulazione del sangue.
Sono stati segnalati disturbi ai reni (sindrome nefrosica) dopo dosi elevate di fattore IX in pazienti
affetti da emofilia B con inibitori del fattore IX e anamnesi di reazioni allergiche.
Quando possibile, registrare (ad es. sull’agenda) il nome e il numero di lotto del prodotto ogni volta
che si utilizza RIXUBIS, allo scopo di tenere traccia dei prodotti e dei lotti di prodotto utilizzati.
Altri medicinali e RIXUBIS
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale. Non sono note interazioni di RIXUBIS con altri medicinali.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale. L’emofilia B si manifesta
molto raramente nelle donne.
Guida di veicoli e utilizzo di macchinari
RIXUBIS non altera la capacità di guidare veicoli e di usare macchinari.
RIXUBIS contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per flaconcino, cioè è essenzialmente
“senza sodio”. Tuttavia, a seconda del suo peso corporeo e della sua dose di RIXUBIS, potrebbe
ricevere più di un flaconcino. Ciò deve essere tenuto in considerazione se sta seguendo una dieta a
tenore di sodio controllato.
3. Come usare RIXUBIS
Il trattamento con RIXUBIS deve essere iniziato da un medico con esperienza nella cura dei pazienti
affetti da emofilia B.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico.
Spetterà al medico decidere la dose di RIXUBIS che le verrà somministrata. La dose e la durata
dipenderanno dalla gravità del deficit di fattore IX, dalla sede e dall’entità del sanguinamento, dalle
sue condizioni cliniche, dall’età e dalla velocità con cui il suo organismo utilizza il fattore IX, che
dovrà essere controllata regolarmente.
RIXUBIS deve essere somministrato dal medico o dall’infermiere per infusione endovenosa (EV)
dopo la ricostituzione della polvere con il solvente in dotazione. RIXUBIS può essere somministrato
per iniezione anche da lei o da un’altra persona, ma solo dopo aver ricevuto un opportuno
addestramento.
Ricostituzione e somministrazione
- Per la ricostituzione, utilizzare solo il solvente e il dispositivo di ricostituzione (BAXJECT II) in dotazione nella confezione.
- Per la somministrazione è necessario l’uso di una siringa luer-lock.
- Non utilizzare se il dispositivo BAXJECT II, la sua barriera sterile o la sua confezione sono danneggiati o mostrano segni di deterioramento.
Ricostituzione
Adottare una tecnica asettica
- 1. Se il prodotto è conservato in frigorifero portare entrambi i flaconcini di polvere e di solvente di RIXUBIS fuori dal frigorifero e tenerli a temperatura ambiente (tra 15 °C-30 °C).
- 2. Lavarsi accuratamente le mani usando sapone e acqua calda.
- 3. Togliere i tappi dai flaconcini di polvere e di solvente.
- 4. Pulire i tappi con batuffoli imbevuti di alcool. Porre i flaconcini su una superficie piana e pulita.
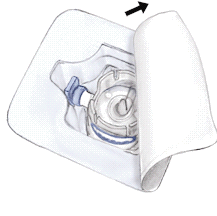
- 5. Aprire la confezione del dispositivo BAXJECT II togliendo la parte superiore senza toccare la superficie interna (Fig. a). Non estrarre il dispositivo dalla confezione.
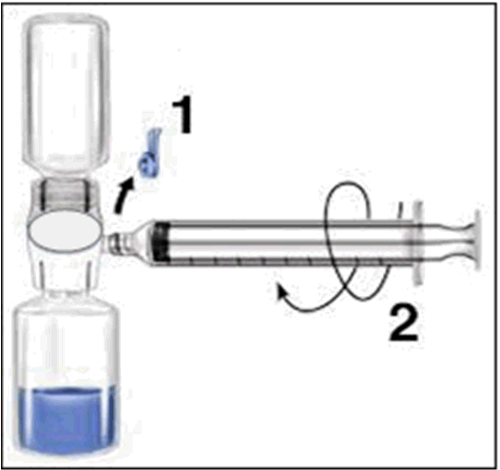
- 6. Capovolgere la confezione e inserire la punta di plastica trasparente attraverso il tappo del solvente. Afferrare la confezione e tirarla via da BAXJECT II (Fig. b). Non togliere il tappo blu dal dispositivo BAXJECT II.
- 7. Con BAXJECT II collegato al flaconcino del solvente, capovolgere il sistema il modo che il flaconcino del solvente si trovi al di sopra del dispositivo. Inserire la punta di plastica bianca attraverso il tappo di RIXUBIS. Il vuoto aspirerà il solvente nel flaconcino di RIXUBIS (Fig. c).
- 8. Agitare delicatamente fino al discioglimento della sostanza. Il prodotto di discioglie rapidamente (entro 2 minuti). Assicurarsi che la polvere di RIXUBIS sia disciolta completamente, altrimenti non tutta la soluzione ricostituita passerà attraverso il filtro del dispositivo. I medicinali ricostituiti devono essere ispezionati prima della somministrazione, allo scopo di rilevare la presenza di eventuale particolato e cambiamento di colore. La soluzione deve essere limpida o leggermente opalescente. Non usare soluzioni torbide o con depositi.
Fig. aFig. bFig. c



Non refrigerare la preparazione dopo la ricostituzione.
Usare immediatamente.
Somministrazione
Adottare una tecnica asettica
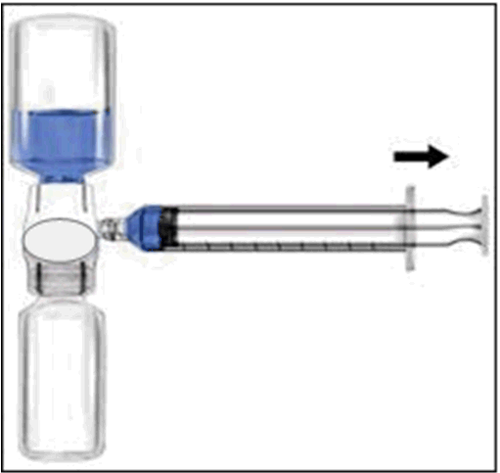
- 1. Togliere il tappo blu dal dispositivo BAXJECT II. Non aspirare aria nella siringa. Collegare la siringa al dispositivo BAXJECT II (Fig. d).
- 2. Capovolgere il sistema (il flaconcino con la soluzione ricostituita deve trovarsi sopra). Aspirare la soluzione ricostituita nella siringa tirando lentamente indietro lo stantuffo (Fig. e).
- 3. Scollegare la siringa.
- 4. Collegare un ago a farfalla alla siringa. Iniettare per via endovenosa. La soluzione deve essere somministrata lentamente, a una velocità determinata dal livello di comfort del paziente, senza superare i 10 ml al minuto.
Fig. dFig. e
Quando possibile, registrare (ad es. sull’agenda) il nome e il numero di lotto del prodotto ogni volta
che si utilizza RIXUBIS, allo scopo di tenere traccia dei prodotti e dei lotti di prodotto utilizzati.
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
Se usa più RIXUBIS di quanto deve
Usi RIXUBIS seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
Se ha iniettato più RIXUBIS della quantità raccomandata, contatti il medico appena possibile.
Se dimentica di usare RIXUBIS
Non inietti una dose doppia per compensare la dimenticanza della dose. Proceda con l’iniezione
successiva programmata e continui secondo le istruzioni del medico.
Se interrompe il trattamento con RIXUBIS
Non interrompa l’uso di RIXUBIS senza consultarsi con il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Con RIXUBIS sono possibili reazioni da ipersensibilità di tipo allergico. Queste reazioni possono
comprendere sensazioni di bruciore e irritazione in sede di infusione, brividi, vampate, letargia,
irrequietezza, formicolio, orticaria, prurito ed eruzione cutanea, pressione del sangue bassa, battito
cardiaco accelerato, sensazione di costrizione al torace, sibilo, gonfiore della gola, anafilassi (reazione
allergica grave), mal di testa, nausea e vomito. Se manifesta questi segni, si rivolga immediatamente al
medico. Il medico potrebbe doverla trattare tempestivamente per queste reazioni (vedere
paragrafo 2 ‘Avvertenze e precauzioni’).
Con RIXUBIS sono stati osservati i seguenti effetti indesiderati:
Effetti indesiderati comuni(possono interessare fino a 1 paziente su 10):
- alterazione del gusto
- dolore agli arti.
Effetti indesiderati con frequenza non nota(la frequenza non può essere definita sulla base dei dati
disponibili)
- reazioni allergiche (ipersensibilità).
Con questo medicinale non sono stati riscontrati problemi legati a una coagulazione eccessiva del
sangue (episodi tromboembolici), che possono però verificarsi con qualsiasi prodotto contenente
fattore IX. Questi problemi possono comprendere attacco cardiaco, formazione di coaguli di sangue
nelle vene o nei polmoni.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite
il sistema nazionale di segnalazione riportato nell ’allegato V. Segnalando gli effetti indesiderati lei
può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare RIXUBIS
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola esterna e sull’etichetta
del flaconcino dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero a temperatura inferiore a 30 °C.
Non congelare.
Usare la soluzione ricostituita immediatamente.
Non usi RIXUBIS se la soluzione non è limpida e incolore.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene RIXUBIS
- Il principio attivo è nonacog gamma (fattore IX della coagulazione umano ricombinante). Ciascun flaconcino di polvere contiene nominalmente 250, 500, 1000, 2000 o 3000 UI, corrispondenti a una concentrazione di 50, 100, 200, 400 o 600 UI/ml dopo la ricostituzione con 5 ml di solvente.
- Gli altri componenti della polvere sono saccarosio, mannitolo, cloruro di sodio, cloruro di calcio, L-istidina, polisorbato 80.
Flaconcino del solvente: 5 ml di acqua sterilizzata per preparazioni iniettabili.
Descrizione dell’aspetto di RIXUBIS e contenuto della confezione
RIXUBIS è fornito come polvere e solvente per soluzione iniettabile.
Il contenuto della confezione è:
- un flaconcino di RIXUBIS 250, 500, 1000, 2000 o 3000 UI polvere, flaconcino di vetro con tappo di gomma
- un flaconcino di 5 ml di acqua sterilizzata per preparazioni iniettabili, flaconcino di vetro con tappo di gomma
- un dispositivo BAXJECT II (dispositivo di ricostituzione senz’ago)
Titolare dell’autorizzazione all’immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Vienna
Austria
Produttore:
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentate locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel: +356 21419070
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España S.A
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Τakeda ΕΛΛΑΣ Α.Ε.
Τηλ: +30 210 6387800
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali: http://www.ema.europa.eu/.
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Monitoraggio del trattamento
Nel corso del trattamento, si consiglia di effettuare un'appropriata determinazione dei livelli di fattore
IX per stabilire la dose da somministrare e la frequenza delle infusioni. La risposta di ciascun paziente
al fattore IX è variabile, potendo presentare emivite e livelli di recupero diversi. La dose definita in
base al peso corporeo potrebbe necessitare di aggiustamenti in pazienti sottopeso o sovrappeso. In
particolare in caso di interventi chirurgici maggiori, è indispensabile condurre un accurato
monitoraggio della terapia sostitutiva attraverso analisi della coagulazione (attività del fattore IX del
plasma).
Per assicurare che sia stato raggiunto il livello desiderato di attività plasmatica del fattore IX , è
consigliato un attento monitoraggio utilizzando un test di attività del fattore IX appropriato; se
necessario, opportuni aggiustamenti della dose e della frequenza delle infusioni devono essere
effettuati . Quando si utilizza un test di coagulazione a uno step in vitrobasato sul tempo di
tromboplastina (aPTT) per la determinazione dell'attività del fattore IX nei campioni di sangue del
paziente, i risultati di tale attività possono essere influenzati in modo significativo sia dal tipo di
reagente per aPTT sia dagli standard di riferimento utilizzati nel test stesso. Ciò risulta essere di
particolare importanza quando si cambia laboratorio e/o i reagenti utilizzati nel test.
Posologia
Dose e durata della terapia sostitutiva dipendono dalla gravità del deficit di fattore IX, dalla sede e
dall’entità del sanguinamento, dalle condizioni cliniche del paziente, dall’età e dai parametri
farmacocinetici di fattore IX, quali il recupero incrementale e l’emivita.
Il numero di unità di fattore IX somministrate viene espresso in Unità Internazionali (UI), riferite allo
standard attuale dell’OMS per i prodotti contenenti fattore IX. L’attività plasmatica del fattore IX è
espressa sia in percentuale (riferita al plasma umano normale) sia in Unità Internazionali (riferite allo
standard internazionale per il fattore IX plasmatico).
Una Unità Internazionale di attività del fattore IX è equivalente alla quantità di fattore IX contenuta in
un ml di plasma umano normale.
Popolazione adulta
Trattamento al bisogno:
Il calcolo della dose necessaria di fattore IX si basa sulla considerazione empirica che prevede
che 1 Unità Internazionale di fattore IX per kg di peso corporeo aumenti l’attività plasmatica di fattore
IX di 0,9 UI/dl (intervallo da 0,5 a 1,4 UI/dl) o 0,9% dell’attività normale in pazienti di età pari e
superiore ai 12 anni (per ulteriori informazioni vedere paragrafo 5.2).
La dose necessaria è determinata per mezzo della seguente formula:
Unità
necessarie
= peso corporeo (kg) x aumento desiderato
del fattore IX
(%) o (UI/dl)
x reciproco del
recupero osservato (dl/kg)
Per un recupero incrementale di 0,9 UI/dl per UI/kg, la dose viene calcolata come segue:
Unità
necessarie
= peso corporeo (kg) x aumento desiderato
del fattore IX
(%) o (UI/dl)
x 1,1 dl/kg
La quantità da somministrare e la frequenza di somministrazione devono essere sempre stabilite
in base all’efficacia clinica del singolo caso.
Nell’eventualità dei seguenti eventi emorragici, l’attività del fattore IX non deve scendere al di sotto
del livello di attività plasmatica determinato (in % del valore normale o in UI/dl) nel periodo
corrispondente. La seguente tabella può essere utilizzata come riferimento per il dosaggio negli
episodi di sanguinamento e in chirurgia:
| Grado di emorragia/Tipo di procedura chirurgica | Livello di fattore IX necessario (%) o (UI/dl) | c Frequenza delle dosi (ore)/Durata della terapia (giorni) |
| Emorragia Emartrosi precoce, sanguinamento muscolare o del cavo orale Emartrosi più estesa, sanguinamento muscolare o ematoma Emorragie potenzialmente letali. |
| a m Ripetere ogni 24 ore. Almeno 1 giorno, fino alla risoluzione dell’episodio di sanguinamento indicato dal dolore o al r raggiungimento della guarigione. a Ripetere l’infusione ogni 24 ore per F
|
| Intervento chirurgico Intervento chirurgico minore, compresa estrazione dentaria | d
| e Ogni 24 ore, almeno 1 giorno, fino al raggiungimento della guarigione. |
| Intervento chirurgico maggiore | a n
| Ripetere l’infusione ogni 8 - 24 ore fino a un’adeguata guarigione della ferita, quindi proseguire la terapia per almeno altri 7 giorni per mantenere un’attività del fattore IX del 30% - 60% (UI/dl). |
Un attento monitoraggio della terapia sostitutiva è particolarmente importante nei casi di intervento
chirurgico maggiore o di emorragie potenzialmente letali.
Profilassi
Per la profilassi a lungo termine del sanguinamento in pazienti affetti da emofilia B grave, le dosi
abituali sono di 40 - 60 UI di fattore IX per chilogrammo di peso corporeo a intervalli di 3 - 4 giorni
per pazienti di età pari e superiore ai 12 anni. In alcuni casi, a seconda della farmacocinetica, dell’età,
del fenotipo di sanguinamento e del livello di attività fisica del singolo paziente, potrebbero essere
necessari intervalli di somministrazione più brevi o dosi più elevate.
Infusione continua
Non somministrare RIXUBIS mediante infusione continua.
Popolazione pediatrica
Pazienti dai 12 ai 17 anni di età:
La posologia è la stessa per gli adulti e per la popolazione pediatrica dai 12 ai 17 anni di età.
Pazienti di età inferiore ai 12 anni:
Trattamento al bisogno
Il calcolo della dose necessaria di fattore IX si basa sulla considerazione empirica che prevede
che 1 Unità Internazionale (UI) di fattore IX per kg di peso corporeo aumenti l’attività plasmatica del
fattore IX di 0,7 UI/dl (intervallo da 0,31 a 1,0 UI/dl) o 0,7% dell’attività normale in pazienti di età
inferiore ai 12 anni (per ulteriori informazioni vedere paragrafo 5.2).
La dose necessaria è determinata per mezzo della seguente formula:
Pazienti di età inferiore ai 12 anni:
Unità
necessarie
= peso corporeo (kg) x aumento desiderato
del fattore IX
(%) o (UI/dl)
x reciproco del
recupero osservato (dl/kg)
Per un recupero incrementale di 0,7 UI/dl per UI/kg, la dose viene calcolata come segue:
Unità
necessarie
= peso corporeo (kg) x aumento desiderato
del fattore IX
(%) o (UI/dl)
x 1,4 dl/kg
Come riferimento per il dosaggio negli episodi di sanguinamento e in chirurgia può essere utilizzata la
stessa tabella degli adulti (vedere sopra).
Profilassi:
La dose raccomandata per i pazienti pediatrici di età inferiore ai 12 anni è compresa tra 40 e 80 UI/kg
a intervalli di 3 - 4 giorni. In alcuni casi, a seconda della farmacocinetica, dell’età, del fenotipo di
sanguinamento e del livello di attività fisica del singolo paziente, potrebbero essere necessari intervalli
di somministrazione più brevi o dosi più elevate.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a RIXUBISForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 500 U.I.Principio attivo: coagulation factor IXProduttore: KEDRION S.P.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 500 UI/10 MLPrincipio attivo: coagulation factor IXProduttore: GRIFOLS ITALIA S.P.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 IUPrincipio attivo: coagulation factor IXProduttore: SWEDISH ORPHAN BIOVITRUM AB (PUBL)Prescrizione richiesta
Medici online per RIXUBIS
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di RIXUBIS — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














