
TAKHZYRO

Come usare TAKHZYRO
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
TAKHZYRO 150 mg soluzione iniettabile in siringa preriempita
lanadelumab
Legga attentamente questo foglio prima di dare al bambino questo medicinale perché contiene
importanti informazioni.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico del bambino, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per suo figlio o il bambino che lei assiste. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali a quelli di suo figlio o del bambino che lei assiste, perché potrebbe essere pericoloso.
- Se il bambino manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al suo medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TAKHZYRO e a cosa serve
- 2. Cosa deve sapere prima di usare TAKHZYRO
- 3. Come usare TAKHZYRO
- 4. Possibili effetti indesiderati
- 5. Come conservare TAKHZYRO
- 6. Contenuto della confezione e altre informazioni
- 7. Istruzioni per l’uso
1. Cos’è TAKHZYRO e a cosa serve
TAKHZYRO contiene il principio attivo lanadelumab.
A cosa serve TAKHZYRO
TAKHZYRO 150 mg è un medicinale utilizzato nei pazienti a partire da 2 anni di età e di peso
inferiore a 40 kg per prevenire attacchi di angioedema, in pazienti con angioedema ereditario (HAE).
Cos’è l’angioedema ereditario (HAE)
L’HAE è una patologia che è presente in alcune famiglie. Con questa patologia il sangue dei pazienti
non ha una quantità sufficiente di una proteina chiamata “inibitore C1”, o l’inibitore C1 non funziona
correttamente. Questo porta alla presenza di troppa “callicreina plasmatica”, che a sua volta produce
livelli più elevati di “bradichinina” nel sangue. Una quantità eccessiva di bradichinina porta a sintomi
di HAE come gonfiore e dolore a:
- mani e piedi;
- viso, palpebre, labbra o lingua;
- laringe, che può rendere difficoltosa la respirazione;
- genitali.
Come funziona TAKHZYRO
TAKHZYRO è un tipo di proteina che blocca l’attività della callicreina plasmatica. Questo aiuta a
ridurre la quantità di bradichinina nel sangue e previene i sintomi dell’HAE.
2. Cosa deve sapere prima di usare TAKHZYRO
Non usi TAKHZYRO
Se suo figlio o il bambino che lei assiste è allergico a lanadelumab o ad uno qualsiasi degli altri
componenti di questo medicinale (elencati al paragrafo 6).
Avvertenze e precauzioni
- Si rivolga al medico del bambino, al farmacista o all’infermiere prima di usare TAKHZYRO.
- Se il bambino ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea, senso di oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamenteil medico del bambino, il farmacista o l’infermiere .
Tenere un registro
Si raccomanda vivamente di annotare il nome e il numero di lotto del medicinale ogni volta che il
bambino assume una dose di TAKHZYRO. Questo serve a tenere una registrazione dei lotti utilizzati.
Esami di laboratorio
Informi il medico del bambino se sta assumendo TAKHZYRO prima di eseguire esami di laboratorio
per misurare quanto bene avvenga la coagulazione del sangue. Questo perché TAKHZYRO nel sangue
può interferire con alcuni esami di laboratorio, generando risultati inaccurati.
Bambini
TAKHZYRO non è raccomandato per l’uso nei bambini sotto i 2 anni di età. Questo perché non è
stato studiato in questa fascia di età.
Altri medicinali e TAKHZYRO
Informi il medico del bambino o il farmacista se il bambino sta assumendo, ha recentemente assunto o
potrebbe assumere qualsiasi altro medicinale.
Non è noto se TAKHZYRO abbia influenza su altri medicinali o sia influenzato da altri medicinali.
Gravidanza e allattamento
Se la paziente è in gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con
latte materno, chieda consiglio al suo medico o al farmacista prima di iniziare a usare TAKHZYRO.
Esistono informazioni limitate sulla sicurezza dell’uso di TAKHZYRO durante la gravidanza e
l’allattamento. Come misura precauzionale, è preferibile evitare l’uso di lanadelumab durante la
gravidanza e l’allattamento. Il medico discuterà con lei i rischi e i benefici derivanti dall’assunzione di
questo medicinale.
Guida di veicoli e utilizzo di macchinari
Questo medicinale non altera o altera in modo trascurabile la capacità di guidare veicoli e di utilizzare
macchinari.
TAKHZYRO contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per siringa preriempita, cioè
essenzialmente “senza sodio”.
3. Come usare TAKHZYRO
TAKHZYRO è fornito in siringhe preriempite monouso come soluzione pronta all’uso. Il trattamento
del bambino o del bambino che assiste verrà iniziato e gestito sotto la supervisione di un medico
esperto nel trattamento di pazienti con HAE.
Usi questo medicinale seguendo sempre esattamente quanto riportato in questo foglio o le istruzioni
del medico del bambino, del farmacista o dell’infermiere. Se ha dubbi oppure se ha qualche altra
domanda consulti il suo medico, il farmacista o l’infermiere.
Quanto TAKHZYRO usare
Per i bambini di età compresa tra 2 e meno di 12 anni, la dose raccomandata dipende dal peso
corporeo:
| Peso corporeo (kg) | Dose iniziale raccomandata | Adattamento della dose |
| Da 10 a meno di 20 kg | 150 mg di lanadelumab ogni 4 settimane | F In pazienti con controllo degli attacchi insufficiente, è possibile considerare un aumento di dose a l 150 mg di lanadelumab ogni 3 settimane |
| Da 20 a meno di 40 kg | e d 150 mg di lanadelumab ogni 2 settimane | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 150 mg di lanadelumab ogni 4 settimane |
| 40 kg o più | a n 300 mg di lanadelumab ogni 2 settimane a | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 300 mg di lanadelumab ogni 4 settimane |
- Per i pazienti con un peso corporeo compreso tra 20 e meno di 40 kg che non hanno avuto attacchi per un lungo periodo, il medico può consentire al bambino di continuare con la stessa dose al raggiungimento dei 12 anni di età.
Per adulti e adolescenti di età compresa tra 12 e meno di 18 anni con un peso corporeo inferiore a
40 kg:
La dose iniziale raccomandata è 300 mg di lanadelumab ogni 2 settimane. Se non ha attacchi
da un periodo lungo, il medico può modificare la dose a 300 mg di lanadelumab ogni
4 settimane, soprattutto se ha un peso corporeo basso.
- Nei pazienti con peso corporeo inferiore a 40 kg, può essere presa in considerazione anche una dose iniziale di 150 mg di lanadelumab ogni 2 settimane. Se non ha attacchi da un periodo lungo, il medico può modificare la dose a 150 mg di lanadelumab ogni 4 settimane.
Come iniettare TAKHZYRO
TAKHZYRO deve essere iniettato da un professionista sanitario o dalla persona che assiste il
paziente. La persona che assiste il paziente deve leggere attentamente e seguire le istruzioni nel
paragrafo 7, “Istruzioni per l’uso”.
- TAKHZYRO deve essere iniettato sotto la pelle (“iniezione sottocutanea”).
- L’iniezione può essere autosomministrata da un professionista sanitario o dalla persona che assiste il paziente.
- Un medico, un farmacista o un infermiere devono mostrarle come preparare e iniettare TAKHZYRO correttamente prima di usarlo per la prima volta. Non lo inietti finché non è stato adeguatamente formato per iniettare il medicinale.
- Inserisca l’ago nel tessuto adiposo nella pancia (addome), nella coscia o nella parte superiore del braccio.
- Inietti il medicinale ogni volta in una zona diversa.
- Utilizzi ciascuna siringa preriempita di TAKHZYRO una sola volta.
Se usa più TAKHZYRO di quanto deve
Informi il medico se al bambino è stato iniettato troppo TAKHZYRO o se la dose è stata
somministrata prima di quanto prescritto dal medico.
Se dimentica di usare TAKHZYRO
Se si dimentica una dose di TAKHZYRO, inietti la dose il più presto possibile. È possibile che sia
necessario modificare la dose raccomandata successiva in base alla frequenza di somministrazione
prevista per assicurarsi che trascorrano
- almeno 10 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 2 settimane,
- almeno 17 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 3 settimane,
- almeno 24 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 4 settimane.
Se non è sicuro di quando iniettare TAKHZYRO dopo una dose dimenticata, si rivolga al medico del
bambino, al farmacista o all’infermiere.
Se interrompe il trattamento con TAKHZYRO
La decisione di interrompere il trattamento con TAKHZYRO deve essere discussa con il medico del
bambino. I sintomi potrebbero ripresentarsi con l’interruzione del trattamento.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico del bambino, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Se il bambino ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea,
senso di oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamente
il suo medico, il farmacista o l’infermiere .
Informi il suo medico, il farmacista o l’infermiere se lei o il bambino notate uno dei seguenti effetti
indesiderati.
Molto comuni (possono interessare più di 1 persona su 10):
- Reazioni nella zona in cui viene praticata l’iniezione: i sintomi includono dolore, arrossamento della pelle, lividi, disagio, gonfiore, sanguinamento, prurito, indurimento della pelle, formicolio, calore ed eruzione cutanea.
Comuni (possono interessare fino a 1 persona su 10):
- Reazioni allergiche incluso prurito, fastidio e formicolio della lingua
- Vertigini, sensazione di svenimento
- Eritema con sollevamento della pelle
- Dolore muscolare
- Esami del sangue che mostrano variazioni al fegato
Segnalazione degli effetti indesiderati
Se suo figlio o il bambino che lei assiste manifesta un qualsiasi effetto indesiderato, compresi quelli
non elencati in questo foglio, si rivolga al suo medico, al farmacista o all’infermiere. Può inoltre
segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato
nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare TAKHZYRO
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta dopo EXP. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
TAKHZYRO 150 mg soluzione iniettabile in siringa preriempita
Conservare in frigorifero (2 °C – 8 °C). Non congelare. Tenere la siringa preriempita nell’imballaggio
esterno per proteggere il medicinale dalla luce.
Le siringhe preriempite possono essere conservate a una temperatura inferiore a 25 °C per un singolo
periodo di 14 giorni, ma non oltre la data di scadenza.
Non rimettere TAKHZYRO in frigorifero dopo averlo conservato a temperatura ambiente.
Dopo aver prelevato una siringa preriempita da una confezione multipla conservata in frigorifero,
riporre le siringhe preriempite rimanenti in frigorifero fino al successivo utilizzo quando necessario.
Non usi questo medicinale se nota segni di deterioramento come particelle nella siringa preriempita o
variazioni del colore della soluzione iniettabile.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TAKHZYRO
- Il principio attivo è lanadelumab. Ogni siringa preriempita contiene 150 mg di lanadelumab in 1 mL di soluzione.
- Gli eccipienti sono fosfato disodico diidrato, acido citrico monoidrato, istidina, cloruro di sodio, polisorbato 80 e acqua per preparazioni iniettabili - vedere paragrafo 2 “TAKHZYRO contiene sodio”.
Descrizione dell’aspetto di TAKHZYRO e contenuto della confezione
TAKHZYRO si presenta come una soluzione iniettabile trasparente, da incolore a leggermente gialla,
in una siringa preriempita.
TAKHZYRO è disponibile:
- in una confezione singola contenente una siringa preriempita da 1 mL in una scatola;
- in una confezione singola contenente due siringhe preriempite da 1 mL in una scatola;
- in confezioni multiple comprendenti 3 scatole, ogni scatola contenente due siringhe preriempite da 1 mL.
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Produttore
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
Irlanda
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: + 420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel: +356 21419070
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu/. Inoltre, sono riportati link ad altri siti web su malattie
rare e relativi trattamenti terapeutici.
Questo foglio è disponibile in tutte le lingue dell’Unione europea/dello Spazio economico europeo sul
sito web dell’Agenzia europea per i medicinali.
7. Istruzioni per l’uso
Si assicuri di leggere, capire e seguire le Istruzioni per l’uso prima di iniettare TAKHZYRO. Se ha
dubbi, si rivolga all’operatore sanitario.
Destinazione d'uso
La siringa preriempita di TAKHZYRO è un dispositivo per iniezione con ago, pronto all’uso,
monouso e a dose fissa (150 mg/1 mL), destinato alla somministrazione sottocutanea del farmaco da
parte di operatori sanitari o dalla persona che assiste il paziente. L’autosomministrazione non è
raccomandata nei pazienti pediatrici (da 2 a meno di 12 anni).
Conservazione di TAKHZYRO
- Conservare la siringa preriempita di TAKHZYRO in frigorifero da 2 °C a 8 °C. Noncongelare.
- La siringa preriempita rimossa dal frigorifero deve essere conservata a temperatura inferiore a 25 °C e utilizzata entro 14 giorni. Non rimettere TAKHZYRO in frigorifero dopo averlo conservato a temperatura ambiente.
- Dopo aver prelevato una siringa preriempita da una confezione multipla conservata in frigorifero, riporre le siringhe preriempite rimanenti in frigorifero fino al successivo utilizzo quando necessario.
- Conservare TAKHZYRO nella confezione originale per proteggere la siringa preriempita dalla luce.
- Gettare (smaltire) la siriga preriempita di TAKHZYRO se è stata tenuta fuori dal frigorifero, congelata o se non è stata conservata nella confezione originale al riparo dalla luce.
- Nonagitare TAKHZYRO.
Tenere TAKHZYRO e tutti i medicinali fuori dalla portata dei bambini.
Componenti della siringa preriempita di TAKHZYRO prima dell’uso (Figura A).
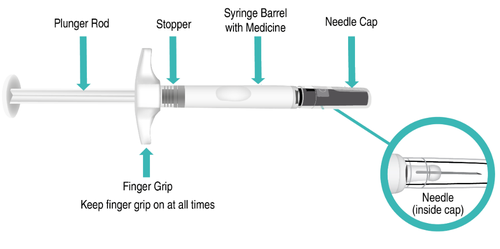
Figura A: Siringa preriempita di TAKHZYRO
Passaggio 1: Preparazione per l’iniezione
- a. Procurarsi un tampone imbevuto di alcool, un batuffolo di cotone/tampone di garza, un cerotto e un contenitore per oggetti taglienti ( Figura B) e posizionarli su una superficie pulita, piana e in un’area ben illuminata. Queste forniture non sono incluse nella confezione di TAKHZYRO.
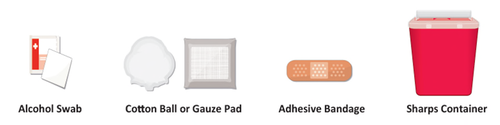
Figura B: Forniture
- b. Rimuovere la scatola della siringa preriempita di TAKHZYRO dal frigorifero 15 minuti prima di praticare l’iniezione.
- Nonusare se il sigillo sulla scatola è aperto o rotto.
- Il medicinale è sensibile alle alte temperature. Nonutilizzare fonti di calore come acqua calda o il microonde per riscaldare la siringa preriempita di TAKHZYRO. Attendere15minuti
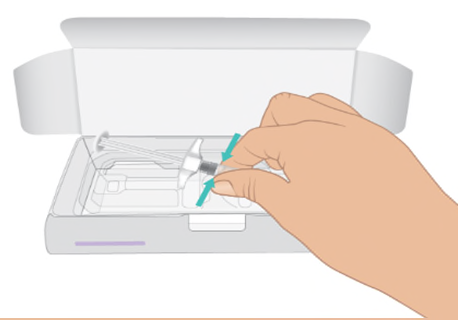
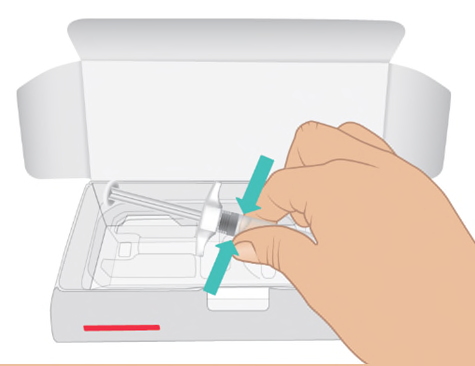
- c. Aprire la scatola. Afferrare il corpo della siringa e rimuovere la siringa preriempita di TAKHZYRO dall’apposito supporto ( Figura C).
- Nonrimuovere il cappuccio dell’ago fino a quando non si è pronti per eseguire l’iniezione.
- Nontoccare o spingere lo stantuffo fino a quando non si è pronti per eseguire l’iniezione.
Figura C: Rimuovere la siringa
preriempita
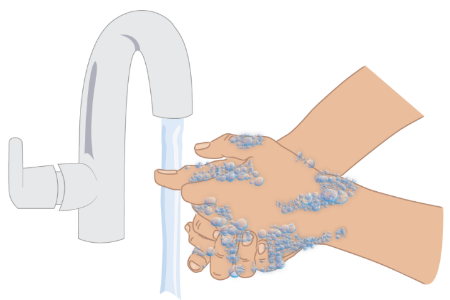
- d. Lavarsi le mani con acqua e sapone. ( Figura D). Asciugarsi completamente le mani.
- Nontoccare alcunasuperficie o parte del corpo dopo aver lavato le mani prima dell’iniezione.
Figura D: Lavarsi le mani
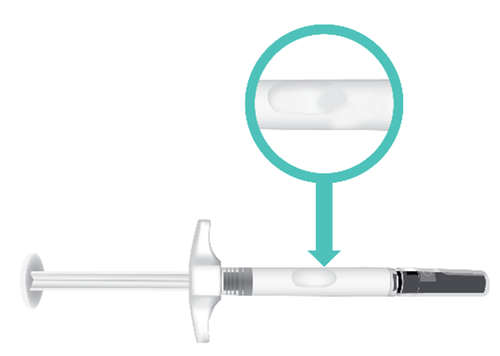
- e. Controllare la data di scadenza (EXP)sul corpo della siringa ( Figura E).
- Nonusare la siringa preriempita di TAKHZYRO se la data di scadenza è stata superata. Se la siringa preriempita di TAKHZYRO è scaduta, gettarla (smaltirla) in un contenitore per oggetti taglienti e contattare l’operatore sanitario.
Figura E: Posizione della data di scadenza
- f. Ispezionarela siringa preriempita di TAKHZYRO per escludere la presenza di danni. Il medicinale all’interno del corpo della siringa deve essere da incolore a leggermente giallo ( Figura F).
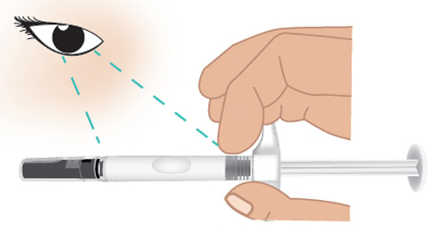
- Nonusare la siringa preriempita di TAKHZYRO se è danneggiata o presenta incrinature.
- Nonusare la siringa preriempita di TAKHZYRO se il medicinale è scolorito, torbido o contiene scaglie o particelle.
- Nella siringa preriempita di TAKHZYRO potrebbero essere visibili delle bolle d’aria. Questo è normale e non influirà sulla dose. Se non è possibile utilizzare la siringa preriempita, contattare l’operatore sanitario. Figura F: Ispezionare la siringa preriempita
Passaggio 2: Selezione e preparazione della sede di iniezione
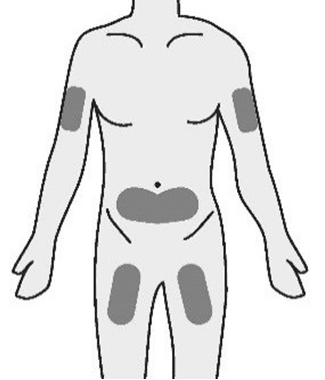
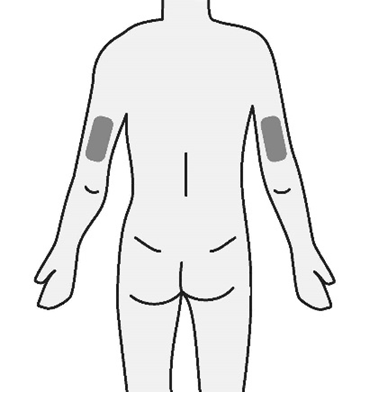
- a. TAKHZYRO deve essere iniettato da un operatore sanitario o dalla persona che assiste il paziente solo nelle seguenti sedi ( Figura G):
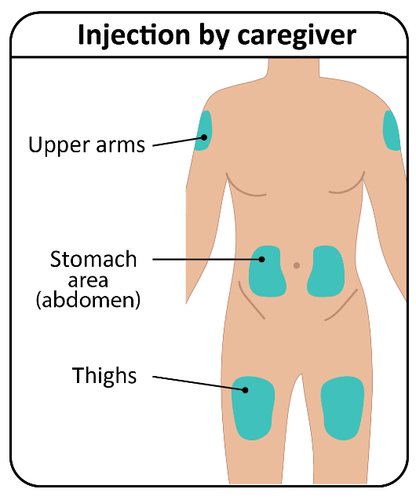
o parte alta del braccio
o stomaco (addome)
o coscia
- Noniniettare inun’area del corpo del bambino dove la pelle è irritata, arrossata, contusa o infetta.
- L’area scelta per l’iniezione deve essere ad almeno 5 cm di distanza da eventuali cicatrici o dall’ombelico del bambino. Importante:
Alternare le sedi di iniezioneper
mantenere la pelle sana. Ogni nuova
iniezione deve essere somministrata ad
almeno 3 cm dall’ultima sede utilizzata.
Figura G: Sedi di iniezione

- b. Pulire la sede di iniezione con una salviettina imbevuta di alcool e lasciare asciugare completamente ( Figura H).
- Nonsoffiare sulla sede pulita.
- Nontoccare di nuovo la sede pulita prima di eseguire l’iniezione.
Figura H: Pulire la sede di iniezione
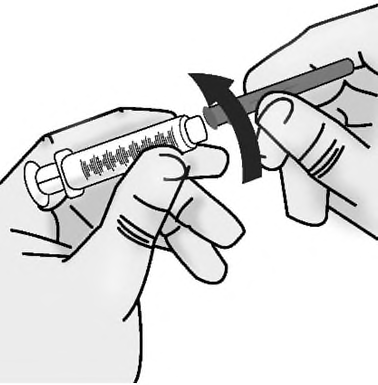
- c. Tenere saldamente la parte centrale della siringa preriempita di TAKHZYRO con una mano e con l’altra rimuovere delicatamente il cappuccio dell’ago diritto ( Figura I).
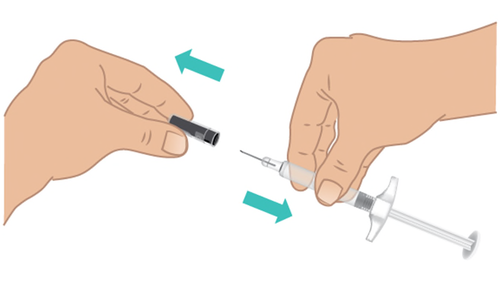
- Nontoccare o premere lo stantuffo fino a quando non si è pronti per eseguire l’iniezione.
- Nonusare la siringa preriempita di TAKHZYRO se è stata fatta cadere senza il cappuccio dell’ago.
- Nonutilizzare la siringa preriempita di TAKHZYRO se l’ago appare danneggiato o piegato.
- Nontoccare l’ago né lasciare che tocchi altre superfici. Potrebbero essere visibili delle bolle d’aria. Questo è normale, nontentare di rimuoverle. Figura I: Rimuovere il cappuccio dell’ago
- d. Gettare il cappuccio dell’ago nei rifiuti domestici o nel contenitore per oggetti taglienti.
- Nonriapplicare il cappuccio sull’ago per evitare ferite da puntura d’ago.
Passaggio 3: Iniettare TAKHZYRO
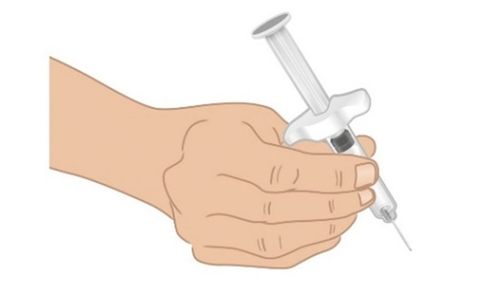
- a. Prendere la siringa preriempita di TAKHZYRO con una mano come una matita ( Figura J). Evitare di toccare l’ago o di premere lo stantuffo.
Figura J: Prendere la siringa preriempita
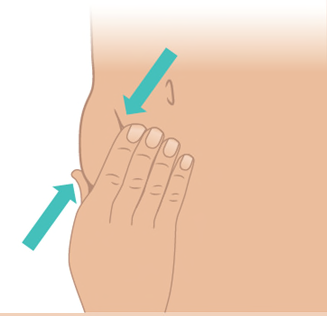
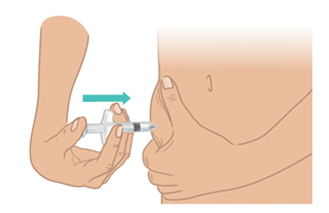
- b. Con l’altra mano, pizzicare delicatamente circa 3 cm di pelle nella sede di iniezione pulita. Tenere pizzicata la pelle fino a quando l’iniezione non è completata e l’ago non è stato rimosso ( Figura K).
Figura K: Pizzicare circa 3 cm di pelle
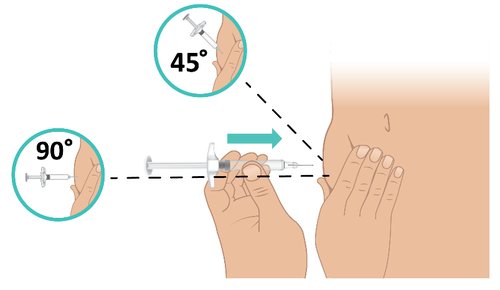
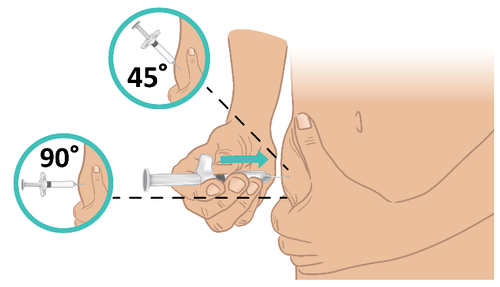
- c. Con un movimento rapido, come nel lancio di una freccetta, inserire l’ago con un angolo di 45-90 gradi. Assicurarsi di mantenere l’ago in posizione ( Figura L).
Importante: praticare
l’iniezione direttamente nel
tessuto adiposo sotto la pelle
(iniezione sottocutanea).
Figura L: Inserire l’ago
- d. Spingere lentamente lo stantuffo fino infondo e fino a quando non si arresta( Figura M).
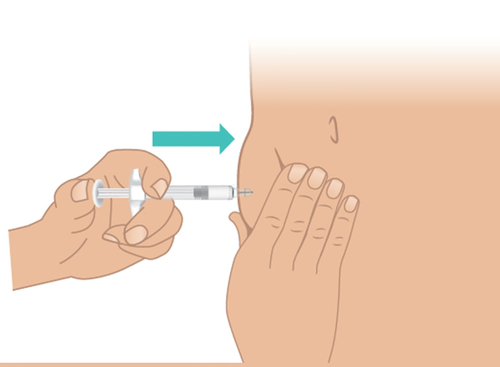
Importante: nonestrarre l’ago fino a
quando tutto il medicinale non è stato
iniettato e il corpo della siringa non è vuoto.
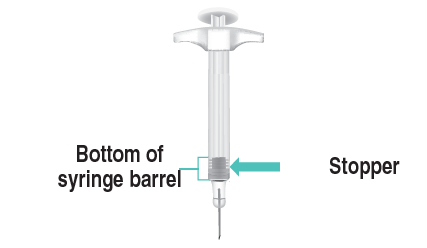
Quando l’iniezione è completata, sarà visibile
il tappo sul fondo del corpo della siringa
( Figura N).
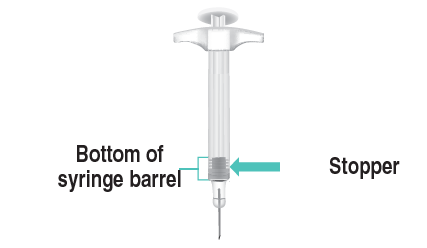
Fondo del
corpo dellaTappo
siringa
Figura N: Tappo sul fondo del corpo della siringa
- e. Estrarre lentamente l’ago senza modificare l’angolo della siringa. Rilasciare delicatamente la piega di pelle.
- f. Premere un batuffolo di cotone o un tampone di garza sulla sede di iniezione, se necessario, e tenere premuto per 10 secondi.
- Nonstrofinare la sede di iniezione. Potrebbe esserci un lieve sanguinamento nel punto in cui è stata eseguita l’iniezione. Questo è normale.
- Coprire la sede di iniezione con un cerotto, se necessario.
Passaggio 4: Gettare (smaltire) la siringa preriempita di
TAKHZYRO
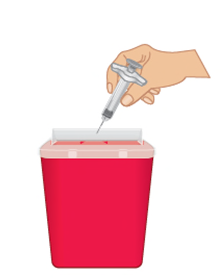
- a. Mettere la siringa preriempita di TAKHZYRO usata in un contenitore per oggetti taglienti subito dopo l’uso ( Figura O).
- Nonriapplicare il cappuccio sull’ago per evitare ferite da puntura d’ago.
- Nonriutilizzare la siringa preriempita di TAKHZYRO e qualsiasi altro materiale di iniezione.
- Nongettare (smaltire) la siringa preriempita di TAKHZYRO nei rifiuti domestici.
- Nontoccare l’ago.
- Importante:tenere sempre il contenitore per oggetti taglienti fuori dalla portata dei bambini.
Figura O: Smaltire in un contenitore
per oggetti taglienti
TAKHZYRO 300 mg soluzione iniettabile in siringa preriempita
lanadelumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TAKHZYRO e a cosa serve
- 2. Cosa deve sapere prima di usare TAKHZYRO
- 3. Come usare TAKHZYRO
- 4. Possibili effetti indesiderati
- 5. Come conservare TAKHZYRO
- 6. Contenuto della confezione e altre informazioni
- 7. Istruzioni per l’uso
1. Cos’è TAKHZYRO e a cosa serve
TAKHZYRO contiene il principio attivo lanadelumab.
A cosa serve TAKHZYRO
TAKHZYRO è un medicinale utilizzato nei pazienti di età pari o superiore a 2 anni per prevenire
attacchi di angioedema, in pazienti con angioedema ereditario (HAE).
Cos’è l’angioedema ereditario (HAE)
L’HAE è una patologia che è presente in alcune famiglie. Con questa patologia il suo sangue non ha
una quantità sufficiente di una proteina chiamata “inibitore C1”, o l’inibitore C1 non funziona
correttamente. Questo porta alla presenza di troppa “callicreina plasmatica”, che a sua volta produce
livelli più elevati di “bradichinina” nel sangue. Una quantità eccessiva di bradichinina porta a sintomi
di HAE come gonfiore e dolore a:
- mani e piedi;
- viso, palpebre, labbra o lingua;
- laringe, che può rendere difficoltosa la respirazione;
- genitali.
Come funziona TAKHZYRO
TAKHZYRO è un tipo di proteina che blocca l’attività della callicreina plasmatica. Questo aiuta a
ridurre la quantità di bradichinina nel sangue e previene i sintomi dell’HAE.
2. Cosa deve sapere prima di usare TAKHZYRO
Non usi TAKHZYRO
Se è allergico a lanadelumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al
paragrafo 6).
Avvertenze e precauzioni
- Si rivolga al medico, al farmacista o all’infermiere prima di usare TAKHZYRO.
- Se ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea, senso di oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamenteil medico, il farmacista o l’infermiere .
Tenere un registro
Si raccomanda vivamente di annotare il nome e il numero di lotto del medicinale ogni volta che si
assume una dose di TAKHZYRO. Questo serve a tenere una registrazione dei lotti utilizzati.
Esami di laboratorio
Informi il medico se sta assumendo TAKHZYRO prima di eseguire esami di laboratorio per misurare
quanto bene avvenga la coagulazione del sangue. Questo perché TAKHZYRO nel sangue può
interferire con alcuni esami di laboratorio, generando risultati inaccurati.
Bambini e adolescenti
TAKHZYRO non è raccomandato per l’uso nei bambini sotto i 2 anni di età. Questo perché non è
stato studiato in questa fascia di età.
Altri medicinali e TAKHZYRO
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Non è noto che TAKHZYRO abbia influenza su altri medicinali o sia influenzato da altri medicinali.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno, chieda consiglio al medico o al farmacista prima di iniziare a usare TAKHZYRO. Esistono
informazioni limitate sulla sicurezza dell’uso di TAKHZYRO durante la gravidanza e l’allattamento.
Come misura precauzionale, è preferibile evitare l’uso di lanadelumab durante la gravidanza e
l’allattamento. Il medico discuterà con lei i rischi e i benefici derivanti dall’assunzione di questo
medicinale.
Guida di veicoli e utilizzo di macchinari
Questo medicinale non altera o altera in modo trascurabile la capacità di guidare veicoli e di utilizzare
macchinari.
TAKHZYRO contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per siringa preriempita, cioè
essenzialmente “senza sodio”.
3. Come usare TAKHZYRO
TAKHZYRO è fornito in siringhe preriempite monouso come soluzione pronta all’uso. Il trattamento
verrà iniziato e gestito sotto la supervisione di un medico esperto nel trattamento di pazienti con HAE.
Usi questo medicinale seguendo sempre esattamente quanto riportato in questo foglio o le istruzioni
del medico, del farmacista o dell’infermiere. Se ha dubbi oppure se ha qualche altra domanda consulti
il medico, il farmacista o l’infermiere.
Quanto TAKHZYRO usare
Per adulti e adolescenti di età compresa tra 12 e meno di 18 anni:
- La dose iniziale raccomandata è di 300 mg di lanadelumab ogni 2 settimane. Se non ha attacchi da un periodo lungo, il medico può modificare la dose a 300 mg di lanadelumab ogni 4 settimane, specialmente se ha un basso peso corporeo.
- Nei pazienti con peso corporeo inferiore a 40 kg, può essere presa in considerazione anche una dose iniziale di 150 mg di lanadelumab ogni 2 settimane. Se non ha attacchi da un periodo lungo, il medico può modificare la dose a 150 mg di lanadelumab ogni 4 settimane.
Per i bambini di età compresa tra 2 e meno di 12 anni, la dose raccomandata dipende dal peso
corporeo:
| Peso corporeo (kg) | Dose iniziale raccomandata | l Adattamento della dose |
| Da 10 a meno di 20 kg | e d 150 mg di lanadelumab ogni 4 settimane | In pazienti con controllo degli attacchi insufficiente, è possibile considerare un aumento di dose a 150 mg di lanadelumab ogni 3 settimane |
| Da 20 a meno di 40 kg | a n 150 mg di lanadelumab ogni 2 settimane | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 150 mg di lanadelumab ogni 4 settimane |
| 40 kg o più | a i 300 mg di lanadelumab ogni l 2 settimane | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 300 mg di lanadelumab ogni 4 settimane |
- Per i pazienti con un peso corporeo compreso tra 20 e meno di 40 kg che non hanno avuto attacchi per un lungo periodo, il medico potrebbe consentire al bambino di continuare con la stessa dose al raggiungimento dei 12 anni di età.
Come iniettare TAKHZYRO
Se si inietta da sé TAKHZYRO o se le viene iniettato dalla persona che l’assiste, lei o la persona
che l’assiste dovete leggere attentamente e seguire le istruzioni nel paragrafo 7, “Istruzioni per
l’uso”.
- TAKHZYRO deve essere iniettato sotto la pelle (“iniezione sottocutanea”).
- L’iniezione può essere autosomministrata o somministrata dalla persona che fornisce assistenza se i pazienti hanno almeno 12 anni.
- L’iniezione può essere somministrata dall’operatore sanitario o dalla persona che fornisce assistenza se i pazienti hanno un’età compresa tra 2 e meno di 12 anni.
- Un medico, un farmacista o un infermiere devono mostrarle come preparare e iniettare TAKHZYRO correttamente prima di usarlo per la prima volta. Non lo inietti a sé stesso o ad altri finché non è stato adeguatamente formato per iniettare il medicinale.
- Inserisca l’ago nel tessuto adiposo nella pancia (addome), nella coscia o nella parte superiore del braccio.
- Inietti il medicinale ogni volta in una zona diversa.
- Utilizzi ciascuna siringa preriempita di TAKHZYRO una sola volta.
Se usa più TAKHZYRO di quanto deve
Informi il medico, il farmacista o l’infermiere se assume troppo TAKHZYRO.
Se dimentica di usare TAKHZYRO
Se si dimentica una dose di TAKHZYRO, inietti la dose il più presto possibile. È possibile che sia
necessario un adattamento della dose successiva programmata in base alla frequenza di assunzione
prevista, per assicurarsi che trascorrano
- almeno 10 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 2 settimane,
- almeno 17 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 3 settimane,
- almeno 24 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 4 settimane.
Se non è sicuro di quando iniettare TAKHZYRO dopo una dose dimenticata, si rivolga al medico, al
farmacista o all’infermiere.
Se interrompe il trattamento con TAKHZYRO
È importante che continui a iniettarsi TAKHZYRO secondo le istruzioni del medico, anche se si sente
meglio. Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Se ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea, senso di
oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamenteil
medico, il farmacista o l’infermiere .
Informi il medico, il farmacista o l’infermiere se nota uno dei seguenti effetti indesiderati.
Molto comuni (possono interessare più di 1 persona su 10):
- Reazioni nella zona in cui viene praticata l’iniezione: i sintomi includono dolore, arrossamento della pelle, lividi, disagio, gonfiore, sanguinamento, prurito, indurimento della pelle, formicolio, calore ed eruzione cutanea.
Comuni (possono interessare fino a 1 persona su 10):
- Reazioni allergiche incluso prurito, fastidio e formicolio della lingua
- Vertigini, sensazione di svenimento
- Eritema con sollevamento della pelle
- Dolore muscolare
- Esami del sangue che mostrano variazioni al fegato
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare TAKHZYRO
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta dopo EXP. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
TAKHZYRO 300 mg soluzione iniettabile in siringa preriempita
Conservare in frigorifero (2 °C – 8 °C). Non congelare. Tenere la siringa preriempita nell’imballaggio
esterno per proteggere il medicinale dalla luce.
Le siringhe preriempite possono essere conservate a una temperatura inferiore a 25 °C per un singolo
periodo di 14 giorni, ma non oltre la data di scadenza.
Non rimettere TAKHZYRO in frigorifero dopo averlo conservato a temperatura ambiente.
Dopo aver prelevato una siringa preriempita da una confezione multipla conservata in frigorifero,
riporre le siringhe preriempite rimanenti in frigorifero fino al successivo utilizzo quando necessario.
Non usi questo medicinale se nota segni di deterioramento come particelle nella siringa preriempita o
variazioni del colore della soluzione iniettabile.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TAKHZYRO
- Il principio attivo è lanadelumab. Ogni siringa preriempita contiene 300 mg di lanadelumab in 2 mL di soluzione.
- Gli eccipienti sono fosfato disodico diidrato, acido citrico monoidrato, istidina, cloruro di sodio, polisorbato 80 e acqua per preparazioni iniettabili - vedere paragrafo 2 “TAKHZYRO contiene sodio”.
Descrizione dell’aspetto di TAKHZYRO e contenuto della confezione
TAKHZYRO si presenta come una soluzione iniettabile trasparente, da incolore a leggermente gialla,
in una siringa preriempita.
TAKHZYRO è disponibile:
- in una confezione singola contenente una siringa preriempita da 2 mL in una scatola;
- in una confezione singola contenente due siringhe preriempite da 2 mL in una scatola;
- in confezioni multiple comprendenti 3 scatole, ogni scatola contenente due siringhe preriempite da 2 mL.
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Produttore
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
Irlanda
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: + 420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel: +356 21419070
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu/ . Inoltre, sono riportati link ad altri siti web su malattie
rare e relativi trattamenti terapeutici.
Questo foglio è disponibile in tutte le lingue dell’Unione europea/dello Spazio economico europeo sul
sito web dell’Agenzia europea per i medicinali.
7. Istruzioni per l’uso
Si assicuri di leggere, capire e seguire le Istruzioni per l’uso prima di iniettare TAKHZYRO. Se ha
dubbi, si rivolga all’operatore sanitario.
Destinazione d'uso
La siringa preriempita di TAKHZYRO è un dispositivo per iniezione con ago, pronto all’uso,
monouso e a dose fissa (300 mg/2 mL), destinato alla somministrazione sottocutanea del farmaco da
parte di operatori sanitari, persone che prestano assistenza o mediante auto-somministrazione (per i
pazienti che hanno almeno 12 anni).
Conservazione di TAKHZYRO
- Conservare la siringa preriempita di TAKHZYRO in frigorifero da 2 °C a 8 °C. Noncongelare.
- La siringa preriempita rimossa dal frigorifero deve essere conservata a temperatura inferiore a 25 °C e utilizzata entro 14 giorni. Non rimettere TAKHZYRO in frigorifero dopo averlo conservato a temperatura ambiente.
- Dopo aver prelevato una siringa preriempita da una confezione multipla conservata in frigorifero, riporre le siringhe preriempite rimanenti in frigorifero fino al successivo utilizzo quando necessario.
- Conservare TAKHZYRO nella confezione originale per proteggere la siringa preriempita dalla luce.
- Gettare (smaltire) la siriga preriempita di TAKHZYRO se è stata tenuta fuori dal frigorifero, congelata o se non è stata conservata nella confezione originale al riparo dalla luce.
- Nonagitare TAKHZYRO.
- Tenere TAKHZYRO e tutti i medicinali fuori dalla portata dei bambini.
Componenti della siringa preriempita di TAKHZYRO prima dell’uso (Figura A).
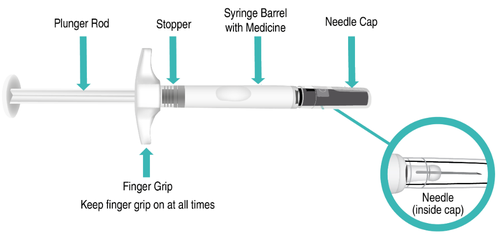
Figura A: Siringa preriempita di TAKHZYRO
PASSAGGIO 1: Preparazione per l’iniezione
- a. Procurarsi un tampone imbevuto di alcool, un batuffolo di cotone o un tampone di garza, un cerotto e un contenitore per oggetti taglienti ( Figura B) e posizionarli su una superficie pulita, piana e in un’area ben illuminata. Queste forniture non sono incluse nella confezione di TAKHZYRO.
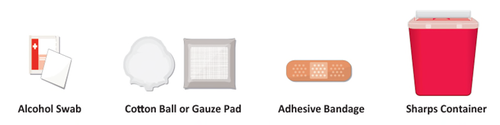
Figura B: Forniture
- b. Rimuovere la scatola della siringa preriempita di TAKHZYRO dal frigorifero.
- Nonusare la siringa preriempita di TAKHZYRO se il sigillo antimanomissione è aperto o rotto.
- Prima di preparare l’iniezione, lasciare che la siringa preriempita raggiunga latemperatura ambiente per almeno 15 minuti.
- Il medicinale è sensibile alle alte temperature. Nonutilizzare fonti di calore come il microonde o acqua calda per riscaldare la siringa preriempita di TAKHZYRO.
- Nonrimuovere il cappuccio dell’ago fino a quando non si è pronti per eseguire l’iniezione.
Attendere
15
minuti
- c. Aprire la scatola. Tenere il corpo della siringa e rimuovere la siringa preriempita di TAKHZYRO dall’apposito supporto ( Figura C).
- d. Lavarsi le mani con acqua e sapone ( Figura D). Asciugarsi completamente le mani.
- Nontoccare alcuna superficie o parte del corpo dopo aver lavato le mani prima dell’iniezione.
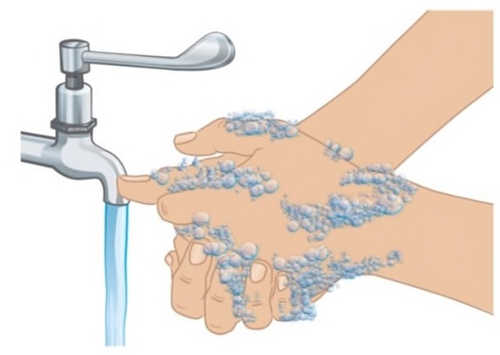
Figura D: Lavarsi le mani
- e. Controllare la data di scadenza (EXP)sul corpo della siringa ( Figura E). Nonusare la siringa preriempita di TAKHZYRO se la data di scadenza è stata superata. Se la siringa preriempita di TAKHZYRO è scaduta, gettarla (smaltirla) in un contenitore per oggetti taglienti e contattare l’operatore sanitario.
Figura E: Posizione della data di scadenza
- f. Ispezionarela siringa preriempita di TAKHZYRO per escludere la presenza di danni e assicurarsi che il medicinale sia da incolore a leggermente giallo ( Figura F).
- Nonusare il prodotto se la siringa è danneggiata, ad esempio se presenta incrinature.
- Nonusare la siringa preriempita di TAKHZYRO se il medicinale è scolorito, torbido o contiene scaglie o particelle.
- Nella siringa preriempita di TAKHZYRO potrebbero essere visibili delle bolle d’aria. Questo è normale e non influirà sulla dose. Se non è possibile utilizzare la siringa, contattare l’operatore sanitario.
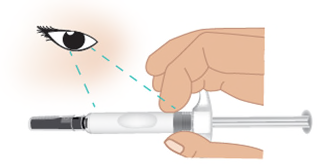
Figura F: Ispezionare la siringa preriempita
PASSAGGIO 2: Selezione e preparazione della sede di iniezione
- a. La siringa preriempita di TAKHZYRO deve essere iniettata solo nelle seguenti sedi ( Figura G): o stomaco (addome) o coscia o parte alta del braccio (solo se l’iniezione viene praticata da un operatore sanitario o da una persona che assiste il paziente .
- Noniniettare in un’area del corpo in cui la pelle è irritata, arrossata, contusa o infetta.
- L’area scelta per l’iniezione deve essere ad almeno 5 cm di distanza da eventuali cicatrici o dall’ombelico.
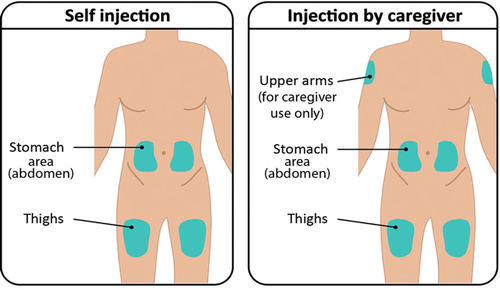
Figura G: Sedi di iniezione
Importante:
Alternare le sedi di iniezione per mantenere la pelle sana. Ogni nuova iniezione deve essere
somministrata ad almeno 3 cm dall’ultima sede utilizzata.
- b. Pulire la sede di iniezione con una salviettina imbevuta di alcool e lasciare asciugare completamente ( Figura H).
- Nonsoffiare sulla sede pulita.
- Nontoccare di nuovo quest’area prima di effettuare l’iniezione.

Figura H: Pulire la sede di iniezione
- c. Tenere saldamente la parte centrale della siringa preriempita di TAKHZYRO con una mano e con l’altra rimuovere delicatamente il cappuccio dell’ago diritto.Gettare il cappuccio dell’ago nei rifiuti domestici o nel contenitore per oggetti taglienti ( Figura I).
- Nontoccare o premere lo stantuffo fino a quando non si è pronti per eseguire l’iniezione.
- Nonriapplicare il cappuccio sulla siringa preriempita di TAKHZYRO per evitare ferite da puntura d’ago.
- Nonusare la siringa preriempita di TAKHZYRO se è stata fatta cadere senza il cappuccio dell’ago.
- Nonusare la siringa preriempita di TAKHZYRO se l’ago appare danneggiato o piegato.
- Nontoccare l’ago né lasciare che tocchi altre superfici.
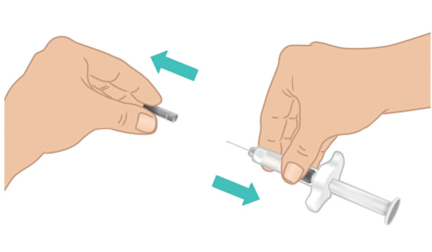
Figura I: Rimuovere il cappuccio dell’ago
PASSAGGIO 3: Iniezione di TAKHZYRO
- a. Prendere la siringa preriempita di TAKHZYRO in una mano come una matita ( Figura J). Evitare di toccare l’ago o di premere lo stantuffo.
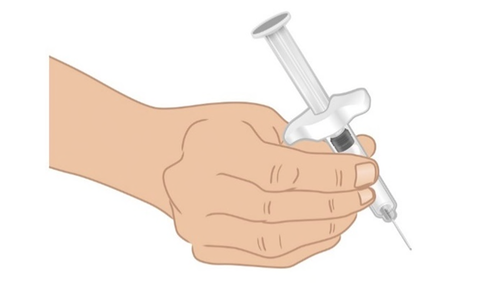
Figura J: Prendere la siringa preriempita
- b. Con l’altra mano, pizzicare delicatamente circa 3 cm di pelle nella sede di iniezione pulita.
- Tenere pizzicata la pelle fino a quando l’iniezione non è completata e l’ago non è stato rimosso ( Figura K).
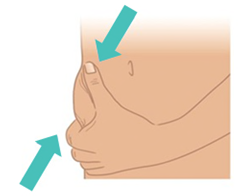
Figura K: Pizzicare 3 cm di pelle
- c. Con un movimento rapido e breve, inserire l’ago nella pelle completamente con un angolo di 45-90 gradi. Assicurarsi di mantenere l’ago in posizione ( Figura L).
Importante:praticare l’iniezione
direttamente nel tessuto adiposo sotto
la pelle (iniezione sottocutanea).
Figura L: Inserire l’ago
- d. Spingere lentamentelo stantuffo fino in fondo e fino a quando non si arresta( Figura M).
- e. Rimuovere lentamente l’ago mantenendo la siringa alla stessa angolazione. Rilasciare delicatamente la piega di pelle.
Importante: nonestrarre l’ago fino a quando
tutto il medicinale non è stato iniettato e il
corpo della siringa non è vuoto.
Figura M: Premere lo stantuffo fino in fondo
Quando l’iniezione è completata, sarà
visibile il tappo sul fondo del corpo
della siringa ( Figura N). Fondo del
corpo dellaTappo
siringa
Figura N: Tappo al fondo del corpo della siringa
- f. Premere un batuffolo di cotone o un tampone di garza sulla sede di iniezione, se necessario, e tenere premuto per 10 secondi.
- Nonstrofinare la sede di iniezione. Potrebbe esserci un lieve sanguinamento. È normale.
- Coprire la sede di iniezione con un cerotto, se necessario.
- g. Gettare (smaltire) la siringa preriempita di TAKHZYRO usata.
- Mettere la siringa preriempita di TAKHZYRO usata in un contenitore per oggetti taglienti subito dopo l’uso ( Figura O).
- Nonriapplicare il cappuccio sull’ago per evitare ferite da puntura d’ago.
- Nonriutilizzare la siringa preriempita di TAKHZYRO e qualsiasi altro materiale di iniezione.
- Nontoccare l’ago. Importante: tenere sempre il contenitore peroggetti taglienti fuori dalla portata dei bambini.Figura O: Smaltire in un contenitore peroggetti taglienti
TAKHZYRO 300 mg soluzione iniettabile in flaconcino
lanadelumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TAKHZYRO e a cosa serve
- 2. Cosa deve sapere prima di usare TAKHZYRO
- 3. Come usare TAKHZYRO
- 4. Possibili effetti indesiderati
- 5. Come conservare TAKHZYRO
- 6. Contenuto della confezione e altre informazioni
- 7. Istruzioni per l’uso
1. Cos’è TAKHZYRO e a cosa serve
TAKHZYRO contiene il principio attivo lanadelumab.
A cosa serve TAKHZYRO
TAKHZYRO è un medicinale utilizzato nei pazienti di età pari o superiore a 2 anni per prevenire
attacchi di angioedema, in pazienti con angioedema ereditario (HAE).
Cos’è l’angioedema ereditario (HAE)
L’HAE è una patologia che è presente in alcune famiglie. Con questa patologia il suo sangue non ha
una quantità sufficiente di una proteina chiamata “inibitore C1”, o l’inibitore C1 non funziona
correttamente. Questo porta alla presenza di troppa “callicreina plasmatica”, che a sua volta produce
livelli più elevati di “bradichinina” nel sangue. Una quantità eccessiva di bradichinina porta a sintomi
di HAE come gonfiore e dolore a:
- mani e piedi;
- viso, palpebre, labbra o lingua;
- laringe, che può rendere difficoltosa la respirazione;
- genitali.
Come funziona TAKHZYRO
TAKHZYRO è un tipo di proteina che blocca l’attività della callicreina plasmatica. Questo aiuta a
ridurre la quantità di bradichinina nel sangue e previene i sintomi dell’HAE.
2. Cosa deve sapere prima di usare TAKHZYRO
Non usi TAKHZYRO
Se è allergico a lanadelumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al
paragrafo 6).
Avvertenze e precauzioni
- Si rivolga al medico, al farmacista o all’infermiere prima di usare TAKHZYRO.
- Se ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea, senso di oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamenteil medico, il farmacista o l’infermiere .
Tenere un registro
Si raccomanda vivamente di annotare il nome e il numero di lotto del medicinale ogni volta che si
assume una dose di TAKHZYRO. Questo serve a tenere una registrazione dei lotti utilizzati.
Esami di laboratorio
Informi il medico se sta assumendo TAKHZYRO prima di eseguire esami di laboratorio per misurare
quanto bene avvenga la coagulazione del sangue. Questo perché TAKHZYRO nel sangue può
interferire con alcuni esami di laboratorio, generando risultati inaccurati.
Bambini e adolescenti
TAKHZYRO non è raccomandato per l’uso nei bambini sotto i 2 anni di età. Questo perché non è
stato studiato in questa fascia di età.
Altri medicinali e TAKHZYRO
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Non è noto che TAKHZYRO abbia influenza su altri medicinali o sia influenzato da altri medicinali.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno, chieda consiglio al medico o al farmacista prima di iniziare a usare TAKHZYRO. Esistono
informazioni limitate sulla sicurezza dell’uso di TAKHZYRO durante la gravidanza e l’allattamento.
Come misura precauzionale, è preferibile evitare l’uso di lanadelumab durante la gravidanza e
l’allattamento. Il medico discuterà con lei i rischi e i benefici derivanti dall’assunzione di questo
medicinale.
Guida di veicoli e utilizzo di macchinari
Questo medicinale non altera o altera in modo trascurabile la capacità di guidare veicoli e di utilizzare
macchinari.
TAKHZYRO contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per flaconcino, cioè essenzialmente
“senza sodio”.
3. Come usare TAKHZYRO
TAKHZYRO è fornito in flaconcini monouso come soluzione pronta all’uso. Il trattamento verrà
iniziato e gestito sotto la supervisione di un medico esperto nel trattamento di pazienti con HAE.
Usi questo medicinale seguendo sempre esattamente quanto riportato in questo foglio o le istruzioni
del medico, del farmacista o dell’infermiere. Se ha dubbi oppure se ha qualche altra domanda consulti
il medico, il farmacista o l’infermiere.
Quanto TAKHZYRO usare
Per adulti e adolescenti di età compresa tra 12 e meno di 18 anni:
- La dose iniziale raccomandata è di 300 mg di lanadelumab ogni 2 settimane. Se non ha attacchi da un periodo lungo, il medico può modificare la dose a 300 mg di lanadelumab ogni 4 settimane, specialmente se ha un basso peso corporeo.
- Nei pazienti con peso corporeo inferiore a 40 kg, può essere presa in considerazione anche una dose iniziale di 150 mg di lanadelumab ogni 2 settimane. Se non ha attacchi da un periodo lungo, il medico può modificare la dose a 150 mg di lanadelumab ogni 4 settimane.
Per i bambini di età compresa tra 2 e meno di 12 anni, la dose raccomandata dipende dal peso
corporeo:
| Peso corporeo (kg) | Dose iniziale raccomandata | Adattamento della dose |
| Da 10 a meno di 20 kg | a n 150 mg di lanadelumab ogni 4 settimane | In pazienti con controllo degli attacchi insufficiente, è possibile considerare un aumento di dose a 150 mg di lanadelumab ogni 3 settimane |
| Da 20 a meno di 40 kg | a i 150 mg di lanadelumab ogni l 2 settimane | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 150 mg di lanadelumab ogni 4 settimane |
| 40 kg o più | a t I 300 mg di lanadelumab ogni 2 settimane | In pazienti che sono stabilmente liberi da attacchi con il trattamento, è possibile considerare una riduzione di dose a 300 mg di lanadelumab ogni 4 settimane |
- Per i pazienti con un peso corporeo compreso tra 20 e meno di 40 kg che non hanno avuto attacchi per un lungo periodo, il medico potrebbe consentire al bambino di continuare con la stessa dose al raggiungimento dei 12 anni di età.
Come iniettare TAKHZYRO
Se si inietta da sé TAKHZYRO o se le viene iniettato dalla persona che l’assiste, lei o la persona
che l’assiste dovete leggere attentamente e seguire le istruzioni nel paragrafo 7, “Istruzioni per
l’uso”.
- TAKHZYRO deve essere iniettato sotto la pelle (“iniezione sottocutanea”).
- L’iniezione può essere autosomministrata o somministrata dalla persona che fornisce assistenza se i pazienti hanno almeno 12 anni.
- L’iniezione può essere somministrata dall’operatore sanitario o dalla persona che fornisce assistenza se i pazienti hanno un’età compresa tra 2 e meno di 12 anni.
- Un medico, un farmacista o un infermiere devono mostrarle come preparare e iniettare
TAKHZYRO correttamente prima di usarlo per la prima volta. Non lo inietti a sé stesso o ad
altri finché non è stato adeguatamente formato per iniettare il farmaco.
- Inserisca l’ago nel tessuto adiposo nella pancia (addome), nella coscia o nella parte superiore del braccio.
- Inietti il farmaco ogni volta in una zona diversa.
- Utilizzi ciascun flaconcino di TAKHZYRO una sola volta.
Se usa più TAKHZYRO di quanto deve
Informi il medico, il farmacista o l’infermiere se assume troppo TAKHZYRO.
Se dimentica di usare TAKHZYRO
Se si dimentica una dose di TAKHZYRO, inietti la dose il più presto possibile. È possibile che sia
necessario un adattamento della dose successiva programmata in base alla frequenza di assunzione
prevista, per assicurarsi che trascorrano
- almeno 10 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 2 settimane,
- almeno 17 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 3 settimane,
- almeno 24 giorni tra una dose e l’altra per i pazienti con un regime di somministrazione ogni 4 settimane.
Se non è sicuro di quando iniettare TAKHZYRO dopo una dose dimenticata, si rivolga al medico, al
farmacista o all’infermiere.
Se interrompe il trattamento con TAKHZYRO
È importante che continui a iniettarsi TAKHZYRO secondo le istruzioni del medico, anche se si sente
meglio.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Se ha una reazione allergica grave a TAKHZYRO con sintomi come eruzione cutanea, senso di
oppressione al petto, respiro sibilante o battito cardiaco accelerato, informi immediatamenteil
medico, il farmacista o l’infermiere .
Informi il medico, il farmacista o l’infermiere se nota uno dei seguenti effetti indesiderati.
Molto comuni (possono interessare più di 1 persona su 10):
- Reazioni nella zona in cui viene praticata l’iniezione: i sintomi includono dolore, arrossamento della pelle, lividi, disagio, gonfiore, sanguinamento, prurito, indurimento della pelle, formicolio, calore ed eruzione cutanea.
Comuni (possono interessare fino a 1 persona su 10):
- Reazioni allergiche incluso prurito, fastidio e formicolio della lingua
- Vertigini, sensazione di svenimento
- Eritema con sollevamento della pelle
- Dolore muscolare
- Esami del sangue che mostrano variazioni al fegato
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare TAKHZYRO
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta dopo EXP. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C). Non congelare. Tenere il flaconcino nell’imballaggio esterno
per proteggere il medicinale dalla luce.
I flaconcini possono essere conservati a una temperatura inferiore a 25 °C per un singolo periodo di
14 giorni, ma non oltre la data di scadenza. Non rimettere TAKHZYRO in frigorifero dopo averlo
conservato a temperatura ambiente.
Non usi questo medicinale se nota segni di deterioramento come particelle nel flaconcino o variazioni
del colore della soluzione iniettabile.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TAKHZYRO
- Il principio attivo è lanadelumab. Ogni flaconcino contiene 300 mg di lanadelumab in 2 mL di soluzione.
- Gli eccipienti sono fosfato disodico diidrato, acido citrico monoidrato, istidina, cloruro di sodio, polisorbato 80 e acqua per preparazioni iniettabili - vedere paragrafo 2 “TAKHZYRO contiene sodio”.
Descrizione dell’aspetto di TAKHZYRO e contenuto della confezione
TAKHZYRO si presenta come una soluzione iniettabile trasparente, da incolore a leggermente gialla
in un flaconcino di vetro.
TAKHZYRO è disponibile in una confezione singola contenente un flaconcino da 2 mL e in
confezioni multiple comprendenti 2 o 6 scatole, ogni scatola contenente 1 flaconcino.
È possibile che non tutte le confezioni siano commercializzate.
Ogni confezione contiene anche i seguenti elementi:
- Siringa vuota da 3 mL
- Ago di accesso al flaconcino con punta smussata calibro 18
- Ago appuntito per la somministrazione (iniezione) calibro 27 x 13 mm.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Produttore
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublino 2
Irlanda
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: + 420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel: +356 21419070
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu/. Inoltre, sono riportati link ad altri siti web su malattie
rare e relativi trattamenti terapeutici.
Questo foglio è disponibile in tutte le lingue dell’Unione europea/dello Spazio economico europeo sul
sito web dell’Agenzia europea per i medicinali.
7. Istruzioni per l’uso
Si assicuri di leggere, capire e seguire passaggio per passaggio le istruzioni per l’iniezione di
TAKHZYRO. Se ha dubbi, si rivolga al medico, al farmacista o all’infermiere.
In aggiunta al flaconcino, ogni confezione di TAKHZYRO contiene anche:
- Una siringa vuota da 3 mL.
- Un ago di accesso al flaconcino con punta smussata calibro 18. Utilizzato per estrarre la soluzione medicinale dal flaconcino nella siringa.

- Un ago appuntito per iniezione calibro 27 x 13 mm. Utilizzato per iniezione sotto la pelle (sottocutanea).
Usi solo le siringhe, gli aghi smussati per l’accesso al flaconcino e gli aghi appuntiti per iniezione che
sono contenuti in questa confezione o che il medico le ha prescritto.
Usi solo una volta le siringhe, gli aghi smussati per l’accesso al flaconcino e gli aghi appuntiti per
iniezione. Inserisca siringhe e aghi usati nel contenitore per rifiuti taglienti.
Non utilizzi le siringhe, gli aghi smussati per l’accesso al flaconcino e gli aghi appuntiti per iniezione
che appaiono danneggiati.
Avrà anche bisogno di:
- Salviettine imbevute di alcool
- Un contenitore per rifiuti taglienti per flaconcini, aghi e siringhe usati
Può richiedere le forniture necessarie al suo medico, farmacista o infermiere.
L’iniezione di TAKHZYRO può essere riassunta in 5 passaggi:
1. Preparazione del flaconcino di TAKHZYRO
2. Collegamento dell’ago di accesso al flaconcino con la punta smussata alla siringa
3. Trasferimento di TAKHZYRO nella siringa e passaggio all’ago appuntito per iniezione
4. Selezione e preparazione della sede di iniezione
5. Iniezione di TAKHZYRO
Passaggio 1: Preparazione del flaconcino di TAKHZYRO
a)Prelevare il flaconcino dal frigorifero
15 minuti prima dell’uso per lasciare che
raggiunga la temperatura ambiente (15 °C –
25 °C) prima di preparare l’iniezione.
b)Pulire la propria area di lavoro e lavare le
mani prima di preparare la dose. Non toccare
alcuna superficie o il corpo, specialmente il
viso, dopo aver lavato le mani prima
dell’iniezione.
c)Prendere TAKHZYRO e le forniture e
posizionarle sulla superficie di lavoro ben
illuminata.
d)Rimuovere il flaconcino dalla confezione.
Non usare il flaconcino se manca il
cappuccio che copre il tappo.
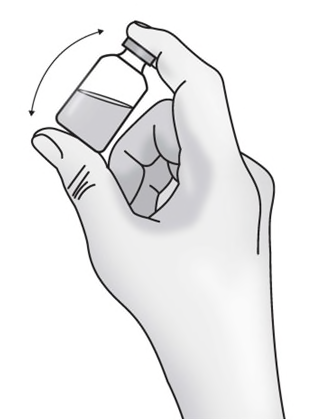
e) Capovolgere delicatamente il flaconcino
da 3 a 5 volte per assicurarsi che la
soluzione sia miscelata. Non agitare il
flaconcino perché questo può causare la
formazione di schiuma.
f)Controllare la soluzione nel flaconcino per
eventuali particelle o un cambiamento nel
colore (normalmente è da incolore a
leggermente gialla). Non usare se si vedono
particelle o cambi di colore.
Importante: Non agitare.
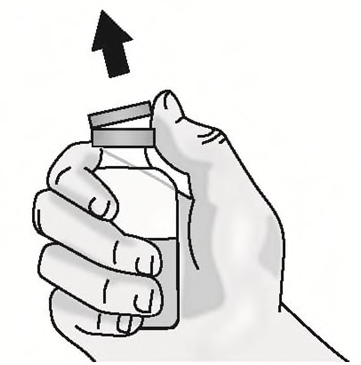
g)Rimuovere il cappuccio di plastica dal
flaconcino. Non rimuovere il tappo di
gomma del flaconcino.
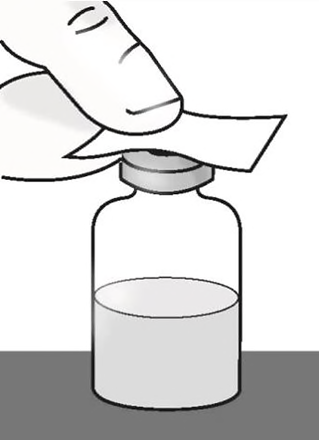
h)Collocare il flaconcino su una superficie
piana. Pulire il tappo di gomma del
flaconcino con una salviettina imbevuta di
alcool e lasciarlo asciugare.
Passaggio 2: Collegamento dell’ago di accesso al flaconcino con la punta smussata alla siringa
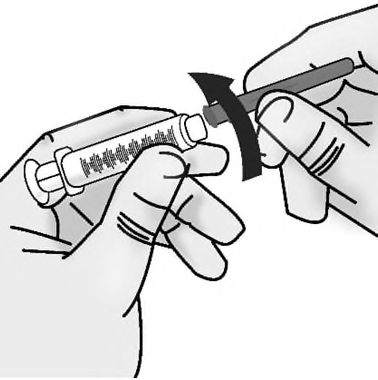
a)Avvitare l’ago di accesso al flaconcino con punta
smussata calibro 18 alla siringa da 3 mL.
Importante:Non rimuovere il cappuccio
dall’ago quando lo si collega alla siringa.
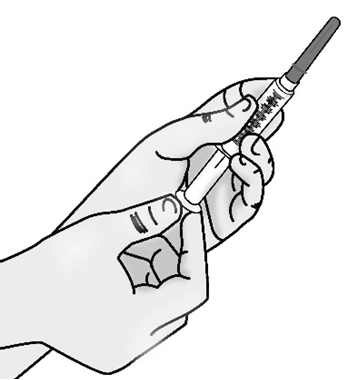
b)Tirare indietro lo stantuffo per riempire la siringa
con una quantità d’aria pari alla quantità di
soluzione nel flaconcino.
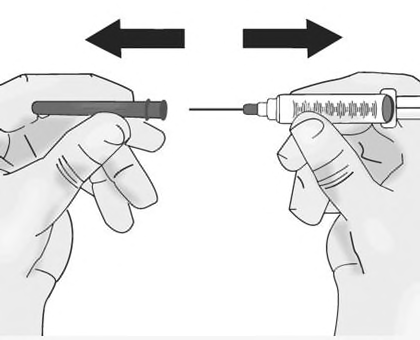
c)Togliere immediatamente il cappuccio dell’ago
dalla siringa senza toccare l’ago. Non tirare lo
stantuffo.
Passaggio 3: Trasferimento di TAKHZYRO nella siringa e passaggio all’ago appuntito per
iniezione
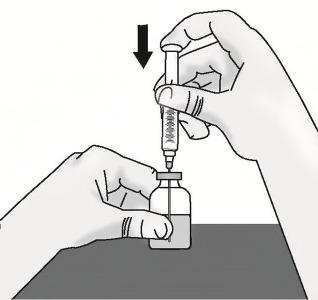
a)Inserire l’ago al centro del tappo di gomma.
b)Spingere lo stantuffo verso il basso per iniettare
aria nel flaconcino e tenere premuto lo stantuffo
verso il basso.
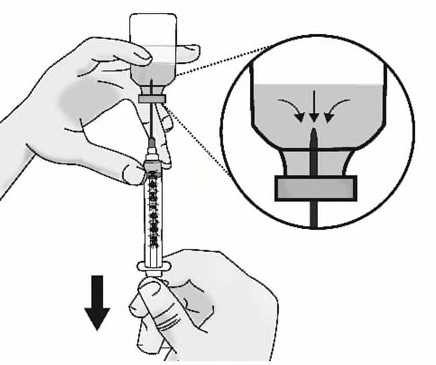
c)Capovolgere lentamente il flaconcino con l’ago e
la siringa attaccati. Tirare indietro lo stantuffo
per prelevare la dose completanel flaconcino.
Importante:Assicurarsi di mantenere la
punta dell'ago nel liquido per evitare di
aspirare aria mentre si tira indietro lo
stantuffo.
 | |
z i a I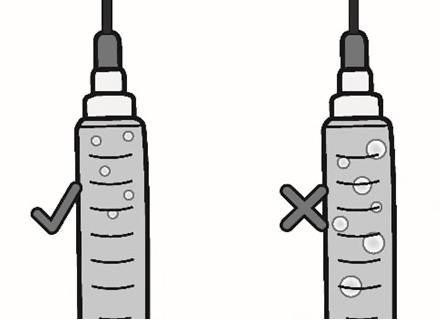 | t |
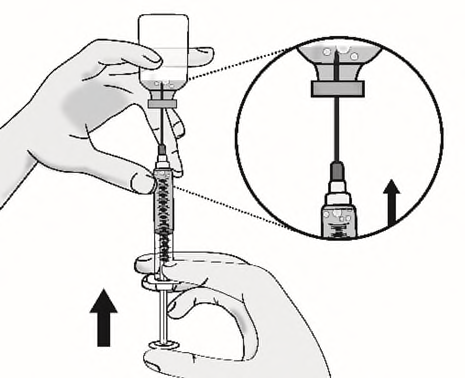
d)Rimuovere le bolle d’aria grandi picchiettando
delicatamente sulla siringa con le dita finché le
bolle non salgono verso l’alto della siringa.
Spingere lentamente lo stantuffo, consentendo
all’aria di tornare nel flaconcino, fino a quando la
soluzione raggiunge la sommità della siringa.
Ripetere questi passaggi fino a rimuovere le bolle
d’aria grandi.
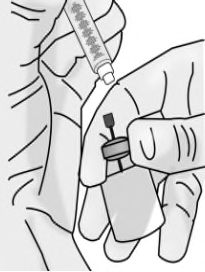
e)Senza rimuovere l’ago dal flaconcino, svitare la
siringa tenendo ferma la parte alta dell’ago e
ruotando la siringa in senso antiorario.
Riportare la siringa in posizione verticale.
f)Mettere l’ago di accesso al flaconcino con punta
smussata calibro 18 e il flaconcino in un
contenitore per oggetti taglienti.
g)Avvitare l’ago appuntito per iniezione calibro
27 x 13 mm alla siringa.
Importante:Non rimuovere il cappuccio
dall’ago quando lo si collega alla siringa.
Nonutilizzare l’ago di accesso al flaconcino
con punta smussata per iniettare
TAKHZYRO poiché ciò potrebbe causare
dolore e sanguinamento.
Passaggio 4: Selezione e preparazione della sede di iniezione
a)Scegliere una sede di iniezione su stomaco
(addome), coscia o parte alta del braccio.
L’iniezione deve essere somministrata per
via sottocutanea.
b)Pulire la sede di iniezione con una salviettina
imbevuta di alcool e lasciare asciugare la
pelle completamente.
Importante:
- È importante usare sedi diverse di iniezione per mantenere la pelle sana.
- L’area scelta per l'iniezione deve essere ad almeno 5 cm di distanza da eventuali cicatrici o dall’ombelico. Non scegliere un'area contusa, gonfia o dolorante.
- L’area esterna del braccio non è raccomandata se ci si inietta il farmaco da soli.
Passaggio 5: Iniezione di TAKHZYRO
c)Togliere il cappuccio dell’ago diritto dalla siringa
senza toccare l’ago. Non tirare lo stantuffo. Non
toccare la punta dell’ago o lasciarle toccare
alcuna altra superficie.
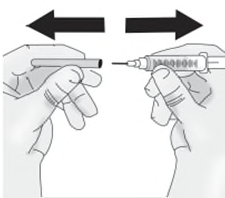
Importante:iniettare TAKHZYRO entro
2 ore dalla preparazione della siringa
dosatrice a temperatura ambiente. In
alternativa, è possibile mettere la siringa
dosatrice in un frigorifero a una temperatura
tra 2 °C e 8 °C e utilizzarla entro 8 ore.
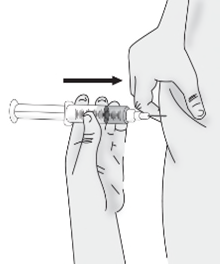
d)Pizzicare delicatamente circa 3 cm di pelle nella
sede di iniezione pulita e inserire l’ago.
Importante:Assicurarsi di eseguire l’iniezione
in uno spazio sottocutaneo che non sia troppo
superficiale (strato cutaneo) o troppo profondo
(muscolo).
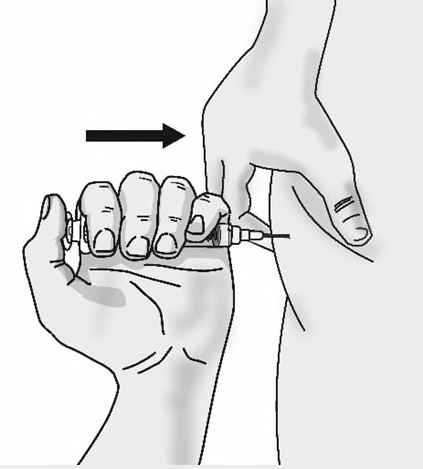
e)Spingere lentamente lo stantuffo fino a quando
tutto il medicinale è stato iniettato. Rilasciare la
piega della pelle e rimuovere delicatamente l’ago.
Non rimettere il cappuccio all’ago.
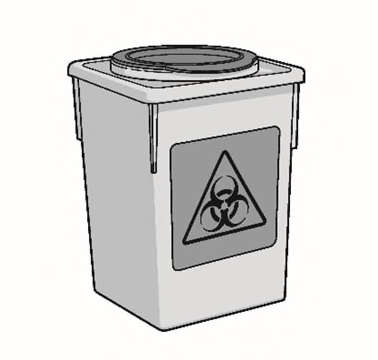
f)Gettare l’ago appuntito per iniezione calibro
27 x 13 mm e la siringa in un contenitore per
oggetti taglienti.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a TAKHZYROForma farmaceutica: Soluzione per infusione in siringa pre-riempita, 200 mgPrincipio attivo: Drugs used in hereditary angioedemaProduttore: CSL BEHRING GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile/ per infusione, <500 UIPrincipio attivo: c1-inhibitor, plasma derivedProduttore: CSL BEHRING GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 500 UPrincipio attivo: c1-inhibitor, plasma derivedProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiesta
Medici online per TAKHZYRO
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di TAKHZYRO — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














