
TWINRIX

Come usare TWINRIX
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
F oglio illustrativo: informazioni per l’utilizzatore
Twinrix Adulti, sospensione iniettabile in siringa preriempita
Vaccino (adsorbito) antiepatite A (inattivato) ed antiepatite B (rDNA) (HAB)
Legga attentamente questo foglio
prima che le venga somministrato il vaccino perché contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo vaccino è stato prescritto soltanto per lei. Non lo dia mai ad altri.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è Twinrix Adulti e a che cosa serve
- 2. Cosa deve sapere prima di ricevere Twinrix Adulti
- 3. Come usare Twinrix Adulti
- 4. Possibili effetti indesiderati
- 5. Come conservare Twinrix Adulti
- 6. Contenuto della confezione e altre informazioni
1. Che cos' è Twinrix Adulti e a che cosa serve
Twinrix Adulti è un vaccino usato negli adulti e negli adolescenti a partire da 16 anni di età per la
prevenzione di due malattie infettive: epatite A ed epatite B. Il vaccino agisce stimolando l’organismo a
produrre una protezione (anticorpi) contro queste malattie.
- Epatite A:l’epatite A è una malattia infettiva che colpisce il fegato e che è causata dal virus dell’epatite A. Il virus dell’epatite A può essere trasmesso da persona a persona tramite il cibo e le bevande che contengono il virus o nuotando in acque contaminate da fognature. I sintomi dell’epatite A iniziano 3-6 settimane dopo essere entrati in contatto con il virus. Questi si manifestano con nausea (malessere), febbre, indolenzimento e dolori. Dopo alcuni giorni la parte bianca degli occhi e la pelle diventano gialle (ittero). La gravità ed il tipo di sintomi possono variare. I bambini piccoli possono non sviluppare l’ittero. La maggior parte delle persone si ristabilisce completamente ma la patologia è usualmente abbastanza grave da comportare uno stato di malessere per circa un mese.
- Epatite B:l’epatite B è causata dal virus dell’epatite B. Esso provoca l’ingrossamento del fegato (infiammazione). Il virus si trova nei fluidi dell’organismo come sangue, fluido seminale, secrezioni vaginali o saliva (sputo) di persone infette.
La vaccinazione è la soluzione migliore per la protezione contro queste malattie. Nessuno dei
componenti contenuti nel vaccino può causare infezione.
2. Cosa deve sapere prima di ricevere Twinrix Adulti
Twinrix Adulti non deve essere somministrato se:
- se è allergico
- al principio attivo o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- alla neomicina I segni di reazione allergica possono comprendere eritema pruriginoso della pelle, respiro corto, gonfiore del volto o della lingua.
- si è precedentemente avuta una reazione allergica con qualsiasi altro vaccino contro epatite A o B.
- si ha un’infezione grave con temperatura elevata (oltre 38°C). Un’infezione lieve come un raffreddore non comporta problemi, ma bisogna informare prima il medico.
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di ricevere Twinrix Adulti se:
- ha avuto qualche problema di salute in seguito a precedenti somministrazioni di vaccino.
- ha un sistema immunitario indebolito a causa di malattie o a trattamento farmacologico.
- ha problemi di sanguinamento o di formazioni eccessive di lividi.
Si può verificare svenimento (soprattutto negli adolescenti) in seguito a, o anche prima di, qualsiasi
iniezione con ago. Pertanto informi il medico o l’infermiere se è svenuto con una iniezione precedente.
Nei soggetti obesi è stata osservata una scarsa risposta al vaccino, con la possibilità che non si
raggiunga la protezione contro l’epatite A. È stata anche osservata una scarsa risposta al vaccino, con
la possibilità che non si raggiunga la protezione contro l’epatite B, negli anziani, negli uomini
piuttosto che nelle donne, nei fumatori, negli obesi, nelle persone ammalate da molto tempo o che
ricevono alcuni tipi di trattamento farmacologico.
Il medico può consigliarla di effettuare un esame del sangue dopo il completamento del ciclo di
vaccinazione allo scopo di controllare se ha raggiunto una risposta immunitaria soddisfacente. In caso
contrario, il medico sarà in grado di consigliarla circa l’eventuale necessità di ulteriori dosi.
Altri medicinali e Twinrix Adulti
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico o al farmacista prima di farsi somministrare questo
vaccino.Non è noto se Twinrix Adulti passi nel latte materno; tuttavia non sono da attendersi problemi
per i bambini che vengono allattati al seno.
Twinrix Adulti contiene neomicina e sodio
Informi il medico se ha manifestato reazioni allergiche alla neomicina (antibiotico).
Questo vaccino contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente ‘senza sodio’.
3. Come usare Twinrix Adulti
Riceverà un totale di 3 iniezioni in 6 mesi. Ogni iniezione verrà somministrata nel corso di differenti
visite. Le rimanenti 2 dosi verranno somministrate un mese e sei mesi dopo la prima dose.
- Prima dose: alla data stabilita
- Seconda dose: 1 mese dopo
- Terza dose: 6 mesi dopo la prima dose
Twinrix Adulti può anche essere somministrato come ciclo di tre dosi in un mese. Questo schema può
essere utilizzato esclusivamente in quegli adulti che necessitano di una protezione rapida (ad esempio:
viaggiatori). La prima dose verrà somministrata ad una data stabilita. Le rimanenti due dosi verranno
date 7 e 21 giorni dopo la prima dose. Si raccomanda la somministrazione di una quarta dose a 12
mesi.
- Prima dose: alla data stabilita
- Seconda dose: 7 giorni dopo
- Terza dose: 21 giorni dopo la prima dose
- Quarta dose: 12 mesi dopo la prima dose
Il medico la informerà se fossero necessarie altre iniezioni o richiami.
Come indicato nel paragrafo 2, una scarsa risposta al vaccino, con la possibilità che non si raggiunga
la protezione contro l’epatite B, è molto più comune negli anziani e negli uomini piuttosto che nelle
donne, nei fumatori, negli obesi, nelle persone ammalate da molto tempo o che ricevono alcuni tipi di
trattamento farmacologico.
Il medico può consigliarla di effettuare un esame del sangue dopo il completamento del ciclo di
vaccinazione allo scopo di controllare se ha raggiunto una risposta immunitaria soddisfacente. In caso
contrario, il medico sarà in grado di consigliarla circa l’eventuale necessità di ulteriori dosi.
Se non si rispetta il calendario di vaccinazione fissato, informi il medico per concordare un’altra visita.
Si assicuri che tutto il ciclo di vaccinazione composto di tre iniezioni sia stato completato. In caso
contrario, potrebbe non essere completamente protetto contro le malattie.
Il medico somministrerà Twinrix Adulti sotto forma di un’iniezione intramuscolare nella parte alta del
braccio.
Il vaccino non deve essere iniettato (profondamente) nella cute o per via intramuscolare nella natica
visto che la protezione potrebbe essere inferiore.
Il vaccino non deve mai essere somministrato in vena.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, Twinrix Adulti può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Gli effetti indesiderati che possono verificarsi sono i seguenti:
Molto comuni(può verificarsi 1 caso ogni 10 o più dosi di vaccino): mal di testa, dolore e gonfiore al
sito di iniezione, stanchezza.
Comuni(può verificarsi fino a 1 caso ogni 10 dosi di vaccino): diarrea, nausea, gonfiore, ematoma o
prurito al sito di iniezione, sensazione generale di malessere.
Non comuni(può verificarsi fino a 1 caso ogni 100 dosi di vaccino): capogiri, vomito, dolore di
stomaco, dolori muscolari, infezione del tratto respiratorio superiore, febbre maggiore o uguale a
37,5°C.
Rari(può verificarsi fino a 1 caso ogni 1.000 dosi di vaccino): gonfiore alle ghiandole del collo, delle
ascelle o dell’inguine (linfoadenopatia), perdita di sensibilità della pelle al dolore o al tatto
(ipoestesia)formicolio (parestesia), eruzione della pelle, prurito, dolore articolare, perdita di appetito,
pressione sanguigna bassa, sintomi simil-influenzali quali temperatura elevata, mal di gola, naso che
gocciola, tosse e brividi.
Molto rari(può verificarsi fino a 1 caso ogni 10.000 dosi di vaccino):
- Gli effetti indesiderati che si sono verificati molto raramente durante gli studi clinici o l’uso routinario del vaccino o dei singoli vaccini antiepatite A e antiepatite B comprendono: riduzione delle piastrine nel sangue, che aumenta il rischio di sanguinamento o di formazione di lividi (trombocitopenia), macchie color porpora o rosso bruno, visibili attraverso la pelle (porpora trombocitopenica), gonfiore o infezione del cervello (encefalite), malattia degenerativa del cervello (encefalopatia), infiammazione dei nervi (neurite), intorpidimento o debolezza delle braccia e delle gambe (neuropatia), paralisi, convulsioni, gonfiore al viso, alla bocca o alla gola (edema
angioneurotico), rigonfiamenti sulla pelle di colore porpora o viola-rossastro (lichen planus), gravi
eruzioni sulla pelle (eritema multiforme), orticaria, gonfiore alle articolazioni, debolezza muscolare,
infezione localizzata attorno al cervello che può dare mal di testa grave con rigidità al collo e
sensibilità alla luce (meningite), infiammazione di alcuni vasi sanguigni (vasculite), risultati anomali
dei test di laboratorio per il fegato, sclerosi multipla, gonfiore del midollo spinale (mielite), palpebre
cascanti e cedimento muscolare in un lato del volto (paralisi facciale), temporanea infiammazione dei
nervi, che provoca dolore, debolezza e paralisi alle estremità che spesso progredisce fino al torace e al
volto (sindrome di Guillain-Barré), malattia ai nervi dell’occhio (neurite ottica), dolore immediato al
sito di iniezione, dolore pungente e sensazione di bruciore.
Gravi reazioni allergiche (anafilassi, reazioni anafilattoidi e forme simili alla malattia da siero possono
verificarsi anche molto raramente (fino a 1 su 10.000 dosi di vaccino).). I segni di gravi reazioni
allergiche possono essere eruzioni sulla pelle che possono essere pruriginose o bollose, gonfiore agli
occhi e al volto, difficoltà nel respirare o nell’inghiottire, improvviso abbassamento della pressione
sanguigna e perdita di conoscenza. Queste reazioni possono manifestarsi prima di lasciare
l’ambulatorio. Tuttavia, se presenta uno qualsiasi di questi sintomi deve contattare con urgenza il
medico.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Twinrix Adulti
Tenere fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sul cartone. La data di scadenza si
riferisce all’ultimo giorno del mese.
Conservare in frigorifero (2 ° C – 8 ° C).
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Non congelare. Il congelamento rovina il vaccino.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. Chieda al
farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione a altre informazioni
Cosa contiene Twinrix Adulti
- I principi attivi sono: Virus dell’epatite A (inattivato) 720 Unità ELISA Antigene di superficie dell’epatite B 20 microgrammi
Prodotto su cellule umane diploidi (MRC-5)
Adsorbito su alluminio idrossido, idrato 0,05 milligrammi Al 3+
Prodotto su cellule di lievito ( Saccharomyces cerevisiae) tramite tecnologia ricombinante del
DNA
Adsorbito su alluminio fosfato 0,4 milligrammi Al 3+
- Gli altri componenti del vaccino sono: sodio cloruro, acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Twinrix Adulti e contenuto della confezione
Sospensione iniettabile in siringa preriempita.
Twinrix Adulti è un liquido bianco leggermente lattiginoso.
Twinrix Adulti è disponibile in siringa preriempita da 1 dose con po senza aghi separati, in confezioni
da 1, 10 e 25.
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’Autorizzazione all’Immissione in commercio e produttore:
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgio
Per ulteriori informazioni su Twinrix Adulti, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio.
België/ Belgique/Belgien
GlaxoSmithKline Pharmaceuticals SA/NV
Tél/Tel: + 32 10 85 52 00
Lietuva
GlaxoSmithKline Biologicals SA
Tel. +370 80000334
България
GlaxoSmithKline Biologicals SA
Тел. +359 80018205
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals SA/NV
Tél/Tel: + 32 10 85 52 00
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11
[email protected]
Magyarország
GlaxoSmithKline Biologicals SA
Tel.: +36 80088309
Danmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
[email protected]
Malta
GlaxoSmithKline Biologicals SA
Tel: +356 80065004
Deutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
[email protected]
Nederland
GlaxoSmithKline BV
Tel: + 31 (0)33 2081100
Norge
GlaxoSmithKline AS
Tlf: + 47 22 70 20 00
Ελλάδα
GlaxoSmithKline Μονοπρόσωπη A.E.B.E.
Tηλ: + 30 210 68 82 100
Eesti
GlaxoSmithKline Biologicals SATel: +372
8002640
Österreich
GlaxoSmithKline Pharma GmbH
Tel: + 43 (0)1 970 75-0
[email protected]
España
GlaxoSmithKline, S.A.
Tel: + 34 900 202 700
[email protected]
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
France
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
[email protected]
Hrvatska
GlaxoSmithKline Biologicals SA
Tel.: +385 800787089
Portugal
Smith Kline & French Portuguesa - Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
[email protected]
România
GlaxoSmithKline Biologicals SA
Tel: +40 800672524
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
Slovenija
GlaxoSmithKline Biologicals SA
Tel: +386 80688869
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
GlaxoSmithKline Biologicals SA
Tel: +421 800500589
Italia
GlaxoSmithKline S.p.A.
Tel: + 39 (0)45 7741111
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Κύπρος
GlaxoSmithKline Biologicals SA
Τηλ: +357 80070017
Sverige
GlaxoSmithKline AB
Tel: + 46 (0)8 638 93 00
[email protected]
Latvija
GlaxoSmithKline Biologicals SA
Tel: +371 80205045
United Kingdom (Irlanda del Nord)
GlaxoSmithKline Biologicals SA
Tel: +44 (0)800 221441
[email protected]
Altre fonti di informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia Europea
dei Medicinali: http://www.ema.europa.eu/.
---------------------------------------------------------------------------------------------------------------------
Le seguenti informazioni sono destinate esclusivamente agli operatori sanitari:
Durante la conservazione, si può osservare un fine deposito bianco ed un surnatante limpido.
Il vaccino deve essere risospeso prima dell’uso. Una volta ricreata la sospensione, il vaccino avrà un
aspetto bianco velato uniforme.
Preparazione della sospensione del vaccino per ottenere l’aspetto bianco velato uniforme
Il vaccino deve essere risospeso seguendo i passaggi di seguito indicati.
- 1. Tenere la siringa in posizione verticale con la mano chiusa.
- 2. Agitare la siringa inclinandola a testa in giù e viceversa.
- 3. Ripetere questa azione vigorosamente per almeno 15 secondi.
- 4. Controllare ancora il vaccino:
- a. se il vaccino appare come una sospensione bianca velata uniforme, è pronto per l'uso - l'aspetto non dovrebbe essere chiaro .
- b. se il vaccino non appare ancora come una sospensione bianca velata uniforme – agitare la siringa nuovamente a testa in giù e viceversa e poi di nuovo per almeno altri 15 secondi - poi ispezionare di nuovo.
Il vaccino deve essere ispezionato visivamente per eventuali corpi estranei e / o cambiamenti
nell'aspetto fisico prima della somministrazione. Nel caso si osservi quanto sopra, non somministrare
il vaccino .
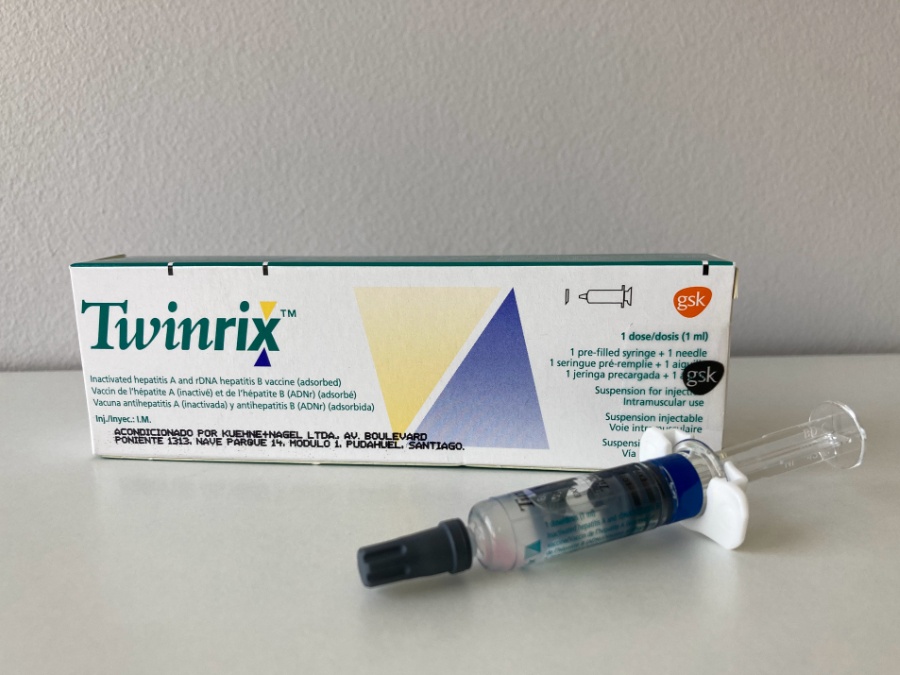
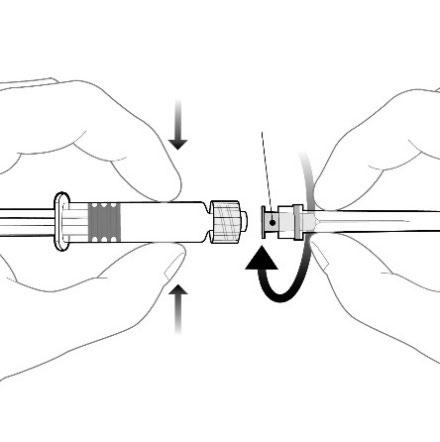
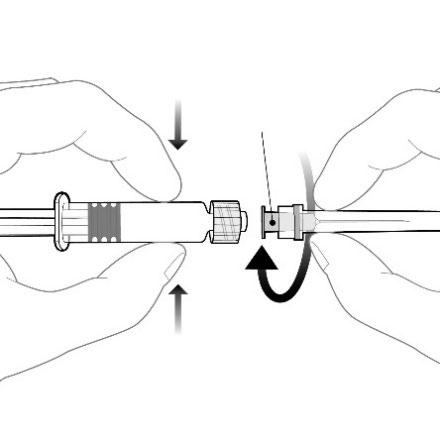
Istruzioni per la siringa pre-riempita
Adattatore Luer Lock
Tenere la siringa per il corpo, non per lo
stantuffo.
Svitare il tappo della siringa ruotando in senso
antiorario.
Stantuff
Corpo
Cappuccio
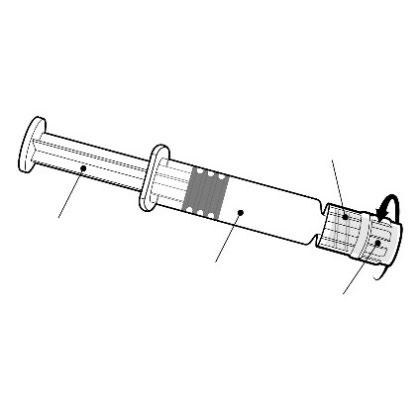
Mozzo dell’ago
Per attaccare l’ago alla siringa, collegare
delicatamente il mozzo dell’ago all’Adattatore
Luer Lock e ruotare un quarto di giro in senso
orario fino a quando se ne avverte il blocco.
Non estrarre lo stantuffo della siringa dal corpo.
Se ciò accade, non somministrare il vaccino.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
Twinrix Pediatrico, Sospensione iniettabile in siringa preriempita
Vaccino (adsorbito) antiepatite A (inattivato) ed antiepatite B (rDNA) (HAB)
Leggere attentamente questo foglio prima che il bambino riceva il vaccino perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo vaccino è stato prescritto soltanto per il bambino. Non lo dia mai ad altri.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
questo vaccino può essere somministrato agli adolescenti e bambini quindi deve leggerlo lei per il suo
bambino.
Contenuto di questo foglio:
- 1. Che cos’è Twinrix Pediatrico e a che cosa serve
- 2. Cosa deve sapere prima di prendere Twinrix Pediatrico
- 3. Come viene somministrato Twinrix Pediatrico
- 4. Possibili effetti indesiderati
- 5. Come conservare Twinrix Pediatrico
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è Twinrix Pediatrico e a che cosa serve
Twinrix Pediatrico è un vaccino usato nei bambini e negli adolescenti a partire da 1 anno fino ai 15 anni
inclusi per la prevenzione di due malattie: epatite A ed epatite B. Il vaccino agisce stimolando
l’organismo a produrre una protezione (anticorpi) contro queste malattie.
- Epatite A:l’epatite A è una malattia infettiva che può colpire il fegato. Questa malattia è causata dal virus dell’epatite A. Il virus dell’epatite A può essere trasmesso da persona a persona tramite il cibo e le bevande o nuotando in acque contaminate da fognature. I sintomi dell’epatite A iniziano 3-6 settimane dopo essere entrati in contatto con il virus. Questi si manifestano con nausea (malessere) febbre, indolenzimento e dolori. Dopo alcuni giorni la parte bianca degli occhi e la pelle possono diventare gialle (ittero). La gravità ed il tipo di sintomi possono variare. I bambini piccoli possono non sviluppare l’ittero. La maggior parte delle persone si ristabilisce completamente ma la malattia è usualmente abbastanza grave da comportare una assenza dal lavoro di circa un mese.
- Epatite B:l’epatite B è causata dal virus dell’epatite B. Esso provoca l’ingrossamento del fegato (infiammazione). Il virus si trova nei fluidi dell’organismo come sangue, fluido seminale, secrezioni vaginali o saliva (sputo) di persone infette.
La vaccinazione è la soluzione migliore per la protezione contro queste malattie. Nessuno dei
componenti del vaccino può causare infezione.
2. Cosa deve sapere prima di prendere Twinrix Pediatrico
Twinrix Pediatrico non deve essere somministrato se:
- lei è allergico a:
- principio attivo o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- neomicina I segni di reazione allergica possono comprendere eritema pruriginoso della pelle, respiro corto, gonfiore del volto o della lingua.
- lei ha precedentemente avuto una reazione allergica con qualsiasi altro vaccino contro epatite A o B.
- lei ha un’infezione grave con temperatura elevata (oltre 38°C). Un’infezione lieve come un raffreddore non comporta problemi, ma bisogna dirlo prima al medico.
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di prendere Twinrix Pediatrico se:
- lei ha avuto qualche problema di salute in seguito a precedenti somministrazioni di vaccino
- il suo sistema immunitario è indebolito a causa di malattia o trattamento farmacologico
- lei ha problemi di sanguinamento o di formazioni eccessive di lividi
Si può verificare svenimento (soprattutto negli adolescenti) in seguito a, o anche prima di, qualsiasi
iniezione con ago. Pertanto, informi il medico o l’infermiere se lei è svenuto con una iniezione
precedente.
Altri medicinali e Twinrix Pediatrico
Twinrix Pediatrico può essere somministrato in concomitanza ad un vaccino contro il Papillomavirus
Umano (HPV) in un sito separato (un’altra parte del corpo, ad esempio l’altro braccio) durante la stessa
visita.
Informi il medico o il farmacista se lei sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico o al farmacista prima di ricevere questo vaccino.
Non è noto se Twinrix Pediatrico passi nel latte materno; tuttavia, non sono da attendersi problemi per i
bambini che vengono allattati al seno.
Twinrix Pediatrico contiene neomicina e sodio
Informi il medico se lei ha manifestato reazioni allergiche alla neomicina (antibiotico).
Questo vaccino contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente ‘senza sodio’.
3. Come viene somministrato Twinrix Pediatrico
Lei riceverà un totale di 3 iniezioni in 6 mesi. Ogni iniezione verrà somministrata nel corso di
differenti visite. La prima dose verrà somministrata alla data stabilita. Le rimanenti 2 dosi verranno
somministrate un mese e sei mesi dopo la prima dose.
- Prima dose: alla data stabilita
- Seconda dose: un mese dopo
- Terza dose: sei mesi dopo la prima dose
Il medico la informerà se fossero necessarie altre iniezioni o richiami.
Se lei non rispetta il calendario di vaccinazione fissato, informi il medico per concordare un’altra
visita.
Si assicuri di avere completato tutto il ciclo di vaccinazione composto da tre iniezioni. In caso
contrario, lei potrebbe non essere completamente protetto contro le malattie.
Il medico somministrerà Twinrix Pediatrico sotto forma di un’iniezione intramuscolare nella parte alta
del braccio o nella parte alta della coscia nei bambini.
Il vaccino non deve mai essere somministrato in vena.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo vaccino può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Gli effetti indesiderati che possono verificarsi sono i seguenti:
Gli effetti indesiderati che si sono verificati durante gli studi clinici o durante l’uso routinario del
vaccino o con i singoli vaccini antiepatite A e antiepatite B o con la formulazione adulti di Twinrix.
Molto comuni(può verificarsi 1 caso ogni 10 o più dosi di vaccino): dolore e rossore al sito di
iniezione.
Comuni(può verificarsi fino a 1 caso ogni 10 dosi di vaccino): sonnolenza, mal di testa, nausea,
perdita di appetito, gonfiore o ematoma al sito di iniezione, sensazione generale di malessere,
stanchezza, febbre maggiore o uguale a 37,5°C, irritabilità.
Non comuni(può verificarsi fino a 1 caso ogni 100 dosi di vaccino): diarrea, vomito, dolore allo
stomaco, eruzione della pelle, dolori muscolari, infezione del tratto respiratorio superiore.
Rari(può verificarsi fino a 1 caso ogni 1.000 dosi di vaccino): gonfiore alle ghiandole del collo, delle
ascelle o dell’inguine (linfoadenopatia), capogiri, perdita di sensibilità della pelle al dolore o al tatto
(ipoestesia), formicolio (parestesia), orticaria, prurito, dolore articolare, pressione sanguigna bassa,
sintomi simil-influenzali quali temperatura elevata, mal di gola, naso che gocciola, tosse e brividi.
Molto rari(può verificarsi fino a 1 caso ogni 10.000 dosi di vaccino): riduzione delle piastrine nel
sangue, che aumenta il rischio di sanguinamento o di formazione di lividi (trombocitopenia), macchie
color porpora o rosso bruno, visibili attraverso la pelle (porpora trombocitopenica), gonfiore o
infezione del cervello (encefalite), malattia degenerativa del cervello (encefalopatia), infiammazione
dei nervi (neurite), intorpidimento o debolezza delle braccia e delle gambe (neuropatia), paralisi,
convulsioni, gonfiore al viso, alla bocca o alla gola (edema angioneurotico), rigonfiamenti sulla pelle
di colore porpora o viola-rossastro (lichen planus), gravi eruzioni sulla pelle (eritema multiforme),
gonfiore alle articolazioni, debolezza muscolare, infezione localizzata attorno al cervello che può dare
mal di testa grave con rigidità al collo e sensibilità alla luce (meningite), infiammazione di alcuni vasi
sanguigni (vasculite), risultati anomali dei test di laboratorio per il fegato, sclerosi multipla, gonfiore
del midollo spinale (mielite), palpebre cascanti e cedimento muscolare in un lato del volto (paralisi
facciale), temporanea infiammazione dei nervi, che provoca dolore, debolezza e paralisi alle estremità
che spesso progredisce fino al torace e al volto (sindrome di Guillain-Barré), malattia ai nervi
dell’occhio (neurite ottica), dolore immediato al sito di iniezione, dolore pungente e sensazione di
bruciore
Gravi reazioni allergiche (anafilassi, reazioni anafilattoidi e forme simili alla malattia da siero)
possono verificarsi anche molto raramente (fino a 1 su 10.000 dosi di vaccino).. I segni di gravi
reazioni allergiche possono essere eruzioni sulla pelle che possono essere pruriginose o bollose,
gonfiore agli occhi e al volto, difficoltà nel respirare o nell’inghiottire, improvviso abbassamento della
pressione sanguigna e perdita di conoscenza. Queste reazioni possono manifestarsi prima di lasciare
l’ambulatorio. Tuttavia, se lei presenta uno qualsiasi di questi sintomi deve contattare con urgenza il
medico.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Twinrix Pediatrico
Tenere fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sul cartone. La data di scadenza si
riferisce all’ultimo giorno del mese.
Conservare in frigorifero (2 ° C – 8 ° C).
Conservare nella confezione originale per proteggere dalla luce.
Non congelare. Il congelamento rovina il vaccino.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. Chieda al
farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Twinrix Pediatrico
- I principi attivi sono: Virus dell’epatite A (inattivato) 360 Unità ELISA Antigene di superficie dell’epatite B 10 microgrammi
Prodotto su cellule umane diploidi (MRC-5)
Adsorbito su alluminio idrossido, idrato 0,025 milligrammi Al 3+
Prodotto su cellule di lievito ( Saccharomyces cerevisiae) tramite tecnologia ricombinante del
DNA
Adsorbito su alluminio fosfato 0,2 milligrammi Al 3+
- Gli altri componenti del vaccino sono: sodio cloruro, acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Twinrix Pediatrico e contenuto della confezione
Sospensione iniettabile in siringa preriempita.
Twinrix Pediatrico è un liquido bianco leggermente lattiginoso.
Twinrix Pediatrico è disponibile in siringa preriempita da 1 dose con o senza aghi separati, confezioni
da 1, 10 e 50.
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’Autorizzazione all’Immissione in commercio e produttore:
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgio
Per ulteriori informazioni su Twinrix Pediatrico, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio.
België/ Belgique/Belgien
GlaxoSmithKline Pharmaceuticals SA/NV
Tél/Tel: + 32 10 85 52 00
Lietuva
GlaxoSmithKline Biologicals SA
Tel. +370 80000334
България
GlaxoSmithKline Biologicals SA
Тел. +359 80018205
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals SA/NV
Tél/Tel: + 32 10 85 52 00
Česká republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11
[email protected]
Magyarország
GlaxoSmithKline Biologicals SA
Tel.: +36 80088309
Danmark
GlaxoSmithKline Pharma A/S
Tlf: + 45 36 35 91 00
[email protected]
Malta
GlaxoSmithKline Biologicals SA
Tel: +356 80065004
Deutschland
GlaxoSmithKline GmbH & Co. KG
Tel: + 49 (0)89 360448701
[email protected]
Nederland
GlaxoSmithKline BV
Tel: + 31 (0)33 2081100
Norge
GlaxoSmithKline AS
Tlf: + 47 22 70 20 00
Ελλάδα
GlaxoSmithKline Μονοπρόσωπη A.E.B.E.
Tηλ: + 30 210 68 82 100
Eesti
GlaxoSmithKline Biologicals SATel: +372
8002640
Österreich
GlaxoSmithKline Pharma GmbH
Tel: + 43 1 970 75-0
[email protected]
España
GlaxoSmithKline, S.A.
Tel: + 34 900 202 700
[email protected]
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Portugal
Smith Kline & French Portuguesa - Produtos
Farmacêuticos, Lda.
Tel: + 351 21 412 95 00
[email protected]
România
GlaxoSmithKline Biologicals SA
Tel: +40 800672524
Ireland
GlaxoSmithKline (Ireland) Ltd
Tel: + 353 (0)1 495 5000
France
Laboratoire GlaxoSmithKline
Tél: + 33 (0) 1 39 17 84 44
[email protected]
Hrvatska
GlaxoSmithKline Biologicals SA
Tel.: +385 800787089
Slovenija
GlaxoSmithKline Biologicals SA.
Tel: +386 80688869
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
GlaxoSmithKline Biologicals SA
Tel.: +421 800500589
Italia
GlaxoSmithKline S.p.A.
Tel: + 39 (0)45 7741 111
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Κύπρος
GlaxoSmithKline Biologicals SA
Τηλ: +357 80070017
Sverige
GlaxoSmithKline AB
Tel: + 46 (0)8 638 93 00
[email protected]
Latvija
GlaxoSmithKline Biologicals SA
Tel: +371 80205045
United Kingdom ((Northern Ireland)
GlaxoSmithKline Biologicals SA
Tel: +44 (0)800 221441
[email protected]
Questo foglio è stato è stato aggiornato il
Altre fonti di informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia
Europea dei Medicinali: http://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------
Le seguenti informazioni sono riservate al personale sanitario.
Durante la conservazione, si può osservare un fine deposito bianco ed un surnatante limpido.
Il vaccino deve essere ri-sospeso prima dell’uso. Una volta ricreata la sospensione, il vaccino avrà un
aspetto bianco velato uniforme.
Preparazione della sospensione del vaccino per ottenere l’aspetto bianco velato uniforme
Il vaccino deve essere risospeso seguendo i passaggi di seguito indicati.
- 1. Tenere la siringa in posizione verticale con la mano chiusa.
- 2. Agitare la siringa inclinandola a testa in giù e viceversa.
- 3. Ripetere questa azione vigorosamente per almeno 15 secondi.
- 4. Controllare ancora il vaccino:
- a. se il vaccino appare come una sospensione bianca velata uniforme, è pronto per l'uso
- l'aspetto non dovrebbe essere chiaro .
- b. se il vaccino non appare ancora come una sospensione bianca velata uniforme – agitare la siringa nuovamente a testa in giù e viceversa e poi di nuovo per almeno altri 15 secondi - poi ispezionare di nuovo.
Il vaccino deve essere ispezionato visivamente per eventuali corpi estranei e / o cambiamenti
nell'aspetto fisico prima della somministrazione. Nel caso si osservi quanto sopra, non somministrare
il vaccino .
Istruzioni per la siringa pre-riempita
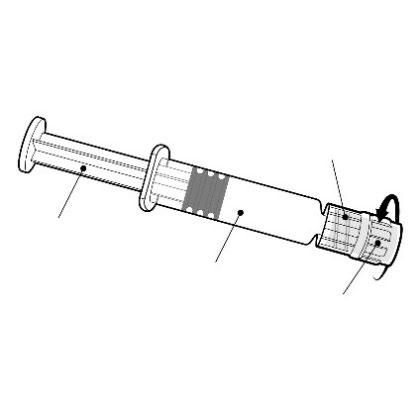
Adattatore Luer Lock
Tenere la siringa per il corpo, non per lo
stantuffo.
Svitare il tappo della siringa ruotando in senso
antiorario.
Stantuffo
Corpo
Cappuccio
Mozzo dell’ago
Per attaccare l’ago alla siringa, collegare
delicatamente il mozzo dell’ago all’Adattatore
Luer Lock e ruotare un quarto di giro in senso
orario fino a quando se ne avverte il blocco.
Non estrarre lo stantuffo della siringa dal corpo.
Se ciò accade, non somministrare il vaccino.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
ai requisiti di legge locali.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaNo
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a TWINRIXForma farmaceutica: Sospensione iniettabile in siringa pre-riempita, 720 U. + 20 MCGPrincipio attivo: combinationsProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiestaForma farmaceutica: Sospensione iniettabilePrincipio attivo: hepatitis B, purified antigenProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiestaForma farmaceutica: Sospensione iniettabile, 0,5MLPrincipio attivo: hepatitis B, purified antigenProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiesta
Medici online per TWINRIX
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di TWINRIX — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














