
CEPROTIN

Come usare CEPROTIN
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
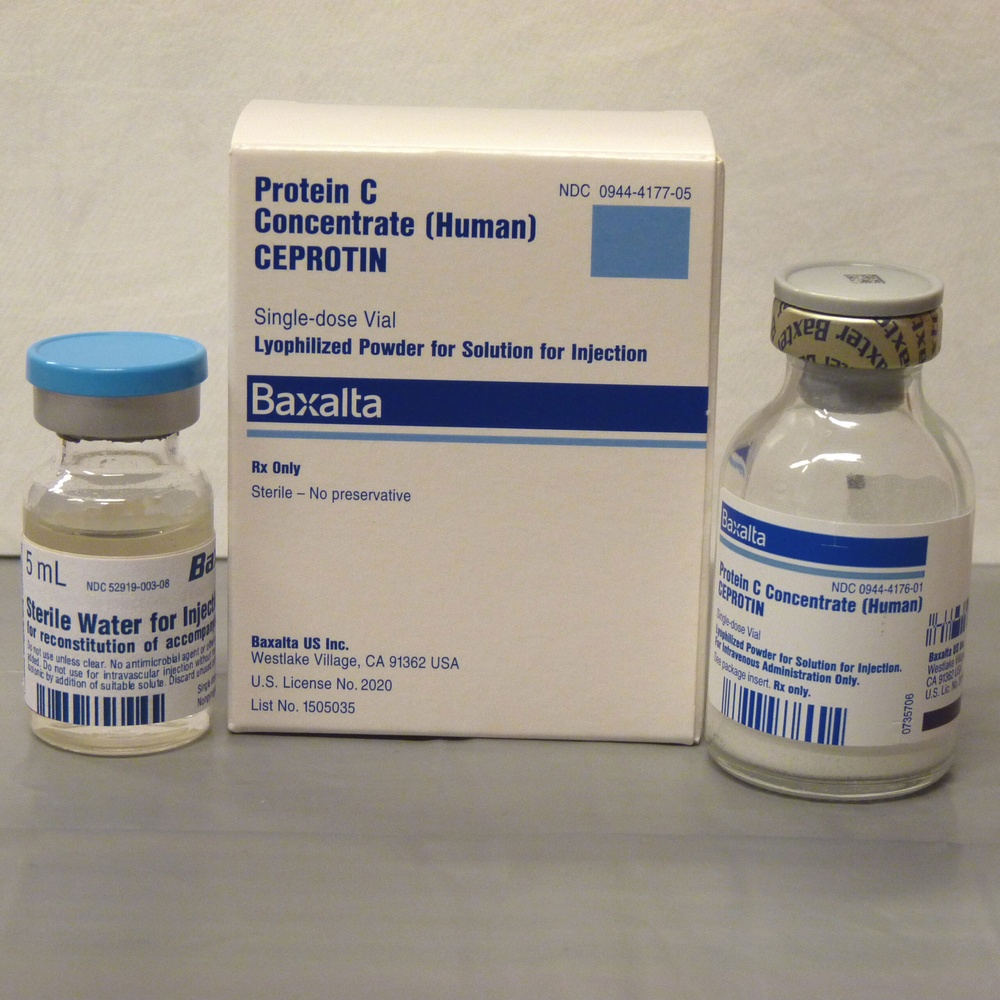
CEPROTIN 500 UI polvere e solvente per soluzione iniettabile
Proteina C umana
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CEPROTIN e a cosa serve
- 2. Cosa deve sapere prima di usare CEPROTIN
- 3. Come usare CEPROTIN
- 4. Possibili effetti indesiderati
- 5. Come conservare CEPROTIN
- 6. Contenuto della confezione e altre informazioni
1. Che cos’è CEPROTIN e a cosa serve
CEPROTIN appartiene ad una classe di medicinali chiamati antitrombotici. Questo medicinale
contiene Proteina C, una proteina naturale prodotta nel fegato e che è presente anche nel sangue.
La Proteina C svolge un ruolo importante nella prevenzione di una formazione eccessiva di coaguli
e quindi previene e/o cura la trombosi intravascolare.
CEPROTIN viene impiegato nel trattamento e nella prevenzione di lesioni cutanee trombotiche ed
emorragiche (denominate porpora fulminante) in pazienti con grave deficit congenito di proteina C.
Inoltre CEPROTIN può essere usato per trattare una rara complicanza di un farmaco usato per rendere
il sangue più fluido (farmaco anticoagulante denominato cumarina) che può causare gravi lesioni
cutanee (necrosi).
Inoltre CEPROTIN viene usato per prevenire la trombosi in pazienti con grave deficit congenito di
proteina C, in presenza di una o più delle seguenti condizioni:
- imminenti interventi chirurgici o terapia invasiva
- all'inizio di terapia a base di cumarina (farmaco anticoagulante, per rendere il sangue più fluido)
- nei casi in cui la terapia a base di cumarina da sola non sia sufficiente
- nei casi in cui la terapia a base di cumarina non sia possibile.
2. Cosa deve sapere prima di usare CEPROTIN
Non usi CEPROTIN:
- se è allergico (ipersensibile) alla Proteina C umana o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6) incluse le proteine murine o l'eparina.
Tuttavia, nel caso di complicazioni derivanti dalla formazione di coaguli di sangue nei vasi sanguigni
(complicanze trombotiche) che comportino un rischio per la vita, il suo medico potrà decidere
comunque di proseguire il trattamento con CEPROTIN.
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare CEPTROTIN. Faccia particolare attenzione con
CEPROTIN in caso di insorgenza di sintomi allergici. Tali sintomi includono arrossamenti cutanei,
prurito, difficoltà respiratoria, bassa pressione sanguigna, oppressione toracica e shock. Nel caso in cui
dovesse avere questi sintomi durante la somministrazione di CEPROTIN, è necessario interrompere
l'iniezione. Questi sintomi possono costituire una reazione allergica verso uno o più dei componenti,
alle proteine murine o all'eparina. Il preparato può contenere tracce di eparina e/o di proteine murine
in conseguenza del processo di produzione. In caso di insorgenza di una reazione del genere, il medico
deciderà il trattamento più appropriato.
Se questo preparato viene utilizzato in pazienti con grave carenza congenita di proteina C, possono
insorgere anticorpi che inibiscono la proteina C e che pertanto diminuiscono l'effetto del preparato.
Tuttavia, fino ad ora ciò non è stato osservato negli studi clinici.
Per i medicinali ottenuti da sangue o plasma umano vengono adottate alcune misure per evitare la
trasmissione di infezioni ai pazienti. Tali misure includono l’attenta selezione dei donatori di sangue
e di plasma per assicurare l’esclusione di coloro che potrebbero essere portatori di infezioni, e l’esame
di ciascuna donazione e di ciascun campione di plasma per individuare segni di virus/infezioni. Nel
processo di lavorazione del sangue o del plasma le aziende produttrici di questi prodotti includono
anche delle fasi in grado di rendere innocui o eliminare i virus. Nonostante questo, quando si
somministrano medicinali ottenuti da sangue o plasma umano, non è possibile escludere totalmente
la possibilità di contrarre delle infezioni. Questo riguarda anche virus finora sconosciuti o emergenti
o altri tipi di infezioni.
Le misure intraprese sono considerate efficaci per i virus capsulati come lo HIV, l’HBV e l’HCV e per
il virus HAV non capsulato. Le misure intraprese possono avere un valore limitato nei confronti di
virus non capsulati come ad esempio il parvovirus B19. L'infezione da parvovirus B19 può risultare
grave per le donne in gravidanza (infezione fetale) e per i soggetti che hanno il sistema immunitario
depresso o che hanno alcuni tipi di anemia (es. anemia emolitica).
Il medico potrà consigliarle la vaccinazione contro l’epatite A e B nel caso in cui le vengano
regolarmente / ripetutamente somministrati prodotti a base di Proteina C ottenuti da plasma umano.
Altri medicinali e CEPROTIN
Attualmente non sono note interazioni con altri medicinali.
Tuttavia, informi il suo medico o farmacista se sta assumendo o ha recentemente assunto qualsiasi
altro medicinale, anche quelli senza prescrizione.
Se lei passa al trattamento con anticoagulanti orali, deve continuare la terapia con CEPROTIN fino
a che il livello di anticoagulante orale nel sangue è adeguato e stabile.
CEPROTIN con cibi e bevande
Non pertinente.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico o al farmacista prima di usare questo medicinale.
Il medico deciderà se può effettuare il trattamento con CEPROTIN durante la gravidanza
e l’allattamento.
Guida di veicoli e utilizzo di macchinari
CEPROTIN non influisce sulla capacità di guida o sull’uso di macchinari.
Informazioni importanti su alcuni eccipienti di CEPROTIN
Poiché la quantità di sodio nella dose massima giornaliera può superare i 200 mg, di ciò devono tener
conto i pazienti che seguono una dieta a basso contenuto di sodio.
3. Come usare CEPROTIN
CEPROTIN deve essere usato per via endovenosa (infusione in vena). Le verrà somministrato sotto il
diretto controllo di un medico esperto nel trattamento della terapia sostitutiva con fattori/inibitori della
coagulazione nei casi in cui è possibile monitorare l'attività della proteina C. Il dosaggio varia a
seconda delle sue condizioni e del suo peso corporeo.
Dosaggio
Il dosaggio, la frequenza di somministrazione e la durata del trattamento dipendono dalla gravità del
suo deficit di proteina C, dalle sue condizioni cliniche e dai suoi livelli di proteina C nel sangue. Il
dosaggio e la frequenza delle somministrazioni devono essere modificate sulla base dell’efficacia
clinica e degli esami di laboratorio.
È necessario raggiungere inizialmente una attività della proteina C del 100% e mantenerla al di sopra
del 25% per tutta la durata del trattamento.
Si raccomanda una dose iniziale di 60-80 UI/kg. Il medico effettuerà diversi prelievi di sangue nel
tempo per determinare la quantità residua di proteina C nell’organismo.
Si raccomanda la misurazione dell'attività di proteina C per mezzo di substrati cromogenici per la
determinazione dei livelli plasmatici di proteina C prima e durante il trattamento con CEPROTIN.
Il dosaggio deve essere determinato sulla base di misurazioni di laboratorio dell’attività della proteina
- C. In caso di formazione di coaguli di sangue nei vasi sanguigni (evento trombotico acuto), queste misure devono essere eseguite ogni 6 ore fino a che le sue condizioni sono stabili, successivamente due volte al giorno e in ogni caso subito prima dell’iniezione successiva. È necessario ricordare che l’emivita della proteina C può risultare drasticamente ridotta in presenza di certe condizioni cliniche quali la trombosi acuta con porpora fulminante e necrosi cutanea.
In caso di malattia renale e/o epatica, è necessario informare il medico, il quale deciderà se modificare
o meno il trattamento.
In caso di passaggio al trattamento profilattico permanente con anticoagulanti orali, la terapia
sostitutiva con proteina C deve essere interrotta solo dopo l’ottenimento di un livello di
anticoagulazione stabile (vedere “Importanti informazioni circa alcuni componenti di CEPROTIN”).
In caso lei riceva un trattamento profilattico con proteina C, livelli di base più elevati dovrebbero
essere garantiti in situazioni a maggiore rischio di trombosi (ad esempio infezioni, traumi o interventi
chirurgici).
In caso di resistenza verso APC che rappresenta un fattore di rischio tromboembolico in una
percentuale fino al 5% della popolazione in Europa, il medico può decidere se modificare o meno il
trattamento.
Somministrazione
CEPROTIN le verrà somministrato per iniezione endovenosa dopo ricostituzione della polvere per
soluzione iniettabile con acqua sterilizzata per preparazioni iniettabili. Si raccomanda fortemente, ogni
volta che le viene somministrata una dose di Ceprotin, di registrare il nome ed il numero di lotto del
prodotto al fine di mantenere una storia dei lotti utilizzati.
Ricostituire la polvere liofilizzata per soluzione iniettabile di CEPROTIN con il solvente contenuto
nella confezione (acqua sterilizzata per preparazioni iniettabili) utilizzando l'ago sterile per la
ricostituzione. Ruotare leggermente il flaconcino fino al discioglimento della polvere.
Dopo la ricostituzione, la soluzione viene aspirata con l'ago filtro sterile in una siringa sterile
monouso. Un altro ago filtro sterile deve essere utilizzato per aspirare il contenuto di ciascun
flaconcino di CEPROTIN ricostituito. La soluzione deve essere eliminata nel caso in cui, dopo la
ricostituzione, risultino visibili delle particelle in sospensione.
La soluzione ricostituita deve essere somministrata immediatamente per iniezione endovenosa.
CEPROTIN deve essere somministrato ad una velocità di iniezione non superiore a 2 ml/minuto. In
bambini con un peso corporeo inferiore ai 10 kg, la velocità di iniezione non deve
superare 0,2 ml/kg/min.
Eventuali soluzioni non utilizzate, flaconcini vuoti, aghi e siringhe usati devono essere eliminati con
cura.
La frequenza e la durata del trattamento dipendono dalla gravità del deficit di proteina C, dai risultati
della determinazione di proteina C nel suo sangue, oltre che dalla localizzazione e dalla gravità della
trombosi.
In caso di trombosi acuta, CEPROTIN può essere somministrato ogni 6 ore. La frequenza delle
iniezioni può essere ridotta col diminuire della tendenza alla formazione di trombi.
Se usa più CEPROTIN di quanto deve
Si raccomanda di rispettare il dosaggio e la frequenza di somministrazione consigliati dal medico. Nel
caso in cui usasse una dose di CEPROTIN maggiore di quella raccomandata, informi il medico al più
presto possibile.
Se dimentica di usare CEPROTIN
Non pertinente.
Se interrompe il trattamento con CEPROTIN
Non interrompa l’uso di CEPROTIN senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Dopo somministrazione di CEPROTIN potrebbe notare qualcuno dei seguenti effetti indesiderati:
- Come con qualsiasi altro prodotto somministrato in vena possono verificarsi reazioni allergiche incluse reazioni gravi e potenzialmente a rischio per la vita (anafilassi).
Lei dovrebbe essere a conoscenza dei sintomi precoci di reazioni allergiche quali senso di
bruciore o di puntura nel sito di iniezione, brividi, rossore del volto, arrossamenti della
pelle, prurito, difficoltà respiratoria, nausea, cefalea, sonnolenza, pressione sanguigna
bassa e oppressione toracica.
- I seguenti effetti indesiderati sono stati osservati raramente nel corso degli studi clinici (meno di 1 caso su 1.000 dosi somministrate ai pazienti): prurito, rash cutaneo e vertigini.
- Nell’esperienza successiva all’immissione in commercio sono state registrate segnalazioni di irrequietezza, eccessiva sudorazione, nonché dolore e arrossamento alla sede di iniezione.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite
il sistema nazionale di segnalazione riportato nell’Allegato V. Segnalando gli effetti indesiderati lei
può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare CEPROTIN
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta dopo EXP. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C-8°C). Non congelare.
Conservare il flacone nell’imballaggio esterno per proteggere il medicinale dalla luce.
La soluzione ricostituita deve essere utilizzata immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene CEPROTIN
Polvere:
- Il principio attivo è la proteina C umana
- Gli altri componenti sono albumina umana, cloruro di sodio e citrato di sodio.2H O. Come solvente viene usata acqua sterilizzata per preparazioni iniettabili.
Descrizione dell’aspetto di CEPROTIN e contenuto della confezione
CEPROTIN si presenta sotto forma di polvere e solvente per soluzione iniettabile bianca o di colore
crema o come sostanza solida friabile. Dopo ricostituzione la soluzione appare incolore o leggermente
giallastra oppure limpida o leggermente opalescente e praticamente priva di particelle visibili.
Ciascuna confezione contiene anche un ago per la ricostituzione ed un ago filtro.
Titolare dell’autorizzazione all’immissione in commercio e produttore
BAXTER AG
Industriestrasse 67
A-1221 Vienna
Austria
Per ulteriori informazioni su questo medicinale, contatti il rappresentate locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Shire Belgium SPRL
Tél/Tel.: +322 711 02 30
Lietuva
UAB Baxalta Lithuania
Tel.: +370 694 14226
БЪЛГАРИЯ
Баксалта България ЕООД
тел.: + 359 2 926 4348
Luxembourg/Luxemburg
Shire Belgium SPRL
Tél/Tel.: +32 2 711 02 30
Česká republika
SHIRE CZECH s.r.o.
Tel. +420 225 379 700
Magyarország
Baxalta Hungary Kft
Tel.: +36 1 202 1981
Danmark
Shire Denmark A/S
Tlf: +45 32 70 12 00
Malta
Baxalta UK Limited
Tel.: +44 1635 798 777
Deutschland
Shire Deutschland GmbH
Tel: +49 (0) 30 206 5820
Nederland
Shire Netherlands B.V.
Tel: +31203 485 200
Eesti
Baxalta Estonia OÜ
Tel.: +370 694 41226
Norge
Shire Norway AS
Tlf: +47-22 585 000
Ελλάδα
Baxalta Ελλάς Μ.ΕΠΕ
Τηλ: +30-210-27 80 000
Österreich
Shire Austria GmbH
Tel: +43 (0)1 20100-0
España
Shire Pharmaceuticals Ibérica S.L.
Tel: +34-915 500 691
Polska
Shire Polska Sp. z o.o.
Tel.: +48 22 223 03 00
France
Shire France
Tél: +33-140 67 33 00
Portugal
Shire Pharmaceuticals Portugal, Lda
Tel: +351 213 500 220
Hrvatska
Baxalta d.o.o.
Tel.: +386 1 420 16 91
România
Baxalta S.R.L.
Tel.: + 4031 860 6200
Ireland
Baxalta UK Limited
Tel: +44 1 635 798 777
Slovenija
Baxalta d.o.o.
Tel.: +386 1 420 1691
Ísland
Shire Sweden AB
Sími: +46 8 544 964 00
Slovenská republika
Baxalta Slovakia, s.r.o.
Tel.: +421 2 2039 9300
Italia
Shire Italia S.p.A
Tel: +39 0265 535 096
Suomi/Finland
Shire Finland Oy
Puh/Tel: +358201 478 200
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ.: +357 22 20 4600
Sverige
Shire Sweden AB
Tel.: +46-8544 964 00
Latvija
UAB Baxalta Lithuania
Tel: +370 694 14226
United Kingdom
Baxalta UK Limited
Tel.: +44 1635 798 777
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali: http://www.ema.europa.eu.
CEPROTIN 1000 UI polvere e solvente per soluzione iniettabile
Proteina C umana
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CEPROTIN e a cosa serve
- 2. Cosa deve sapere prima di usare CEPROTIN
- 3. Come usare CEPROTIN
- 4. Possibili effetti indesiderati
- 5. Come conservare CEPROTIN
- 6. Contenuto della confezione e altre informazioni
1. Che cos’è CEPROTIN e a cosa serve
CEPROTIN appartiene ad una classe di medicinali chiamati antitrombotici. Questo medicinale
contiene Proteina C, una proteina naturale prodotta nel fegato e che è presente anche nel sangue.
La Proteina C svolge un ruolo importante nella prevenzione di una formazione eccessiva di coaguli
e quindi previene e/o cura la trombosi intravascolare.
CEPROTIN viene impiegato nel trattamento e nella prevenzione di lesioni cutanee trombotiche ed
emorragiche (denominate porpora fulminante) in pazienti con grave deficit congenito di proteina C.
Inoltre CEPROTIN può essere usato per trattare una rara complicanza di un farmaco usato per rendere
il sangue più fluido (farmaco anticoagulante denominato cumarina) che può causare gravi lesioni
cutanee (necrosi).
Inoltre CEPROTIN viene usato per prevenire la trombosi in pazienti con grave deficit congenito di
proteina C, in presenza di una o più delle seguenti condizioni:
- imminenti interventi chirurgici o terapia invasiva
- all'inizio di terapia a base di cumarina (farmaco anticoagulante, per rendere il sangue più fluido)
- nei casi in cui la terapia a base di cumarina da sola non sia sufficiente
- nei casi in cui la terapia a base di cumarina non sia possibile.
2. Cosa deve sapere prima di usare CEPROTIN
Non usi CEPROTIN:
- se è allergico (ipersensibile) alla Proteina C umana o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6) incluse le proteine murine o l'eparina.
Tuttavia, nel caso di complicazioni derivanti dalla formazione di coaguli di sangue nei vasi sanguigni
(complicanze trombotiche) che comportino un rischio per la vita, il suo medico potrà decidere
comunque di proseguire il trattamento con CEPROTIN.
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare CEPTROTIN. Faccia particolare attenzione con
CEPROTIN in caso di insorgenza di sintomi allergici. Tali sintomi includono arrossamenti cutanei,
prurito, difficoltà respiratoria, bassa pressione sanguigna, oppressione toracica e shock. Nel caso in cui
dovesse avere questi sintomi durante la somministrazione di CEPROTIN, è necessario interrompere
l'iniezione. Questi sintomi possono costituire una reazione allergica verso uno o più dei componenti,
alle proteine murine o all'eparina. Il preparato può contenere tracce di eparina e/o di proteine murine
in conseguenza del processo di produzione. In caso di insorgenza di una reazione del genere, il medico
deciderà il trattamento più appropriato.
Se questo preparato viene utilizzato in pazienti con grave carenza congenita di proteina C, possono
insorgere anticorpi che inibiscono la proteina C e che pertanto diminuiscono l'effetto del preparato.
Tuttavia, fino ad ora ciò non è stato osservato negli studi clinici.
Per i medicinali ottenuti da sangue o plasma umano vengono adottate alcune misure per evitare la
trasmissione di infezioni ai pazienti. Tali misure includono l’attenta selezione dei donatori di sangue
e di plasma per assicurare l’esclusione di coloro che potrebbero essere portatori di infezioni, e l’esame
di ciascuna donazione e di ciascun campione di plasma per individuare segni di virus/infezioni.
Nel processo di lavorazione del sangue o del plasma le aziende produttrici di questi prodotti includono
anche delle fasi in grado di rendere innocui o eliminare i virus. Nonostante questo, quando si
somministrano medicinali ottenuti da sangue o plasma umano, non è possibile escludere totalmente la
possibilità di contrarre delle infezioni. Questo riguarda anche virus finora sconosciuti o emergenti o
altri tipi di infezioni.
Le misure intraprese sono considerate efficaci per i virus capsulati come lo HIV, l’HBV e l’HCV e per
il virus HAV non capsulato. Le misure intraprese possono avere un valore limitato nei confronti di
virus non capsulati come ad esempio il parvovirus B19. L'infezione da parvovirus B19 può risultare
grave per le donne in gravidanza (infezione fetale) e per i soggetti che hanno un sistema immunitario
depresso o che hanno alcuni tipi di anemia (es. anemia emolitica).
Il medico potrà consigliarle la vaccinazione contro l’epatite A e B nel caso in cui le vengano
regolarmente / ripetutamente somministrati prodotti a base di Proteina C ottenuti da plasma umano.
Altri medicinali e CEPROTIN
Attualmente non sono note interazioni con altri medicinali.
Tuttavia, informi il suo medico o farmacista se sta assumendo o ha recentemente assunto qualsiasi
altro medicinale, anche quelli senza prescrizione.
Se lei passa al trattamento con anticoagulanti orali, deve continuare la terapia con CEPROTIN fino a
che il livello di anticoagulante orale nel sangue è adeguato e stabile.
CEPROTIN con cibi e bevande
Non applicabile.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico o al farmacista prima di usare questo medicinale.
Il medico deciderà se può effettuare il trattamento con CEPROTIN durante la gravidanza
e l’allattamento.
Guida di veicoli e utilizzo di macchinari
CEPROTIN non influisce sulla capacità di guida o sull’uso di macchinari.
Informazioni importanti su alcuni eccipienti di CEPROTIN:
Poiché la quantità di sodio nella dose massima giornaliera può superare i 200 mg, di ciò devono tener
conto i pazienti che seguono una dieta a basso contenuto di sodio.
3. Come usare CEPROTIN
CEPROTIN deve essere usato per via endovenosa (infusione in vena). Le verrà somministrato sotto il
diretto controllo di un medico esperto nel trattamento della terapia sostitutiva con fattori/inibitori della
coagulazione nei casi in cui è possibile monitorare l'attività della proteina C. Il dosaggio varia
a seconda delle sue condizioni e del suo peso corporeo.
Dosaggio
Il dosaggio, la frequenza di somministrazione e la durata del trattamento dipendono dalla gravità
del suo deficit di proteina C, dalle sue condizioni cliniche e dai suoi livelli di proteina C nel sangue.
Il dosaggio e la frequenza delle somministrazioni devono essere modificate sulla base dell’efficacia
clinica e degli esami di laboratorio.
È necessario raggiungere inizialmente una attività della proteina C del 100% e mantenerla al di sopra
del 25% per tutta la durata del trattamento.
Si raccomanda una dose iniziale di 60-80 UI/kg. Il medico effettuerà diversi prelievi di sangue nel
tempo per determinare la quantità residua di proteina C nell’organismo.
Si raccomanda la misurazione dell'attività di proteina C per mezzo di substrati cromogenici per la
determinazione dei livelli plasmatici di proteina C prima e durante il trattamento con CEPROTIN.
Il dosaggio deve essere determinato sulla base di misurazioni di laboratorio dell’attività della proteina
- C. In caso di formazione di coaguli di sangue nei vasi sanguigni (evento trombotico acuto), queste misure devono essere eseguite ogni 6 ore fino a che le sue condizioni sono stabili, successivamente due volte al giorno e in ogni caso subito prima dell’iniezione successiva. È necessario ricordare che l’emivita della proteina C può risultare drasticamente ridotta in presenza di certe condizioni cliniche quali la trombosi acuta con porpora fulminante e necrosi cutanea.
In caso di malattia renale e/o epatica, è necessario informare il medico, il quale deciderà se modificare
o meno il trattamento.
In caso di passaggio al trattamento profilattico permanente con anticoagulanti orali, la terapia
sostitutiva con proteina C deve essere interrotta solo dopo l’ottenimento di un livello di
anticoagulazione stabile (vedere “Importanti informazioni circa alcuni componenti di CEPROTIN”).
In caso lei riceva un trattamento profilattico con proteina C, livelli di base più elevati dovrebbero
essere garantiti in situazioni a maggiore rischio di trombosi (ad esempio infezioni, traumi o interventi
chirurgici).
In caso di resistenza verso APC che rappresenta un fattore di rischio tromboembolico in una
percentuale fino al 5% della popolazione in Europa, il medico può decidere se modificare o meno
il trattamento.
Somministrazione
CEPROTIN le verrà somministrato per iniezione endovenosa dopo ricostituzione della polvere per
soluzione iniettabile con acqua sterilizzata per preparazioni iniettabili. Si raccomanda fortemente, ogni
volta che le viene somministrata una dose di Ceprotin, di registrare il nome ed il numero di lotto del
prodotto al fine di mantenere una storia dei lotti utilizzati.
Ricostituire la polvere liofilizzata per soluzione iniettabile di CEPROTIN con il solvente contenuto
nella confezione (acqua sterilizzata per preparazioni iniettabili) utilizzando l'ago sterile per la
ricostituzione. Ruotare leggermente il flaconcino fino al discioglimento della polvere.
Dopo la ricostituzione, la soluzione viene aspirata con l'ago filtro sterile in una siringa sterile
monouso. Un altro ago filtro sterile deve essere utilizzato per aspirare il contenuto di ciascun
flaconcino di CEPROTIN ricostituito. La soluzione deve essere eliminata nel caso in cui, dopo
la ricostituzione, risultino visibili delle particelle in sospensione.
La soluzione ricostituita deve essere somministrata immediatamente per iniezione endovenosa
CEPROTIN deve essere somministrato ad una velocità di iniezione non superiore a 2 ml/minuto.
In bambini con un peso corporeo inferiore ai 10 kg, la velocità di iniezione non deve
superare 0,2 ml/kg/min.
Eventuali soluzioni non utilizzate, flaconcini vuoti, aghi e siringhe usati devono essere eliminati
con cura.
La frequenza e la durata del trattamento dipendono dalla gravità del deficit di proteina C, dai risultati
della determinazione di proteina C nel suo sangue, oltre che dalla localizzazione e dalla gravità della
trombosi.
In caso di trombosi acuta, CEPROTIN può essere somministrato ogni 6 ore. La frequenza delle
iniezioni può essere ridotta col diminuire della tendenza alla formazione di trombi.
Se usa più CEPROTIN di quanto deve
Si raccomanda di rispettare il dosaggio e la frequenza di somministrazione consigliati dal medico.
Nel caso in cui usasse una dose di CEPROTIN maggiore di quella raccomandata, informi il medico
al più presto possibile.
Se dimentica di usare CEPROTIN
Non pertinente.
Se interrompe il trattamento con CEPROTIN
Non interrompa l’uso di CEPROTIN senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Dopo somministrazione di CEPROTIN potrebbe notare qualcuno dei seguenti effetti indesiderati:
- Come con qualsiasi altro prodotto somministrato in vena possono verificarsi reazioni allergiche incluse reazioni gravi e potenzialmente a rischio per la vita (anafilassi). Lei dovrebbe essere a conoscenza dei sintomi precoci di reazioni allergiche quali senso di bruciore o di puntura nel sito di iniezione, brividi, rossore del volto, arrossamenti della pelle, prurito, difficoltà respiratoria, nausea, cefalea, sonnolenza, pressione sanguigna bassa e oppressione toracica.
- I seguenti effetti indesiderati sono stati osservati raramente nel corso degli studi clinici (meno di 1 caso su 1.000 dosi somministrate ai pazienti): prurito, rash cutaneo e vertigini.
- Nell’esperienza successiva all’immissione in commercio sono state registrate segnalazioni di irrequietezza, eccessiva sudorazione, nonché dolore e arrossamento alla sede di iniezione .
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite
il sistema nazionale di segnalazione riportato nell’Allegato V. Segnalando gli effetti indesiderati lei
può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare CEPROTIN
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta dopo EXP. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C-8°C). Non congelare.
Conservare il flacone nell’imballaggio esterno per proteggere il medicinale dalla luce.
La soluzione ricostituita deve essere utilizzata immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene CEPROTIN
Polvere:
- Il principio attivo è la proteina C umana
- Gli altri componenti sono albumina umana, cloruro di sodio e citrato di sodio.2H O. Come solvente viene usata acqua sterilizzata per preparazioni iniettabili.
Descrizione dell’aspetto di CEPROTIN e contenuto della confezione
CEPROTIN si presenta sotto forma di polvere e solvente per soluzione iniettabile bianca o di colore
crema o come sostanza solida friabile. Dopo ricostituzione la soluzione appare incolore o leggermente
giallastra oppure limpida o leggermente opalescente e praticamente priva di particelle visibili.
Ciascuna confezione contiene anche un ago per la ricostituzione ed un ago filtro.
Titolare dell’autorizzazione all’immissione in commercio e produttore
BAXTER AG
Industriestrasse 67
A-1221 Vienna
Austria
Per ulteriori informazioni su questo medicinale, contatti il rappresentate locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Shire Belgium SPRL
Tél/Tel.: +32 2 711 02 30
Lietuva
UAB Baxalta Lithuania
Tel: +370 694 14226
БЪЛГАРИЯ
Баксалта България ЕООД
тел.: + 359 2 926 4348
Luxembourg/Luxemburg
Shire Belgium SPRL
Tél/Tel.: +32 2 711 02 30
Česká republika
SHIRE CZECH s.r.o.
Tel.: +420 225379 700
Magyarország
Baxalta Hungary Kft
Tel: +36 1 202 1981
Danmark
Shire Denmark A/S
Tlf: +45 32 70 12 00
Malta
Baxalta UK Limited
Tel.: +44 1635 798 777
Deutschland
Shire Deutschland GmbH
Tel: +49 (0) 30 206 5820
Nederland
Shire Netherlands B.V.
Tel: +31 203485 200
Eesti
Baxalta Estonia OÜ
Tel.: +370 694 14226
Norge
Shire Norway AS
Tlf: +47-22 585 000
Ελλάδα
Baxalta Ελλάς Μ.ΕΠΕ
Τηλ: +30-210-27 80 000
Österreich
Shire Austria GmbH
Tel: +43 (0)1 20100-0
España
Shire Pharmaceuticals Ibérica S.L.
Tel: +34815 500 691
Polska
Shire Polska. z o.o.
Tel: +48 22 223 03 00
France
Shire France
Tél: +33-140 67 33 00
Portugal
Shire Pharmaceuticals Portugal, Lda.
Tel: +351 213 500 220
Hrvatska
Baxalta d.o.o.
Tel: +386 1 420 1691
România
Baxalta S.R.L.
Tel.: + 4031 860 6200
Ireland
Baxalta UK Limited
Tel: +44 1 635 798 777
Slovenija
Baxalta d.o.o.
Tel.: +386 1 420 1691
Ísland
Shire Sweden AB
Sími: +46 8 544 964 00
Slovenská republika
Baxalta Slovakia, s.r.o.
Tel: +421 2 2039 9300
Italia
Shire Italia S.p.A.
Tel: +39 02 65 535 096
Suomi/Finland
Shire Finland Oy
Puh/Tel: +358201 478 200
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22 20 4600
Sverige
Shire Sweden AB
Tel: +46-8-544 964 00
Latvija
UAB Baxalta Lithuania
Tel.: +370 694 14226
United Kingdom
Baxalta UK Limited
Tel: +44 1635 798 777
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali: http://www.ema.europa.eu.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a CEPROTINForma farmaceutica: Polvere e solvente per soluzione iniettabile/ per infusione, 10 MGPrincipio attivo: alteplaseProduttore: BOEHRINGER INGELHEIM ITALIA S.P.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 500 IUPrincipio attivo: apadamtase alfa and cinaxadamtase alfaProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 8000 U/8 MLPrincipio attivo: tenecteplaseProduttore: BOEHRINGER INGELHEIM INTERNATIONAL GMBHPrescrizione richiesta
Medici online per CEPROTIN
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di CEPROTIN — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.










