
SPEVIGO

Come usare SPEVIGO
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
Spevigo 450 mg concentrato per soluzione per infusione
spesolimab

Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio perché contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Spevigo e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Spevigo
- 3. Come le verrà somministrato Spevigo
- 4. Possibili effetti indesiderati
- 5. Come conservare Spevigo
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Spevigo e a cosa serve
Cos’è Spevigo
Spevigo contiene il principio attivo spesolimab. Spesolimab appartiene a un gruppo di medicinali
chiamati inibitori dell’interleuchina (IL). Questo medicinale agisce bloccando l’attività di IL36R, una
proteina che è coinvolta nell’infiammazione.
A cosa serve Spevigo
Spevigo è usato da solo negli adulti e negli adolescenti di età pari o superiore a 12 anni per il
trattamento delle riacutizzazioni di una rara malattia infiammatoria della pelle detta psoriasi pustolosa
generalizzata (GPP). La riacutizzazione è caratterizzata dall’improvvisa comparsa di dolorose vesciche
su vaste aree della pelle. Queste vesciche, dette anche pustole, sono piene di pus. La pelle può
arrossarsi, seccarsi, screpolarsi o desquamarsi e può manifestarsi prurito. I pazienti possono anche
manifestare segni e sintomi più generali, come febbre, mal di testa, stanchezza estrema o una
sensazione di bruciore sulla pelle.
Spevigo favorisce la guarigione delle lesioni e riduce i sintomi della GPP che si manifestano durante
una riacutizzazione.
2. Cosa deve sapere prima che le venga somministrato Spevigo
Il trattamento sarà avviato e avverrà sotto la supervisione di un medico esperto nel trattamento di
pazienti con malattie infiammatorie della pelle.
Spevigo non le deve essere somministrato se:
- è allergico a spesolimab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- ha una tubercolosi attiva o altre gravi infezioni (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o all’infermiere prima che le venga somministrato Spevigo se:
- ha un’infezione in corso o presenta un’infezione ricorrente. Febbre, sintomi simil-influenzali, stanchezza o respiro affannoso, tosse persistente, calore, rossore e dolore cutaneo o un’eruzione dolorosa con presenza di vesciche possono essere segni e sintomi di un’infezione.
- ha, ha avuto la tubercolosi oppure se è stato a stretto contatto con qualcuno con la tubercolosi.
- ha ricevuto recentemente o deve ricevere un vaccino. Certi tipi di vaccini (vaccini vivi) non devono essere somministrati per almeno 16 settimane dopo aver ricevuto Spevigo.
- manifesta sintomi come una debolezza alle braccia o alle gambe che prima non era presente o intorpidimento (perdita di sensibilità), formicolio o una sensazione di bruciore in qualsiasi parte del corpo. Potrebbero essere segni di una neuropatia periferica (danno dei nervi periferici).
Infezioni
Informi il medico il prima possibile se nota la comparsa di qualsiasi segno o sintomo di infezione dopo
che le è stato somministrato Spevigo, vedere paragrafo 4 “Possibili effetti indesiderati”.
Reazioni allergiche
Richieda immediatamente assistenza medica se nota la comparsa di qualsiasi segno o sintomo di
reazione allergica durante il trattamento o dopo che le è stato somministrato questo medicinale. Una
reazione allergica può manifestarsi anche alcuni giorni o settimane dopo aver ricevuto Spevigo. Per i
segni e sintomi, vedere paragrafo 4 “Possibili effetti indesiderati”.
Bambini e adolescenti
Spevigo non è raccomandato nei bambini di età inferiore a 12 anni poiché non è stato studiato in
questa fascia di età.
Altri medicinali e Spevigo
Informi il medico se:
- sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale, incluso qualsiasi altro medicinale per il trattamento della GPP.
- sta per sottoporsi o si è recentemente sottoposto a una vaccinazione. Certi tipi di vaccini (vaccini vivi) non devono essere somministrati per almeno 16 settimane dopo aver ricevuto Spevigo.
Gravidanza e allattamento
Gravidanza
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza chieda consiglio al medico
prima che le venga somministrato questo medicinale. Questo perché non si sa in che modo questo
medicinale influirà sul bambino.
È dunque preferibile evitare l’uso di Spevigo durante la gravidanza.
Se è in corso una gravidanza, il medicinale deve essere somministrato solo se chiaramente
raccomandato dal medico.
Allattamento
Non è noto se Spevigo passi nel latte materno. Spevigo può passare nel latte materno nei primi giorni
dopo il parto. Deve quindi informare il medico se sta allattando o se intende allattare, in modo da poter
decidere insieme a lui se può ricevere Spevigo.
Guida di veicoli e utilizzo di macchinari
Non si prevede che Spevigo alteri la capacità di guidare veicoli e di usare macchinari.
Spevigo contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente ‘senza
sodio’.
3. Come le verrà somministrato Spevigo
La dose raccomandata negli adulti e negli adolescenti di età pari o superiore a 12 anni e peso corporeo
pari o superiore a 40 kg è di 900 mg (due flaconcini da 450 mg).
La dose raccomandata negli adolescenti di età pari o superiore a 12 anni e peso corporeo compreso
tra 30 e meno di 40 kg è di 450 mg (un flaconcino da 450 mg).
Il medico o l’infermiere le somministreranno il medicinale mediante un’infusione (flebo) in una vena
in un periodo di 90 minuti, fino ad un periodo massimo di 180 minuti nel caso in cui l’infusione venga
rallentata o temporaneamente interrotta.
Se i sintomi della riacutizzazione persistono, il medico può decidere di somministrarle una seconda
dose di Spevigo una settimana dopo la prima dose.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
Se le viene somministrato più Spevigo di quanto deve ricevere
Questo medicinale le sarà somministrato dal medico o dall’infermiere. Se ritiene di aver ricevuto
troppo Spevigo, informi subito il medico o l’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Richieda immediatamente assistenza medica se nota la comparsa di qualsiasi segno o sintomo di
reazione allergica durate il trattamento o dopo che le è stato somministrato questo medicinale.
Questi possono includere:
- difficoltà a respirare o a deglutire
- gonfiore di viso, labbra, lingua o gola
- prurito cutaneo intenso, con un’eruzione cutanea rossa o pomfi diversi dai sintomi di GPP
- sensazione di svenimento
Una reazione allergica può manifestarsi anche alcuni giorni o settimane dopo aver ricevuto Spevigo.
Richieda immediatamente assistenza medicase sviluppa un’eruzione cutanea estesa che prima non
era presente, febbre e/o gonfiore del viso 2-8 settimane dopo aver ricevuto il medicinale. Questi
potrebbero essere segni di una reazione allergica (ipersensibilità) ritardata.
Informi il medico il prima possibile se nota la comparsa di qualsiasi segno o sintomo di infezione.
Molto comune(può interessare più di 1 persona su 10). Questi possono includere:
- febbre, tosse
- minzione frequente, dolore o bruciore alla minzione o sangue nelle urine, che possono essere sintomi di infezioni delle vie urinarie
Informi il medico o l’infermiere se manifesta uno qualsiasi dei seguenti altri effetti indesiderati:
Molto comune(può interessare più di 1 persona su 10)
- rossore, gonfiore, indurimento, calore, dolore, esfoliazione della pelle, piccoli pomfi duri sulla pelle, prurito, eruzione cutanea o orticaria nella sede di iniezione
Comune(può interessare fino a 1 persona su 10)
- prurito
- sensazione di stanchezza
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Spevigo
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sul flaconcino dopo EXP e sulla
scatola dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C - 8°C) (vedere le informazioni per gli operatori sanitari riportate alla
Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
6. Contenuto della confezione e altre informazioni
Cosa contiene Spevigo
- Il principio attivo è spesolimab. Ogni flaconcino contiene 450 mg di spesolimab in 7,5 mL di concentrato per soluzione per infusione.
- Gli altri componenti sono sodio acetato triidrato (E262), acido acetico glaciale (E260) (per la regolazione del pH), saccarosio, arginina cloridrato, polisorbato 20 (E432) e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Spevigo e contenuto della confezione
Spevigo concentrato per soluzione per infusione è una soluzione da limpida a leggermente
opalescente, da incolore a leggermente giallo-brunastra, fornita in un flaconcino di vetro (vetro di
tipo I) incolore da 10 mL con tappo in gomma rivestito e ghiera in alluminio con capsula a strappo in
plastica blu.
Ogni confezione contiene due flaconcini.
Titolare dell’autorizzazione all’immissione in commercio
Boehringer Ingelheim International GmbH
Binger Str. 173
55216 Ingelheim am Rhein
Germania
Produttore
Boehringer Ingelheim Pharma GmbH & Co. KG
Birkendorfer Strasse 65
88397 Biberach an der Riss
Germania
Boehringer Ingelheim France
100‑104 Avenue de France
75013 Parigi
Francia
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Boehringer Ingelheim SComm
Tél/Tel: +32 2 773 33 11
Lietuva
Boehringer Ingelheim RCV GmbH & Co KG
Lietuvos filialas
Tel: +370 5 2595942
България
Бьорингер Ингелхайм РЦВ ГмбХ и Ко. КГ –
клон България
Тел: +359 2 958 79 98
Luxembourg/Luxemburg
Boehringer Ingelheim SComm
Tél/Tel: +32 2 773 33 11
Česká republika
Boehringer Ingelheim spol. s r.o.
Tel: +420 234 655 111
Magyarország
Boehringer Ingelheim RCV GmbH & Co KG
Magyarországi Fióktelepe
Tel: +36 1 299 89 00
Danmark
Boehringer Ingelheim Danmark A/S
Tlf: +45 39 15 88 88
Malta
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
Deutschland
Boehringer Ingelheim Pharma GmbH & Co. KG
Tel: +49 (0) 800 77 90 900
Nederland
Boehringer Ingelheim B.V.
Tel: +31 (0) 800 22 55 889
Eesti
Boehringer Ingelheim RCV GmbH & Co KG
Eesti filiaal
Tel: +372 612 8000
Norge
Boehringer Ingelheim Danmark
Norwegian branch
Tlf: +47 66 76 13 00
Ελλάδα
Boehringer Ingelheim Ελλάς Μονοπρόσωπη A.E.
Tηλ: +30 2 10 89 06 300
Österreich
Boehringer Ingelheim RCV GmbH & Co KG
Tel: +43 1 80 105-7870
España
Boehringer Ingelheim España, S.A.
Tel: +34 93 404 51 00
Polska
Boehringer Ingelheim Sp. z o.o.
Tel: +48 22 699 0 699
France
Boehringer Ingelheim France S.A.S.
Tél: +33 3 26 50 45 33
Portugal
Boehringer Ingelheim Portugal, Lda.
Tel: +351 21 313 53 00
Hrvatska
Boehringer Ingelheim Zagreb d.o.o.
Tel: +385 1 2444 600
România
Boehringer Ingelheim RCV GmbH & Co KG
Viena - Sucursala Bucureşti
Tel: +40 21 302 28 00
Ireland
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
Slovenija
Boehringer Ingelheim RCV GmbH & Co KG
Podružnica Ljubljana
Tel: +386 1 586 40 00
Ísland
Vistor ehf.
Sími: +354 535 7000
Slovenská republika
Boehringer Ingelheim RCV GmbH & Co KG
organizačná zložka
Tel: +421 2 5810 1211
Italia
Boehringer Ingelheim Italia S.p.A.
Tel: +39 02 5355 1
Suomi/Finland
Boehringer Ingelheim Finland Ky
Puh/Tel: +358 10 3102 800
Κύπρος
Boehringer Ingelheim Ελλάς Μονοπρόσωπη A.E.
Tηλ: +30 2 10 89 06 300
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Latvija
Boehringer Ingelheim RCV GmbH & Co KG
Latvijas filiāle
Tel: +371 67 240 011
United Kingdom (Northern Ireland)
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
A questo medicinale è stata rilasciata un’autorizzazione “subordinata a condizioni”. Ciò significa che
devono essere forniti ulteriori dati su questo medicinale.
L’Agenzia europea per i medicinali esaminerà almeno annualmente le nuove informazioni su questo
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Posologia e modo di somministrazione
La dose raccomandata negli adulti e negli adolescenti di età pari o superiore a 12 anni e peso corporeo
pari o superiore a 40 kg è una dose singola da 900 mg (2 flaconcini da 450 mg) somministrata come
infusione endovenosa. Se i sintomi della riacutizzazione persistono, può essere somministrata
un’ulteriore dose da 900 mg 1 settimana dopo la dose iniziale.
La dose raccomandata negli adolescenti di età pari o superiore a 12 anni e peso corporeo compreso
tra ≥ 30 e < 40 kg è una dose singola da 450 mg (1 flaconcino da 450 mg) somministrata come
infusione endovenosa. Se i sintomi della riacutizzazione persistono, può essere somministrata
un’ulteriore dose da 450 mg 1 settimana dopo la dose iniziale.
Spevigo deve essere diluito prima dell’uso. Non deve essere somministrato come pusho bolo
endovenoso.
Dopo diluizione con soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%), Spevigo è
somministrato come infusione endovenosa continua attraverso una linea di infusione dotata di filtro in
linea sterile, apirogeno, a basso legame proteico (dimensione dei pori di 0,2 micron) in un periodo di
90 minuti. Non devono essere somministrate altre infusioni in parallelo utilizzando lo stesso accesso
venoso.
Nel caso in cui l’infusione venga rallentata o temporaneamente interrotta, il tempo totale di infusione
(inclusa la durata dell’interruzione) non deve superare i 180 minuti.
Istruzioni per la manipolazione
- Il flaconcino deve essere ispezionato visivamente prima dell’uso. o Spevigo è una soluzione da incolore a leggermente giallo-brunastra, da limpida a leggermente opalescente. o Se la soluzione appare torbida, presenta alterazioni di colore o contiene particelle di grandi dimensioni o colorate, il flaconcino deve essere eliminato.
- Spesolimab concentrato sterile è solo monouso.
- La soluzione per infusione deve essere preparata utilizzando una tecnica asettica: o Per la dose raccomandata da 900 mg, prelevare ed eliminare 15 mL di soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%) da un contenitore da 100 mL e sostituirli lentamente con 15 mL di concentrato sterile di spesolimab (due flaconcini da 450 mg/7,5 mL). o Per la dose raccomandata da 450 mg, prelevare ed eliminare 7,5 mL di soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%) da un contenitore da 100 mL e sostituirli lentamente con 7,5 mL di concentrato sterile di spesolimab (un flaconcino da 450 mg/7,5 mL). o Miscelare delicatamente prima dell’uso. La soluzione per infusione diluita di spesolimab deve essere usata immediatamente.
- Spevigo non deve essere miscelato con altri medicinali. Per la somministrazione della soluzione per infusione diluita di spesolimab può essere utilizzata una linea endovenosa preesistente. La linea deve essere lavata con soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%) prima e al termine dell’infusione. Non devono essere somministrate altre infusioni in parallelo utilizzando lo stesso accesso venoso.
- Spevigo è compatibile con set per infusione in polivinilcloruro (PVC), polietilene (PE), polipropilene (PP), polibutadiene e poliuretano (PUR) e filtri in linea a membrane in polietersulfone (PES, neutro e a carica positiva) e poliammide (PA) a carica positiva.
Condizioni di conservazione
Flaconcino chiuso
- Conservare in frigorifero (2°C - 8°C). Non congelare.
- Conservare nella confezione originale per proteggere il medicinale dalla luce.
- Prima dell’uso, il flaconcino chiuso può essere tenuto a temperature fino a 30°C per un massimo di 24 ore, se conservato nella confezione originale per proteggere il medicinale dalla luce.
Dopo l’apertura
- Dal punto di vista microbiologico, il medicinale deve essere diluito e somministrato immediatamente dopo l’apertura.
Dopo la preparazione dell’infusione
- La stabilità chimica e fisica durante l’uso della soluzione diluita è stata dimostrata per 24 ore a 2°C - 30°C.
- Dal punto di vista microbiologico, la soluzione per infusione diluita deve essere usata immediatamente. In caso contrario, le condizioni di conservazione durante l’uso sono sotto la responsabilità dell’utilizzatore e normalmente non dovrebbero superare le 24 ore a 2°C - 8°C, a meno che la diluizione non sia avvenuta in condizioni asettiche controllate e validate. Nel periodo compreso tra la preparazione e l’inizio della somministrazione, la soluzione per infusione deve essere protetta dalla luce nel rispetto delle procedure standard locali.
Spevigo 150 mg soluzione iniettabile in siringa preriempita
spesolimab

Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio perché contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Spevigo e a cosa serve
- 2. Cosa deve sapere prima di usare Spevigo
- 3. Come usare Spevigo
- 4. Possibili effetti indesiderati
- 5. Come conservare Spevigo
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Spevigo e a cosa serve
Cos’è Spevigo
Spevigo contiene il principio attivo spesolimab. Spesolimab appartiene a un gruppo di medicinali
chiamati inibitori dell’interleuchina (IL). Questo medicinale agisce bloccando l’attività di IL36R, una
proteina che è coinvolta nell’infiammazione.
A cosa serve Spevigo
Spevigo è usato negli adulti e negli adolescenti per il trattamento e la prevenzione delle riacutizzazioni
di una rara malattia infiammatoria della pelle detta psoriasi pustolosa generalizzata (GPP). La
riacutizzazione è caratterizzata dall’improvvisa comparsa di dolorose vesciche su vaste aree della
pelle. Queste vesciche, dette anche pustole, sono piene di pus. La pelle può arrossarsi, seccarsi,
screpolarsi o desquamarsi e può manifestarsi prurito. I pazienti possono anche manifestare segni e
sintomi più generali, come febbre, mal di testa, stanchezza estrema o una sensazione di bruciore sulla
pelle.
Spevigo elimina le pustole e le altre manifestazioni sulla pelle e può così aiutare a ridurre i segni e i
sintomi della malattia.
2. Cosa deve sapere prima di usare Spevigo
Il trattamento sarà avviato e avverrà sotto la supervisione di un medico esperto nel trattamento di
pazienti con malattie infiammatorie della pelle.
Non usi Spevigo se:
- è allergico a spesolimab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- ha una tubercolosi attiva o altre gravi infezioni (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o all’infermiere prima e durante l’uso di Spevigo se:
- ha un’infezione in corso o presenta un’infezione ricorrente. Febbre, sintomi simil-influenzali, stanchezza o respiro affannoso, tosse persistente, calore, rossore e dolore cutaneo o un’eruzione dolorosa con presenza di vesciche possono essere segni e sintomi di un’infezione.
- ha, ha avuto la tubercolosi oppure se è stato a stretto contatto con qualcuno con la tubercolosi.
- ha ricevuto recentemente o deve ricevere un vaccino. Certi tipi di vaccini (vaccini vivi) non devono essere somministrati per almeno 16 settimane dopo la somministrazione di Spevigo. Il medico controllerà se ha bisogno di qualsiasi vaccinazione prima di iniziare a usare Spevigo.
- manifesta sintomi come una debolezza alle braccia o alle gambe che prima non era presente o intorpidimento (perdita di sensibilità), formicolio o una sensazione di bruciore in qualsiasi parte del corpo. Potrebbero essere segni di una neuropatia periferica (danno dei nervi periferici).
È importante registrare il numero di lotto della confezione di Spevigo.
Ogni volta che riceve una nuova confezione di Spevigo, prenda nota della data e del numero di lotto
(che si trova sulla confezione dopo “Lotto/Lot”) e conservi queste informazioni in un luogo sicuro.
Infezioni
Informi il medico il prima possibile se nota la comparsa di qualsiasi segno o sintomo di infezione
durante l’uso di Spevigo, vedere paragrafo 4 “Possibili effetti indesiderati”.
Reazioni allergiche
Richieda immediatamente assistenza medica se nota la comparsa di qualsiasi segno o sintomo di
reazione allergica durante l’uso di questo medicinale o dopo averlo usato. Una reazione allergica può
manifestarsi anche alcuni giorni o settimane dopo aver iniziato a usare Spevigo. Per i segni e sintomi,
vedere paragrafo 4 “Possibili effetti indesiderati”.
Bambini e adolescenti
Spevigo non è raccomandato nei bambini di età inferiore a 12 anni poiché non è stato studiato in
questa fascia di età.
Altri medicinali e Spevigo
Informi il medico se:
- sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale.
- sta per sottoporsi o si è recentemente sottoposto a una vaccinazione. Certi tipi di vaccini (vaccini vivi) non devono essere somministrati per almeno 16 settimane dopo aver ricevuto Spevigo.
Se ha dubbi, si rivolga al medico, al farmacista o all’infermiere prima e durante l’uso di Spevigo.
Gravidanza e allattamento
Gravidanza
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza chieda consiglio al medico
prima di usare questo medicinale. Questo perché non si sa in che modo questo medicinale influirà sul
bambino.
È dunque preferibile evitare l’uso di Spevigo durante la gravidanza.
Se è in corso una gravidanza, il medicinale deve essere somministrato solo se chiaramente
raccomandato dal medico.
Allattamento
Non è noto se Spevigo passi nel latte materno. Spevigo può passare nel latte materno nei primi giorni
dopo il parto. Deve quindi informare il medico se sta allattando o se intende allattare, in modo da poter
decidere insieme a lui se può usare Spevigo.
Guida di veicoli e utilizzo di macchinari
Non si prevede che Spevigo alteri la capacità di guidare veicoli e di usare macchinari.
Spevigo contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente ‘senza
sodio’.
3. Come usare Spevigo
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Quanto Spevigo usare
| F Adulti e adolescenti di età pari o superiore a 12 anni e peso corporeo pari o superiore a 40 kg: | ||
| Quanto? | Quando? | |
| 1adose | 600 mg (quattro iniezioni da 150 mg) | Quando glielo dice il medico l |
| Dosi successive | 300 mg (due iniezioni da 150 mg) | e Ogni 4 settimane a partire da dopo la 1adose |
La prima dose deve esserle somministrata dal medico o dall’infermiere.
Lei, insieme al medico o all’infermiere, potrà decidere se può auto-somministrarsi questo medicinale.
Non si auto-somministri il medicinale a meno che il medico o l’infermiere non le abbiano spiegato
come farlo. Anche la persona che la assiste può effettuare le iniezioni, dopo essere stata addestrata a
farlo.
Prima di auto-iniettarsi Spevigo, legga le “Istruzioni per l’uso” alla fine di questo foglio
illustrativo.
| l Adolescenti di età pari o superiore a 12 anni e peso corporeo compreso tra 30 e meno di 40 kg: | ||
| a Quanto? | Quando? | |
| 1adose | t 300 mg (due iniezioni da 150 mg) | Quando glielo dice il medico |
| Dosi successive | I 150 mg (un’iniezione da 150 mg) | Ogni 4 settimane a partire da dopo la 1adose |
Spevigo deve esserle somministrato dal medico o dall’infermiere.
Se usa più Spevigo di quanto deve
Se ha usato più Spevigo di quanto deve o se la dose le è stata somministrata prima di quando
prescritto, si rivolga al medico.
Se dimentica di usare Spevigo
Se dimentica di usare Spevigo, inietti una dose non appena se ne ricorda. Se ha dubbi, si rivolga al
medico.
Se interrompe il trattamento con Spevigo
Non interrompa l’uso di Spevigo senza parlarne prima con il medico. Se interrompe il trattamento, i
sintomi possono ricomparire o potrebbe manifestare una riacutizzazione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Richieda immediatamente assistenza medica se nota la comparsa di qualsiasi segno o sintomo di
reazione allergica durate l’uso o dopo aver usato questo medicinale.Questi possono includere:
- difficoltà a respirare o a deglutire
- gonfiore di viso, labbra, lingua o gola
- prurito cutaneo intenso, con un’eruzione cutanea rossa o pomfi diversi dai sintomi di GPP
- sensazione di svenimento
Una reazione allergica può manifestarsi anche alcuni giorni o settimane dopo aver usato Spevigo.
Richieda immediatamente assistenza medicase sviluppa un’eruzione cutanea estesa che prima non
era presente, febbre e/o gonfiore del viso 2-8 settimane dopo aver usato il medicinale. Questi
potrebbero essere segni di una reazione allergica (ipersensibilità) ritardata.
Informi il medico il prima possibile se nota la comparsa di qualsiasi segno o sintomo di infezione.
Questi possono includere:
Molto comune(può interessare più di 1 persona su 10)
- febbre, tosse
- minzione frequente, dolore o bruciore alla minzione o sangue nelle urine, che possono essere sintomi di infezioni delle vie urinarie
Informi il medico o l’infermiere se manifesta uno qualsiasi dei seguenti altri effetti indesiderati:
Molto comune(può interessare più di 1 persona su 10)
- rossore, gonfiore, indurimento, calore, dolore, esfoliazione della pelle, piccoli pomfi duri sulla pelle, prurito, eruzione cutanea o orticaria nella sede di iniezione
Comune(può interessare fino a 1 persona su 10)
- prurito
- sensazione di stanchezza
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Spevigo
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Nonusi questo medicinale dopo la data di scadenza che è riportata sulla siringa preriempita dopo EXP
e sulla scatola dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C - 8°C). Noncongelare. Nonusare Spevigo se è stato congelato, anche
se è stato scongelato.
Se necessario, Spevigo può essere conservato a temperatura ambiente (fino a 25°C) per un massimo di
14 giorni. Elimini Spevigo se è stato tenuto a temperatura ambiente per più di 14 giorni.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Nonusi questo medicinale se il liquido è torbido o contiene fiocchi o particelle di grandi dimensioni.
Nongetti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Spevigo
- Il principio attivo è spesolimab. Ogni siringa preriempita contiene 150 mg di spesolimab in 1 mL di soluzione.
- Gli altri componenti sono sodio acetato triidrato (E262), acido acetico glaciale (E260) (per la regolazione del pH), saccarosio, arginina cloridrato, polisorbato 20 (E432) e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Spevigo e contenuto della confezione
Spevigo soluzione iniettabile è una soluzione da limpida a leggermente opalescente, da incolore a
leggermente giallo-brunastra, in siringa preriempita con dispositivo di sicurezza. Il liquido può
contenere piccole particelle bianche o trasparenti. Ogni siringa preriempita contiene 150 mg in 1 mL
di soluzione iniettabile.
Ogni confezione contiene 2 siringhe preriempite.
Titolare dell’autorizzazione all’immissione in commercio
Boehringer Ingelheim International GmbH
Binger Str. 173
55216 Ingelheim am Rhein
Germania
Produttore
Boehringer Ingelheim Pharma GmbH & Co. KG
Birkendorfer Strasse 65
88397 Biberach an der Riss
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Boehringer Ingelheim SComm
Tél/Tel: +32 2 773 33 11
Lietuva
Boehringer Ingelheim RCV GmbH & Co KG
Lietuvos filialas
Tel: +370 5 2595942
България
Бьорингер Ингелхайм РЦВ ГмбХ и Ко. КГ –
клон България
Тел: +359 2 958 79 98
Luxembourg/Luxemburg
Boehringer Ingelheim SComm
Tél/Tel: +32 2 773 33 11
Česká republika
Boehringer Ingelheim spol. s r.o.
Tel: +420 234 655 111
Magyarország
Boehringer Ingelheim RCV GmbH & Co KG
Magyarországi Fióktelepe
Tel: +36 1 299 89 00
DanmarkMalta
Boehringer Ingelheim Danmark A/S
Tlf: +45 39 15 88 88
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
Deutschland
Boehringer Ingelheim Pharma GmbH & Co. KG
Tel: +49 (0) 800 77 90 900
Nederland
Boehringer Ingelheim B.V.
Tel: +31 (0) 800 22 55 889
Eesti
Boehringer Ingelheim RCV GmbH & Co KG
Eesti filiaal
Tel: +372 612 8000
Norge
Boehringer Ingelheim Danmark
Norwegian branch
Tlf: +47 66 76 13 00
Ελλάδα
Boehringer Ingelheim Ελλάς Μονοπρόσωπη A.E.
Tηλ: +30 2 10 89 06 300
Österreich
Boehringer Ingelheim RCV GmbH & Co KG
Tel: +43 1 80 105-7870
España
Boehringer Ingelheim España, S.A.
Tel: +34 93 404 51 00
Polska
Boehringer Ingelheim Sp. z o.o.
Tel: +48 22 699 0 699
France
Boehringer Ingelheim France S.A.S.
Tél: +33 3 26 50 45 33
Portugal
Boehringer Ingelheim Portugal, Lda.
Tel: +351 21 313 53 00
Hrvatska
Boehringer Ingelheim Zagreb d.o.o.
Tel: +385 1 2444 600
România
Boehringer Ingelheim RCV GmbH & Co KG
Viena - Sucursala Bucureşti
Tel: +40 21 302 28 00
Ireland
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
Slovenija
Boehringer Ingelheim RCV GmbH & Co KG
Podružnica Ljubljana
Tel: +386 1 586 40 00
Ísland
Vistor ehf.
Sími: +354 535 7000
Slovenská republika
Boehringer Ingelheim RCV GmbH & Co KG
organizačná zložka
Tel: +421 2 5810 1211
Italia
Boehringer Ingelheim Italia S.p.A.
Tel: +39 02 5355 1
Suomi/Finland
Boehringer Ingelheim Finland Ky
Puh/Tel: +358 10 3102 800
Κύπρος
Boehringer Ingelheim Ελλάς Μονοπρόσωπη A.E.
Tηλ: +30 2 10 89 06 300
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Latvija
Boehringer Ingelheim RCV GmbH & Co KG
Latvijas filiāle
Tel: +371 67 240 011
United Kingdom (Northern Ireland)
Boehringer Ingelheim Ireland Ltd.
Tel: +353 1 295 9620
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu .
Istruzioni per l’uso
Spevigo 150 mg soluzione iniettabile in siringa preriempita
Familiarizzare con Spevigo
La siringa preriempita contiene il principio attivo spesolimab in soluzione per iniezione sottocutanea
che consente la somministrazione di una dose fissa di spesolimab.
Prima di iniziare a usare questo medicinale su di sé o sul suo bambino, si assicuri di ricevere
istruzioni per l’uso per assicurarsi di somministrare la dose corretta. Se ha problemi di vista ed è
ipovedente, deve essere aiutato dalla persona che la assiste adeguatamente addestrata.
Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
Spevigo è monouso. Nonriutilizzi la siringa preriempita.
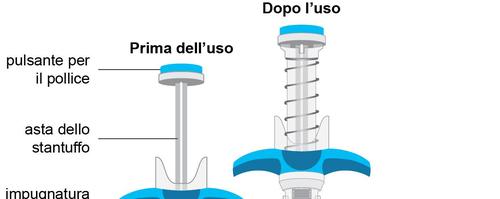
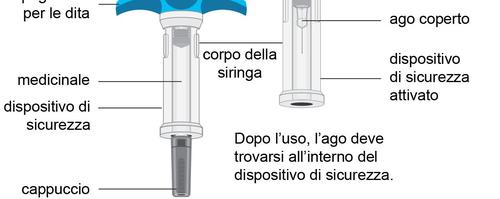
Descrizione dell’aspetto della siringa preriempita di Spevigo
Spevigo è una siringa preriempita dotata di un dispositivo di sicurezza. Dopo l’iniezione, l’ago si ritrae
nel dispositivo di sicurezza.
La figura seguente mostra Spevigo prima e dopo l’uso, con il dispositivo di sicurezza attivato.
Il medico ha prescritto a lei o al suo bambino una dose di Spevigo che richiede due iniezioni per
somministrare una dose completa. Per somministrare la dose completa, deve iniettare il contenuto di
entrambe le siringhe preriempite che troverà nella scatola.
Informazioni importantida conoscere prima di iniettare Spevigo
- Nonusi la siringa preriempita fino a quando non le sarà stato mostrato il modo corretto di effettuare l’iniezione e fino a quando non avrà letto e compreso queste istruzioni per l’uso.
- Esamini la scatola contenente il prodotto per assicurarsi di avere a disposizione il medicinale corretto e il giusto numero di siringhe preriempite per la dose prescritta a lei o al suo bambino e per verificare l’eventuale presenza di danni e la data di scadenza.
- Nonrimuova il cappuccio finché non è pronto per l’iniezione.
- Nonusi Spevigo:
- se il liquido è torbido o contiene fiocchi o particelle di grandi dimensioni.
- se la data di scadenza (EXP)è passata.
- se le siringhe preriempite sono cadute o appaiono danneggiate.
- È importante registrare il numero di lotto della confezione di Spevigo. Ogni volta che riceve una nuova confezione di Spevigo, prenda nota della data e del numero di lotto (che si trova sulla confezione dopo “Lotto/Lot”) e conservi queste informazioni in un luogo sicuro.
- Inietti Spevigo sotto la pelle (iniezione sottocutanea) nella parte alta delle cosce oppure nella zona dello stomaco (addome). Noninietti Spevigo in nessun’altra area del corpo.
- Se ha qualsiasi problema con l’iniezione, nonripeta i passaggi per l’iniezione con la siringa preriempita di Spevigo. Chiami il medico per richiedere assistenza.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
Segua i passaggi descritti qui sotto quando usa Spevigo
| PASSAGGIO 1 | a Preparazione dei materiali |
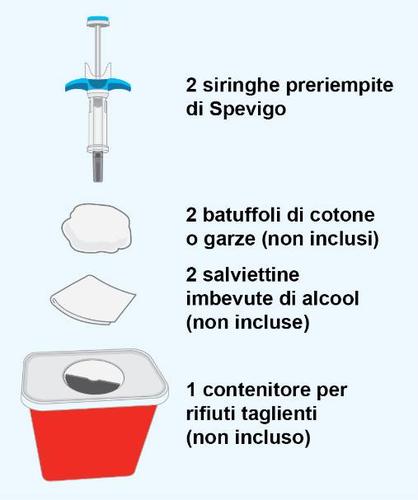 | F
|
| PASSAGGIO 2 | i l Preparazione all’iniezione di Spevigo |
i a I t a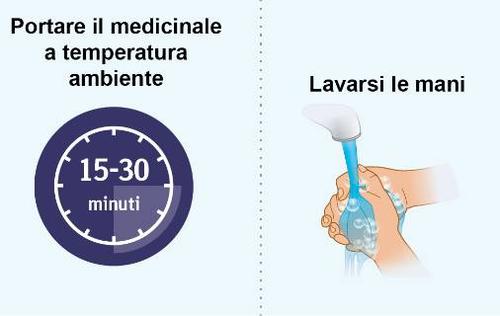 |
|
PASSAGGIO 3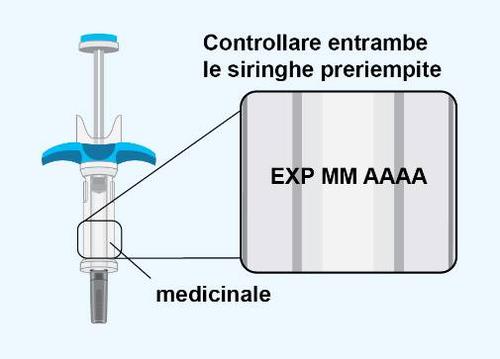 | Ispezione delle siringhe preriempite |
o A questo punto, controllare entrambe le siringhe preriempite:
| |
| d Preparazione alla prima iniezione | |
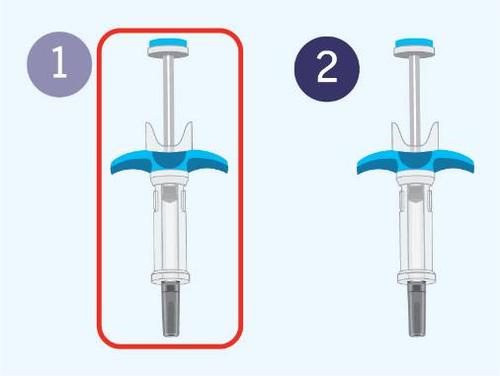 | a Prepararsi alla prima delle due iniezioni. n Si ricorda che i passaggi seguenti dovranno essere ripetuti con la seconda siringa preriempita subito dopo la prima iniezione. a Per una dose completa sono necessarie due iniezioni. i l |
| a t PASSAGGIO 4 | Scelta della sede di iniezione |
e n z i a I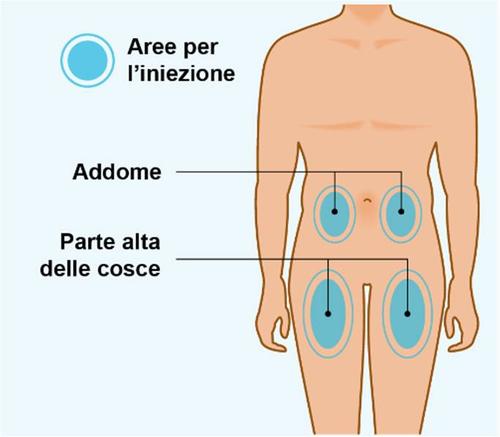 | Scegliere una sede di iniezione.
|
| PASSAGGIO 5 | Pulizia della sede di iniezione |
 | o
|
PASSAGGIO 6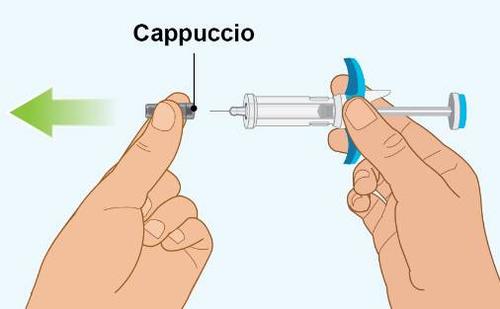 | r Rimozione del cappuccio |
a
| |
| PASSAGGIO 7 | a Preparazione della plica di pelle |
I t a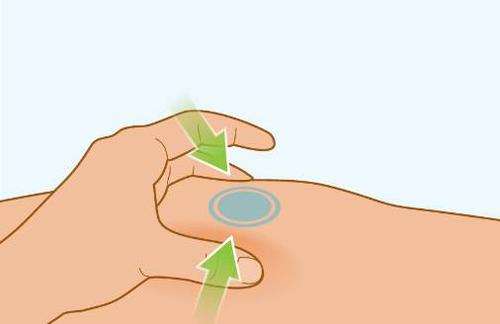 | i l
|
| a i PASSAGGIO 8 | Prima dell’iniezione, rivedere i passaggi A, B e C per apprendere la tecnica di iniezione corretta |
| z n Importante: non muovere la siringa preriempita quando si inserisce l’ago nella pelle, durante l’iniezione o al momento di rimuovere l’ago dalla pelle. | |
A g e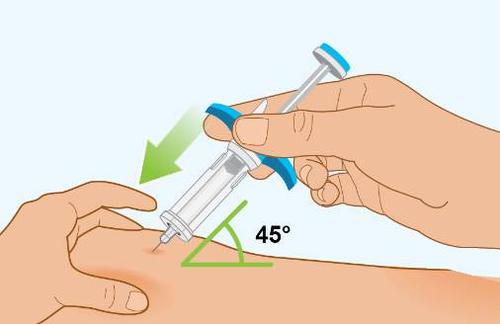 |
|
| A Inserimento dell’ago | |
 | o Per iniettare Spevigo:
|
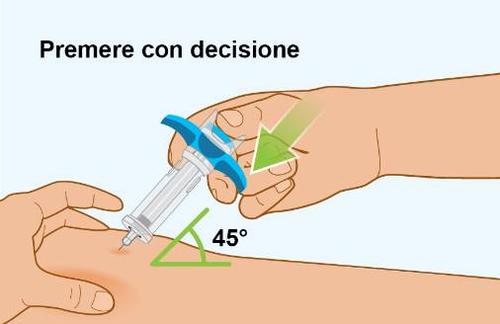
| B Iniezione del medicinale | |
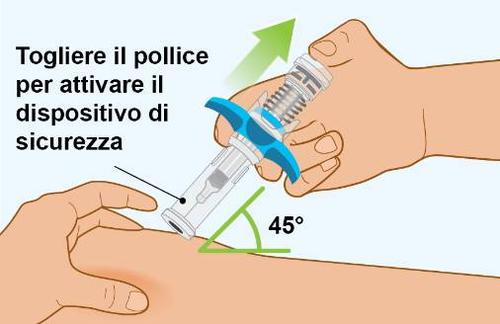 | a
|
| C Verifica del completamento dell’iniezione | |
PASSAGGIO 9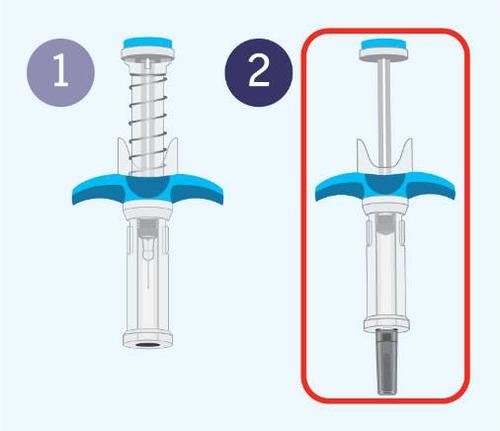 | a Seconda iniezione |
| I t a | n a
|
| a i PASSAGGIO 10 | Smaltimento delle siringhe preriempite usate e dei cappucci usati |
A g e n z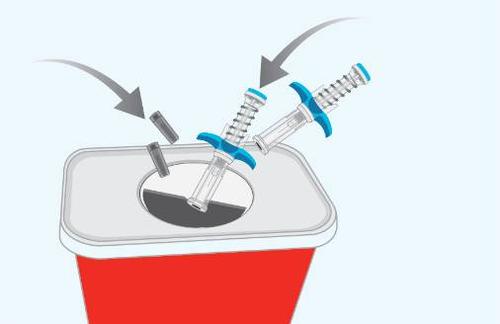 |
|
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a SPEVIGOForma farmaceutica: Soluzione iniettabile in siringa pre-riempita, 45 mgPrincipio attivo: ustekinumabProduttore: ACCORD HEALTHCARE, S.L.U.Prescrizione richiestaForma farmaceutica: Concentrato per soluzione per infusione, 20 mg/mLPrincipio attivo: tocilizumabProduttore: CELLTRION HEALTHCARE HUNGARY KFTPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 160 mgPrincipio attivo: bimekizumabProduttore: UCB PHARMA S.A.Prescrizione richiesta
Medici online per SPEVIGO
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di SPEVIGO — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





