
TEPADINA

Come usare TEPADINA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- TEPADINA 15 mg polvere per concentrato per soluzione per infusione
- TEPADINA 100 mg polvere per concentrato per soluzione per infusione
- TEPADINA 200 mg polvere e solvente per soluzione per infusione
- Cos’è TEPADINA e a cosa serve
- Cosa deve sapere prima di usare TEPADINA
- Come usare TEPADINA
- Possibili effetti indesiderati
- Come conservare TEPADINA
- Contenuto della confezione e altre informazioni
- PRESENTAZIONE
- POSOLOGIA E METODO DI SOMMINISTRAZIONE
- PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
- TEPADINA 400 mg polvere e solvente per soluzione per infusione
- Cos’è TEPADINA e a cosa serve
- Cosa deve sapere prima di usare TEPADINA
- Come usare TEPADINA
- Possibili effetti indesiderati
- Come conservare TEPADINA
- Contenuto della confezione e altre informazioni
- PRESENTAZIONE
- POSOLOGIA E METODO DI SOMMINISTRAZIONE
- PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
TEPADINA 15 mg polvere per concentrato per soluzione per infusione
tiotepa
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TEPADINA e a cosa serve
- 2. Cosa deve sapere prima di usare TEPADINA
- 3. Come usare TEPADINA
- 4. Possibili effetti indesiderati
- 5. Come conservare TEPADINA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è TEPADINA e a cosa serve
TEPADINA contiene il principio attivo tiotepa, che appartiene a un gruppo di medicinali chiamati
agenti alchilanti.
TEPADINA è usata per preparare i pazienti al trapianto di midollo osseo; opera distruggendo le cellule
del midollo osseo. In tal modo, consente il trapianto di nuove cellule del midollo osseo (cellule
progenitrici emopoietiche), che a loro volta consentono al corpo di produrre cellule del sangue sane.
TEPADINA può essere usata negli adulti e nei bambini e negli adolescenti.
2. Cosa deve sapere prima di usare TEPADINA
Non usi TEPADINA
- se è allergico a tiotepa,
- se è in stato di gravidanza o se sospetta una gravidanza,
- se sta allattando al seno,
- se sta assumendo vaccino contro la febbre gialla, a virus vivi e vaccini batterici.
Avvertenze e precauzioni
Informi il medico se ha:
- problemi al fegato o renali,
- problemi cardiaci o polmonari,
- convulsioni (epilessia) o se ne ha avute in passato (se trattato con fenitoina o fosfofenitoina).
Dal momento che TEPADINA distrugge le cellule del midollo osseo responsabili della produzione
delle cellule del sangue, durante il trattamento le verranno effettuati prelievi regolari del sangue per
verificare la conta delle cellule del sangue.
Per la prevenzione e il trattamento delle infezioni le saranno somministrati antinfettivi.
TEPADINA potrebbe provocare un altro tipo di tumore in futuro. Il medico discuterà con lei di questo
rischio.
Altri medicinali e TEPADINA
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza, allattamento e fertilità
Prima di assumere TEPADINA, informi il medico se è in stato di gravidanza o se sospetta una
gravidanza. Non usi TEPADINA in gravidanza.
Durante il trattamento con TEPADINA sia gli uomini che le donne devono usare mezzi di
contraccezione efficaci. Gli uomini non devono procreare durante il trattamento con TEPADINA e
nell’anno successivo all’interruzione del trattamento.
Non è noto se questo medicinale sia escreto nel latte materno. Come misura precauzionale, le donne
non devono allattare al seno durante il trattamento con TEPADINA.
TEPADINA può compromettere la fertilità maschile e femminile. Si raccomanda ai pazienti di sesso
maschile di effettuare la conservazione dello sperma prima di iniziare la terapia.
Guida di veicoli e utilizzo di macchinari
E’ probabile che alcune reazioni avverse di tiotepa come vertigini, cefalea e visione offuscata possano
alterare la sua capacità di guidare veicoli e di usare macchinari. Se avverte questi sintomi, non guidi
veicoli e non usi macchinari.
3. Come usare TEPADINA
Il medico calcolerà il dosaggio a seconda della superficie corporea, o del peso, e della malattia.
Come si somministra TEPADINA
TEPADINA è somministrata da un operatore sanitario qualificato, mediante infusione endovenosa
(flebo in una vena) dopo la diluizione del singolo flaconcino. Ogni infusione durerà 2-4 ore.
Frequenza di somministrazione
Le infusioni saranno somministrate ogni 12 o 24 ore. Il trattamento può durare fino a 5 giorni. La
frequenza di somministrazione e la durata del trattamento dipendono dalla malattia.
4. Possibili effetti indesiderati
Come tutti i medicinali, TEPADINA può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
I più gravi effetti indesiderati della terapia con TEPADINA o della procedura di trapianto includono:
- riduzione della conta delle cellule del sangue circolanti (effetto voluto del medicinale per prepararla all’infusione per il trapianto)
- infezione
- disturbi al fegato, tra cui l’ostruzione di una vena del fegato
- il trapianto attacca l’organismo (malattia del trapianto contro l’ospite)
- complicanze respiratorie Il medico controllerà regolarmente la conta delle cellule del sangue e gli enzimi del fegato per individuare e controllare tali eventi.
Gli effetti indesiderati di TEPADINA possono verificarsi con varie frequenze, definite come segue:
Effetti indesiderati molto comuni (possono interessare più di 1 paziente su 10)
- maggiore predisposizione alle infezioni
- stato infiammatorio che coinvolge l’intero corpo (sepsi)
- ridotta conta di globuli bianchi, piastrine e globuli rossi (anemia)
- le cellule trapiantate attaccano l’organismo (malattia del trapianto contro l’ospite)
- vertigini, mal di testa, visione offuscata
- tremore incontrollato del corpo (convulsioni)
- sensazione di formicolio, pizzicore e intorpidimento (parestesia)
- perdita parziale del movimento
- arresto cardiaco
- nausea, vomito, diarrea
- infiammazione della mucosa della bocca (mucosite)
- irritazione dello stomaco, dell’esofago e dell’intestino
- infiammazione del colon
- anoressia, calo dell’appetito
- alto livello di glucosio nel sangue
- eruzione cutanea, prurito, desquamazione
- alterazione del colore della pelle (da non confondere con l’ittero - vedere sotto)
- arrossamento della pelle (eritema)
- perdita di capelli
- dolori addominali e alla schiena, dolori
- dolori muscolari e articolari
- attività elettriche anormali del cuore (aritmia)
- infiammazione del tessuto polmonare
- fegato ingrossato
- funzione organica alterata
- ostruzione di una vena epatica (VOD - venous occlusive disease, malattia veno-occlusiva)
- ingiallimento della pelle e degli occhi (ittero)
- diminuzione dell’udito
- ostruzione linfatica
- alta pressione sanguigna
- incremento degli enzimi del fegato, renali e digestivi
- elettroliti del sangue anormali
- aumento di peso
- febbre, debolezza, brividi
- sanguinamento (emorragia)
- sangue dal naso
- gonfiore generale dovuto alla ritenzione di liquidi (edema)
- dolore o infiammazione al sito di iniezione
- infezione dell’occhio (congiuntivite)
- ridotta conta di spermatozoi
- sanguinamento vaginale
- assenza del ciclo mestruale (amenorrea)
- perdita della memoria
- ritardo dell’aumento del peso e della crescita in altezza
- disfunzioni della vescica
- diminuzione della produzione di testosterone
- produzione insufficiente degli ormoni tiroidei
- ridotta attività della ghiandola pituitaria
- stato confusionale
Effetti indesiderati comuni(possono interessare fino a 1 paziente su 10)
- ansia, confusione
- rigonfiamento anormale verso l’esterno di una delle arterie cerebrali (aneurisma intracranico)
- elevata creatinina
- reazioni allergiche
- occlusione di un vaso sanguigno (embolia)
- disturbi del ritmo cardiaco
- alterazione della funzionalità cardiaca
- alterazione della funzionalità cardiovascolare
- carenza d’ossigeno
- accumulo di fluidi nei polmoni (edema polmonare)
- sanguinamento polmonare
- arresto respiratorio
- sangue nell’urina (ematuria) e insufficienza renale moderata
- infiammazione della vescica urinaria
- difficoltà ad urinare e diminuzione della quantità di urina (disuria e oliguria)
- aumento della quantità di composti azotati nel sangue (aumento del BUN)
- cataratta
- alterazione della funzionalità del fegato
- emorragia cerebrale
- tosse
- stipsi e disturbi allo stomaco
- ostruzione intestinale
- perforazione dello stomaco
- alterazione del tono muscolare
- mancanza di coordinazione dei movimenti muscolari
- lividi dovuti a bassa conta piastrinica
- sintomi della menopausa
- cancro (secondo tumore primario)
- funzione cerebrale anormale
- infertilità maschile e femminile
Effetti indesiderati non comuni (possono interessare fino a 1 paziente su 100)
- infiammazione ed esfoliazione della pelle (psoriasi eritrodermica)
- delirio, nervosismo, allucinazioni, agitazione
- ulcera gastrointestinale
- infiammazione del tessuto miocardico (miocardite)
- condizioni cardiache anormali (cardiomiopatia)
Frequenza non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- aumentata pressione del sangue nelle arterie (vasi sanguigni) dei polmoni (ipertensione arteriosa polmonare);
- gravi danni alla pelle (ad esempio, lesioni gravi, vescicole, etc.) che possono interessare tutta la superficie corporea e che possono anche essere pericolosi per la vita.
- danni a una componente del cervello (la cosiddetta materia bianca) che possono anche essere pericolosi per la vita (leucoencefalopatia).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all'infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ Allegato V .
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare TEPADINA
Tenere questo medicinale fuori dalla vista e dalla portata vista dei bambini.
Non usi TEPADINA dopo la data di scadenza che è riportata sull’etichetta del cartone e del
flaconcino, dopo SCAD. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare e trasportare in frigorifero (2 °C-8 °C).
Non congelare.
Dopo la ricostituzione, il prodotto è stabile per 80 ore se conservato a 2 °C -8 °C.
Dopo la diluizione il prodotto è stabile fino a 48 ore se conservato a 2°C -8°C e fino a 6 ore se
conservato a 25°C. Dal punto di vista microbiologico, il prodotto dev’essere usato immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TEPADINA
- Il principio attivo è tiotepa. Un flaconcino contiene 15 mg di tiotepa. Dopo la ricostituzione, ogni mL contiene 10 mg di tiotepa (10 mg/mL).
- TEPADINA non contiene altri componenti.
Descrizione dell’aspetto di TEPADINA e contenuto della confezione
TEPADINA è una polvere cristallina bianca contenuta in un flaconcino di vetro; ogni flaconcino
contiene 15 mg di tiotepa.
Ogni scatola contiene un flaconcino.
Titolare dell’autorizzazione all’immissione in commercio e produttore
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italia
Tel: +39-02 40700445
[email protected]
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Accord Healthcare bv
Tèl/Tel: +32 51 79 40 12
Lietuva
Accord Healthcare AB
Tel: +46 8 624 00 25
България
Accord Healthcare Polska Sp. z o.o.
Teл.: +48 22 577 28 00
Luxembourg/Luxemburg
Accord Healthcare bv
Tèl/Tel: +32 51 79 40 12
Česká republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Magyarország
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
Danmark
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Malta
Accord Healthcare Ireland Ltd
Tel: +44 (0) 208 901 3370
Deutschland
Accord Healthcare GmbH
Tel: +49 89 700 9951 0
Nederland
Accord Healthcare B.V.
Tel: +31 30 850 6014
Eesti
Accord Healthcare AB
Tel: +46 8 624 00 25
Norge
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Ελλάδα
Accord Healthcare Italia Srl
Τηλ: + 39 02 943 23 700
Österreich
Accord Healthcare GmbH
Tel: +43 (0)662 424899-0
España
Accord Healthcare S.L.U.
Tel: +34 93 301 00 64
Polska
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
France
Accord Healthcare France SAS
Tél: +33 (0)320 401 770
Portugal
Accord Healthcare, Unipessoal Lda
Tel: +351 214 697 835
Hrvatska
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
România
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ireland
Accord Healthcare Ireland Ltd
Tel: +44 (0)1271 385257
Slovenija
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ísland
Accord Healthcare AB
Sími: + 46 8 624 00 25
Slovenská republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Italia
Accord Healthcare Italia Srl
Tel: +39 02 943 23 700
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Κύπρος
Accord Healthcare S.L.U.
Τηλ: + 34 93 301 00 64
Sverige
Accord Healthcare AB
Tel: + 46 8 624 00 25
Latvija
Accord Healthcare AB
Tel: +46 8 624 00 25
United Kingdom (Northern Ireland)
Accord-UK Ltd
Tel: +44 (0)1271 385257
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu .
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari.
ISTRUZIONI PER LA PREPARAZIONE
TEPADINA 15 mg polvere per concentrato per soluzione per infusione
Tiotepa
Leggere queste istruzioni prima di preparare e somministrare TEPADINA.
1. PRESENTAZIONE
TEPADINA si presenta come 15 mg polvere per concentrato per soluzione per infusione.
TEPADINA dev’essere ricostituita e diluita prima della somministrazione.
2. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
Aspetti generali
Per la manipolazione e lo smaltimento di medicinali antitumorali si devono seguire le procedure
appropriate. Tutte le procedure di trasferimento richiedono una stretta osservanza di tecniche asettiche,
e preferibilmente l’impiego di una cappa di sicurezza a flusso laminare verticale.
Come per altri composti citotossici, è necessario prestare estrema attenzione nella manipolazione e
preparazione delle soluzioni di TEPADINA, per evitare il contatto accidentale con la pelle o con le
membrane della mucosa. Possono verificarsi reazioni topiche associate all’esposizione accidentale a
tiotepa. Si consiglia quindi di indossare guanti prima di preparare la soluzione per infusione. Se la
soluzione con tiotepa entra in contatto accidentalmente con la pelle, lavare accuratamente e
immediatamente l’area esposta con acqua e sapone. In caso di contatto accidentale di tiotepa con le
membrane della mucosa, si raccomanda di lavare abbondantemente le stesse con acqua.
Calcolo del dosaggio di TEPADINA
TEPADINA è somministrata a dosaggi diversi in associazione con altri medicinali chemioterapici
prima del convenzionale trapianto di cellule emopoietiche progenitrici ( haematopoietic progenitor cell
transplantation,HPCT) in pazienti con patologie ematologiche o tumori solidi.
La posologia indicata di TEPADINA, nei pazienti adulti e pediatrici, dipende dal tipo di HPCT
(autologo o allogenico) e dalla patologia.
Posologia negli adulti
HPCT AUTOLOGO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a
300 mg/m /giorno (8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni
consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per
tutto il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 300 mg/m /giorno
(8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni consecutivi prima
dell’HPCT autologo, a seconda dell’associazione con altri medicinali chemioterapici, senza superare
la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per tutto il periodo del regime di
condizionamento.
LINFOMA DEL SISTEMA NERVOSO CENTRALE
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
Tumori solidi
La dose raccomandata nei tumori solidi varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a
250 mg/m /giorno (6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
2 fino a 5 giorni consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri
medicinali chemioterapici, senza superare la dose cumulativa totale massima di 800 mg/m (21,62
mg/kg), per tutto il periodo del regime di condizionamento.
CARCINOMA MAMMARIO
La dose raccomandata varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 3 a 5 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 800 mg/m (21,62 mg/kg), per tutto il periodo del regime di
condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 3 a 4 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per
tutto il periodo del regime di condizionamento.
CARCINOMA OVARICO
La dose raccomandata è 250 mg/m /giorno (6,76 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 500 mg/m (13,51 mg/kg), per tutto il periodo del regime di condizionamento.
TUMORI A CELLULE GERMINALI
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 185 mg/m /giorno (5 mg/kg/giorno) a
481 mg/m /giorno (13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
1 a 3 giorni consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata nel linfoma è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni
giornaliere prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera prima
dell’HPCT allogenico, senza superare la dose cumulativa totale massima di 185 mg/m (5 mg/kg), per
tutto il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata varia da 185 mg/m /giorno (5 mg/kg/giorno) a 481 mg/m /giorno
(13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1 a 2 giorni
consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Posologia nei pazienti pediatrici
HPCT AUTOLOGO
Tumori solidi
La dose raccomandata nei tumori solidi varia da 150 mg/m /giorno (6 mg/kg/giorno) a
350 mg/m /giorno (14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 3 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per
tutto il periodo del regime di condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 250 mg/m /giorno (10 mg/kg/giorno) a 350 mg/m /giorno
(14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (5 mg/kg/giorno) a
250 mg/m /giorno (10 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
1 a 3 giorni consecutivi prima dell’HPCT allogenico, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 375 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata varia da 200 mg/m /giorno (8 mg/kg/giorno) a 250 mg/m /giorno
(10 mg/kg/giorno) suddivisa in due infusioni giornaliere, somministrate prima dell’HPCT allogenico
senza superare la dose cumulativa totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del
regime di condizionamento.
CITOPENIA REFRATTARIA
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 3 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 375 mg/m (15 mg/kg), per tutto il periodo del regime di condizionamento.
MALATTIE GENETICHE
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
ANEMIA DREPANOCITICA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Ricostituzione
TEPADINA dev’essere ricostituita con 1,5 mL d’acqua per preparazioni iniettabili.
Usando una siringa con ago già montato, aspirare 1,5 mL di acqua per preparazioni iniettabili con
manovre asettiche.
Iniettare il contenuto della siringa nel flaconcino attraverso il tappo di gomma.
Rimuovere la siringa e l’ago e miscelare manualmente con inversioni ripetute.
Usare esclusivamente soluzioni incolori, prive di materiale particellare. Le soluzioni ricostituite
possono mostrare occasionalmente opalescenza; dette soluzioni possono ancora essere somministrate.
Ulteriore diluizione nella sacca per infusione
La soluzione ricostituita è ipotonica e deve essere ulteriormente diluita prima della somministrazione
in 500 mL di soluzione di cloruro di sodio 9 mg/mL (0,9%) per iniezioni (1 000 mL se la dose è
maggiore di 500 mg) o in un volume appropriato di soluzione di cloruro di sodio 9 mg/mL (0,9%) per
iniezioni al fine di ottenere una concentrazione finale di TEPADINA tra 0,5 e 1 mg/mL.
Somministrazione
La soluzione per infusione di TEPADINA dev’essere essere controllata visivamente in modo da
escludere la presenza di materiale particellare prima della somministrazione. Eliminare le soluzioni
contenenti un precipitato.
La soluzione per infusione deve essere somministrata ai pazienti mediante un set di infusione
provvisto di filtro in linea da 0,2 µm. Il filtraggio non altera il potere della soluzione.
Somministrare TEPADINA in maniera asettica mediante infusione di 2-4 ore a temperatura ambiente
(circa 25°C) e in condizioni di luce normali.
Prima e dopo ciascuna infusione, lavare bene il condotto del catetere a permanenza con circa 5 mL di
soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%).
Smaltimento
TEPADINA è esclusivamente monouso.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
TEPADINA 100 mg polvere per concentrato per soluzione per infusione
tiotepa
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TEPADINA e a cosa serve
- 2. Cosa deve sapere prima di usare TEPADINA
- 3. Come usare TEPADINA
- 4. Possibili effetti indesiderati
- 5. Come conservare TEPADINA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è TEPADINA e a cosa serve
TEPADINA contiene il principio attivo tiotepa, che appartiene a un gruppo di medicinali chiamati
agenti alchilanti.
TEPADINA è usata per preparare i pazienti al trapianto di midollo osseo; opera distruggendo le cellule
del midollo osseo. In tal modo, consente il trapianto di nuove cellule del midollo osseo (cellule
progenitrici emopoietiche), che a loro volta consentono al corpo di produrre cellule del sangue sane.
TEPADINA può essere usata negli adulti e nei bambini e negli adolescenti.
2. Cosa deve sapere prima di usare TEPADINA
Non usi TEPADINA
- se è allergico a tiotepa,
- se è in stato di gravidanza o se sospetta una gravidanza,
- se sta allattando al seno,
- se sta assumendo vaccino contro la febbre gialla, a virus vivi e vaccini batterici.
Avvertenze e precauzioni
Informi il medico se ha:
- problemi al fegato o renali,
- problemi cardiaci o polmonari,
- convulsioni (epilessia) o se ne ha avute in passato (se trattato con fenitoina o fosfofenitoina).
Dal momento che TEPADINA ditrugge le cellule del midollo osseo responsabili della produzione
delle cellule del sangue durante il trattamento le verranno effettuati prelievi regolari del sangue per
verificare la conta delle cellule del sangue.
Per la prevenzione e il trattamento delle infezioni le saranno somministrati antinfettivi.
TEPADINA potrebbe provocare un altro tipo di tumore in futuro. Il medico discuterà con lei di questo
rischio.
Altri medicinali e TEPADINA
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza, allattamento e fertilità
Prima di assumere TEPADINA, informi il medico se è in stato di gravidanza o se sospetta una
gravidanza. Non usi TEPADINA in gravidanza.
Durante il trattamento con TEPADINA sia gli uomini che le donne devono usare mezzi di
contraccezione efficaci. Gli uomini non devono procreare durante il trattamento con TEPADINA e
nell’anno successivo all’interruzione del trattamento.
Non è noto se questo medicinale sia escreto nel latte materno. Come misura precauzionale, le donne
non devono allattare al seno durante il trattamento con TEPADINA.
TEPADINA può compromettere la fertilità maschile e femminile. Si raccomanda ai pazienti di sesso
maschile di effettuare la conservazione dello sperma prima di iniziare la terapia.
Guida di veicoli e utilizzo di macchinari
E’ probabile che alcune reazioni avverse di tiotepa come vertigini, cefalea e visione offuscata possano
alterare la sua capacità di guidare veicoli e di usare macchinari. Se avverte questi sintomi, non guidi
veicoli e non usi macchinari.
3. Come usare TEPADINA
Il medico calcolerà il dosaggio a seconda della superficie corporea, o del peso, e della malattia.
Come si somministra TEPADINA
TEPADINA è somministrata da un operatore sanitario qualificato mediante infusione endovenosa
(flebo in una vena) dopo la diluizione del singolo flaconcino. Ogni infusione durerà 2-4 ore.
Frequenza di somministrazione
Le infusioni saranno somministrate ogni 12 o 24 ore. Il trattamento può durare fino a 5 giorni. La
frequenza di somministrazione e la durata del trattamento dipendono dalla malattia.
4. Possibili effetti indesiderati
Come tutti i medicinali, TEPADINA può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
I più gravi effetti indesiderati della terapia con TEPADINA o della procedura di trapianto includono:
- riduzione della conta delle cellule del sangue circolanti (effetto voluto del medicinale per prepararla all’infusione per il trapianto)
- infezione
- disturbi al fegato, tra cui l’ostruzione di una vena del fegato
- il trapianto attacca l’organismo (malattia del trapianto contro l’ospite)
- complicanze respiratorie Il medico controllerà regolarmente la conta delle cellule del sangue e gli enzimi del fegato per individuare e controllare tali eventi.
Gli effetti indesiderati di TEPADINA possono verificarsi con varie frequenze, definite come segue.
Effetti indesiderati molto comuni (possono interessare più di 1 paziente su 10)
- maggiore predisposizione alle infezioni
- stato infiammatorio che coinvolge l’intero corpo (sepsi)
- ridotta conta di globuli bianchi, piastrine e globuli rossi (anemia)
- le cellule trapiantate attaccano l’organismo (malattia del trapianto contro l’ospite)
- vertigini, mal di testa, visione offuscata
- tremore incontrollato del corpo (convulsioni)
- sensazione di formicolio, pizzicore e intorpidimento (parestesia)
- perdita parziale del movimento
- arresto cardiaco
- nausea, vomito, diarrea
- infiammazione della mucosa della bocca (mucosite)
- irritazione dello stomaco, dell’esofago e dell’intestino
- infiammazione del colon
- anoressia, calo dell’appetito
- alto livello di glucosio nel sangue
- eruzione cutanea, prurito, desquamazione
- alterazione del colore della pelle (da non confondere con l’ittero - vedere sotto)
- arrossamento della pelle (eritema)
- perdita di capelli
- dolori addominali e alla schiena, dolori
- dolori muscolari e articolari
- attività elettriche anormali del cuore (aritmia)
- infiammazione del tessuto polmonare
- fegato ingrossato
- funzione organica alterata
- ostruzione di una vena epatica (VOD - veno occlusive disease, malattia veno-occlusiva)
- ingiallimento della pelle e degli occhi (ittero)
- diminuzione dell’udito
- ostruzione linfatica
- alta pressione sanguigna
- incremento degli enzimi del fegato, renali e digestivi
- elettroliti del sangue anormali
- aumento di peso
- febbre, debolezza, brividi
- sanguinamento (emorragia)
- sangue dal naso
- gonfiore generale dovuto alla ritenzione di liquidi (edema)
- dolore o infiammazione al sito di iniezione
- infezione dell’occhio (congiuntivite)
- ridotta conta di spermatozoi
- sanguinamento vaginale
- assenza del ciclo mestruale (amenorrea)
- perdita della memoria
- ritardo dell’aumento del peso e della crescita in altezza
- disfunzioni della vescica
- diminuzione della produzione di testosterone
- produzione insufficiente degli ormoni tiroidei
- ridotta attività della ghiandola pituitaria
- stato confusionale
Effetti indesiderati comuni (possonointeressare fino a 1 paziente su 10)
- ansia, confusione
- rigonfiamento anormale verso l’esterno di una delle arterie cerebrali (aneurisma intracranico)
- elevata creatinina
- reazioni allergiche
- occlusione di un vaso sanguigno (embolia)
- disturbi del ritmo cardiaco
- alterazione della funzionalità cardiaca
- alterazione della funzionalità cardiovascolare
- carenza d’ossigeno
- accumulo di fluidi nei polmoni (edema polmonare)
- sanguinamento polmonare
- arresto respiratorio
- sangue nell’urina (ematuria) e insufficienza renale moderata
- infiammazione della vescica urinaria
- difficoltà ad urinare e diminuzione della quantità di urina (disuria e oliguria)
- aumento della quantità di composti azotati nel sangue (aumento del BUN)
- cataratta
- alterazione della funzionalità del fegato
- emorragia cerebrale
- tosse
- stipsi e disturbi allo stomaco
- ostruzione intestinale
- perforazione dello stomaco
- alterazione del tono muscolare
- mancanza di coordinazione dei movimenti muscolari
- lividi dovuti a bassa conta piastrinica
- sintomi della menopausa
- cancro (secondo tumore primario)
- funzione cerebrale anormale
- infertilità maschile e femminile
Effetti indesiderati non comuni (possono interessare fino a 1 paziente su 100)
- infiammazione ed esfoliazione della pelle (psoriasi eritrodermica)
- delirio, nervosismo, allucinazioni, agitazione
- ulcera gastrointestinale
- infiammazione del tessuto miocardico (miocardite)
- condizioni cardiache anormali (cardiomiopatia)
Frequenza non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- aumentata pressione del sangue nelle arterie (vasi sanguigni) dei polmoni (ipertensione arteriosa polmonare);
- gravi danni alla pelle (ad esempio, lesioni gravi, vescicole, etc.) che possono interessare tutta la superficie corporea e che possono anche essere pericolosi per la vita.
- danni a una componente del cervello (la cosiddetta materia bianca) che possono anche essere pericolosi per la vita (leucoencefalopatia).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere/a. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’ Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare TEPADINA
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi TEPADINA dopo la data di scadenza che è riportata sull’etichetta del cartone e del
flaconcino, dopo SCAD. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare e trasportare in frigorifero (2 °C-8 °C).
Non congelare.
Dopo la ricostituzione, il prodotto è stabile per 80 ore se conservato a 2 °C -8 °C.
Dopo la diluizione il prodotto è stabile fino a 48 ore se conservato a 2 °C -8 °C e fino a 6 ore se
conservato a 25°C. Dal punto di vista microbiologico, il prodotto dev’essere usato immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TEPADINA
- Il principio attivo è tiotepa. Un flaconcino contiene 100 mg di tiotepa. Dopo la ricostituzione, ogni mL contiene 10 mg di tiotepa (10 mg/mL).
- TEPADINA non contiene altri componenti.
Descrizione dell’aspetto di TEPADINA e contenuto della confezione
TEPADINA è una polvere cristallina bianca contenuta in un flaconcino di vetro; ogni flaconcino
contiene 100 mg di tiotepa.
Ogni scatola contiene un flaconcino.
Titolare dell’autorizzazione all’immissione in commercio e produttore
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italia
Tel: +39-02 40700445
[email protected]
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Accord Healthcare bv
Tél: +32 51 79 40 12
Lietuva
Accord Healthcare AB
Tel: +46 8 624 00 25
България
Accord Healthcare Polska Sp. z o.o.
Teл.: +48 22 577 28 00
Luxembourg/Luxemburg
Accord Healthcare bv
Tèl/Tel: +32 51 79 40 12
Česká republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Magyarország
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
Danmark
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Malta
Accord Healthcare Ireland Ltd
Tel: +44 (0) 208 901 3370
DeutschlandNederland
Accord Healthcare GmbH
Tel: +49 89 700 9951 0
Accord Healthcare B.V.
Tel: +31 30 850 6014
Eesti
Accord Healthcare AB
Tel: +46 8 624 00 25
Norge
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Ελλάδα
Accord Healthcare Italia Srl
Τηλ: + 39 02 943 23 700
Österreich
Accord Healthcare GmbH
Tel: +43 (0)662 424899-0
España
Accord Healthcare S.L.U.
Tel: +34 93 301 00 64
Polska
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
France
Accord Healthcare France SAS
Tél: +33 (0)320 401 770
Portugal
Accord Healthcare, Unipessoal Lda
Tel: +351 214 697 835
Hrvatska
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
România
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ireland
Accord Healthcare Ireland Ltd
Tel: +44 (0)1271 385257
Slovenija
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ísland
Accord Healthcare AB
Sími: + 46 8 624 00 25
Slovenská republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Italia
Accord Healthcare Italia Srl
Tel: +39 02 943 23 700
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Κύπρος
Accord Healthcare S.L.U.
Τηλ: + 34 93 301 00 64
Sverige
Accord Healthcare AB
Tel: + 46 8 624 00 25
Latvija
Accord Healthcare AB
Tel: +46 8 624 00 25
United Kingdom (Northern Ireland)
Accord-UK Ltd
Tel: +44 (0)1271 385257
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu .
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari.
ISTRUZIONI PER LA PREPARAZIONE
TEPADINA 100 mg polvere per concentrato per soluzione per infusione
Tiotepa
Leggere queste istruzioni prima di preparare e somministrare TEPADINA.
1. PRESENTAZIONE
TEPADINA si presenta come 100 mg polvere per concentrato per soluzione per infusione.
TEPADINA dev’essere ricostituita e diluita prima della somministrazione.
2. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
Aspetti generali
Per la manipolazione e lo smaltimento di medicinali antitumorali si devono seguire le procedure
appropriate. Tutte le procedure di trasferimento richiedono una stretta osservanza di tecniche asettiche,
e preferibilmente l’impiego di una cappa di sicurezza a flusso laminare verticale.
Come per altri composti citotossici, è necessario prestare estrema attenzione nella manipolazione e
preparazione delle soluzioni di TEPADINA, per evitare il contatto accidentale con la pelle o con le
membrane della mucosa. Possono verificarsi reazioni topiche associate all’esposizione accidentale a
tiotepa. Si consiglia quindi di indossare guanti prima di preparare la soluzione per infusione. Se la
soluzione con tiotepa entra in contatto accidentalmente con la pelle, lavare accuratamente e
immediatamente l’area esposta con acqua e sapone. In caso di contatto accidentale di tiotepa con le
membrane della mucosa, si raccomanda di lavare abbondantemente le stesse con acqua.
Calcolo del dosaggio di TEPADINA
TEPADINA è somministrata a dosaggi diversi in associazione con altri medicinali chemioterapici
prima del convenzionale trapianto di cellule emopoietiche progenitrici ( haematopoietic progenitor cell
transplantation, HPCT) in pazienti con patologie ematologiche o tumori solidi.
La posologia indicata di TEPADINA, nei pazienti adulti e pediatrici, dipende dal tipo di HPCT
(autologo o allogenico) e dalla patologia.
Posologia negli adulti
HPCT AUTOLOGO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a
300 mg/m /giorno (8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni
consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per
tutto il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 300 mg/m /giorno
(8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni consecutivi prima
dell’HPCT autologo, a seconda dell’associazione con altri medicinali chemioterapici, senza superare
la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per tutto il periodo del regime di
condizionamento.
LINFOMA DEL SISTEMA NERVOSO CENTRALE
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
Tumori solidi
La dose raccomandata nei tumori solidi varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a
250 mg/m /giorno (6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
2 fino a 5 giorni consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri
medicinali chemioterapici, senza superare la dose cumulativa totale massima di 800 mg/m
(21,62 mg/kg), per tutto il periodo del regime di condizionamento.
CARCINOMA MAMMARIO
La dose raccomandata varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 3 a 5 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 800 mg/m (21,62 mg/kg), per tutto il periodo del regime di
condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 3 a 4 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per
tutto il periodo del regime di condizionamento.
CARCINOMA OVARICO
La dose raccomandata è 250 mg/m /giorno (6,76 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 500 mg/m (13,51 mg/kg), per tutto il periodo del regime di condizionamento.
TUMORI A CELLULE GERMINALI
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 185 mg/m /giorno (5 mg/kg/giorno) a
481 mg/m /giorno (13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
1 a 3 giorni consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata nel linfoma è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni
giornaliere prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera prima
dell’HPCT allogenico, senza superare la dose cumulativa totale massima di 185 mg/m (5 mg/kg), per
tutto il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata varia da 185 mg/m /giorno (5 mg/kg/giorno) a 481 mg/m /giorno
(13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1 a 2 giorni
consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Posologia nei pazienti pediatrici
HPCT AUTOLOGO
Tumori solidi
La dose raccomandata nei tumori solidi varia da 150 mg/m /giorno (6 mg/kg/giorno) a
350 mg/m /giorno (14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 3 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per
tutto il periodo del regime di condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 250 mg/m /giorno (10 mg/kg/giorno) a 350 mg/m /giorno
(14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (5 mg/kg/giorno) a
250 mg/m /giorno (10 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1
a 3 giorni consecutivi prima dell’HPCT allogenico, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 375 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata varia da 200 mg/m /giorno (8 mg/kg/giorno) a 250 mg/m /giorno
(10 mg/kg/giorno) suddivisa in due infusioni giornaliere, somministrate prima dell’HPCT allogenico
senza superare la dose cumulativa totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del
regime di condizionamento.
CITOPENIA REFRATTARIA
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 3 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 375 mg/m (15 mg/kg), per tutto il periodo del regime di condizionamento.
MALATTIE GENETICHE
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
ANEMIA DREPANOCITICA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Ricostituzione
TEPADINA dev’essere ricostituita con 10 mL d’acqua per preparazioni iniettabili.
Usando una siringa con ago già montato, aspirare 10 mL di acqua per preparazioni iniettabili con
manovre asettiche.
Iniettare il contenuto della siringa nel flaconcino attraverso il tappo di gomma.
Rimuovere la siringa e l’ago e miscelare manualmente con inversioni ripetute.
Usare esclusivamente soluzioni incolori, prive di materiale particellare. Le soluzioni ricostituite
possono mostrare occasionalmente opalescenza; dette soluzioni possono ancora essere somministrate.
Ulteriore diluizione nella sacca per infusione
La soluzione ricostituita è ipotonica e dev’essere ulteriormente diluita prima della somministrazione
con 500 mL di soluzione di cloruro di sodio 9 mg/mL (0,9%) per iniezioni (1 000 mL se la dose è
maggiore di 500 mg) o in un volume appropriato di soluzione di cloruro di sodio 9 mg/mL (0,9%) per
iniezioni al fine di ottenere una concentrazione finale di TEPADINA tra 0,5 e 1 mg/mL.
Somministrazione
La soluzione per infusione di TEPADINA dev’essere essere controllata visivamente in modo da
escludere la presenza di materiale particellare prima della somministrazione. Eliminare le soluzioni
contenenti un precipitato.
La soluzione per infusione deve essere somministrata ai pazienti mediante un set di infusione
provvisto di filtro in linea da 0,2 µm. Il filtraggio non altera il potere della soluzione.
Somministrare TEPADINA in maniera asettica mediante infusione di 2-4 ore a temperatura ambiente
(circa 25°C) e in condizioni di luce normali.
Prima e dopo ciascuna infusione, lavare bene il condotto del catetere a permanenza con circa 5 mL di
soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%).
Smaltimento
TEPADINA è esclusivamente monouso.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
TEPADINA 200 mg polvere e solvente per soluzione per infusione
tiotepa
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è TEPADINA e a cosa serve
- 2. Cosa deve sapere prima di usare TEPADINA
- 3. Come usare TEPADINA
- 4. Possibili effetti indesiderati
- 5. Come conservare TEPADINA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è TEPADINA e a cosa serve
TEPADINA contiene il principio attivo tiotepa, che appartiene a un gruppo di medicinali chiamati
agenti alchilanti.
TEPADINA è usata per preparare i pazienti al trapianto di midollo osseo; opera distruggendo le cellule
del midollo osseo. In tal modo, consente il trapianto di nuove cellule del midollo osseo (cellule
progenitrici emopoietiche), che a loro volta consentono al corpo di produrre cellule del sangue sane.
TEPADINA può essere usata negli adulti e nei bambini e negli adolescenti.
2. Cosa deve sapere prima di usare TEPADINA
Non usi TEPADINA
- se è allergico a tiotepa,
- se è in stato di gravidanza o se sospetta una gravidanza,
- se sta allattando al seno,
- se sta assumendo vaccino contro la febbre gialla, a virus vivi e vaccini batterici.
Avvertenze e precauzioni
Informi il medico se ha:
- problemi al fegato o renali,
- problemi cardiaci o polmonari,
- convulsioni (epilessia) o se ne ha avute in passato (se trattato con fenitoina o fosfofenitoina).
Dal momento che TEPADINA ditrugge le cellule del midollo osseo responsabili della produzione
delle cellule del sangue durante il trattamento le verranno effettuati prelievi regolari del sangue per
verificare la conta delle cellule del sangue.
Per la prevenzione e il trattamento delle infezioni le saranno somministrati antinfettivi.
TEPADINA potrebbe provocare un altro tipo di tumore in futuro. Il medico discuterà con lei di questo
rischio.
Altri medicinali e TEPADINA
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza, allattamento e fertilità
Prima di assumere TEPADINA, informi il medico se è in stato di gravidanza o se sospetta una
gravidanza. Non usi TEPADINA in gravidanza.
Durante il trattamento con TEPADINA sia gli uomini che le donne devono usare mezzi di
contraccezione efficaci. Gli uomini non devono procreare durante il trattamento con TEPADINA e
nell’anno successivo all’interruzione del trattamento.
Non è noto se questo medicinale sia escreto nel latte materno. Come misura precauzionale, le donne
non devono allattare al seno durante il trattamento con TEPADINA.
TEPADINA può compromettere la fertilità maschile e femminile. Si raccomanda ai pazienti di sesso
maschile di effettuare la conservazione dello sperma prima di iniziare la terapia.
Guida di veicoli e utilizzo di macchinari
E’ probabile che alcune reazioni avverse di tiotepa come vertigini, cefalea e visione offuscata possano
alterare la sua capacità di guidare veicoli e di usare macchinari. Se avverte questi sintomi, non guidi
veicoli e non usi macchinari.
TEPADINA contiene sodio
Questo medicinale contiene 709 mg (30,8 mmol) di sodio (componente principale del sale da cucina) in
ogni sacca. Questo equivale al 35,5% dell’assunzione massima giornaliera raccomandata con la dieta
diun adulto.
3. Come usare TEPADINA
Il medico calcolerà il dosaggio a seconda della superficie corporea, o del peso, e della malattia.
Come si somministra TEPADINA
TEPADINA è somministrata da un operatore sanitario qualificato mediante infusione endovenosa
(flebo in una vena) dopo la diluizione del singolo flaconcino. Ogni infusione durerà 2-4 ore.
Frequenza di somministrazione
Le infusioni saranno somministrate ogni 12 o 24 ore. Il trattamento può durare fino a 5 giorni. La
frequenza di somministrazione e la durata del trattamento dipendono dalla malattia.
4. Possibili effetti indesiderati
Come tutti i medicinali, TEPADINA può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
I più gravi effetti indesiderati della terapia con TEPADINA o della procedura di trapianto includono:
- riduzione della conta delle cellule del sangue circolanti (effetto voluto del medicinale per prepararla all’infusione per il trapianto)
- infezione
- disturbi al fegato, tra cui l’ostruzione di una vena del fegato
- il trapianto attacca l’organismo (malattia del trapianto contro l’ospite)
- complicanze respiratorie Il medico controllerà regolarmente la conta delle cellule del sangue e gli enzimi del fegato per individuare e controllare tali eventi.
Gli effetti indesiderati di TEPADINA possono verificarsi con varie frequenze, definite come segue.
Effetti indesiderati molto comuni (possono interessare più di 1 paziente su 10)
- maggiore predisposizione alle infezioni
- stato infiammatorio che coinvolge l’intero corpo (sepsi)
- ridotta conta di globuli bianchi, piastrine e globuli rossi (anemia)
- le cellule trapiantate attaccano l’organismo (malattia del trapianto contro l’ospite)
- vertigini, mal di testa, visione offuscata
- tremore incontrollato del corpo (convulsioni)
- sensazione di formicolio, pizzicore e intorpidimento (parestesia)
- perdita parziale del movimento
- arresto cardiaco
- nausea, vomito, diarrea
- infiammazione della mucosa della bocca (mucosite)
- irritazione dello stomaco, dell’esofago e dell’intestino
- infiammazione del colon
- anoressia, calo dell’appetito
- alto livello di glucosio nel sangue
- eruzione cutanea, prurito, desquamazione
- alterazione del colore della pelle (da non confondere con l’ittero - vedere sotto)
- arrossamento della pelle (eritema)
- perdita di capelli
- dolori addominali e alla schiena, dolori
- dolori muscolari e articolari
- attività elettriche anormali del cuore (aritmia)
- infiammazione del tessuto polmonare
- fegato ingrossato
- funzione organica alterata
- ostruzione di una vena epatica (VOD - veno occlusive disease, malattia veno-occlusiva)
- ingiallimento della pelle e degli occhi (ittero)
- diminuzione dell’udito
- ostruzione linfatica
- alta pressione sanguigna
- incremento degli enzimi del fegato, renali e digestivi
- elettroliti del sangue anormali
- aumento di peso
- febbre, debolezza, brividi
- sanguinamento (emorragia)
- sangue dal naso
- gonfiore generale dovuto alla ritenzione di liquidi (edema)
- dolore o infiammazione al sito di iniezione
- infezione dell’occhio (congiuntivite)
- ridotta conta di spermatozoi
- sanguinamento vaginale
- assenza del ciclo mestruale (amenorrea)
- perdita della memoria
- ritardo dell’aumento del peso e della crescita in altezza
- disfunzioni della vescica
- diminuzione della produzione di testosterone
- produzione insufficiente degli ormoni tiroidei
- ridotta attività della ghiandola pituitaria
- stato confusionale
Effetti indesiderati comuni (possonointeressare fino a 1 paziente su 10)
- ansia, confusione
- rigonfiamento anormale verso l’esterno di una delle arterie cerebrali (aneurisma intracranico)
- elevata creatinina
- reazioni allergiche
- occlusione di un vaso sanguigno (embolia)
- disturbi del ritmo cardiaco
- alterazione della funzionalità cardiaca
- alterazione della funzionalità cardiovascolare
- carenza d’ossigeno
- accumulo di fluidi nei polmoni (edema polmonare)
- sanguinamento polmonare
- arresto respiratorio
- sangue nell’urina (ematuria) e insufficienza renale moderata
- infiammazione della vescica urinaria
- difficoltà ad urinare e diminuzione della quantità di urina (disuria e oliguria)
- aumento della quantità di composti azotati nel sangue (aumento del BUN)
- cataratta
- alterazione della funzionalità del fegato
- emorragia cerebrale
- tosse
- stipsi e disturbi allo stomaco
- ostruzione intestinale
- perforazione dello stomaco
- alterazione del tono muscolare
- mancanza di coordinazione dei movimenti muscolari
- lividi dovuti a bassa conta piastrinica
- sintomi della menopausa
- cancro (secondo tumore primario)
- funzione cerebrale anormale
- infertilità maschile e femminile
Effetti indesiderati non comuni (possono interessare fino a 1 paziente su 100)
- infiammazione ed esfoliazione della pelle (psoriasi eritrodermica)
- delirio, nervosismo, allucinazioni, agitazione
- ulcera gastrointestinale
- infiammazione del tessuto miocardico (miocardite)
- condizioni cardiache anormali (cardiomiopatia)
Frequenza non nota (la frequenza non può essere definita sulla base dei dati disponibili
- aumentata pressione del sangue nelle arterie (vasi sanguigni) dei polmoni (ipertensione arteriosa polmonare);
- gravi danni alla pelle (ad esempio, lesioni gravi, vescicole, etc.) che possono interessare tutta la superficie corporea e che possono anche essere pericolosi per la vita.
- danni a una componente del cervello (la cosiddetta materia bianca) che possono anche essere pericolosi per la vita (leucoencefalopatia).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere/a. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’ Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare TEPADINA
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi TEPADINA dopo la data di scadenza che è riportata sulla confezione, sull’etichetta
dell’involucro di alluminio e sulla sacca, dopo SCAD. La data di scadenza si riferisce all’ultimo
giorno di quel mese mese.
Conservare e trasportare in frigorifero (2 °C-8 °C).
Non congelare.
Tenere la sacca nell’involucro di alluminio per proteggere il medicinale dall’attivazione.
Dopo l’attivazione e la ricostituzione della sacca, il prodotto è stabile fino a 48 ore se conservato a
2 °C -8 °C e fino a 6 ore se conservato a 25 °C.
Dal punto di vista microbiologico, il medicinale deve essere usato immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TEPADINA
- Il principio attivo è tiotepa.. Una sacca contiene 200 mg di tiotepa. Dopo la ricostituzione con il solvente, ogni mL di soluzione contiene 1 mg di tiotepa.
- Gli altri componenti sono sodio cloruro e acqua per soluzioni iniettabili (vedere paragrafo 2 “TEPADINA contiene sodio”).
Descrizione dell’aspetto di TEPADINA e contenuto della confezione
TEPADINA è fornito in una sacca a due camere contenenti una 200 mg di polvere e l’altra 200 mL di
sodio cloruro 9 mg/mL (0,9%) soluzione iniettabile.
Dopo la ricostituzione la sacca contiene una soluzione per infusione limpida e incolore.
Ogni sacca è confezionata in un involucro di alluminio.
Confezione da 1 sacca.
Titolare dell’autorizzazione all’immissione in commercio e produttore
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italia
Tel: +39-02 40700445
[email protected]
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Accord Healthcare bv
Tél: +32 51 79 40 12
Lietuva
Accord Healthcare AB
Tel: +46 8 624 00 25
България
Accord Healthcare Polska Sp. z o.o.
Teл.: +48 22 577 28 00
Luxembourg/Luxemburg
Accord Healthcare bv
Tèl/Tel: +32 51 79 40 12
Česká republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Magyarország
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
Danmark
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Malta
Accord Healthcare Ireland Ltd
Tel: +44 (0) 208 901 3370
Deutschland
Accord Healthcare GmbH
Tel: +49 89 700 9951 0
Nederland
Accord Healthcare B.V.
Tel: +31 30 850 6014
Eesti
Accord Healthcare AB
Tel: +46 8 624 00 25
Norge
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Ελλάδα
Accord Healthcare Italia Srl
Τηλ: + 39 02 943 23 700
Österreich
Accord Healthcare GmbH
Tel: +43 (0)662 424899-0
España
Accord Healthcare S.L.U.
Tel: +34 93 301 00 64
Polska
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
France
Accord Healthcare France SAS
Tél: +33 (0)320 401 770
Portugal
Accord Healthcare, Unipessoal Lda
Tel: +351 214 697 835
Hrvatska
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
România
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ireland
Accord Healthcare Ireland Ltd
Tel: +44 (0)1271 385257
Slovenija
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ísland
Accord Healthcare AB
Sími: + 46 8 624 00 25
Slovenská republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Italia
Accord Healthcare Italia Srl
Tel: +39 02 943 23 700
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Κύπρος
Accord Healthcare S.L.U.
Τηλ: + 34 93 301 00 64
Sverige
Accord Healthcare AB
Tel: + 46 8 624 00 25
Latvija
Accord Healthcare AB
Tel: +46 8 624 00 25
United Kingdom (Northern Ireland)
Accord-UK Ltd
Tel: +44 (0)1271 385257
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu .
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari.
ISTRUZIONI PER LA PREPARAZIONE
TEPADINA 200 mg polvere e solvente per soluzione per infusione
Tiotepa
Leggere queste istruzioni prima di preparare e somministrare TEPADINA.
1. PRESENTAZIONE
Una sacca contiene 200 mg di tiotepa.
Dopo la ricostituzione con il solvente, ogni mL di soluzione contiene 1 mg di tiotepa.
TEPADINA deve essere ricostituito prima della somministrazione.
2. POSOLOGIA E METODO DI SOMMINISTRAZIONE
Calcolo della dose di TEPADINA
TEPADINA è somministrato a dosaggi diversi in associazione con altri medicinali chemioterapici
prima del convenzionale trapianto di cellule emopoietiche progenitrici ( haematopoietic progenitor cell
transplantation, HPCT) in pazienti con patologie ematologiche o tumori solidi.
La posologia indicata di TEPADINA, nei pazienti adulti e pediatrici, dipende dal tipo di HPCT
(autologo o allogenico) e dalla patologia.
Se necessario, deve essere eseguito un aggiustamento della dose di TEPADINA in base all’applicazione
specifica.
Nel caso in cui la dose calcolata richiesta sia superiore a 200 mg ma inferiore ad un multiplo di tale
valore, l’utilizzatore deve aggiungere i mg necessari dai flaconcini di TEPADINA usando la porta
Nel caso in cui la dose calcolata richiesta sia inferiore a 200 mg, l’utilizzatore deve rimuovere i mg non
necessari della soluzione da 1 mg/mL completamente ricostituita o impostare una pompa da infusione
con la quantità in mL di medicinale da somministrare.
Posologia negli adulti
HPCT AUTOLOGO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a
300 mg/m /giorno (8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni
consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per
tutto il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 300 mg/m /giorno
(8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni consecutivi prima
dell’HPCT autologo, a seconda dell’associazione con altri medicinali chemioterapici, senza superare
la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per tutto il periodo del regime di
condizionamento.
LINFOMA DEL SISTEMA NERVOSO CENTRALE
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
Tumori solidi
La dose raccomandata nei tumori solidi varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a
250 mg/m /giorno (6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
2 fino a 5 giorni consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri
medicinali chemioterapici, senza superare la dose cumulativa totale massima di 800 mg/m
(21,62 mg/kg), per tutto il periodo del regime di condizionamento.
CARCINOMA MAMMARIO
La dose raccomandata varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 3 a 5 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 800 mg/m (21,62 mg/kg), per tutto il periodo del regime di
condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 3 a 4 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per
tutto il periodo del regime di condizionamento.
CARCINOMA OVARICO
La dose raccomandata è 250 mg/m /giorno (6,76 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 500 mg/m (13,51 mg/kg), per tutto il periodo del regime di condizionamento.
TUMORI A CELLULE GERMINALI
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 185 mg/m /giorno (5 mg/kg/giorno) a
481 mg/m /giorno (13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1
a 3 giorni consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata nel linfoma è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni
giornaliere prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera prima
dell’HPCT allogenico, senza superare la dose cumulativa totale massima di 185 mg/m (5 mg/kg), per
tutto il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata varia da 185 mg/m /giorno (5 mg/kg/giorno) a 481 mg/m /giorno
(13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1 a 2 giorni
consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Posologia nei pazienti pediatrici
HPCT AUTOLOGO
Tumori solidi
La dose raccomandata nei tumori solidi varia da 150 mg/m /giorno (6 mg/kg/giorno) a
350 mg/m /giorno (14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 3 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per
tutto il periodo del regime di condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 250 mg/m /giorno (10 mg/kg/giorno) a 350 mg/m /giorno
(14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (5 mg/kg/giorno) a
250 mg/m /giorno (10 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1
a 3 giorni consecutivi prima dell’HPCT allogenico, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 375 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata varia da 200 mg/m /giorno (8 mg/kg/giorno) a 250 mg/m /giorno
(10 mg/kg/giorno) suddivisa in due infusioni giornaliere, somministrate prima dell’HPCT allogenico
senza superare la dose cumulativa totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del
regime di condizionamento.
CITOPENIA REFRATTARIA
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 3 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 375 mg/m (15 mg/kg), per tutto il periodo del regime di condizionamento.
MALATTIE GENETICHE
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
ANEMIA DREPANOCITICA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Attivazione della sacca e ricostituzione
TEPADINA 200 mg deve essere ricostituita con 200 mL soluzione iniettabile di sodio cloruro
9 mg/mL (0,9%). La soluzione finale ricostituita si ottiene dopo aver rotto il sigillo rimovibile della
sacca a doppia camera ed averne miscelato i contenuti (polvere e solvente) fino alla completa
dissoluzione della polvere.
Dopo la ricostituzione con il solvente, ogni ml di soluzione contiene 1 mg di tiotepa.
Devono essere usate solo le soluzioni incolori, prive di materiale particellare.
Non usare questo medicinale se si notano segni visibili di deterioramento.
Somministrazione
La soluzione per infusione di TEPADINA dev’essere essere controllata visivamente in modo da
escludere la presenza di materiale particellare prima della somministrazione. Eliminare le soluzioni
contenenti un precipitato.
La soluzione per infusione deve essere somministrata ai pazienti mediante un set di infusione
provvisto di filtro in linea da 0,2 µm. Il filtraggio non altera il potere della soluzione.
Somministrare TEPADINA in maniera asettica mediante infusione di 2-4 ore a temperatura ambiente
(circa 25°C) e in condizioni di luce normali.
Prima e dopo ciascuna infusione, lavare bene il condotto del catetere a permanenza con circa 5 mL di
soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%).
3. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
Aspetti generali
Per la manipolazione e lo smaltimento di medicinali antitumorali si devono seguire le procedure
appropriate. Tutte le procedure di trasferimento richiedono una stretta osservanza di tecniche asettiche,
e preferibilmente l’impiego di una cappa di sicurezza a flusso laminare verticale.
Come per altri composti citotossici, è necessario prestare estrema attenzione nella manipolazione e
preparazione delle soluzioni di TEPADINA, per evitare il contatto accidentale con la pelle o con le
membrane delle mucose. Possono verificarsi reazioni topiche associate all’esposizione accidentale a
tiotepa. Si consiglia quindi di indossare guanti prima di preparare la soluzione per infusione. Se la
soluzione con tiotepa entra in contatto accidentalmente con la pelle, lavare accuratamente e
immediatamente l’area esposta con acqua e sapone. In caso di contatto accidentale di tiotepa con le
membrane delle mucose, si raccomanda di lavare abbondantemente le stesse con acqua.
Smaltimento
TEPADINA è esclusivamente monouso.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
o Istruzioni per l'uso – TEPADINA® 200 mg/sacca  | |
Figura A
| c Figura B a
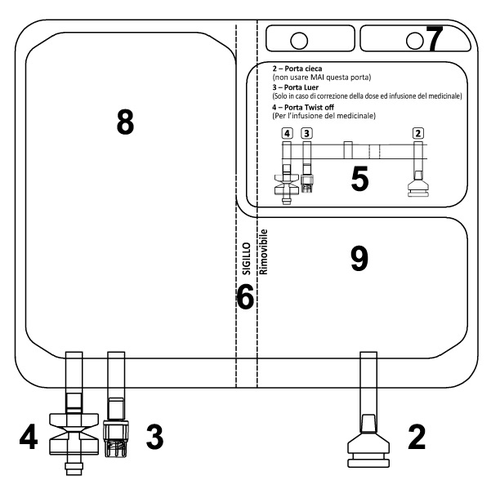 |
- 1 – RIMUOVERE L'INVOLUCRO ESTERNOa)Posizionare la sacca su una superficie a)Rimuovere la sacca flessibile a doppia camera dal pulita e stabile prima di aprirla. b)Strappare l’involucro esterno partendo dalla tacca posizionata vicino alle porte (Figura A - punto 1).c)Strappare il lato corto per accedere alla sacca interna come da Figura C.confezionamento secondario in alluminio e distendere la sacca Figura D.
Figura CFigura D
- 2 – ISPEZIONARE LA SACCA PRIMADELL'ATTIVAZIONE.
- 3 – ATTIVARE LA SACCASovrapporre le mani sulla porzione inferiore della camera 8(come da Figura F). Premere saldamente in modo da applicare una pressione uniforme fino a quando il sigillo rimovibile 6è completamente attivato (possono volerci fino a 5 secondi di pressione continua per rompere il sigillo rimovibile 6).
Figura F
Posizionare la sacca su una superficie pulita e
stabile con il lato scritto verso l'alto e le porte
rivolte dalla parte opposta dell'utilizzatore,
come da Figura E.
Controllare che non vi sia liquido o fuoriuscita
di prodotto dalle porte di connessione 2, 3, 4
e dalla camera 8, 9.
Controllare l'integrità del sigillo rimovibile 6,
verificando l'assenza di liquido nella camera 9.
Figura E
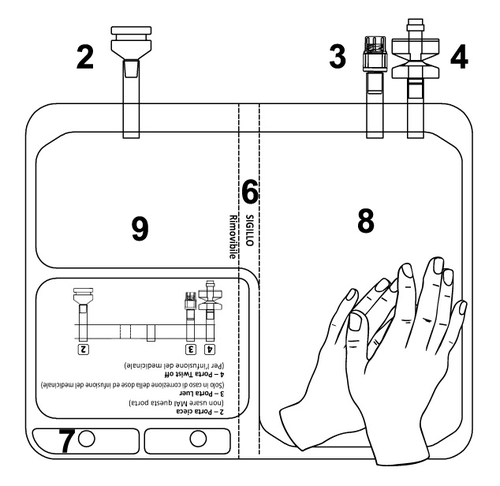
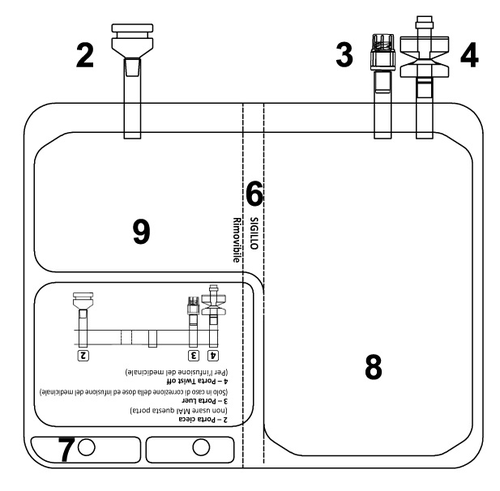
SACCA PRIMA DELL'ATTIVAZIONESACCA DOPO L'ATTIVAZIONE
Figura GFigura H
NON strizzare o premere con forza.
Figura I
- 4 – ISPEZIONARE LA SACCA PER CONFERMARE L'ATTIVAZIONE.Controllare che il sigillo rimovibile 6sia adesso completamente attivato. Le camere 8e 9sono unite.
Figura J
Mescolare delicatamente fino alla dissoluzione
completa del prodotto.
Figura K
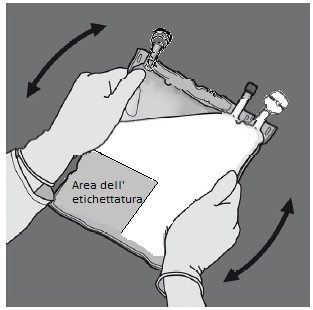
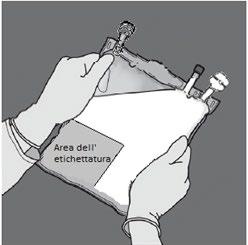
- 5 – AGGIUSTAMENTO DELLA DOSE - Consultare i paragrafi 2. "Posologia e modo di somministrazione"e 3. "Precauzioni particolari per lo smaltimento e la manipolazione"Avvitare il dispositivo luer lock come da Figura M. Eseguire l'aggiustamento della dose come descritto nei paragrafi 2 e 3.Nel caso in cui sia necessaria una correzione della dose, identificare la Porta Luer 3. Rimuovere il tappo di plastica dalla Porta Luer. Non usare dispositivi impropri non luer lock sulla porta 3.
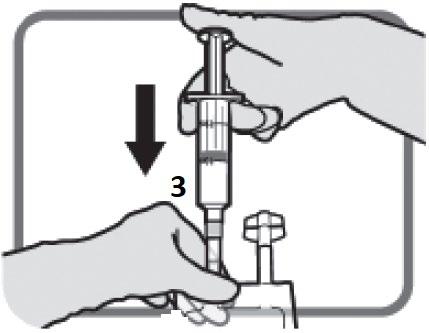
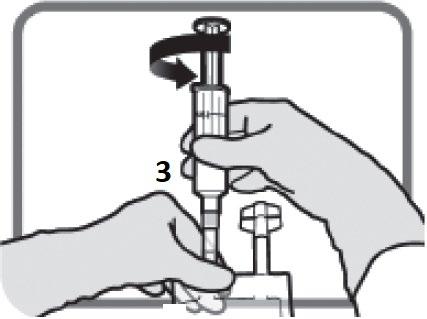
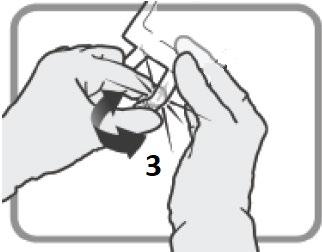
Figura M
Figura N
Alla fine dell'operazione, svitare il
dispositivo.
Figura L
Assicurarsi che la connessione sia
completamente alloggiata e
stretta. Posizionare il tappo di plastica
sulla Porta Luer 3prima di
procedere con l'infusione.
- 6 – CONNESSIONE - Il set da infusione può essere connesso alla sacca mediante il connettore luer o ilconnettore spike.OPZIONE A - CONNESSIONE CON SPIKEIdentificare la Porta Twist off 4nel caso di set da infusione spike. OPZIONE B - CONNESSIONE LUERSelezionare la porta con tappo luer 3nel caso di set da infusione con connettore luer. Rimuovere il tappo di plastica della Porta Luer 3prima di collegare il connettore luer. Svitare il tappo di plastica prima di inserire lo spike.
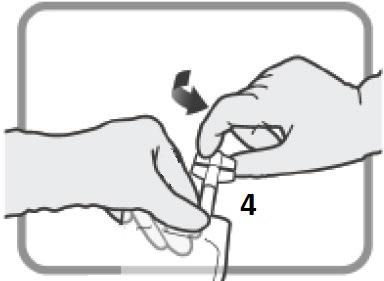
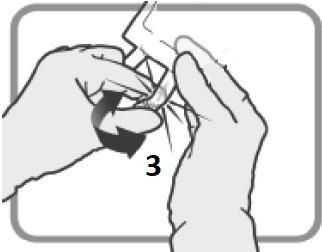
Figura Q
Figura O
Inserire il connettore luer.
Inserire il connettore spike.
Figura R
Assicurarsi che la connessione sia completamente
alloggiata e stretta.
Figura P
- 7 – APPENDERE LA SACCA
Appendere la sacca dal foro 7. Figura S
TEPADINA 400 mg polvere e solvente per soluzione per infusione
tiotepa
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 7. Cos’è TEPADINA e a cosa serve
- 8. Cosa deve sapere prima di usare TEPADINA
- 9. Come usare TEPADINA
- 10. Possibili effetti indesiderati
- 11. Come conservare TEPADINA
- 12. Contenuto della confezione e altre informazioni
1. Cos’è TEPADINA e a cosa serve
TEPADINA contiene il principio attivo tiotepa, che appartiene a un gruppo di medicinali chiamati
agenti alchilanti.
TEPADINA è usata per preparare i pazienti al trapianto di midollo osseo; opera distruggendo le cellule
del midollo osseo. In tal modo, consente il trapianto di nuove cellule del midollo osseo (cellule
progenitrici emopoietiche), che a loro volta consentono al corpo di produrre cellule del sangue sane.
TEPADINA può essere usata negli adulti e nei bambini e negli adolescenti.
2. Cosa deve sapere prima di usare TEPADINA
Non usi TEPADINA
- se è allergico a tiotepa,
- se è in stato di gravidanza o se sospetta una gravidanza,
- se sta allattando al seno,
- se sta assumendo vaccino contro la febbre gialla, a virus vivi e vaccini batterici.
Avvertenze e precauzioni
Informi il medico se ha:
- problemi al fegato o renali,
- problemi cardiaci o polmonari,
- convulsioni (epilessia) o se ne ha avute in passato (se trattato con fenitoina o fosfofenitoina).
Dal momento che TEPADINA ditrugge le cellule del midollo osseo responsabili della produzione
delle cellule del sangue durante il trattamento le verranno effettuati prelievi regolari del sangue per
verificare la conta delle cellule del sangue.
Per la prevenzione e il trattamento delle infezioni le saranno somministrati antinfettivi.
TEPADINA potrebbe provocare un altro tipo di tumore in futuro. Il medico discuterà con lei di questo
rischio.
Altri medicinali e TEPADINA
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza, allattamento e fertilità
Prima di assumere TEPADINA, informi il medico se è in stato di gravidanza o se sospetta una
gravidanza. Non usi TEPADINA in gravidanza.
Durante il trattamento con TEPADINA sia gli uomini che le donne devono usare mezzi di
contraccezione efficaci. Gli uomini non devono procreare durante il trattamento con TEPADINA e
nell’anno successivo all’interruzione del trattamento.
Non è noto se questo medicinale sia escreto nel latte materno. Come misura precauzionale, le donne
non devono allattare al seno durante il trattamento con TEPADINA.
TEPADINA può compromettere la fertilità maschile e femminile. Si raccomanda ai pazienti di sesso
maschile di effettuare la conservazione dello sperma prima di iniziare la terapia.
Guida di veicoli e utilizzo di macchinari
E’ probabile che alcune reazioni avverse di tiotepa come vertigini, cefalea e visione offuscata possano
alterare la sua capacità di guidare veicoli e di usare macchinari. Se avverte questi sintomi, non guidi
veicoli e non usi macchinari.
TEPADINA contiene sodio
Questo medicinale contiene 1 418 mg (61,6 mmol) di sodio (componente principale del sale da cucina)
in ogni sacca. Questo equivale al 70,9% dell’assunzione massima giornaliera raccomandata con la dieta
di un adulto.
3. Come usare TEPADINA
Il medico calcolerà il dosaggio a seconda della superficie corporea, o del peso, e della malattia.
Come si somministra TEPADINA
TEPADINA è somministrata da un operatore sanitario qualificato mediante infusione endovenosa
(flebo in una vena) dopo la diluizione del singolo flaconcino. Ogni infusione durerà 2-4 ore.
Frequenza di somministrazione
Le infusioni saranno somministrate ogni 12 o 24 ore. Il trattamento può durare fino a 5 giorni. La
frequenza di somministrazione e la durata del trattamento dipendono dalla malattia.
4. Possibili effetti indesiderati
Come tutti i medicinali, TEPADINA può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
I più gravi effetti indesiderati della terapia con TEPADINA o della procedura di trapianto includono:
- riduzione della conta delle cellule del sangue circolanti (effetto voluto del medicinale per prepararla all’infusione per il trapianto)
- infezione
- disturbi al fegato, tra cui l’ostruzione di una vena del fegato
- il trapianto attacca l’organismo (malattia del trapianto contro l’ospite)
- complicanze respiratorie Il medico controllerà regolarmente la conta delle cellule del sangue e gli enzimi del fegato per individuare e controllare tali eventi.
Gli effetti indesiderati di TEPADINA possono verificarsi con varie frequenze, definite come segue.
Effetti indesiderati molto comuni (possono interessare più di 1 paziente su 10)
- maggiore predisposizione alle infezioni
- stato infiammatorio che coinvolge l’intero corpo (sepsi)
- ridotta conta di globuli bianchi, piastrine e globuli rossi (anemia)
- le cellule trapiantate attaccano l’organismo (malattia del trapianto contro l’ospite)
- vertigini, mal di testa, visione offuscata
- tremore incontrollato del corpo (convulsioni)
- sensazione di formicolio, pizzicore e intorpidimento (parestesia)
- perdita parziale del movimento
- arresto cardiaco
- nausea, vomito, diarrea
- infiammazione della mucosa della bocca (mucosite)
- irritazione dello stomaco, dell’esofago e dell’intestino
- infiammazione del colon
- anoressia, calo dell’appetito
- alto livello di glucosio nel sangue
- eruzione cutanea, prurito, desquamazione
- alterazione del colore della pelle (da non confondere con l’ittero - vedere sotto)
- arrossamento della pelle (eritema)
- perdita di capelli
- dolori addominali e alla schiena, dolori
- dolori muscolari e articolari
- attività elettriche anormali del cuore (aritmia)
- infiammazione del tessuto polmonare
- fegato ingrossato
- funzione organica alterata
- ostruzione di una vena epatica (VOD - veno occlusive disease, malattia veno-occlusiva)
- ingiallimento della pelle e degli occhi (ittero)
- diminuzione dell’udito
- ostruzione linfatica
- alta pressione sanguigna
- incremento degli enzimi del fegato, renali e digestivi
- elettroliti del sangue anormali
- aumento di peso
- febbre, debolezza, brividi
- sanguinamento (emorragia)
- sangue dal naso
- gonfiore generale dovuto alla ritenzione di liquidi (edema)
- dolore o infiammazione al sito di iniezione
- infezione dell’occhio (congiuntivite)
- ridotta conta di spermatozoi
- sanguinamento vaginale
- assenza del ciclo mestruale (amenorrea)
- perdita della memoria
- ritardo dell’aumento del peso e della crescita in altezza
- disfunzioni della vescica
- diminuzione della produzione di testosterone
- produzione insufficiente degli ormoni tiroidei
- ridotta attività della ghiandola pituitaria
- stato confusionale
Effetti indesiderati comuni (possonointeressare fino a 1 paziente su 10)
- ansia, confusione
- rigonfiamento anormale verso l’esterno di una delle arterie cerebrali (aneurisma intracranico)
- elevata creatinina
- reazioni allergiche
- occlusione di un vaso sanguigno (embolia)
- disturbi del ritmo cardiaco
- alterazione della funzionalità cardiaca
- alterazione della funzionalità cardiovascolare
- carenza d’ossigeno
- accumulo di fluidi nei polmoni (edema polmonare)
- sanguinamento polmonare
- arresto respiratorio
- sangue nell’urina (ematuria) e insufficienza renale moderata
- infiammazione della vescica urinaria
- difficoltà ad urinare e diminuzione della quantità di urina (disuria e oliguria)
- aumento della quantità di composti azotati nel sangue (aumento del BUN)
- cataratta
- alterazione della funzionalità del fegato
- emorragia cerebrale
- tosse
- stipsi e disturbi allo stomaco
- ostruzione intestinale
- perforazione dello stomaco
- alterazione del tono muscolare
- mancanza di coordinazione dei movimenti muscolari
- lividi dovuti a bassa conta piastrinica
- sintomi della menopausa
- cancro (secondo tumore primario)
- funzione cerebrale anormale
- infertilità maschile e femminile
Effetti indesiderati non comuni (possono interessare fino a 1 paziente su 100)
- infiammazione ed esfoliazione della pelle (psoriasi eritrodermica)
- delirio, nervosismo, allucinazioni, agitazione
- ulcera gastrointestinale
- infiammazione del tessuto miocardico (miocardite)
- condizioni cardiache anormali (cardiomiopatia)
Frequenza non nota (la frequenza non può essere definita sulla base dei dati disponibili
- aumentata pressione del sangue nelle arterie (vasi sanguigni) dei polmoni (ipertensione arteriosa polmonare);
- gravi danni alla pelle (ad esempio, lesioni gravi, vescicole, etc.) che possono interessare tutta la superficie corporea e che possono anche essere pericolosi per la vita.
- danni a una componente del cervello (la cosiddetta materia bianca) che possono anche essere pericolosi per la vita (leucoencefalopatia).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere/a. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’ Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare TEPADINA
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi TEPADINA dopo la data di scadenza che è riportata sulla confezione, sull’etichetta
dell’involucro di alluminio e sulla sacca, dopo SCAD. La data di scadenza si riferisce all’ultimo
giorno di quel mese mese.
Conservare e trasportare in frigorifero (2 °C-8 °C).
Non congelare.
Tenere la sacca nell’involucro di alluminio per proteggere il medicinale dall’attivazione.
Dopo l’attivazione e la ricostituzione della sacca, il prodotto è stabile fino a 48 ore se conservato a
2 °C -8 °C e fino a 6 ore se conservato a 25 °C.
Dal punto di vista microbiologico, il medicinale deve essere usato immediatamente.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene TEPADINA
- Il principio attivo è tiotepa.. Una sacca contiene 400 mg di tiotepa. Dopo la ricostituzione con il solvente, ogni mL di soluzione contiene 1 mg di tiotepa.
- Gli altri componenti sono sodio cloruro e acqua per soluzioni iniettabili (vedere paragrafo 2 “TEPADINA contiene sodio”).
Descrizione dell’aspetto di TEPADINA e contenuto della confezione
TEPADINA è fornito in una sacca a due camere contenenti una 400 mg di polvere e l’altra 400 mL di
sodio cloruro 9 mg/mL (0,9%) soluzione iniettabile.
Dopo la ricostituzione la sacca contiene una soluzione per infusione limpida e incolore.
Ogni sacca è confezionata in un involucro di alluminio.
Confezione da 1 sacca.
Titolare dell’autorizzazione all’immissione in commercio e produttore
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italia
Tel: +39-02 40700445
[email protected]
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Accord Healthcare bv
Tél: +32 51 79 40 12
Lietuva
Accord Healthcare AB
Tel: +46 8 624 00 25
България
Accord Healthcare Polska Sp. z o.o.
Teл.: +48 22 577 28 00
Luxembourg/Luxemburg
Accord Healthcare bv
Tèl/Tel: +32 51 79 40 12
Česká republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Magyarország
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
Danmark
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Malta
Accord Healthcare Ireland Ltd
Tel: +44 (0) 208 901 3370
Deutschland
Accord Healthcare GmbH
Tel: +49 89 700 9951 0
Nederland
Accord Healthcare B.V.
Tel: +31 30 850 6014
Eesti
Accord Healthcare AB
Tel: +46 8 624 00 25
Norge
Accord Healthcare AB
Tlf: + 46 8 624 00 25
Ελλάδα
Accord Healthcare Italia Srl
Τηλ: + 39 02 943 23 700
Österreich
Accord Healthcare GmbH
Tel: +43 (0)662 424899-0
España
Accord Healthcare S.L.U.
Tel: +34 93 301 00 64
Polska
Accord Healthcare Polska Sp. z o.o.
Tel.: +48 22 577 28 00
France
Accord Healthcare France SAS
Tél: +33 (0)320 401 770
Portugal
Accord Healthcare, Unipessoal Lda
Tel: +351 214 697 835
Hrvatska
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
România
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ireland
Accord Healthcare Ireland Ltd
Tel: +44 (0)1271 385257
Slovenija
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Ísland
Accord Healthcare AB
Sími: + 46 8 624 00 25
Slovenská republika
Accord Healthcare Polska Sp. z o.o.
Tel: +48 22 577 28 00
Italia
Accord Healthcare Italia Srl
Tel: +39 02 943 23 700
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Κύπρος
Accord Healthcare S.L.U.
Τηλ: + 34 93 301 00 64
Sverige
Accord Healthcare AB
Tel: + 46 8 624 00 25
Latvija
Accord Healthcare AB
Tel: +46 8 624 00 25
United Kingdom (Northern Ireland)
Accord-UK Ltd
Tel: +44 (0)1271 385257
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i Medicinali, http://www.ema.europa.eu .
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari.
ISTRUZIONI PER LA PREPARAZIONE
TEPADINA 400 mg polvere e solvente per soluzione per infusione
Tiotepa
Leggere queste istruzioni prima di preparare e somministrare TEPADINA.
1. PRESENTAZIONE
Una sacca contiene 400 mg di tiotepa.
Dopo la ricostituzione con il solvente, ogni mL di soluzione contiene 1 mg di tiotepa.
TEPADINA deve essere ricostituito prima della somministrazione.
2. POSOLOGIA E METODO DI SOMMINISTRAZIONE
Calcolo della dose di TEPADINA
TEPADINA è somministrato a dosaggi diversi in associazione con altri medicinali chemioterapici
prima del convenzionale trapianto di cellule emopoietiche progenitrici ( haematopoietic progenitor cell
transplantation, HPCT) in pazienti con patologie ematologiche o tumori solidi.
La posologia indicata di TEPADINA, nei pazienti adulti e pediatrici, dipende dal tipo di HPCT
(autologo o allogenico) e dalla patologia.
Se necessario, deve essere eseguito un aggiustamento della dose di TEPADINA in base all’applicazione
specifica.
Nel caso in cui la dose calcolata richiesta sia superiore a 400 mg ma inferiore ad un multiplo di tale
valore, l’utilizzatore deve aggiungere i mg necessari dai flaconcini di TEPADINA usando la porta
Nel caso in cui la dose calcolata richiesta sia inferiore a 400 mg, l’utilizzatore deve rimuovere i mg non
necessari della soluzione da 1 mg/mL completamente ricostituita o impostare una pompa da infusione
con la quantità in mL di medicinale da somministrare.
Posologia negli adulti
HPCT AUTOLOGO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a
300 mg/m /giorno (8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni
consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per
tutto il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 300 mg/m /giorno
(8,10 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 4 giorni consecutivi prima
dell’HPCT autologo, a seconda dell’associazione con altri medicinali chemioterapici, senza superare
la dose cumulativa totale massima di 900 mg/m (24,32 mg/kg), per tutto il periodo del regime di
condizionamento.
LINFOMA DEL SISTEMA NERVOSO CENTRALE
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
Tumori solidi
La dose raccomandata nei tumori solidi varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a
250 mg/m /giorno (6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da
2 fino a 5 giorni consecutivi prima dell’HPCT autologo, a seconda dell’associazione con altri
medicinali chemioterapici, senza superare la dose cumulativa totale massima di 800 mg/m
(21,62 mg/kg), per tutto il periodo del regime di condizionamento.
CARCINOMA MAMMARIO
La dose raccomandata varia da 120 mg/m /giorno (3,24 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 3 a 5 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 800 mg/m (21,62 mg/kg), per tutto il periodo del regime di
condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 125 mg/m /giorno (3,38 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 3 a 4 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per
tutto il periodo del regime di condizionamento.
CARCINOMA OVARICO
La dose raccomandata è 250 mg/m /giorno (6,76 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT autologo, senza superare la dose cumulativa
totale massima di 500 mg/m (13,51 mg/kg), per tutto il periodo del regime di condizionamento.
TUMORI A CELLULE GERMINALI
La dose raccomandata varia da 150 mg/m /giorno (4,05 mg/kg/giorno) a 250 mg/m /giorno
(6,76 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 750 mg/m (20,27 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 185 mg/m /giorno (5 mg/kg/giorno) a
481 mg/m /giorno (13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1
a 3 giorni consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LINFOMA
La dose raccomandata nel linfoma è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni
giornaliere prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
MIELOMA MULTIPLO
La dose raccomandata è 185 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera prima
dell’HPCT allogenico, senza superare la dose cumulativa totale massima di 185 mg/m (5 mg/kg), per
tutto il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata varia da 185 mg/m /giorno (5 mg/kg/giorno) a 481 mg/m /giorno
(13 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1 a 2 giorni
consecutivi prima dell’HPCT allogenico a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 555 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata è 370 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
370 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Posologia nei pazienti pediatrici
HPCT AUTOLOGO
Tumori solidi
La dose raccomandata nei tumori solidi varia da 150 mg/m /giorno (6 mg/kg/giorno) a
350 mg/m /giorno (14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata da 2 a 3 giorni
consecutivi prima dell’HPCT autologo a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per
tutto il periodo del regime di condizionamento.
TUMORI CEREBRALI
La dose raccomandata varia da 250 mg/m /giorno (10 mg/kg/giorno) a 350 mg/m /giorno
(14 mg/kg/giorno) in un’unica infusione giornaliera, somministrata per 3 giorni consecutivi prima
dell’HPCT autologo a seconda dell’associazione con altri medicinali chemioterapici, senza superare la
dose cumulativa totale massima di 1 050 mg/m (42 mg/kg), per tutto il periodo del regime di
condizionamento.
HPCT ALLOGENICO
Patologie ematologiche
La dose raccomandata nelle patologie ematologiche varia da 125 mg/m /giorno (5 mg/kg/giorno) a
250 mg/m /giorno (10 mg/kg/giorno) suddivisa in una o due infusioni giornaliere, somministrate da 1
a 3 giorni consecutivi prima dell’HPCT allogenico, a seconda dell’associazione con altri medicinali
chemioterapici, senza superare la dose cumulativa totale massima di 375 mg/m (15 mg/kg), per tutto
il periodo del regime di condizionamento.
LEUCEMIA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico, senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
TALASSEMIA
La dose raccomandata varia da 200 mg/m /giorno (8 mg/kg/giorno) a 250 mg/m /giorno
(10 mg/kg/giorno) suddivisa in due infusioni giornaliere, somministrate prima dell’HPCT allogenico
senza superare la dose cumulativa totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del
regime di condizionamento.
CITOPENIA REFRATTARIA
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 3 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 375 mg/m (15 mg/kg), per tutto il periodo del regime di condizionamento.
MALATTIE GENETICHE
La dose raccomandata è 125 mg/m /giorno (5 mg/kg/giorno) in un’unica infusione giornaliera,
somministrata per 2 giorni consecutivi prima dell’HPCT allogenico, senza superare la dose cumulativa
totale massima di 250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
ANEMIA DREPANOCITICA
La dose raccomandata è 250 mg/m /giorno (10 mg/kg/giorno) suddivisa in due infusioni giornaliere,
somministrate prima dell’HPCT allogenico senza superare la dose cumulativa totale massima di
250 mg/m (10 mg/kg), per tutto il periodo del regime di condizionamento.
Attivazione della sacca e ricostituzione
TEPADINA 400 mg deve essere ricostituita con 400 mL soluzione iniettabile di sodio cloruro
9 mg/mL (0,9%). La soluzione finale ricostituita si ottiene dopo aver rotto il sigillo rimovibile della
sacca a doppia camera ed averne miscelato i contenuti (polvere e solvente) fino alla completa
dissoluzione della polvere.
Dopo la ricostituzione con il solvente, ogni ml di soluzione contiene 1 mg di tiotepa.
Devono essere usate solo le soluzioni incolori, prive di materiale particellare.
Non usare questo medicinale se si notano segni visibili di deterioramento.
Somministrazione
La soluzione per infusione di TEPADINA dev’essere essere controllata visivamente in modo da
escludere la presenza di materiale particellare prima della somministrazione. Eliminare le soluzioni
contenenti un precipitato.
La soluzione per infusione deve essere somministrata ai pazienti mediante un set di infusione
provvisto di filtro in linea da 0,2 µm. Il filtraggio non altera il potere della soluzione.
Somministrare TEPADINA in maniera asettica mediante infusione di 2-4 ore a temperatura ambiente
(circa 25°C) e in condizioni di luce normali.
Prima e dopo ciascuna infusione, lavare bene il condotto del catetere a permanenza con circa 5 mL di
soluzione iniettabile di cloruro di sodio 9 mg/mL (0,9%).
3. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO E LA MANIPOLAZIONE
Aspetti generali
Per la manipolazione e lo smaltimento di medicinali antitumorali si devono seguire le procedure
appropriate. Tutte le procedure di trasferimento richiedono una stretta osservanza di tecniche asettiche,
e preferibilmente l’impiego di una cappa di sicurezza a flusso laminare verticale.
Come per altri composti citotossici, è necessario prestare estrema attenzione nella manipolazione e
preparazione delle soluzioni di TEPADINA, per evitare il contatto accidentale con la pelle o con le
membrane delle mucose. Possono verificarsi reazioni topiche associate all’esposizione accidentale a
tiotepa. Si consiglia quindi di indossare guanti prima di preparare la soluzione per infusione. Se la
soluzione con tiotepa entra in contatto accidentalmente con la pelle, lavare accuratamente e
immediatamente l’area esposta con acqua e sapone. In caso di contatto accidentale di tiotepa con le
membrane delle mucose, si raccomanda di lavare abbondantemente le stesse con acqua.
Smaltimento
TEPADINA è esclusivamente monouso.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
ADIENNE Istruzioni per l'uso della sacca  | |
Figura A
| o Figura B c
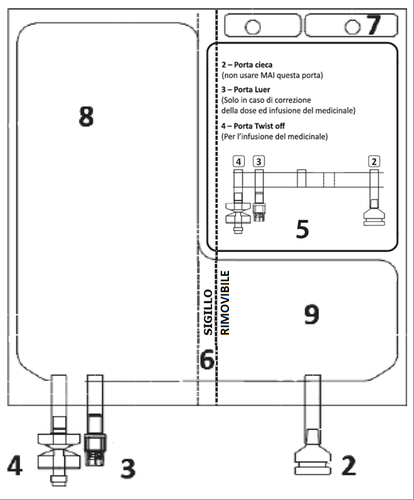 |
- 1 – RIMUOVERE L'INVOLUCRO ESTERNOd)Posizionare la sacca su una superficie b)Rimuovere la sacca flessibile a doppia camera dal pulita e stabile prima di aprirla. e)Strappare l’involucro esterno partendo dalla tacca posizionata vicino alle porte (Figura A - punto 1).f)Strappare il lato corto per accedere alla sacca interna come da Figura C.confezionamento secondario in alluminio e distendere la sacca Figura D.
Figura CFigura D
- 2 – ISPEZIONARE LA SACCA PRIMADELL'ATTIVAZIONE.
- 3 – ATTIVARE LA SACCAPosizionare la sacca su una superficie pulita e stabile con il lato scritto verso l'alto e le porte rivolte dalla parte opposta dell'utilizzatore, come da Figura E. Controllare che non vi sia liquido o fuoriuscita di prodotto dalle porte di connessione 2, 3, 4e dalla camera 8, 9.Controllare l'integrità del sigillo rimovibile 6, verificando l'assenza di liquido nella camera 9.
Figura E
Sovrapporre le mani sulla porzione inferiore della
camera 8(come da Figura F).
Premere saldamente in modo da applicare una
pressione uniforme fino a quando il sigillo rimovibile 6
è completamente attivato (possono volerci fino a 5
secondi di pressione continua per rompere il sigillo
rimovibile 6).
Figura F
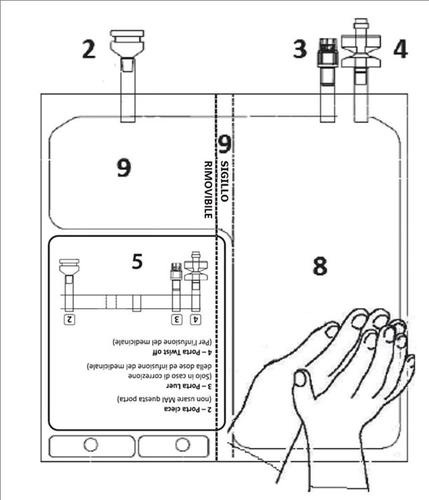
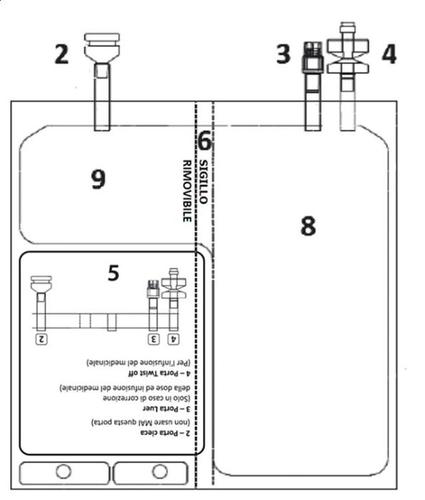
SACCA PRIMA DELL'ATTIVAZIONESACCA DOPO L'ATTIVAZIONE
Figura GFigura H
NON strizzare o premere con forza.
Figura I
- 4 – ISPEZIONARE LA SACCA PER CONFERMARE L'ATTIVAZIONE.Controllare che il sigillo rimovibile 6sia adesso completamente attivato. Le camere 8e 9sono unite.
Figura J
Mescolare delicatamente fino alla dissoluzione
completa del prodotto.
Figura K
- 5 – AGGIUSTAMENTO DELLA DOSE - Consultare i paragrafi 2. "Posologia e modo di somministrazione"e 3. "Precauzioni particolari per lo smaltimento e la manipolazione"Avvitare il dispositivo luer lock come da Figura M. Eseguire l'aggiustamento della dose come descritto nei paragrafi 2 e 3.Nel caso in cui sia necessaria una correzione della dose, identificare la Porta Luer 3. Rimuovere il tappo di plastica dalla Porta Luer. Non usare dispositivi impropri non luer lock sulla porta 3.
Figura M
Figura N
Alla fine dell'operazione, svitare il
dispositivo.
Figura L
Assicurarsi che la connessione sia
completamente alloggiata e
stretta. Posizionare il tappo di plastica
sulla Porta Luer 3prima di
procedere con l'infusione.
- 6 – CONNESSIONE - Il set da infusione può essere connesso alla sacca mediante il connettore luer o ilconnettore spike.OPZIONE A - CONNESSIONE CON SPIKEIdentificare la Porta Twist off 4nel caso di set da infusione spike. OPZIONE B - CONNESSIONE LUERSelezionare la porta con tappo luer 3nel caso di set da infusione con connettore luer. Rimuovere il tappo di plastica della Porta Luer 3prima di collegare il connettore luer. Svitare il tappo di plastica prima di inserire lo spike.
Figura Q
Figura O
Inserire il connettore luer.
Inserire il connettore spike.
Figura R
Assicurarsi che la connessione sia completamente
alloggiata e stretta.
Figura P
- 7 – APPENDERE LA SACCA
Appendere la sacca dal foro 7. Figura S
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a TEPADINAForma farmaceutica: Polvere per concentrato per soluzione per infusione, 15 MGPrincipio attivo: thiotepaPrescrizione richiestaForma farmaceutica: Polvere per concentrato per soluzione per infusione, 15 MGPrincipio attivo: thiotepaProduttore: Esteve Pharmaceuticals GmbHPrescrizione richiestaForma farmaceutica: Polvere per concentrato per soluzione per infusione, 15 MGPrincipio attivo: thiotepaProduttore: SEACROSS PHARMA (EUROPE) LTDPrescrizione richiesta
Medici online per TEPADINA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di TEPADINA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





