
ABECMA

Come usare ABECMA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
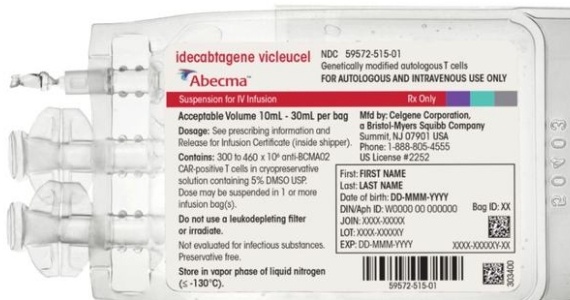
Abecma 260 - 500 x 10 cellule dispersione per infusione
idecabtagene vicleucel (cellule T vitali che esprimono il recettore antigenico chimerico, CAR)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Il medico le consegnerà una scheda di allerta per il paziente. La legga attentamente e segua le istruzioni che vi sono contenute.
- Mostri sempre la scheda di allerta per il paziente al medico o all’infermiere in occasione delle visite o se va in ospedale.
- Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Abecma e a cosa serve
- 2. Cosa deve sapere prima di ricevere Abecma
- 3. Come viene somministrato Abecma
- 4. Possibili effetti indesiderati
- 5. Come conservare Abecma
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Abecma e a cosa serve
Cos’è Abecma
Abecma è un tipo di medicinale chiamato “terapia cellulare geneticamente modificata”. Il principio
attivo contenuto nel medicinale è idecabtagene vicleucel, il quale è prodotto a partire dai suoi stessi
globuli bianchi, denominati cellule T.
A cosa serve Abecma
Abecma viene usato per il trattamento di adulti con mieloma multiplo, che è un tumore del midollo
osseo.
Viene somministrato quando i trattamenti precedenti per il tumore non hanno funzionato o il tumore si
è ripresentato.
Come agisce Abecma
I globuli bianchi prelevati dal suo sangue vengono modificati geneticamente per andare a colpire le
cellule del mieloma presenti nel suo organismo.
Quando Abecma viene infuso nel sangue, i globuli bianchi modificati eliminano le cellule del
mieloma.
2. Cosa deve sapere prima di ricevere Abecma
Non deve ricevere Abecma
- se è allergico ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6). Se pensa di poter essere allergico, chieda consiglio al medico.
- se è allergico ad uno qualsiasi dei componenti del medicinale che le sarà somministrato per la chemioterapia linfodepletiva, usata per preparare il suo organismo al trattamento con Abecma.
Avvertenze e precauzioni
Prima di ricevere Abecma, deve informare il medico se:
- soffre di problemi al cuore o ai polmoni;
- soffre di pressione sanguigna bassa;
- è stato sottoposto a un trapianto di cellule staminali negli ultimi 4 mesi;
- presenta segni o sintomi di malattia del trapianto contro l’ospite. Questo accade quando le cellule trapiantate attaccano l’organismo, causando sintomi come eruzione cutanea, nausea, vomito, diarrea e sangue nelle feci;
- presenta un’infezione. L’infezione sarà trattata prima che le venga somministrato Abecma;
- nota che i sintomi del suo tumore peggiorano. Nel mieloma questi potrebbero includere febbre, sensazione di debolezza, dolore alle ossa e perdita di peso inspiegabile;
- ha contratto un’infezione da citomegalovirus (CMV), epatite B o C o da virus dell’immunodeficienza umana (HIV);
- ha ricevuto una vaccinazione nelle ultime 6 settimane o ha in programma di riceverne una nei prossimi mesi.
Se rientra in una qualsiasi delle condizioni sopra descritte (oppure se ha dubbi), si rivolga al medico
prima di ricevere Abecma.
I pazienti trattati con Abecma possono sviluppare nuovi tipi di cancro. Sono stati segnalati casi di
pazienti che, dopo il trattamento con Abecma e medicinali simili, hanno sviluppato un cancro che ha
avuto origine in un tipo di globuli bianchi denominati cellule T. Si rivolga al medico nel caso in cui
manifesti nuovo gonfiore delle ghiandole (linfonodi) o alterazioni della pelle, come nuovi noduli o
eruzioni.
Esami e controlli
Prima che le venga somministrato Abecma, il medico provvederà a:
- sottoporla a un controllo di polmoni, cuore e pressione sanguigna
- individuare segni di infezione; qualsiasi infezione sarà trattata prima che le venga somministrato Abecma
- verificare se il tumore sta peggiorando
- verificare se presenta un’infezione da CMV, epatite B, epatite C o infezione da HIV.
Dopo aver ricevuto Abecma
- Vi sono effetti indesiderati gravi di cui dovrà informare immediatamente il medico o l’infermiere e che potrebbero richiedere cure mediche d’urgenza. Vedere paragrafo 4 sotto “Effetti indesiderati gravi”.
- Il medico controllerà regolarmente le sue conte ematiche in quanto il numero di cellule del sangue potrebbe diminuire.
- Rimanga nei pressi del centro di trattamento presso il quale ha ricevuto Abecma per almeno 4 settimane. Vedere paragrafi 3 e 4.
- Non doni sangue, organi, tessuti o cellule per trapianto.
Bambini e adolescenti
Abecma non deve essere somministrato a bambini e adolescenti al di sotto dei 18 anni di età.
Altri medicinali e Abecma
Informi il medico o l’infermiere se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale, inclusi quelli che non necessitano di prescrizione.
Medicinali che influiscono sul sistema immunitario
Prima di ricevere Abecma, informi il medico o l’infermiere se sta assumendo medicinali che
indeboliscono il sistema immunitario, come i corticosteroidi. Questo perché tali medicinali possono
interferire con l’effetto di Abecma.
Consulti il paragrafo 3 per informazioni circa i medicinali che le verranno somministrati prima di
ricevere Abecma.
Vaccinazioni
Non deve ricevere determinati vaccini noti come vaccini vivi:
- nelle 6 settimane prima di sottoporsi a un breve ciclo di chemioterapia (chiamata chemioterapia linfodepletiva) per preparare il suo corpo a ricevere Abecma;
- durante il trattamento con Abecma;
- dopo il trattamento mentre il sistema immunitario è in fase di recupero.
Si rivolga al suo medico se ha bisogno di eventuali vaccinazioni.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di ricevere questo medicinale. Questo perché gli effetti di
Abecma nelle donne in gravidanza o in fase di allattamento non sono noti e tale medicinale potrebbe
nuocere al feto o al neonato allattato con latte materno.
- Se è in gravidanza o pensa di esserlo dopo il trattamento con Abecma, consulti immediatamente il medico.
- Le sarà fornito un test di gravidanza prima dell’inizio del trattamento. Abecma deve essere somministrato solo se i risultati mostrano che lei non è incinta.
Parli della gravidanza con il medico se ha ricevuto Abecma.
Guida di veicoli e utilizzo di macchinari
Eviti di guidare veicoli, usare macchinari o intraprendere attività che richiedono attenzione per almeno
8 settimane dopo il trattamento o fino a quando il medico non confermerà il suo completo recupero.
Abecma può provocare sonnolenza, causare confusione o attacchi (crisi convulsive).
Abecma contiene sodio, potassio e dimetilsolfossido (DMSO)
Questo medicinale contiene fino a 752 mg di sodio (componente principale del sale da cucina) per
dose. Questo equivale al 37,6% dell’assunzione massima giornaliera raccomandata con la dieta di un
adulto.
Questo medicinale contiene fino a 274 mg di potassio per dose. Da tenere in considerazione in pazienti
con ridotta funzionalità renale o in pazienti che seguono una dieta a basso contenuto di potassio.
Se non è stato esposto a DMSO in precedenza, deve essere tenuto sotto stretta osservazione durante i
primi minuti dell’infusione.
3. Come viene somministrato Abecma
Prelievo di sangue per produrre Abecma dai globuli bianchi
- Il medico le preleverà del sangue utilizzando un tubo (catetere) inserito in una vena. Alcuni dei suoi globuli bianchi saranno separati dal sangue e il sangue rimanente sarà restituito al suo corpo. Questa procedura è detta “leucaferesi” e può richiedere da 3 a 6 ore. È probabile che la procedura debba essere ripetuta.
- I suoi globuli bianchi saranno quindi congelati e inviati per la produzione di Abecma.
Altri medicinali che le verranno somministrati prima di Abecma
- Pochi giorni prima di ricevere Abecma, sarà sottoposto a un breve ciclo di chemioterapia. Questo serve ad eliminare i globuli bianchi esistenti.
- Poco prima di ricevere Abecma, le verranno somministrati paracetamolo e un antistaminico. Ciò al fine di ridurre il rischio di reazioni all’infusione e febbre.
Come viene somministrato Abecma
- Il medico controllerà che Abecma sia stato preparato dal suo stesso sangue verificando che i dati identificativi del paziente riportati sull’etichetta del medicinale corrispondano ai dettagli che la riguardano.
- Abecma viene somministrato mediante fleboclisi (infusione) attraverso un tubicino inserito in una vena.
Dopo la somministrazione di Abecma
- Rimanga nei pressi del centro di trattamento presso il quale ha ricevuto Abecma per almeno 4 settimane.
- Potrebbe essere monitorato quotidianamente presso il centro di trattamento per almeno 10 giorni al fine di verificare se il trattamento sta funzionando e assisterla qualora dovesse manifestare eventuali effetti indesiderati. Vedere paragrafi 2 e 4.
- Non doni sangue, organi, tessuti o cellule per trapianto.
Se salta un appuntamento
Chiami il medico o il centro di trattamento non appena possibile per fissare un altro appuntamento.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Effetti indesiderati gravi
Informi immediatamente il medico se, dopo aver ricevuto Abecma, manifesta uno qualsiasi dei
seguenti effetti indesiderati, che si presentano in genere nelle prime 8 settimane dopo l’infusione, ma
che possono svilupparsi anche successivamente:
Molto comuni: possono interessare più di 1 persona su 10
- febbre, brividi, respirazione difficoltosa, capogiri o leggera confusione mentale, nausea, cefalea, battito cardiaco accelerato, pressione arteriosa bassa o stanchezza: questi possono essere sintomi della sindrome da rilascio di citochine (CRS), una condizione grave e che può causare la morte;
- qualsiasi segno di infezione, che può includere febbre, brividi o tremori, tosse, respiro affannoso o accelerato e polso rapido;
- sensazione di estrema stanchezza o debolezza o mancanza di respiro, che possono essere segni di bassi livelli dei globuli rossi (anemia);
- maggiore facilità di sanguinamento o formazione di lividi senza una causa, inclusi sangue dal naso o sanguinamento dalla bocca o dall’intestino, che può essere un segno di bassi livelli di piastrine nel sangue.
Comuni: possono interessare fino a 1 persona su 10
- tremolio, debolezza con perdita dei movimenti su un lato del corpo, tremore, movimenti lenti o rigidità che potrebbero essere sintomi di parkinsonismo.
Non comuni: possono interessare fino a 1 persona su 100
- confusione, difficoltà di memoria, difficoltà a parlare o linguaggio lento, difficoltà a comprendere i discorsi, perdita dell’equilibrio o della coordinazione, disorientamento, riduzione dello stato di allerta (riduzione dello stato di coscienza) o eccessiva sonnolenza, perdita di coscienza, delirio, attacchi (crisi convulsive) che potrebbero essere sintomi di una condizione chiamata sindrome di neurotossicità associata a cellule effettrici immunitarie (ICANS).
Informi immediatamente il medico se accusa uno qualsiasi dei suddetti effetti indesiderati, in quanto
potrebbe aver bisogno di un trattamento medico urgente.
Altri possibili effetti indesiderati
Molto comuni: possono interessare più di 1 persona su 10
- perdita di energia
- pressione del sangue elevata
- appetito ridotto
- stipsi
- gonfiore a caviglie, braccia, gambe e viso
- dolore articolare
- difficoltà a dormire
- basso numero di globuli bianchi (neutrofili, leucociti e linfociti), che può aumentare il rischio di infezione
- infezioni, incluse infezione polmonare o infezioni delle vie respiratorie, di bocca, pelle, vie urinarie o del sangue, che possono essere di origine batterica, virale o fungina
- risultati degli esami di laboratorio che mostrano bassi livelli di anticorpi, chiamati immunoglobuline (ipogammaglobulinemia), che sono importanti per combattere le infezioni
- risultati delle analisi di laboratorio che mostrano una riduzione dei livelli di calcio, sodio, magnesio, potassio, fosfato o albumina, che possono causare stanchezza, debolezza muscolare o crampi o un battito cardiaco irregolare
- risultati delle analisi di laboratorio che mostrano livelli degli enzimi del fegato aumentati o un più alto livello della proteina C reattiva nel sangue che può indicare infiammazione.
Comuni: possono interessare fino a 1 persona su 10
- grave infiammazione causata dall’attivazione del sistema immunitario, che potrebbe provocare gravi danni all’organismo
- dolore muscolare
- movimenti del corpo anormali o mancanza di coordinazione
- battito del cuore discontinuo o irregolare
- liquido nei polmoni
- basso livello di ossigeno nel sangue, che può causare respiro affannoso, confusione o sonnolenza.
Rari: possono interessare fino a 1 persona su 1 000
- un nuovo tipo di cancro che ha origine in un tipo di globuli bianchi denominati cellule T (neoplasia secondaria maligna originata da cellule T)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Abecma
Le seguenti informazioni sono destinate esclusivamente ai medici.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta della cassetta
metallica e sull’etichetta della sacca per infusione dopo “Scad.”
Conservare e trasportare congelato in vapori di azoto liquido (≤ -130 °C). Non scongelare il prodotto
fino a quando non sia pronto per essere utilizzato. Non ricongelare.
Non usi questo medicinale se la sacca per infusione è danneggiata o presenta perdite.
6. Contenuto della confezione e altre informazioni
Cosa contiene Abecma
- Il principio attivo è idecabtagene vicleucel. Ogni sacca per infusione di Abecma contiene idecabtagene vicleucel dispersione cellulare a una concentrazione dipendente dal lotto di cellule T autologhe geneticamente modificate che esprimono il CAR anti-BCMA (cellule T vitali che esprimono il recettore CAR). Una o più sacche per infusione contengono un totale di
- 260 - 500 x 10 cellule T vitali che esprimono il recettore CAR.
- Gli altri componenti (eccipienti) sono CryoStor CS10, sodio cloruro, sodio gluconato, sodio acetato triidrato, potassio cloruro, magnesio cloruro, acqua per preparazioni iniettabili. Vedere paragrafo 2, “Abecma contiene sodio, potassio e DMSO”.
Questo medicinale contiene cellule ematiche umane geneticamente modificate.
Descrizione dell’aspetto di Abecma e contenuto della confezione
Abecma è una dispersione cellulare per infusione incolore, fornita in una o più sacche per infusione
avvolte singolarmente in un involucro di plastica trasparente ripiegato sul retro della sacca per
infusione e confezionate in una cassetta metallica. Ogni sacca contiene da 10 mL a 100 mL di
dispersione cellulare.
Titolare dell’autorizzazione all’immissione in commercio
Bristol-Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Irlanda
Produttore
Celgene Distribution B.V.
Orteliuslaan 1000
3528 BD Utrecht
Paesi Bassi
BMS Netherlands Operations B.V.
Francois Aragostraat 2
2342 DK Oegstgeest
Paesi Bassi
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
Belgique/België/Belgien
N.V. Bristol-Myers Squibb Belgium S.A.
Tél/Tel: + 32 2 352 76 11
[email protected]
Lietuva
Swixx Biopharma UAB
Tel: + 370 52 369140
[email protected]
България
Swixx Biopharma EOOD
Teл.: + 359 2 4942 480
[email protected]
Luxembourg/Luxemburg
N.V. Bristol-Myers Squibb Belgium S.A.
Tél/Tel: + 32 2 352 76 11
[email protected]
Česká republika
Bristol-Myers Squibb spol. s r.o.
Tel: + 420 221 016 111
[email protected]
Magyarország
Bristol-Myers Squibb Kft.
Tel.: + 36 1 301 9797
[email protected]
Danmark
Bristol-Myers Squibb Denmark
Tlf: + 45 45 93 05 06
[email protected]
Malta
A.M. Mangion Ltd
Tel: + 356 23976333
[email protected]
Deutschland
Bristol-Myers Squibb GmbH & Co. KGaA
Tel: 0800 0752002 (+ 49 89 121 42 350)
[email protected]
Nederland
Bristol-Myers Squibb B.V.
Tel: + 31 (0)30 300 2222
[email protected]
Eesti
Swixx Biopharma OÜ
Tel: + 372 640 1030
[email protected]
Norge
Bristol-Myers Squibb Norway AS
Tlf: + 47 67 55 53 50
[email protected]
Ελλάδα
Bristol-Myers Squibb A.E.
Τηλ: + 30 210 6074300
[email protected]
Österreich
Bristol-Myers Squibb GesmbH
Tel: + 43 1 60 14 30
[email protected]
España
Bristol-Myers Squibb, S.A.
Tel: + 34 91 456 53 00
[email protected]
Polska
Bristol-Myers Squibb Polska Sp. z o.o.
Tel.: + 48 22 2606400
[email protected]
France
Bristol-Myers Squibb SAS
Tél: + 33 (0)1 58 83 84 96
[email protected]
Portugal
Bristol-Myers Squibb Farmacêutica Portuguesa,
S.A.
Tel: + 351 21 440 70 00
[email protected]
Hrvatska
Swixx Biopharma d.o.o.
Tel: + 385 1 2078 500
[email protected]
România
Bristol-Myers Squibb Marketing Services S.R.L.
Tel: + 40 (0)21 272 16 19
[email protected]
Ireland
Bristol-Myers Squibb Pharmaceuticals uc
Tel: 1 800 749 749 (+ 353 (0)1 483 3625)
[email protected]
Slovenija
Swixx Biopharma d.o.o.
Tel: + 386 1 2355 100
[email protected]
Ísland
Vistor ehf.
Sími: + 354 535 7000
[email protected]
Slovenská republika
Swixx Biopharma s.r.o.
Tel: + 421 2 20833 600
[email protected]
Italia
Bristol-Myers Squibb S.r.l.
Tel: + 39 06 50 39 61
[email protected]
Suomi/Finland
Oy Bristol-Myers Squibb (Finland) Ab
Puh/Tel: + 358 9 251 21 230
[email protected]
Κύπρος
Bristol-Myers Squibb A.E.
Τηλ: 800 92666 (+ 30 210 6074300)
[email protected]
Sverige
Bristol-Myers Squibb Aktiebolag
Tel: + 46 8 704 71 00
[email protected]
Latvija
Swixx Biopharma SIA
Tel: + 371 66164750
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, https://www.ema.europa.eu . Inoltre, sono riportati link ad altri siti web su malattie rare
e relativi trattamenti terapeutici.
------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
È importante leggere l’intero contenuto di questa procedura prima di somministrare Abecma.
Precauzioni che devono essere prese prima della manipolazione o della somministrazione del
medicinale
- Abecma deve essere trasportato all’interno della struttura in contenitori chiusi, ermetici e a prova di rottura o perdita.
- Questo medicinale contiene cellule ematiche umane. Gli operatori sanitari che manipolano Abecma devono prendere le opportune precauzioni (indossare guanti e occhiali protettivi) per evitare la potenziale trasmissione di malattie infettive.
Preparazione prima della somministrazione
- Prima dell’infusione di Abecma, si deve confermare che l’identità del paziente corrisponda ai dati identificativi del paziente riportati sulla/e cassetta/e, sulla/e sacca/sacche per infusione e sul certificato di rilascio per l’infusione (RfIC) di Abecma.
- La sacca per infusione di Abecma non deve essere rimossa dalla cassetta se le informazioni sull’etichetta specifica per il paziente non corrispondono a quelle del paziente da trattare. Qualora vi siano eventuali discrepanze fra le etichette e i dati identificativi del paziente, occorre contattare immediatamente l’azienda.
- Se per il trattamento è stata ricevuta più di una sacca per infusione, scongelare, una alla volta, ciascuna sacca per infusione. Le tempistiche di scongelamento e di infusione di Abecma devono essere coordinate. L’ora di inizio dell’infusione deve essere confermata in anticipo e regolata per lo scongelamento in maniera tale che, quando il paziente è pronto, Abecma sia disponibile per l’infusione.
Scongelamento
- Rimuovere la sacca per infusione di Abecma dalla cassetta e ispezionarla allo scopo di rilevare eventuali compromissioni dell’integrità del contenitore, come rotture o crepe, prima dello scongelamento. Se la sacca per infusione appare danneggiata o sembra avere delle perdite, non si deve procedere all’infusione e la sacca deve essere smaltita secondo le linee guida locali sulla manipolazione dei rifiuti derivati da materiale di origine umana.
- Collocare la sacca per infusione all’interno di una seconda sacca sterile.
- Scongelare Abecma a una temperatura di circa 37 °C usando un dispositivo di scongelamento approvato o un bagno ad acqua fino a quando non vi sia più ghiaccio visibile nella sacca per infusione. Miscelare delicatamente il contenuto della sacca per disperdere eventuali grumi visibili di materiale cellulare. La presenza in Abecma di piccoli grumi di materiale cellulare è attesa. Non lavare, centrifugare e/o risospendere Abecma in un nuovo mezzo prima dell’infusione.
- La sacca per infusione di Abecma è avvolta da un rivestimento di plastica trasparente ripiegato sul retro della sacca per infusione. Rimuovere delicatamente la sacca per infusione dall’involucro dispiegando il rivestimento di plastica sul retro per esporre la sacca per infusione. Estrarre la sacca per infusione dall’involucro.
Somministrazione
- NON utilizzare un filtro per leucodeplezione.
- L’infusione endovenosa di Abecma deve essere somministrata solo da un operatore sanitario con esperienza nel trattamento di pazienti immunodepressi e addestrato nella gestione dell’anafilassi.
- Assicurarsi che tocilizumab e le apparecchiature di emergenza siano disponibili prima dell’infusione e durante il periodo di recupero. Nel caso eccezionale in cui tocilizumab non fosse disponibile a causa di una carenza riportata nell’elenco dei farmaci carenti dell’Agenzia europea dei medicinali, assicurarsi che siano disponibili in loco misure adeguate alternative a tocilizumab per trattare la CRS.
- Per l’infusione di Abecma può essere usato un accesso venoso centrale, consigliato nei pazienti con scarso accesso periferico.
- Prima della somministrazione, è necessario confermare che l’identità del paziente corrisponda alle informazioni uniche sul paziente riportate sulla sacca per infusione di Abecma e sulla documentazione allegata. Verificare inoltre il numero totale di sacche per infusione da somministrare rispetto alle informazioni specifiche per il paziente riportate sul certificato di rilascio per infusione (RfIC).
- Caricare il tubo del set di infusione con una soluzione iniettabile di sodio cloruro 9 mg/mL (0,9%) prima dell’infusione. Per i prodotti scongelati deve essere utilizzato il set per infusione con filtro in linea (un filtro non per leucodeplezione con una dimensione dei pori compresa tra 170 e 260 μm).
- Infondere Abecma, mediante flusso a gravità, entro 1 ora dall’inizio dello scongelamento quanto più rapidamente possibile in base alla tollerabilità.
- Una volta infuso l’intero contenuto della sacca per infusione, sciacquare il tubo, incluso il filtro in linea, con una soluzione iniettabile di sodio cloruro 9 mg/mL (0,9%) alla stessa velocità di infusione per garantire che vengano infuse al paziente quante più cellule possibile.
- Seguire la stessa procedura per tutte le successive sacche per infusione per il paziente identificato.
Misure da adottare in caso di esposizione accidentale
- In caso di esposizione accidentale, seguire le linee guida locali sulla manipolazione di materiale di origine umana. Le superfici di lavoro e i materiali che sono stati potenzialmente a contatto con Abecma devono essere decontaminati con un disinfettante appropriato.
Precauzioni che devono essere prese per lo smaltimento del medicinale
- Il medicinale non utilizzato e tutti i materiali che sono stati a contatto con Abecma (rifiuti solidi e liquidi) devono essere manipolati e smaltiti come rifiuti potenzialmente infettivi in conformità alle linee guida locali sulla manipolazione di materiale di origine umana.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a ABECMAForma farmaceutica: Dispersione per infusione, 3,2 ? 10 alla sesta ?1,0 ? 10 alla ottavaPrincipio attivo: ciltacabtagene autoleucelProduttore: JANSSEN-CILAG INTERNATIONAL N.V.Prescrizione richiestaForma farmaceutica: Dispersione per preparazione iniettabile, 2,8 ? 10 alla settima ? 7,3 ? 10 alla settima cellule/mLPrincipio attivo: tabelecleucelProduttore: PIERRE FABRE MEDICAMENTPrescrizione non richiestaForma farmaceutica: Dispersione per infusione, 1,2 X 10 ALLA SESTA - 6 X 10 ALLA OTTAVAPrincipio attivo: tisagenlecleucelProduttore: NOVARTIS EUROPHARM LIMITEDPrescrizione richiesta
Medici online per ABECMA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di ABECMA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





