
KYMRIAH

Come usare KYMRIAH
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
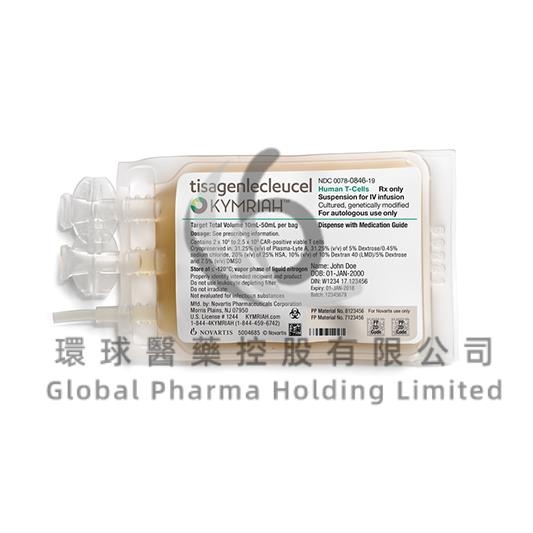
Kymriah 1,2 × 10 – 6 × 10 cellule dispersione per infusione
tisagenlecleucel (cellule T vitali CAR+)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che a lei (o al suo bambino) sia somministrato questo
medicinale perché contiene importanti informazioni.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Il medico le consegnerà una scheda di allerta per il paziente. La legga attentamente e segua le istruzioni che vi sono contenute.
- Mostri sempre la scheda di allerta per il paziente al medico o all’infermiere in occasione delle visite o se va in ospedale.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
- Le informazioni in questo foglio sono per lei o per il suo bambino - ma nel foglio si dirà semplicemente “lei”.
Contenuto di questo foglio
- 1. Cos’è Kymriah e a cosa serve
- 2. Cosa deve sapere prima di ricevere Kymriah
- 3. Come viene somministrato Kymriah
- 4. Possibili effetti indesiderati
- 5. Come conservare Kymriah
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Kymriah e a cosa serve
Cose’è Kymriah
Kymriah, noto anche come tisagenlecleucel, è prodotto da alcuni dei suoi globuli bianchi chiamati
cellule T. Le cellule T sono importanti per il corretto funzionamento del suo sistema immunitario (le
difese dell’organismo).
Come funziona Kymriah?
Le cellule T sono prese dal suo sangue e un nuovo gene viene inserito nelle cellule T in modo che
possano attaccare le cellule tumorali nel suo corpo. Quando Kymriah viene infuso nel sangue, le
cellule T modificate trovano le cellule tumorali e le distruggono.
A cosa serve Kymriah
Kymriah è utilizzato per trattare:
- Leucemia linfoblastica acuta a cellule B(LLA a cellule B) - una forma di tumore che colpisce alcuni altri tipi di globuli bianchi. Il medicinale può essere utilizzato nei bambini e nei giovani adulti fino ai 25 anni di età inclusi con questo tumore quando non ha risposto al trattamento precedente, si è ripresentato due o più volte o si è ripresentato dopo un trapianto di cellule staminali.
- Linfoma diffuso a grandi cellule B (DLBCL)- una forma di tumore che colpisce alcuni tipi di globuli bianchi, principalmente nei linfonodi. Il medicinale può essere utilizzato negli adulti (dai 18 anni in su) con questo tumore quando si è ripresentato o non ha risposto dopo due o più trattamenti precedenti.
- Linfoma follicolare (LF)- una forma di tumore che colpisce alcuni tipi di globuli bianchi, chiamati linfociti, principalmente nei linfonodi. Il medicinale può essere utilizzato negli adulti (dai 18 anni in su) con questo tumore quando si è ripresentato o non ha risposto dopo due o più trattamenti precedenti.
Se ha domande su come Kymriah funzioni o sul perché le sia stato prescritto questo medicinale, si
rivolga al medico.
2. Cosa deve sapere prima di ricevere Kymriah
Non deve ricevere Kymriah:
- se è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6). Se pensa di poter essere allergico, chieda consiglio al medico.
- Se non può ricevere un trattamento, chiamato chemioterapia linfodepletiva, che riduce il numero di globuli bianchi nel sangue.
Avvertenze e precauzioni
Kymriah è ottenuto dai suoi globuli bianchi e deve essere somministrato unicamente a lei.
I pazienti trattati con Kymriah possono sviluppare nuovi tipi di cancro. Sono stati segnalati casi di
pazienti che, dopo il trattamento con Kymriah e medicinali simili, hanno sviluppato un cancro che ha
avuto origine in un tipo di globuli bianchi denominati cellule T. Si rivolga al medico nel caso in cui
manifesti nuovo gonfiore delle ghiandole (linfonodi) o alterazioni della pelle, come nuovi noduli o
eruzioni.
Le verrà chiesto di iscriversi a un registro per almeno 15 anni per comprendere meglio gli effetti a
lungo termine di Kymriah.
Prima che le venga somministrato Kymriah deve informare il medico se:
- Ha avuto un trapianto di cellule staminali negli ultimi 4 mesi. Il medico controllerà se ha segni o sintomi della malattia del trapianto contro l’ospite. Questo accade quando le cellule trapiantate attaccano il suo corpo, causando sintomi come eruzioni cutanee, nausea, vomito, diarrea e sangue nelle feci.
- Ha problemi ai polmoni, al cuore o alla pressione sanguigna (bassa o aumentata).
- Nota che i sintomi del suo tumore stanno peggiorando. Se ha la leucemia questa può includere febbre, sensazione di debolezza, sanguinamento gengivale, lividi. Se ha il linfoma, questo può includere febbre inspiegabile, sensazione di debolezza, sudorazioni notturne, improvvisa perdita di peso.
- Ha un’infezione. L’infezione sarà trattata prima dell’infusione di Kymriah.
- Ha avuto infezioni da virus dell’epatite B, epatite C o dell’immunodeficienza umana (HIV).
- Ha in corso una gravidanza, pensa di poter essere in gravidanza o la sta pianificando (vedere di sotto i paragrafi “Gravidanza e allattamento” e “Contraccezione per donne e uomini”).
- È stato vaccinato nelle 6 settimane precedenti o lo sarà nei prossimi mesi. Se rientra in una delle situazioni summenzionate (o non ne ha certezza), si rivolga al medico prima che le sia somministrato Kymriah.
Test e controlli
Prima che le venga somministrato Kymriah il medico:
- Controllerà i polmoni, il cuore e la pressione sanguigna.
- Rileverà la presenza di segni di infezione; ogni infezione sarà trattata prima che le venga somministrato Kymriah.
- Controllerà se il linfoma o la leucemia sta peggiorando.
- Rileverà la presenza di segni della malattia del trapianto contro l’ospite che può verificarsi dopo un trapianto.
- Controllerà il livello di acido urico nel suo sangue e quante cellule tumorali sono presenti nel sangue. Questo indicherà la probabilità di sviluppare una condizione chiamata sindrome da lisi tumorale. Le possono venir somministrati medicinali per aiutare a prevenire la condizione.
- Effettuerà controlli per l’infezione da virus dell’epatite B, dell’epatite C o da HIV.
Dopo che le è stato somministrato Kymriah
Informi immediatamente il medico o l’infermiere se ha una delle seguenti condizioni:
- Febbre, che può essere un sintomo di una infezione. Il medico controllerà regolarmente le conte ematiche poiché il numero delle cellule del sangue e di altri componenti del sangue può diminuire.
- Controlli la sua temperatura due volte al giorno per 3-4 settimane dopo la somministrazione di Kymriah. Se la sua temperatura è elevata, contatti immediatamente il medico.
- Alterazione o diminuzione dello stato di coscienza, delirio, ansia, capogiri, tremori, mal di testa, confusione, agitazione, crisi convulsive, difficoltà a parlare e capire, e/o perdita di equilibrio. Questo si verifica solitamente entro le prime 8 settimane dopo l’infusione, ma può verificarsi anche successivamente. Questi possono essere sintomi di una condizione chiamata sindrome di neurotossicità associata a cellule effettrici immunitarie (ICANS).
- Stanchezza estrema, debolezza e respiro corto, che possono essere sintomi di una mancanza di globuli rossi.
- Sanguinamento o facile formazione di lividi, che possono essere sintomi di bassi livelli di cellule nel sangue note come piastrine.
Vi può essere un effetto sui risultati di alcuni tipi di test per l’HIV – per questo si rivolga al medico.
Dopo aver ricevuto Kymriah, il suo medico monitorerà regolarmente la sua conta ematica poichè può
verificarsi una riduzione del numero delle cellule ematiche e di altri componenti del sangue.
Non doni sangue, organi, tessuti o cellule.
Bambini e adolescenti
- L’esperienza con Kymriah in pazienti pediatrici di età inferiore ai 3 anni è limitata.
- L’uso di Kymriah non è raccomandato nei bambini e negli adolescenti al di sotto dei 18 anni di età per il trattamento del DLBCL. Questo perché l’esperienza nel trattamento del linfoma non Hodgkin in questa fascia di età è limitata.
- Kymriah non deve essere utilizzato nei bambini e negli adolescenti al di sotto dei 18 anni di età per il trattamento del LF. Questo perché Kymriah non è stato studiato in questa fascia di età.
Altri medicinali e Kymriah
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale, compresi quelli senza prescrizione medica. Questo perché altri medicinali possono
influenzare il modo in cui Kymriah funziona.
In particolare, non le devono essere somministrati certi vaccini chiamati vaccini vivi:
- nelle 6 settimane che precedono la somministrazione del breve ciclo di chemioterapia (chiamata chemioterapia linfodepletiva) per preparare il suo corpo alle cellule di Kymriah.
- durante il trattamento con Kymriah.
- dopo il trattamento mentre il sistema immunitario si sta riprendendo. Si rivolga al medico se ha bisogno di eventuali vaccinazioni.
Prima che le venga somministrato Kymriah informi il medico o l’infermiere se sta assumento
medicinali che indeboliscono il sistema immunitario come corticosteroidi, poichè questi medicinali
possono interferire con l’effetto di Kymriah.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima che le sia somministrato questo medicinale. Questo perché
non sono noti gli effetti di Kymriah nelle donne in gravidanza o che allattano con latte materno, e può
nuocere al nascituro o al neonato/lattante.
- Se inizia una gravidanza o sospetta una gravidanza durante il trattamento con Kymriah, si rivolga al medico immediatamente.
- Verrà eseguito un test di gravidanza prima dell’inizio del trattamento. Kymriah deve essere somministrato solo se il risultato mostra che non è in corso una gravidanza.
Contraccezione per donne e uomini
Se lei ha ricevuto Kymriah, discuta l’eventualità di una gravidanza con il medico.
Guida di veicoli e utilizzo di macchinari
Alcune persone possono sentirsi confuse, avere problemi come alterazione o diminuzione dello stato
di coscienza, confusione e crisi convulsive (attacchi) dopo aver ricevuto Kymriah. Pertanto, non guidi,
non utilizzi macchinari, o prenda parte ad attività che richiedano attenzione nelle 8 settimane
successive all’infusione.
Kymriah contiene sodio, dimetilsolfossido (DMSO), destrano 40 e potassio
Questo medicinale contiene da 24,3 a 121,5 mg di sodio (componente principale del sale da cucina) in
ogni dose. Questo equivale allo 1-6% dell’assunzione massima giornaliera di sodio raccomandata con
la dieta di un adulto.
Questo medicinale contiene destrano 40 e DMSO (sostanze utilizzate per conservare le cellule
congelate), le quali a volte possono causare difficoltà a respirare e/o capogiri (possibili sintomi di
gravi reazioni allergiche o di ipersensibilità). Lei deve essere osservato attentamente durante il periodo
di infusione.
Questo medicinale contiene potassio, meno di 1 mmol (39 mg) per dose, cioè essenzialmente ‘senza
potassio’.
3. Come viene somministrato Kymriah
Kymriah sarà sempre somministrato da un medico in un centro clinico qualificato per il trattamento.
Fornire il sangue per produrre Kymriah
Kymriah è prodotto dai suoi stessi globuli bianchi.
- Il medico le preleverà del sangue utilizzando un catetere posto in una vena (una procedura chiamata leucoaferesi). Alcuni dei suoi globuli bianchi vengono separati dal sangue e il resto del sangue viene reinfuso nella vena. Questa procedura può richiedere da 3 a 6 ore e può dover essere ripetuta.
- I suoi globuli bianchi vengono congelati e spediti per produrre Kymriah. Di solito occorrono dalle 3 alle 4 settimane per produrre Kymriah ma il tempo può variare.
- Kymriah è un trattamento che è prodotto appositamente per lei.
- Prima di somministrare Kymriah, il medico può sottoporla a un tipo di trattamento chiamato chemioterapia linfodepletiva per alcuni giorni per preparare il suo corpo.
Trattamento del tumore durante la preparazione di Kymriah
Durante il periodo in cui viene prodotto Kymriah, il suo linfoma o la leucemia possono peggiorare e il
suo medico può decidere di utilizzare un trattamento aggiuntivo (noto come “terapia ponte”) per
stabilizzare il tumore impedendo lo sviluppo di nuove cellule tumorali. Questo trattamento può
comportare effetti collaterali e questi possono essere gravi o pericolosi per la vita. Il medico la
informerà dei potenziali effetti indesiderati di questo trattamento.
Altri medicinali somministrati immediatamente prima del trattamento con Kymriah
Durante i 30-60 minuti prima che le venga somministrato Kymriah le possono essere somministrati
altri medicinali. Questo per aiutare a prevenire reazioni all’infusione e febbre. Questi altri medicinali
possono includere:
- Paracetamolo
- Un antistaminico come difenidramina.
Come viene somministrato Kymriah
- Il medico controllerà che gli identificativi individuali del paziente sulla sacca da infusione di Kymriah corrispondano ai suoi.
- Il medico le somministrerà Kymriah per infusione, che significa che le sarà somministrato come una flebo attraverso una cannula posta in una vena. Questo di solito richiede meno di 1 ora. Durante l’infusione il medico controllerà se lei ha difficoltà a respirare o capogiri (possibili sintomi di una reazione allergica).
- Il trattamento con Kymriah è previsto una sola volta.
Dopo la somministrazione di Kymriah
- Per almeno 4 settimane dopo la somministrazione di Kymriah consideri di rimanere nel raggio di 2 ore di viaggio dall’ospedale dove è stato trattato. Durante la prima settimana dopo il trattamento, il medico può raccomandarle di tornare in ospedale 2 o 3 volte, o più frequentemente. In questo modo il medico può controllare se il trattamento funziona e aiutarla se ha qualsiasi effetto indesiderato.
Se salta un appuntamento
Se salta un appuntamento, chiami il medico o l’ospedale il più presto possibile per rifissarlo.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Informi immediatamente il medicose manifesta uno qualsiasi dei seguenti effetti indesiderati dopo
l’infusione di Kymriah. Questi di solito si verificano nelle prime 8 settimane dopo l’infusione, ma
possono svilupparsi anche più tardi:
Molto comuni: possono interessare più di 1 persona su 10
- febbre alta e brividi. Questi possono essere sintomi di una grave condizione chiamata sindrome da rilascio di citochine che può essere pericolosa per la vita o fatale. Altri sintomi della sindrome da rilascio di citochine sono difficoltà respiratoria, nausea, vomito, diarrea, perdita di appetito, stanchezza, dolore muscolare, dolore articolare, gonfiore, pressione sanguigna bassa, battito cardiaco veloce, mal di testa, insufficienza cardiaca, polmonare e renale e danno al fegato. Questi sintomi si verificano quasi sempre entro i primi 14 giorni dopo il trattamento con Kymriah, ma in alcuni pazienti possono svilupparsi anche più tardi.
- problemi come alterazione del pensiero o diminuzione dello stato di coscienza, perdita di contatto con la realtà, confusione, agitazione, crisi convulsive, difficoltà a parlare e nel comprendere un discorso, difficoltà nel camminare. Questi possono essere sintomi di una condizione chiamata sindrome di neurotossicità associata a cellule effettrici immunitarie (ICANS). Questi sintomi si manifestano principalmente entro le prime 8 settimane dopo il trattamento con Kymriah, ma in alcuni pazienti possono svilupparsi anche più tardi.
- sensazione di calore, febbre, brividi o tremori, mal di gola o ulcerazioni della bocca possono essere segni di un’infezione. Alcune infezioni possono essere pericolose per la vita o fatali.
Comuni: possono interessare fino a 1 persona su 10
- Rapida rottura delle cellule tumorali con conseguente rilascio del loro contenuto nel flusso sanguigno. Ciò può interferire con il funzionamento di vari organi del corpo, in particolare reni, cuore e sistema nervoso (sindrome da lisi tumorale).
Altri possibil effetti indesiderati
Altri effetti indesiderati sono elencati di seguito. Se questi effetti indesiderati diventano intensi o gravi,
informi il medico immediatamente.
Molto comuni(possono interessare più di 1 persona su 10)
- Pelle pallida, debolezza, mancanza di respiro a causa di un basso numero di globuli rossi o di emoglobina bassa
- Eccessivi o prolungati sanguinamenti o lividi a causa di un basso numero di piastrine
- Febbre con una conta dei globuli bianchi pericolosamente bassa
- Aumento del rischio di infezione a causa di un anormale basso numero di globuli bianchi
- Infezioni frequenti e persistenti a causa di una riduzione degli anticorpi nel sangue
- Debolezza, ritmi cardiaci anormali, a causa di un anormale basso livello di sali nel sangue tra cui fosforo, potassio
- Alti livelli di enzimi del fegato o di creatinina nel sangue che mostrano che fegato e reni non funzionano normalmente
- Pressione del sangue aumentata
- Respiro corto, respiro affannoso, respirazione rapida
- Tosse
- Dolore addominale, stitichezza
- Dolore osseo e alla schiena
- Eruzione cutanea
- Caviglie, arti e viso gonfi
Comuni(possono interessare fino a 1 persona su 10)
- Febbre, malessere, ingrossamento del fegato, colore giallo della pelle e degli occhi, conta delle cellule del sangue bassa a causa di un’attivazione immunitaria grave
- Capogiro o svenimento, rossore, eruzione cutanea, prurito, febbre, respiro corto o vomito, dolore addominale, diarrea a causa di reazioni correlate all’infusione
- Eruzione cutanea, nausea, vomito, diarrea incluse feci con sangue (possibili sintomi della malattia del trapianto contro l’ospite che si verifica quando le cellule trapiantate attaccano le sue cellule)
- Dolore alle articolazioni a causa di alto livello di acido urico
- Risultati anormali degli esami del sangue (alti livelli di: fosforo, potassio, calcio e sodio, d- dimero della fibrina, ferritina sierica; bassi livelli di: una proteina del sangue chiamata albumina, sodio, magnesio)
- Convulsioni, crisi (crisi convulsive)
- Spasmi/crampi muscolari a causa di un anormale basso livello di sali nel sangue tra cui il calcio
- Movimenti involontari o incontrollabili
- Tremiti involontari del corpo, difficoltà a scrivere, difficoltà ad esprimere i pensieri verbalmente, alterazione dell’attenzione, sonnolenza
- Formicolio o intorpidimento, difficoltà a muoversi a causa di danno ai nervi
- Riduzione della visione
- Sete, scarsa produzione di urina, urine scure, pelle secca arrossata, irritabilità (possibili sintomi di un alto livello di zucchero nel sangue)
- Perdita di peso
- Dolore dei nervi
- Ansia, irritabilità
- Stato di confusione grave
- Difficoltà a dormire
- Mancanza di respiro, difficoltà a respirare quando si è sdraiati, gonfiore dei piedi o delle gambe (possibili sintomi di insufficienza cardiaca), battito cardiaco veloce o irregolare battito cardiaco arrestato
- Gonfiore e dolore a causa di coaguli di sangue
- Gonfiore a causa della fuoriuscita di fluidi dai vasi sanguigni nel tessuto circostante
- Gonfiore e disagio (distensione addominale), a causa di un accumulo di liquidi nell’addome
- Bocca secca, ulcerazioni della bocca, sanguinamento in bocca
- Pelle e occhi gialli a causa di livelli anormalmente elevati di bilirubina nel sangue
- Prurito
- Sudorazione eccessiva, sudorazioni notturne
- Malattia simil-influenzale
- Insufficienza multiorgano
- Liquido nei polmoni
- Naso chiuso
- Difetti nella coagulazione del sangue (coagulopatia, rapporto internazionale normalizzato aumentato, tempo di protrombina prolungato, fibrinogeno nel sangue diminuito, tempo di tromboplastina parziale attivata prolungato)
Non comuni(possono interessare fino a 1 persona su 100)
- Risultati anormali degli esami del sangue (alti livelli di magnesio)
- Debolezza o paralisi degli arti o del volto, difficoltà nel parlare (possibili sintomi di ictus come risultato di un ridotto afflusso di sangue)
- Pelle calda o che si arrossa rapidamente
- Tosse che presenta catarro o talvolta sangue, febbre, respiro corto o difficoltà respiratoria
- Difficoltà a controllare il movimento
Raro(può interessare fino a 1 persona su 1 000)
- Un nuovo tipo di cancro che ha origine in un tipo di globuli bianchi denominati cellule T (neoplasia secondaria maligna originata da cellule T)
Non noti(la frequenza non può essere definita sulla base dei dati disponibili)
- Difficoltà a respirare o capogiri (possibili sintomi di una reazione allergica)
- Debolezza o intorpidimento delle braccia o delle gambe, peggioramento o perdita della vista, pensieri fissi e irrazionali che non sono condivisi da altri, mal di testa, memoria o pensiero alterati, comportamento insolito
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Kymriah
Le seguenti informazioni sono destinate esclusivamente ai medici.
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta della sacca per
infusione dopo SCAD.
Conservare e trasportare a ≤ -120°C. Non scongelare il prodotto fino a quando non deve essere pronto
per l’uso.
Non usi questo medicinale se la sacca per infusione è danneggiata o perde.
6. Contenuto della confezione e altre informazioni
Cosa contiene Kymriah
- Il principio attivo è tisagenlecleucel. Ogni sacca per infusione di Kymriah contiene la dispersione cellulare di tisagenlecleucel ad una concentrazione lotto-dipendente di cellule T autologhe geneticamente modificate per esprimere un recettore chimerico per l’antigene anti- CD19 (cellule T vitali CAR-positive). 1 o più sacche contengono un totale di 1,2 × 10 - 6 × 10 di cellule T vitali CAR+.
- Gli altri componenti sono glucosio, sodio cloruro, soluzione di albumina umana, destrano 40 per preparazioni iniettabili, dimetilsolfossido, sodio gluconato, sodio acetato, potassio cloruro, magnesio cloruro, sodio N-acetiltriptofanato, sodio caprilato, alluminio, e acqua per preparazioni iniettabili. Vedere paragrafo 2, “Kymriah contiene sodio, dimetilsolfossido (DMSO), destrano 40 e potassio”.
Questo medicinale contiene cellule di origine umana.
Descrizione dell’aspetto di Kymriah e contenuto della confezione
Kymriah è una dispersione cellulare per infusione. Viene fornito in una sacca per infusione contenente
una dispersione di cellule da torbida a chiara, da incolore a leggermente gialla. Ogni sacca contiene da
10 mL a 50 mL di dispersione.
Titolare dell’autorizzazione all’immissione in commercio
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlanda
Produttore
Novartis Pharma GmbH
Roonstrasse 25
90429 Norimberga
Germania
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Norimberga
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentate locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Lietuva
SIA Novartis Baltics Lietuvos filialas
Tel: +370 5 269 16 50
България
Novartis Bulgaria EOOD
Тел: +359 2 489 98 28
Luxembourg/Luxemburg
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Česká republika
Novartis s.r.o.
Tel: +420 225 775 111
Magyarország
Novartis Hungária Kft.
Tel.: +36 1 457 65 00
Danmark
Novartis Healthcare A/S
Tlf.: +45 39 16 84 00
Malta
Novartis Pharma Services Inc.
Tel: +356 2122 2872
Deutschland
Novartis Pharma GmbH
Tel: +49 911 273 0
Nederland
Novartis Pharma B.V.
Tel: +31 88 04 52 111
Eesti
SIA Novartis Baltics Eesti filiaal
Tel: +372 66 30 810
Norge
Novartis Norge AS
Tlf: +47 23 05 20 00
Ελλάδα
Novartis (Hellas) A.E.B.E.
Τηλ: +30 210 281 17 12
Österreich
Novartis Pharma GmbH
Tel: +43 1 86 6570
España
Novartis Farmacéutica, S.A.
Tel: +34 93 306 42 00
Polska
Novartis Poland Sp. z o.o.
Tel.: +48 22 375 4888
France
Novartis Pharma S.A.S.
Tél: +33 1 55 47 66 00
Portugal
Novartis Farma - Produtos Farmacêuticos, S.A.
Tel: +351 21 000 8600
Hrvatska
Novartis Hrvatska d.o.o.
Tel. +385 1 6274 220
România
Novartis Pharma Services Romania SRL
Tel: +40 21 31299 01
Ireland
Novartis Ireland Limited
Tel: +353 1 260 12 55
Slovenija
Novartis Pharma Services Inc.
Tel: +386 1 300 75 50
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Novartis Slovakia s.r.o.
Tel: +421 2 5542 5439
Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Κύπρος
Novartis Pharma Services Inc.
Τηλ: +357 22 690 690
Sverige
Novartis Sverige AB
Tel: +46 8 732 32 00
Latvija
SIA Novartis Baltics
Tel: +371 67 887 070
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, https://www.ema.europa.eu/
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Precauzioni che devono essere prese prima della manipolazione o della somministrazione del
medicinale
Kymriah deve essere trasportato all’interno della struttura in contenitori chiusi, infrangibili ed
ermetici.
Questo medicinale contiene cellule ematiche umane. Gli operatori sanitari che manipolano Kymriah
devono prendere le opportune precauzioni (indossare guanti e occhiali protettivi) per evitare la
potenziale trasmissione di malattie infettive.
Preparazione prima della somministrazione
Prima della somministrazione, è necessario verificare che l’identità del paziente corrisponda alle
informazioni univoche sul paziente riportate sulle sacche per infusione di Kymriah e sulla
documentazione allegata. Verificare inoltre il numero totale di sacche per infusione da somministrare
rispetto alle informazioni specifiche per il paziente riportate sulla documentazione lotto-specifica
allegata al medicinale.
I tempi di scongelamento e infusione di Kymriah devono essere coordinati. Il tempo di inizio
dell’infusione deve essere confermato in anticipo e adeguato per lo scongelamento in modo tale che
Kymriah sia disponibile per l’infusione quando il paziente è pronto. Una volta scongelato e a
temperatura ambiente (20°C-25°C), Kymriah deve essere infuso entro 30 minuti per mantenere la
massima vitalità del prodotto, incluse eventuali interruzioni durante l’infusione.
Ispezione e scongelamento della/e sacca/sacche per infusione
Non scongelare il prodotto fino a quando non deve essere pronto per l’uso.
Durante lo scongelamento la sacca per infusione deve essere collocata all’interno di una seconda sacca
sterile al fine di proteggere gli accessi della sacca per infusione dalla contaminazione ed evitare
fuoriuscite nell’improbabile caso in cui la sacca perda. Kymriah deve essere scongelato a 37°C
utilizzando un bagno termostatico oppure un metodo di scongelamento a secco fino a quando non vi
sarà più ghiaccio visibile nella sacca per infusione. La sacca deve essere rimossa immediatamente dal
dispositivo di scongelamento e tenuta a temperatura ambiente (20°C-25°C) fino all’infusione. Se è
stata ricevuta più di una sacca per infusione per la dose di trattamento (fare riferimento al certificato
del lotto per il numero di sacche che costituiscono una dose), la sacca successiva deve essere
scongelata solo dopo aver infuso il contenuto della precedente sacca.
Kymriah non deve essere manipolato. Per esempio, Kymriah non deve essere lavato (centrifugato e
risospeso in una nuova soluzione) prima dell’infusione.
La/e sacca/sacche per infusione deve/devono essere esaminata/e per la presenza di eventuali rotture o
crepe prima dello scongelamento. Se la sacca per infusione sembra essere stata danneggiata o presenta
perdite, non deve essere usata per l’infusione e deve essere smaltita secondo le linee guida locali per la
gestione di rifiuti biologici.
Somministrazione
L’infusione endovenosa di Kymriah deve essere somministrata da un operatore sanitario che abbia
esperienza con i pazienti immunosoppressi e sia preparato a gestire l’anafilassi. In caso di sindrome da
rilascio di citochine (CRS), assicurarsi che per prima dell’infusione siano disponibili almeno una dose
di tocilizumab per paziente e le apparecchiature di emergenza. Gli ospedali devono avere accesso a
dosi aggiuntive di tocilizumab entro 8 ore. Nel caso eccezionale in cui tocilizumab non sia disponibile
a causa di una carenza elencata nel catalogo delle carenze dell’Agenzia europea per i medicinali,
assicurarsi che siano disponibili in loco misure alternative adeguate per il trattamento della sindrome
da rilascio di citochine.
L’identità del paziente deve corrispondere con gli identificativi del paziente riportati sulla sacca da
infusione. Kymriah è destinato esclusivamente all’uso autologo e non deve, in alcun caso, essere
somministrato ad altri pazienti.
Kymriah deve essere somministrato come infusione endovenosa utilizzando una linea di infusione
endovenosa senza lattice e senza filtro per leucodeplezione, a una velocità di flusso di circa 10-
20 mL/minuto per gravità. Tutto il contenuto di ogni sacca per infusione deve essere infuso. Deve
essere utilizzata una soluzione iniettabile di sodio cloruro 9 mg/mL (0,9%) per preparare la linea di
infusione prima dell’infusione e per lavare la stessa dopo l’infusione. Quando l’intero volume di
Kymriah è stato infuso, la sacca per infusione deve essere lavata con 10-30 mL di soluzione iniettabile
di sodio cloruro 9 mg/mL (0,9%) mediante retro-caricamento per assicurare che il maggior numero
possibile di cellule sia infuso nel paziente.
Se il volume di Kymriah da somministrare è ≤20 mL, si puo’ utilizzare l’infusione endovenosa veloce
in bolo come metodo alternativo di somministrazione.
Misure da adottare in caso di esposizione accidentale
In caso di esposizione accidentale, seguire le linee guida locali sulla manipolazione di materiale di
origine umana. Le superfici di lavoro e i materiali che sono stati potenzialmente a contatto con
Kymriah devono essere decontaminati con un disinfettante appropriato.
Precauzioni che devono essere prese per lo smaltimento del medicinale
Il medicinale non utilizzato e tutti i materiali che sono stati a contatto con Kymriah (rifiuti solidi e
liquidi) devono essere manipolati e smaltiti come rifiuti potenzialmente infettivi in conformità alle
linee guida locali sulla manipolazione di materiale di origine umana.
ALLEGATO IV
CONCLUSIONI SCIENTIFICHE E MOTIVAZIONI PER LA VARIAZIONE DEI TERMINI
DELLE AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) dei Rapporti periodici di aggiornamento
sulla sicurezza ( Periodic Safety Update Report, PSUR) per tisagenlecleucel, le conclusioni scientifiche
del PRAC sono le seguenti:
Alla luce dei dati disponibili su una maggiore frequenza della sindrome di neurotossicità associata a
cellule effettrici immunitarie (ICANS) provenienti dalla letteratura e da segnalazioni spontanee, e in
considerazione di un plausibile meccanismo d’azione, il PRAC considera una relazione causale tra
tisagenlecleucel e ICANS. Il PRAC ha concluso che le informazioni di prodotto dei prodotti
contenenti tisagenlecleucel devono essere di conseguenza modificate.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
( Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione.
Motivazioni per la variazione dei termini delle autorizzazioni all’immissione in commercio
Sulla base delle conclusioni scientifiche su tisagenlecleucel il CHMP ritiene che il rapporto
beneficio/rischio dei medicinali contenenti tisagenlecleucel sia invariato fatte salve le modifiche
proposte alle informazioni del prodotto.
Il CHMP raccomanda la variazione dei termini delle autorizzazioni all’immissione in commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a KYMRIAHForma farmaceutica: Dispersione per infusione, 260 - 500 X 10 ALLA SESTAPrincipio attivo: idecabtagene vicleucelProduttore: BRISTOL-MYERS SQUIBB PHARMA EEIGPrescrizione richiestaForma farmaceutica: Dispersione per infusione, 3,2 ? 10 alla sesta ?1,0 ? 10 alla ottavaPrincipio attivo: ciltacabtagene autoleucelProduttore: JANSSEN-CILAG INTERNATIONAL N.V.Prescrizione richiestaForma farmaceutica: Dispersione per preparazione iniettabile, 2,8 ? 10 alla settima ? 7,3 ? 10 alla settima cellule/mLPrincipio attivo: tabelecleucelProduttore: PIERRE FABRE MEDICAMENTPrescrizione non richiesta
Medici online per KYMRIAH
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di KYMRIAH — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





