
CLINIMIX

Come usare CLINIMIX
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- CLINIMIX N9G15E, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N9G20E, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N12G20, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N12G20E, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N14G30, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N14G30E, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N17G35, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
- CLINIMIX N17G35E, soluzione per infusione
- Che cos'è CLINIMIX e perchè viene somministrato
- Cosa deve sapere prima che CLINIMIX le sia somministrato
- Come viene somministrato CLINIMIX
- Possibili effetti indesiderati
- Come conservare CLINIMIX
- Contenuto della confezione ed altre informazioni
- COMPOSIZIONE QUANTITATIVA
- POSOLOGIA E MODO DI SOMMINISTRAZIONE
- AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
- INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
- PERIODO DI VALIDITÀ
Clinimix FI Apr 2021
CLINIMIX N9G15E, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perchè contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi con elettroliti mentre il secondo contiene una soluzione di glucosio con
calcio cloruro. I compartimenti sono separati da una membrana non permanente. Appena prima della
somministrazione, il contenuto dei due compartimenti viene miscelato arrotolando l’estremità superiore della
sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
- i livelli di sodio, potassio, magnesio, calcio e/o fosforo nel suo sangue sono troppo elevati (ipernatremia, iperkalemia, ipermagnesemia, ipercalcemia e/o iperfosfatemia).
- Nei bambini di età inferiore a 28 giorni, il ceftriaxone non deve essere co-somministrato con soluzioni ev contenenti calcio a causa del rischio di formazione di particelle.
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cuteanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Pagina 1 di 96
Clinimix FI Apr 2021
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
CLINIMIX con elettroliti contiene calcio. Non deve essere somministrato insieme all’antibiotico ceftriaxone per
il rischio di formazione di particelle.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
CLINIMIX con elettroliti contiene calcio. Non deve essere dato insieme all’antibiotico ceftriaxone a causa del
rischio di formazione di particelle.
A causa del suo contenuto di potassio, CLINIMIX deve essere somministrato con cautela in pazienti trattati con
diuretici risparmiatori di potassio (per es. amiloride, spironolattone, triamterene), con inibitori degli enzimi che
convertono l’angiotensina (ACE-inibitori), antagonisti del recettore dell’angiotensina II, o gli immunosoppressori
tacrolimo e ciclosporine in relazione al rischio di iperkaliemia.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Pagina 2 di 96
Clinimix FI Apr 2021
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico.Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Pagina 3 di 96
Clinimix FI Apr 2021
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili. Pagina 4 di 96
| Principi attivi | n 1 l | 1,5 l | 2 l |
| L-alanina L-arginina Glicina l L-istidina a L-isoleucina L-leucina t L-lisina I (come lisina cloridrata) L-metionina L-fenilalanina a L-prolina i L-serina L-treonina z L-triptofano L-tirosina n L-valina Sodio acetato, 3H O e 2 Potassio fosfato bibasico Sodio cloruro g Magnesio cloruro, 6H O 2 Glucosio anidro (come glucosio monoidrato) Calcio cloruro, 2H O 2 | a 5,70 g i 3,17 g 2,84 g 1,32 g 1,65 g 2,01 g 1,60 g (2,00 g) 1,10 g 1,54 g 1,87 g 1,38 g 1,16 g 0,50 g 0,11 g 1,60 g 2,16 g 2,61 g 1,12 g 0,51 g 75 g (83 g) 0,33 g | 8,54 g 4,75 g 4,25 g 1,98 g 2,48 g 3,02 g 2,39 g (2,99 g) 1,65 g 2,31 g 2,81 g 2,06 g 1,73 g 0,74 g 0,17 g 2,39 g 3,23 g 3,92 g 1,68 g 0,77 g 113 g (124 g) 0,50 g | 11,39 g 6,33 g 5,67 g 2,64 g 3,30 g 4,02 g 3,19 g (3,99 g) 2,20 g 3,08 g 3,74 g 2,75 g 2,31 g 0,99 g 0,22 g 3,19 g 4,31 g 5,22 g 2,24 g 1,02 g 150 g (165 g) 0,66 g |
Clinimix FI Apr 2021
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N9G15E, soluzione per infusione
In alcuni paesi è registrato con altre denominazioni come di seguito descritto:
Austria: Clinimix 3% G-E
---------------------------------------------------------------------------------------------------------------------------
Pagina 5 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
| 1 l | 1,5 l | c 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 4,6 28 75 | 6,8 41 113 | a 9,1 55 150 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 410 300 | m 615 450 | 820 600 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- (mmol) 4 | 35 30 2,5 2,3 50 40 15 | r 53 a 45 3,8 F 3,4 75 60 23 | 70 60 5,0 4,5 100 80 30 |
| pH Osmolarità (mOsm/l) | l 6 845 | ||
Pagina 6 di 96
Clinimix FI Apr 2021
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 3 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
In pazienti di età superore ai 28 giorni (adulti inclusi) il ceftriaxone non deve essere somministrato
simultaneamente a soluzioni endovenose contenenti calcio incluso CLINIMIX N9G15E attraverso la stessa linea
di infusione (es. attraverso un connettore ad Y).
Se si usa la stessa linea di infusione per la somministrazione sequenziale, la linea deve essere lavata
accuratamente con un liquido compatibile tra le infusioni.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
Pagina 7 di 96
Clinimix FI Apr 2021
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Pagina 8 di 96
Clinimix FI Apr 2021
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
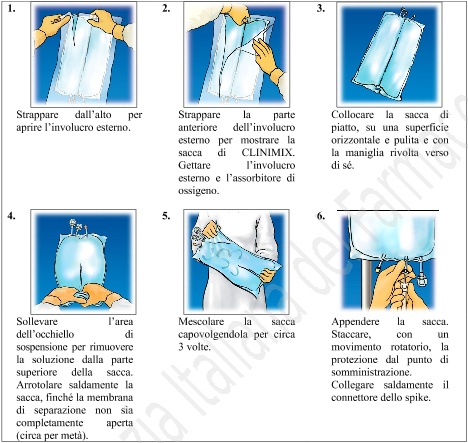
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.

Sollevare l’area
dell’occhiello di
sospensione per rimuovere
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
Pagina 9 di 96
Clinimix FI Apr 2021
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| l CLINIMIX N9G15E a 1 l + 100 ml di lipidi al 20% | CLINIMIX N9G15E 1,5 l + 100 ml di lipidi al 20% | CLINIMIX N9G15E 2 l + 250 ml di lipidi al 20% | |
| Azoto (g) Amminoacidi (g) Glucosio (g) Lipidi (g) | t 4,6 I 28 75 20 | 6,8 41 113 20 | 9,1 55 150 50 |
| Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | a 610 i 300 z 200 60/40 | 815 450 200 69/31 | 1320 600 500 55/45 |
| Sodio (mmol) Potassio (mmol) e Magnesio (mmol) g Calcio (mmol) Acetato (mmol) A Cloruri (mmol) Fosfati come HPO 2- 4 (mmol) | n 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5,0 4,5 100 80 30 |
| pH Osmolarità (mOsm/l) | 6 795 | 6 810 | 6 785 |
Pagina 10 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
CLINIMIX N9G15E contiene ioni calcio che aumentano il rischio della formazione di precipitati coagulati nel
sangue o componenti del sangue trattati con citrato come anticoagulante/conservante.
| Sodio | Potassio | Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | 5,6 mmol | o 3,0 mmol |
| Fino ad una concentrazione finale di | Rame | 10 mol | Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | Cobalto | m 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | r Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | 1750 U.I. | Biotina | 35g |
| Vitamina B6 | 2,27 mg | Vitamina B1 | 1,76 mg | |
| Vitamina D | 110 U.I. | l Acido folico | 207g | |
| Vitamina B12 | e 3,0 g | Vitamina B2 | 2,07 mg | |
| Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| Vitamina PP | d 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75g |
Pagina 11 di 96
Clinimix FI Apr 2021
Come per altre miscele per nutrizione parenterale, devono essere considerati i rapporti tra calcio e fosfato. Una
aggiunta eccessiva di calcio e fosfato, specialmente sotto forma di sali minerali, può portare alla formazione di
precipitati di fosfato di calcio.
Come per altre soluzioni per infusione contenenti calcio, il trattamento concomitante di ceftriaxone e CLINIMIX
N9G15E è controindicato nei neonati (≤28 giorni di età), anche in caso di infusione con linee separate (vi è il
rischio di precipitazione fatale del sale di calcio ceftriaxone nel flusso sanguigno del neonato).
In pazienti con età superiore ai 28 giorni (inclusi gli adulti) ceftriaxone non deve essere somministrato
simultaneamente per via endovenosa con soluzioni contenenti calcio, incluso CLINIMIX N9G15E tramite la
stessa linea di infusione (vedere il paragrafo “Avvertenze”)
Se viene utilizzata la stessa linea di infusione per somministrazioni susseguenti, la linea deve essere lavata
internamente con un fluido compatibile tra le infusioni.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N9G20E, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perchè contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione e altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi con elettroliti mentre il secondo contiene una soluzione di glucosio con
calcio cloruro. I compartimenti sono separati da una membrana non permanente. Appena prima della
Pagina 12 di 96
Clinimix FI Apr 2021
somministrazione, il contenuto dei due compartimenti viene miscelato arrotolando l’estremità superiore della
sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
- i livelli di sodio, potassio, magnesio, calcio e/o fosforo nel suo sangue sono troppo elevati (ipernatremia, iperkalemia, ipermagnesemia, ipercalcemia e/o iperfosfatemia).
- Nei bambini di età inferiore a 28 giorni, il ceftriaxone non deve essere co-somministrato con soluzioni ev contenenti calcio a causa del rischio di formazione di particelle.
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
CLINIMIX con elettroliti contiene calcio. Non deve essere somministrato insieme all’antibiotico ceftriaxone per
il rischio di formazione di particelle.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
Pagina 13 di 96
Clinimix FI Apr 2021
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
CLINIMIX con elettroliti contiene calcio. Non deve essere dato insieme all’antibiotico ceftriaxone a causa del
rischio di formazione di particelle.
A causa del suo contenuto di potassio, CLINIMIX deve essere somministrato con cautela in pazienti trattati con
diuretici risparmiatori di potassio (per es. amiloride, spironolattone, triamterene), con inibitori degli enzimi che
convertono l’angiotensina (ACE-inibitori), antagonisti del recettore dell’angiotensina II, o gli immunosoppressori
tacrolimo e ciclosporine in relazione al rischio di iperkaliemia.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Pagina 14 di 96
Clinimix FI Apr 2021
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Pagina 15 di 96
Clinimix FI Apr 2021
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili.
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Pagina 16 di 96
| Principi attivi | 1 l | 1,5 l | o 2 l |
| L-alanina L-arginina Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Sodio acetato, 3H O 2 Potassio fosfato bibasico Sodio cloruro Magnesio cloruro, 6H O 2 Glucosio anidro (come glucosio monoidrato) Calcio cloruro, 2H O 2 | 5,70 g 3,17 g 2,84 g 1,32 g 1,65 g 2,01 g 1,60 g (2,00 g) 1,10 g 1,54 g 1,87 g 1,38 g 1,16 g 0,50 g 0,11 g e 1,60 g 2,16 g d 2,61 g 1,12 g 0,51 g a 100 g (110 g) 0,33 g | 8,54 g 4,75 g 4,25 g 1,98 g m 2,48 g 3,02 g 2,39 g r (2,99 g) a 1,65 g 2,31 g F 2,81 g 2,06 g 1,73 g 0,74 g l 0,17 g 2,39 g 3,23 g 3,92 g 1,68 g 0,77 g 150 g (165 g) 0,50 g | c 11,39 g 6,33 g a 5,67 g 2,64 g 3,30 g 4,02 g 3,19 g (3,99 g) 2,20 g 3,08 g 3,74 g 2,75 g 2,31 g 0,99 g 0,22 g 3,19 g 4,31 g 5,22 g 2,24 g 1,02 g 200 g (220 g) 0,66 g |
Clinimix FI Apr 2021
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N9G20E, soluzione per infusione
---------------------------------------------------------------------------------------------------------------------------
Pagina 17 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
.
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età.
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Pagina 18 di 96
| 1 l | 1,5 l | 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 4,6 28 100 | 6,8 m 41 150 | a 9,1 55 200 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 510 400 | 765 600 | 1020 800 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- (mmol) 4 | 35 30 2,5 2,3 50 40 15 | r a 53 45 F 3,8 3,4 75 60 l 23 | 70 60 5,0 4,5 100 80 30 |
| pH Osmolarità (mOsm/l) | e 6 980 | ||
Clinimix FI Apr 2021
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 2,5 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
In pazienti di età superore ai 28 giorni (adulti inclusi) il ceftriaxone non deve essere somministrato
simultaneamente a soluzioni endovenose contenenti calcio incluso CLINIMIX N9G20E attraverso la stessa linea
di infusione (es. attraverso un connettore ad Y).
Se si usa la stessa linea di infusione per la somministrazione sequenziale, la linea deve essere lavata
accuratamente con un liquido compatibile tra le infusioni.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
Pagina 19 di 96
Clinimix FI Apr 2021
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Pagina 20 di 96
Clinimix FI Apr 2021
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici. L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
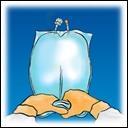

Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
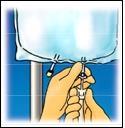
Staccare, con un
movimento rotatorio, la
protezione dal punto di
Pagina 21 di 96
Clinimix FI Apr 2021
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| l CLINIMIX N9G20E a 1 l + 100 ml di lipidi al 20% | CLINIMIX N9G20E 1,5 l + 250 ml di lipidi al 20% | CLINIMIX N9G20E 2 l + 250 ml di lipidi al 20% | |
| Azoto (g) Amminoacidi (g) Glucosio (g) Lipidi (g) | t 4,6 I 28 100 20 | 6,8 41 150 50 | 9,1 55 200 50 |
| Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | a 710 i 400 z 200 67/33 | 1265 600 500 55/45 | 1520 800 500 62/38 |
| Sodio (mmol) Potassio (mmol) e Magnesio (mmol) g Calcio (mmol) Acetato (mmol) A Cloruri (mmol) Fosfati come HPO 2- 4 (mmol) | n 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5,0 4,5 100 80 30 |
| pH Osmolarità (mOsm/l) | 6 915 | 6 880 | 6 900 |
Pagina 22 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
CLINIMIX N9G15E contiene ioni calcio che aumentano il rischio della formazione di precipitati coagulati nel
sangue o componenti del sangue trattati con citrato come anticoagulante/conservante.
Pagina 23 di 96
| Sodio | Potassio | Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | 5,6 mmol | o 3,0 mmol |
| Fino ad una concentrazione finale di | Rame | 10 mol | Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | Cobalto | m 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | r Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | 1750 U.I. | Biotina | 35g |
| Vitamina B6 | 2,27 mg | l Vitamina B1 | 1,76 mg | |
| Vitamina D | e 110 U.I. | Acido folico | 207g | |
| Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| Vitamina E | d 5,1 mg | Vitamina C | 63 mg | |
| Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75g |
Clinimix FI Apr 2021
Come per altre miscele per nutrizione parenterale, devono essere considerati i rapporti tra calcio e fosfato. Una
aggiunta eccessiva di calcio e fosfato, specialmente sotto forma di sali minerali, può portare alla formazione di
precipitati di fosfato di calcio.
Come per altre soluzioni per infusione contenenti calcio, il trattamento concomitante di ceftriaxone e CLINIMIX
N9G20E è controindicato nei neonati (≤28 giorni di età), anche in caso di infusione con linee separate (vi è il
rischio di precipitazione fatale del sale di calcio ceftriaxone nel flusso sanguigno del neonato).
In pazienti con età superiore ai 28 giorni (inclusi gli adulti) ceftriaxone non deve essere somministrato
simultaneamente per via endovenosa con soluzioni contenenti calcio, incluso CLINIMIX N9G20E tramite la
stessa linea di infusione (vedere il paragrafo “Avvertenze”).
Se viene utilizzata la stessa linea di infusione per somministrazioni susseguenti, la linea deve essere lavata
internamente con un fluido compatibile tra le infusioni.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N12G20, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi mentre il secondo contiene una soluzione di glucosio. I compartimenti
sono separati da una membrana non permanente. Appena prima della somministrazione, il contenuto dei due
compartimenti viene miscelato arrotolando l’estremità superiore della sacca per attivare le membrane.
Pagina 24 di 96
Clinimix FI Apr 2021
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Pagina 25 di 96
Clinimix FI Apr 2021
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Pagina 26 di 96
Clinimix FI Apr 2021
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Pagina 27 di 96
| Principi attivi | 1 l | 1,5 l | 2 l |
| L-alanina L-arginina | 7,25 g 4,03 g | 10,87 g 6,04 g | 14,49 g 8,05 g |
Clinimix FI Apr 2021
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili.
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A.,, Boulevard René Branquart, 80, 7860 Lessines, Belgium
| Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Glucosio anidro (come glucosio monoidrato) | 3,61 g 1,68 g 2,10 g 2,56 g 2,03 g (2,54 g) 1,40 g 1,96 g 2,38 g 1,75 g 1,47 g 0,63 g 0,14 g 2,03 g 100 g (110 g) | 5,41 g 2,52 g 3,15 g 3,83 g 3,05 g (3,80 g) 2,10 g 2,94 g 3,57 g m 2,63 g 2,21 g 0,95 g r 0,21 g 3,05 g a 150 g (165 g) | 7,21 g 3,36 g 4,20 g o 5,11 g 4,06 g c (5,07 g) 2,80 g a 3,92 g 4,76 g 3,50 g 2,94 g 1,26 g 0,28 g 4,06 g 200 g (220 g) |
Pagina 28 di 96
Clinimix FI Apr 2021
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N12G20, soluzione per infusione
---------------------------------------------------------------------------------------------------------------------------
Pagina 29 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 2,5 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Pagina 30 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 5,8 35 100 | m 8,7 53 150 | 11,6 70 200 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 540 400 | r 810 600 | 1080 800 |
| Acetato (mmol) Cloruri (mmol) | 27 15 | a 41 22 | 54 29 |
| pH Osmolarità (mOsm/l) | F 6 920 | ||
Clinimix FI Apr 2021
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
Pagina 31 di 96
Clinimix FI Apr 2021
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Pagina 32 di 96
Clinimix FI Apr 2021
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.

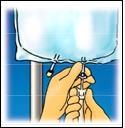
Sollevare l’area
dell’occhiello di
sospensione per rimuovere
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
Pagina 33 di 96
Clinimix FI Apr 2021
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
- Elettroliti: per litro di CLINIMIX
| a CLINIMIX N12G20 1 l + 100 ml di lipidi t al 20% | CLINIMIX N12G20 1,5 l + 250 ml di lipidi al 20% | CLINIMIX N12G20 2 l + 250 ml di lipidi al 20% | |
| Azoto (g) Amminoacidi (g) Glucosio (g) Lipidi (g) | I 5,8 35 a 100 20 | 8,7 53 150 50 | 11,6 70 200 50 |
| Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | i 740 z 400 200 67/33 | 1310 600 500 55/45 | 1580 800 500 62/38 |
| n Acetato (mmol) e Cloruri (mmol) | 27 15 | 41 22 | 54 29 |
| g pH Osmolarità (mOsm/l) | 6 860 | 6 830 | 6 850 |
| Sodio | Potassio | Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
Pagina 34 di 96
Clinimix FI Apr 2021
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
5. PERIODO DI VALIDITÀ
Pagina 35 di 96
| Fino ad una concentrazione finale di | Rame | 10 mol | Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | o 2,5 mol | |
| Fluoro | 38 mol | Cobalto | c 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | a 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | 1750 U.I. | Biotina | 35g |
| Vitamina B6 | 2,27 mg | l Vitamina B1 | 1,76 mg | |
| Vitamina D | 110 U.I. | Acido folico | 207g | |
| Vitamina B12 | e 3,0 g | Vitamina B2 | 2,07 mg | |
| Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| Vitamina PP | d 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75g |
Clinimix FI Apr 2021
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N12G20E, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi con elettroliti mentre il secondo contiene una soluzione di glucosio con
calcio cloruro. I compartimenti sono separati da una membrana non permanente. Appena prima della
somministrazione, il contenuto dei due compartimenti viene miscelato arrotolando l’estremità superiore della
sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave). Pagina 36 di 96
Clinimix FI Apr 2021
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
- i livelli di sodio, potassio, magnesio, calcio e/o fosforo nel suo sangue sono troppo elevati (ipernatremia, iperkalemia, ipermagnesemia, ipercalcemia e/o iperfosfatemia).
- Nei bambini di età inferiore a 28 giorni, il ceftriaxone non deve essere co-somministrato con soluzioni ev contenenti calcio a causa del rischio di formazione di particelle.
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
CLINIMIX con elettroliti contiene calcio. Non deve essere somministrato insieme all’antibiotico ceftriaxone per
il rischio di formazione di particelle.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
CLINIMIX con elettroliti contiene calcio. Non deve essere dato insieme all’antibiotico ceftriaxone a causa del
rischio di formazione di particelle.
A causa del suo contenuto di potassio, CLINIMIX deve essere somministrato con cautela in pazienti trattati con
diuretici risparmiatori di potassio (per es. amiloride, spironolattone, triamterene), con inibitori degli enzimi che
convertono l’angiotensina (ACE-inibitori), antagonisti del recettore dell’angiotensina II, o gli immunosoppressori
tacrolimo e ciclosporine in relazione al rischio di iperkaliemia.
Pagina 37 di 96
Clinimix FI Apr 2021
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
Pagina 38 di 96
Clinimix FI Apr 2021
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Pagina 39 di 96
| e Principi attivi | 1 l | 1,5 l | 2 l |
| g L-alanina L-arginina A Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) | 7,25 g 4,03 g 3,61 g 1,68 g 2,10 g 2,56 g 2,03 g (2,54 g) | 10,87 g 6,04 g 5,41 g 2,52 g 3,15 g 3,83 g 3,05 g (3,80 g) | 14,49 g 8,05 g 7,21 g 3,36 g 4,20 g 5,11 g 4,06 g (5,07 g) |
Clinimix FI Apr 2021
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili. Descrizione dell’aspetto di CLINIMIX e contenuto della confezioneCLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA (poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
Pagina 40 di 96
| L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Sodio acetato, 3H O 2 Potassio fosfato bibasico Sodio cloruro Magnesio cloruro, 6H O 2 Glucosio anidro (come glucosio monoidrato) Calcio cloruro, 2H O 2 | 1,40 g 1,96 g 2,38 g 1,75 g 1,47 g 0,63 g 0,14 g 2,03 g 2,58 g 2,61 g 0,94 g 0,52 g 100 g (110 g) 0,33 g | 2,10 g 2,94 g 3,57 g 2,63 g 2,21 g 0,95 g 0,21 g 3,05 g 3,86 g m 3,92 g 1,41 g 0,77 g r 150 g (165 g) 0,50 g | 2,80 g 3,92 g 4,76 g o 3,50 g 2,94 g c 1,26 g 0,28 g a 4,06 g 5,15 g 5,22 g 1,88 g 1,02 g 200 g (220 g) 0,66 g |
Clinimix FI Apr 2021
CLINIMIX N12G20E, soluzione per infusione
In alcuni paesi è registrato con altre denominazioni come di seguito descritto:
Germania: CLINIMIX 3,5% G-E
---------------------------------------------------------------------------------------------------------------------------
Pagina 41 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
l dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età.
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.Il fabbisogno calorico varia da 25 kcal/kg/die a 40 kcal/kg/die, a
seconda dello stato nutrizionale del paziente e del grado di catabolismo.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
Pagina 42 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 5,8 35 100 | m 8,7 53 150 | 11,6 70 200 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 540 400 | r 810 600 | 1080 800 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- (mmol) 4 | 35 30 2,5 2,3 60 40 15 | a 53 F 45 3,8 3,4 90 l 60 23 | 70 60 5,0 4,5 120 80 30 |
| pH Osmolarità (mOsm/l) | e 6 1060 | ||
Clinimix FI Apr 2021
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 2,5 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
In pazienti di età superore ai 28 giorni (adulti inclusi) il ceftriaxone non deve essere somministrato
simultaneamente a soluzioni endovenose contenenti calcio incluso CLINIMIX N12G20E attraverso la stessa
linea di infusione (es. attraverso un connettore ad Y).
Se si usa la stessa linea di infusione per la somministrazione sequenziale, la linea deve essere lavata
accuratamente con un liquido compatibile tra le infusioni.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
Pagina 43 di 96
Clinimix FI Apr 2021
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
Pagina 44 di 96
Clinimix FI Apr 2021
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
Pagina 45 di 96
Clinimix FI Apr 2021

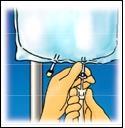
Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| e | CLINIMIX N12G20E 1 l + 100 ml di lipidi al 20% | CLINIMIX N12G20E 1,5 l + 250 ml di lipidi al 20% | CLINIMIX N12G20E 2 l + 250 ml di lipidi al 20% |
| g Azoto (g) A Amminoacidi (g) Glucosio (g) Lipidi (g) | 5,8 35 100 20 | 8,7 53 150 50 | 11,6 70 200 50 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 740 400 | 1310 600 | 1580 800 |
Pagina 46 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
| Calorie da lipidi (kcal) Rapporto glucosio/lipidi | 200 67/33 | 500 55/45 | 500 62/38 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- 4 (mmol) | 35 30 2,5 2,3 60 30 15 | 53 45 3,8 3,4 90 60 23 | o 70 60 c 5,0 4,5 a 120 80 m 30 |
| pH Osmolarità (mOsm/l) | 6 990 | 6 950 | 6 975 |
| Sodio | Potassio | F Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo). Pagina 47 di 96
| Fino ad una concentrazione finale di | Rame | d 10 mol | Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | Cobalto | 0,0125 mol | |
| Selenio | a 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | a 1750 U.I. | Biotina | 35g |
| i Vitamina B6 | 2,27 mg | Vitamina B1 | 1,76 mg | |
| l Vitamina D | 110 U.I. | Acido folico | 207g | |
| Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| a Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| t Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| I Vitamina K | 75g |
Clinimix FI Apr 2021
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
CLINIMIX N12G20E contiene ioni calcio che aumentano il rischio della formazione di precipitati coagulati nel
sangue o componenti del sangue trattati con citrato come anticoagulante/conservante.
Come per altre miscele per nutrizione parenterale, devono essere considerati i rapporti tra calcio e fosfato. Una
aggiunta eccessiva di calcio e fosfato, specialmente sotto forma di sali minerali, può portare alla formazione di
precipitati di fosfato di calcio.
Come per altre soluzioni per infusione contenenti calcio, il trattamento concomitante di ceftriaxone e CLINIMIX
N12G20E è controindicato nei neonati (≤28 giorni di età), anche in caso di infusione con linee separate (vi è il
rischio di precipitazione fatale del sale di calcio ceftriaxone nel flusso sanguigno del neonato).
In pazienti con età superiore ai 28 giorni (inclusi gli adulti) ceftriaxone non deve essere somministrato
simultaneamente per via endovenosa con soluzioni contenenti calcio, incluso CLINIMIX N12G20E tramite la
stessa linea di infusione (vedere il paragrafo “Avvertenze”).
Se viene utilizzata la stessa linea di infusione per somministrazioni susseguenti, la linea deve essere lavata
internamente con un fluido compatibile tra le infusioni.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N14G30, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato Pagina 48 di 96
Clinimix FI Apr 2021
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi mentre il secondo contiene una soluzione di glucosio. I compartimenti
sono separati da una membrana non permanente. Appena prima della somministrazione, il contenuto dei due
compartimenti viene miscelato arrotolando l’estremità superiore della sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Pagina 49 di 96
Clinimix FI Apr 2021
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico.Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
Pagina 50 di 96
Clinimix FI Apr 2021
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Pagina 51 di 96
Clinimix FI Apr 2021
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
| Principi attivi | 1 l | 1,5 l | 2 l |
| L-alanina L-arginina Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Glucosio anidro (come glucosio monoidrato) | 8,80 g 4,89 g 4,38 g 2,04 g 2,55 g 3,11 g 2,47 g (3,08 g) e 1,70 g 2,38 g d 2,89 g 2,13 g 1,79 g a 0,77 g 0,17 g n 2,47 g 150 g (165 g) | r 13,20 g a 7,34 g 6,57 g F 3,06 g 3,83 g 4,66 g 3,70 g l (4,62 g) 2,55 g 3,57 g 4,34 g 3,19 g 2,68g 1,15 g 0,26 g 3,70 g 225 g (248 g) | 17,60 g 9,78 g 8,76 g 4,08 g 5,10 g 6,21 g 4,93 g (6,16 g) 3,40 g 4,76 g 5,78 g 4,25 g 3,57 g 1,53 g 0,34 g 4,93 g 300 g (330 g) |
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili.
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Pagina 52 di 96
Clinimix FI Apr 2021
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89
00142 ROMA
Produttori
Baxter S.A. , Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N14G30, soluzione per infusione
---------------------------------------------------------------------------------------------------------------------------
Pagina 53 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.Il fabbisogno calorico varia da 25 kcal/kg/die a 40 kcal/kg/die, a
seconda dello stato nutrizionale del paziente e del grado di catabolismo.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Pagina 54 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 7,0 43 150 | m 10,5 64 225 | 14,0 85 300 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 770 600 | r 1155 900 | 1540 1200 |
| Acetato (mmol) Cloruri (mmol) | 34 17 | a 51 26 | 68 34 |
| pH Osmolarità (mOsm/l) | F 6 1270 | ||
Clinimix FI Apr 2021
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 1,7 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
Pagina 55 di 96
Clinimix FI Apr 2021
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
Pagina 56 di 96
Clinimix FI Apr 2021
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
Pagina 57 di 96
Clinimix FI Apr 2021
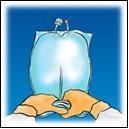

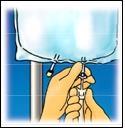
Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| n CLINIMIX N14G30 1 l + 250 ml di lipidi al 20% | CLINIMIX N14G30 1,5 l + 250 ml di lipidi al 20% | CLINIMIX N14G30 2 l + 500 ml di lipidi al 20% | |
| e Azoto (g) g Amminoacidi (g) Glucosio (g) Lipidi (g) | 7,0 43 150 50 | 10,5 64 225 50 | 14,0 85 300 100 |
| A Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | 1270 600 500 55/45 | 1655 900 500 64/36 | 2540 1200 1000 55/45 |
Pagina 58 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Incompatibilità
Pagina 59 di 96
| Acetato (mmol) Cloruri (mmol) | 34 17 | 51 26 | 68 34 |
| pH Osmolarità (mOsm/l) | 6 1075 | 6 1130 | o 6 1075 |
| Sodio | Potassio | Magnesio | a Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | m 5,6 mmol | 3,0 mmol |
| Fino ad una concentrazione finale di | Rame | 10 mol | a Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | F Cobalto | 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | n 1750 U.I. | Biotina | 35g |
| Vitamina B6 | a 2,27 mg | Vitamina B1 | 1,76 mg | |
| Vitamina D | 110 U.I. | Acido folico | 207g | |
| i Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| l Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| a Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75g |
Clinimix FI Apr 2021
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N14G30E, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi con elettroliti mentre il secondo contiene una soluzione di glucosio con
calcio cloruro. I compartimenti sono separati da una membrana non permanente. Appena prima della
somministrazione, il contenuto dei due compartimenti viene miscelato arrotolando l’estremità superiore della
sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
Pagina 60 di 96
Clinimix FI Apr 2021
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
- i livelli di sodio, potassio, magnesio, calcio e/o fosforo nel suo sangue sono troppo elevati (ipernatremia, iperkalemia, ipermagnesemia, ipercalcemia e/o iperfosfatemia).
- Nei bambini di età inferiore a 28 giorni, il ceftriaxone non deve essere co-somministrato con soluzioni ev contenenti calcio a causa del rischio di formazione di particelle.
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
CLINIMIX con elettroliti contiene calcio. Non deve essere somministrato insieme all’antibiotico ceftriaxone per
il rischio di formazione di particelle.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Pagina 61 di 96
Clinimix FI Apr 2021
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
CLINIMIX con elettroliti contiene calcio. Non deve essere dato insieme all’antibiotico ceftriaxone a causa del
rischio di formazione di particelle.
A causa del suo contenuto di potassio, CLINIMIX deve essere somministrato con cautela in pazienti trattati con
diuretici risparmiatori di potassio (per es. amiloride, spironolattone, triamterene), con inibitori degli enzimi che
convertono l’angiotensina (ACE-inibitori), antagonisti del recettore dell’angiotensina II, o gli immunosoppressori
tacrolimo e ciclosporine in relazione al rischio di iperkaliemia.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Pagina 62 di 96
Clinimix FI Apr 2021
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
Pagina 63 di 96
Clinimix FI Apr 2021
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili.
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
Pagina 64 di 96
| Principi attivi | 1 l | 1,5 l | 2 l |
| L-alanina L-arginina Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Sodio acetato 3H O 2 Potassio fosfato bibasico Sodio cloruro Magnesio cloruro 6H O 2 Glucosio anidro (come glucosio monoidrato) Calcio cloruro 2H O 2 | 8,80 g 4,89 g 4,38 g 2,04 g 2,55 g 3,11 g 2,47 g (3,08 g) 1,70 g 2,38 g 2,89 g 2,13 g 1,79 g 0,77 g 0,17 g 2,47 g 2,97 g e 2,61 g 0,77 g d 0,51 g 150 g (165 g) 0,33 g | 13,20 g 7,34 g 6,57 g 3,06 g 3,83 g 4,66 g m 3,70 g (4,62 g) 2,55 g r 3,57 g a 4,34 g 3,19 g F 2,68g 1,15 g 0,26 g 3,70 g l 4,46 g 3,92 g 1,16 g 0,77 g 225 g (248 g) 0,50 g | o 17,60 g 9,78 g c 8,76 g 4,08 g a 5,10 g 6,21 g 4,93 g (6,16 g) 3,40 g 4,76 g 5,78 g 4,25 g 3,57 g 1,53 g 0,34 g 4,93 g 5,94 g 5,22 g 1,54 g 1,02 g 300 g (330g) 0,66 g |
Clinimix FI Apr 2021
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N14G30E, soluzione per infusione
In alcuni paesi è registrato con altre denominazioni come di seguito descritto:
Germania: CLINIMIX 4,5% G-E
---------------------------------------------------------------------------------------------------------------------------
Pagina 65 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.Il fabbisogno calorico varia da 25 kcal/kg/die a 40 kcal/kg/die, a
seconda dello stato nutrizionale del paziente e del grado di catabolismo.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
Pagina 66 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 7,0 43 150 | m 10,5 64 225 | 14,0 85 300 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 770 600 | r 1155 900 | 1540 1200 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- (mmol) 4 | 35 30 2,5 2,3 70 40 15 | a 53 F 45 3,8 3,4 105 l 60 23 | 70 60 5,0 4,5 140 80 30 |
| pH Osmolarità (mOsm/l) | e 6 1415 | ||
Clinimix FI Apr 2021
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 1,7 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 40 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
In pazienti di età superore ai 28 giorni (adulti inclusi) il ceftriaxone non deve essere somministrato
simultaneamente a soluzioni endovenose contenenti calcio incluso CLINIMIX N14G30E attraverso la stessa
linea di infusione (es. attraverso un connettore ad Y).
Se si usa la stessa linea di infusione per la somministrazione sequenziale, la linea deve essere lavata
accuratamente con un liquido compatibile tra le infusioni.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
Pagina 67 di 96
Clinimix FI Apr 2021
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
Pagina 68 di 96
Clinimix FI Apr 2021
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
Pagina 69 di 96
Clinimix FI Apr 2021

Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| e | CLINIMIX N14G30E 1 l + 250 ml di lipidi al 20% | CLINIMIX N14G30E 1,5 l + 250 ml di lipidi al 20% | CLINIMIX N14G30E 2 l + 500 ml di lipidi al 20% |
| g Azoto (g) A Amminoacidi (g) Glucosio (g) Lipidi (g) | 7,0 43 150 50 | 10,5 64 225 50 | 14,0 85 300 100 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 1270 600 | 1655 900 | 2540 1200 |
Pagina 70 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
| Calorie da lipidi (kcal) Rapporto glucosio/lipidi | 500 55/45 | 500 64/36 | 1000 55/45 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- 4 (mmol) | 35 30 2,5 2,3 70 40 15 | 53 45 3,8 3,4 105 60 23 | o 70 60 c 5,0 4,5 a 140 80 m 30 |
| pH Osmolarità (mOsm/l) | 6 1190 | 6 1255 | 6 1190 |
| Sodio | Potassio | F Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo). Pagina 71 di 96
| Fino ad una concentrazione finale di | Rame | d 10 mol | Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | Cobalto | 0,0125 mol | |
| Selenio | a 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | a 1750 U.I. | Biotina | 35g |
| i Vitamina B6 | 2,27 mg | Vitamina B1 | 1,76 mg | |
| l Vitamina D | 110 U.I. | Acido folico | 207g | |
| Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| a Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| t Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| I Vitamina K | 75g |
Clinimix FI Apr 2021
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
CLINIMIX N14G30E contiene ioni calcio che aumentano il rischio della formazione di precipitati coagulati nel
sangue o componenti del sangue trattati con citrato come anticoagulante/conservante.
Come per altre miscele per nutrizione parenterale, devono essere considerati i rapporti tra calcio e fosfato. Una
aggiunta eccessiva di calcio e fosfato, specialmente sotto forma di sali minerali, può portare alla formazione di
precipitati di fosfato di calcio.
Come per altre soluzioni per infusione contenenti calcio, il trattamento concomitante di ceftriaxone e CLINIMIX
N14G30E è controindicato nei neonati (≤28 giorni di età), anche in caso di infusione con linee separate (vi è il
rischio di precipitazione fatale del sale di calcio ceftriaxone nel flusso sanguigno del neonato).
In pazienti con età superiore ai 28 giorni (inclusi gli adulti) ceftriaxone non deve essere somministrato
simultaneamente per via endovenosa con soluzioni contenenti calcio, incluso CLINIMIX N14G30E tramite la
stessa linea di infusione (vedere il paragrafo “Avvertenze”).
Se viene utilizzata la stessa linea di infusione per somministrazioni susseguenti, la linea deve essere lavata
internamente con un fluido compatibile tra le infusioni.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N17G35, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato Pagina 72 di 96
Clinimix FI Apr 2021
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi mentre il secondo contiene una soluzione di glucosio. I compartimenti
sono separati da una membrana non permanente. Appena prima della somministrazione, il contenuto dei due
compartimenti viene miscelato arrotolando l’estremità superiore della sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Pagina 73 di 96
Clinimix FI Apr 2021
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico.Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
Pagina 74 di 96
Clinimix FI Apr 2021
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Pagina 75 di 96
Clinimix FI Apr 2021
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
| Principi attivi | 1 l | 1,5 l | 2 l |
| L-alanina L-arginina Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Glucosio anidro (come glucosio monoidrato) | 10,35 g 5,75 g 5,15 g 2,40 g 3,00 g 3,65 g 2,90 g (3,63 g) e 2,00 g 2,80 g d 3,40g 2,50 g 2,10 g a 0,90 g 0,20 g n 2,90 g 175 g (193 g) | r 15,53 g a 8,63 g 7,73 g F 3,60 g 4,50 g 5,48 g 4,35 g l (5,44 g) 3,00 g 4,20 g 5,10 g 3,75 g 3,15 g 1,35 g 0,30 g 4,35 g 263 g (289 g) | 20,70 g 11,50 g 10,30 g 4,80 g 6,00 g 7,30 g 5,80 g (7,25 g) 4,00 g 5,60 g 6,80 g 5,00 g 4,20 g 1,80 g 0,40 g 5,80 g 350 g (385 g) |
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili.
Descrizione dell’aspetto di CLINIMIX e contenuto della confezione
CLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in
plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di
copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA
(poli (etilene-vinil acetato) e in un copoliestere.
Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle.
Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla.
Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera
all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Pagina 76 di 96
Clinimix FI Apr 2021
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A.,, Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N17G35, soluzione per infusione
---------------------------------------------------------------------------------------------------------------------------
Pagina 77 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.Il fabbisogno calorico varia da 25 kcal/kg/die a 40 kcal/kg/die, a
seconda dello stato nutrizionale del paziente e del grado di catabolismo.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Pagina 78 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 8,3 50 175 | m 12,4 75 263 | 16,5 100 350 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 900 700 | r 1350 1050 | 1800 1400 |
| Acetato (mmol) Cloruri (mmol) | 43 20 | a 65 30 | 86 40 |
| pH Osmolarità (mOsm/l) | F 6 1490 | ||
Clinimix FI Apr 2021
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 1,4 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 30 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
Pagina 79 di 96
Clinimix FI Apr 2021
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
Pagina 80 di 96
Clinimix FI Apr 2021
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
Pagina 81 di 96
Clinimix FI Apr 2021

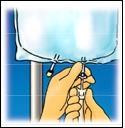
Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| n CLINIMIX N17G35 1 l + 250 ml di lipidi al 20% | CLINIMIX N17G35 1,5 l + 500 ml di lipidi al 20% | CLINIMIX N17G35 2 l + 500 ml di lipidi al 20% | |
| e Azoto (g) g Amminoacidi (g) Glucosio (g) Lipidi (g) | 8,3 50 175 50 | 12,4 75 263 100 | 16,5 100 350 100 |
| A Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | 1400 700 500 58/42 | 2350 1050 1000 51/49 | 2800 1400 1000 58/42 |
Pagina 82 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Incompatibilità
Pagina 83 di 96
| Acetato (mmol) Cloruri (mmol) | 43 20 | 65 30 | 86 40 |
| pH Osmolarità (mOsm/l) | 6 1255 | 6 1195 | o 6 1255 |
| Sodio | Potassio | Magnesio | a Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | m 5,6 mmol | 3,0 mmol |
| Fino ad una concentrazione finale di | Rame | 10 mol | a Zinco | 77 mol |
| Cromo | 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | 38 mol | F Cobalto | 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | n 1750 U.I. | Biotina | 35g |
| Vitamina B6 | a 2,27 mg | Vitamina B1 | 1,76 mg | |
| Vitamina D | 110 U.I. | Acido folico | 207g | |
| i Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| l Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| a Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75g |
Clinimix FI Apr 2021
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
CLINIMIX N17G35E, soluzione per infusione
Legga attentamente questo foglio prima che le sia somministrato questo medicinale, perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Che cos’è CLINIMIX e perchè viene somministrato
- 2. Cosa deve sapere prima che CLINIMIX le sia somministrato
- 3. Come viene somministrato CLINIMIX
- 4. Possibili effetti indesiderati
- 5. Come conservare CLINIMIX
- 6. Contenuto della confezione ed altre informazioni
1. Che cos'è CLINIMIX e perchè viene somministrato
CLINIMIX è una soluzione per infusione. E’ confezionata in una sacca a due compartimenti. Un compartimento
contiene una soluzione di amminoacidi con elettroliti mentre il secondo contiene una soluzione di glucosio con
calcio cloruro. I compartimenti sono separati da una membrana non permanente. Appena prima della
somministrazione, il contenuto dei due compartimenti viene miscelato arrotolando l’estremità superiore della
sacca per attivare le membrane.
CLINIMIX viene somministrato per fornire nutrimento in adulti e bambini mediante un tubo in una vena, quando
non sia idonea la normale alimentazione per bocca.
Pagina 84 di 96
Clinimix FI Apr 2021
CLINIMIX deve essere somministrato esclusivamente sotto controllo medico.
2. Cosa deve sapere prima che CLINIMIX le sia somministrato
CLINIMIX non deve essere somministrato se:
- è allergico ad uno qualsiasi dei componenti di questo medicinale (elencati al paragrafo 6).
- l’uso di determinati amminoacidi crea problemi al suo corpo.
- ha troppo zucchero nel sangue (iperglicemia grave).
- il suo sangue è eccessivamente acido (acidosi metabolica dovuta ad un eccesso di lattato).
- i livelli di sodio, potassio, magnesio, calcio e/o fosforo nel suo sangue sono troppo elevati (ipernatremia, iperkalemia, ipermagnesemia, ipercalcemia e/o iperfosfatemia).
- Nei bambini di età inferiore a 28 giorni, il ceftriaxone non deve essere co-somministrato con soluzioni ev contenenti calcio a causa del rischio di formazione di particelle.
In tutti i casi, il medico deciderà se lei dovrà ricevere questa medicina sulla base di fattori quali età, peso e
condizione clinica, insieme ai risultati degli esami eseguiti.
Avvertenze e precauzioni
Parli con il medico o con l’infermiere prima che CLINIMIX le sia somministrato.
In caso di sviluppo di qualsiasi segno o sintomo di reazione allergica come febbre, brividi, eruzioni cutanee o
difficoltà respiratoria, eccessiva sudorazione, nausea o mal di testa, informi il medico o l’infermiere: l’infusione
deve essere immediatamente interrotta. Il medico controllerà le sue condizioni mentre riceve questo medicinale e
potrebbe cambiare il dosaggio o darle nutrienti in aggiunta come lipidi, vitamine, elettroliti ed oligoelementi
qualora lo ritenesse opportuno.
Alcuni farmaci e determinate malattie possono accrescere il rischio di infezione o di sepsi (presenza di batteri nel
sangue). Il rischio di infezione o sepsi è particolarmente elevato quando si infila un tubo (catetere endovenoso) in
una vena. Il medico la visiterà con cura per individuare eventuali segni di infezione. Il rischio di infezione può
essere ridotto usando una “tecnica asettica" ("senza germi") quando si posiziona e si mantiene il catetere e quando
si prepara la formula nutritiva.
CLINIMIX con elettroliti contiene calcio. Non deve essere somministrato insieme all’antibiotico ceftriaxone per
il rischio di formazione di particelle.
Se lei è gravemente malnutrito, tanto da aver bisogno di ricevere nutrimento per via endovenosa, si raccomanda di
iniziare la nutrizione parenterale lentamente e con attenzione.
Il medico controllerà le sue condizioni all’inizio dell’infusione, in particolare se lei ha problemi epatici, renali,
surrenali, cardiaci o di circolazione. Il medico deve inoltre essere informato di qualsiasi grave condizione che
riguardi come il suo corpo gestisce gli zuccheri, i grassi, le proteine o i sali (disordini metabolici). L’infusione
deve essere interrotta in caso di sviluppo di segni anormali, inclusa l’irritazione venosa.
Per verificare l’efficacia e la sicurezza della somministrazione, il medico effettuerà test clinici e di laboratorio
mentre lei riceve questo medicinale. Se lei riceve questo medicinale per diverse settimane il suo sangue verrà
esaminato su base regolare. In particolare, in caso di intolleranza al glucosio, il glucosio nel sangue e nell’urina
deve essere regolarmente controllato, e se lei è diabetico, il dosaggio dell’insulina potrebbe essere modificato.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
L’esposizione di Clinimix alla luce ambientale, specialmente dopo l’aggiunta di oligoelementi e/o vitamine,
genera perossidi e altri prodotti di degradazione che possono essere ridotti con la protezione dall’esposizione alla
luce.
Altri medicinali e CLINIMIX
Pagina 85 di 96
Clinimix FI Apr 2021
Informi il medico se sta assumendo o utilizzando, ha recentemente assunto o utilizzato o potrebbe assumere o
utilizzare qualsiasi altro medicinale.
CLINIMIX con elettroliti contiene calcio. Non deve essere dato insieme all’antibiotico ceftriaxone a causa del
rischio di formazione di particelle.
A causa del suo contenuto di potassio, CLINIMIX deve essere somministrato con cautela in pazienti trattati con
diuretici risparmiatori di potassio (per es. amiloride, spironolattone, triamterene), con inibitori degli enzimi che
convertono l’angiotensina (ACE-inibitori), antagonisti del recettore dell’angiotensina II, o gli immunosoppressori
tacrolimo e ciclosporine in relazione al rischio di iperkaliemia.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno
chieda consiglio al medico prima che questo medicinale le sia somministrato.
3. Come viene somministrato CLINIMIX
Prima di somministrare il prodotto, la membrana non permanente tra i due compartimenti deve essere rotta ed il
contenuto dei due compartimenti deve essere miscelato.
CLINIMIX può essere dato agli adulti ed ai bambini.
E’ una soluzione per infusione da somministrare mediante un tubo in una vena del suo braccio o in una vena
grande del suo torace.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Dosaggio – adulti e bambini
Il suo medico deciderà la quantità da somministrarle e per quanto tempo. Ciò dipenderà dall’età, dal peso e
dall’altezza, dalla sua condizione clinica, dal volume di fluido giornaliero e dalle sue necessità energetiche e di
azoto.
Prenda CLINIMIX seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il medico.
La prescrizione può essere continuata per tutto il tempo necessario, a seconda della sua condizione clinica.
L’infusione di una sacca dura di solito tra 8 e 24 ore.
Se le viene somministrato più CLINIMIX del dovuto
Se la dose data è troppo alta o l’infusione è troppo veloce, può aumentare la quantità di sangue in circolazione o il
suo sangue potrebbe diventare troppo acido. È possibile che il contenuto di glucosio aumenti i livelli del glucosio
presenti nel suo sangue e nelle sue urine. La somministrazione di un volume troppo elevato può causare nausea,
vomito, brividi e squilibri elettrolitici; in tali condizioni l’infusione deve essere interrotta immediatamente.
In alcuni casi gravi, il suo medico può sottoporla temporaneamente a dialisi renale per aiutare i suoi reni a
eliminare il prodotto in eccesso.
Per impedire che accadano tali eventi, il suo medico monitorerà regolarmente la sua condizione e analizzerà i suoi
parametri ematici.
Se ha qualsiasi dubbio sull’uso di questo prodotto, si rivolga al medico.
Pagina 86 di 96
Clinimix FI Apr 2021
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino. Se percepisce cambiamenti nel modo in cui si sente, durante o dopo il trattamento, lo comunichi
prontamente al medico o all’infermiere.
Gli esami che effettuerà il medico mentre il medicinale le viene somministrato hanno lo scopo di ridurre i rischi di
effetti indesiderati.
In caso di sviluppo di qualsiasi segno anormale o sintomo di reazione allergica come pressione del sangue
eccessivamente bassa o alta, comparsa di colorazione blu o rossa della pelle, frequenza cardiaca troppo elevata,
difficoltà respiratoria, nausea, vomito, eruzioni cutanee, aumento della temperatura corporea, eccessiva
sudorazione, brividi e tremori, l’infusione deve essere immediatamente interrotta.
Sono stati osservati altri effetti indesiderati, che si verificano con maggiore o minore frequenza:
- Anafilassi (seria reazione allergica che insorge rapidamente e che può causare la morte).
- Alte concentrazioni di glucosio, ammoniaca e composti contenenti azoto nel sangue.
- Compromissione della funzione epatica, analisi del sangue anormali per la funzionalità epatica.
- Infiammazione della cistifellea, presenza di calcoli biliari nella cistifellea.
- Infiammazione venosa nel punto di iniezione, irritazione venosa, dolore, irritazione, calore, gonfiore.
- Presenza di glucosio nelle urine.
- Coma diabetico.
- Formazione di piccole particelle che bloccano i vasi sanguigni polmonari.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o
all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare CLINIMIX
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione
(vedere paragrafo 2).
Questo medicinale non deve essere somministrato dopo la data di scadenza che è riportata sul contenitore e sulla
confezione esterna (MM/AAAA). La data di scadenza si riferisce all’ultimo giorno di quel mese.
Non congelare.
Tenere il contenitore nell’imballaggio esterno.
Non getti alcun medicinale nell’acqua di scarico o nei rifiuti domestici. Chieda al farmacista come eliminare i
medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione ed altre informazioni
Cosa contiene CLINIMIX
Pagina 87 di 96
Clinimix FI Apr 2021
I principi attivi per ciascuna sacca della soluzione ricostituita sono:
Gli altri componenti sono:
- acido acetico, acido cloridrico (per l’aggiustamento del pH della soluzione),
- acqua per preparazioni iniettabili. Descrizione dell’aspetto di CLINIMIX e contenuto della confezioneCLINIMIX è una soluzione per infusione confezionata in una sacca a due compartimenti, che è una sacca in plastica multistrato. Il materiale dello strato interno (di contatto) della sacca è a base di polimeri (miscela di copolimeri poliolefinici) compatibile con i costituenti e gli additivi autorizzati. Altri strati sono realizzati in EVA (poli (etilene-vinil acetato) e in un copoliestere. Prima della ricostituzione, le soluzioni di amminoacidi e di glucosio sono limpide e incolori o lievemente gialle. Dopo la ricostituzione la soluzione è ancora limpida e incolore o lievemente gialla. Per impedire il contatto con l’ossigeno dell’aria, la sacca è confezionata in un involucro esterno con barriera all’ossigeno, che contiene un sacchetto che assorbe l’ossigeno.
Confezioni
Sacca da 1000 ml: scatola con 8 sacche
1000 ml: 1 sacca
Sacca da 1500 ml: scatola con 6 sacche
1500 ml: 1 sacca
Sacca da 2000 ml: scatola con 4 sacche
2000 ml: 1 sacca
E’ possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Per ulteriori informazioni su CLINIMIX, contatti il titolare dell’autorizzazione all’immissione in commercio:
BAXTER S.p.A.
Pagina 88 di 96
| Principi attivi | 1 l | 1,5 l | 2 l |
| L-alanina L-arginina Glicina L-istidina L-isoleucina L-leucina L-lisina (come lisina cloridrata) L-metionina L-fenilalanina L-prolina L-serina L-treonina L-triptofano L-tirosina L-valina Sodio acetato, 3H O 2 Potassio fosfato bibasico Sodio cloruro Magnesio cloruro, 6H O 2 Glucosio anidro (come glucosio monoidrato) Calcio cloruro, 2H O 2 | 10,35 g 5,75 g 5,15 g 2,40 g 3,00 g 3,65 g 2,90 g (3,63 g) 2,00 g 2,80 g 3,40g 2,50 g 2,10 g 0,90 g 0,20 g 2,90 g 3,40 g e 2,61 g 0,59 g d 0,51 g 175 g (193 g) 0,33 g | 15,53 g 8,63 g 7,73 g 3,60 g 4,50 g 5,48 g m 4,35 g (5,44 g) 3,00 g r 4,20 g a 5,10 g 3,75 g F 3,15 g 1,35 g 0,30 g 4,35 g l 5,10 g 3,92g 0,88 g 0,77 g 263 g (289 g) 0,50 g | o 20,70 g 11,50 g c 10,30 g 4,80 g a 6,00 g 7,30 g 5,80 g (7,25 g) 4,00 g 5,60 g 6,80 g 5,00 g 4,20 g 1,80 g 0,40 g 5,80 g 6,80 g 5,22 g 1,18 g 1,02 g 350 g (385 g) 0,66 g |
Clinimix FI Apr 2021
Via del Serafico 89 00142 ROMA
Produttori
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Belgium
Questo medicinale è autorizzato negli Stati Membri dello Spazio Economico Europeo con le seguenti
denominazioni:
CLINIMIX N17G35E, soluzione per infusione
In alcuni paesi è registrato con altre denominazioni come di seguito descritto:
Austria: CLINIMIX 5% G-E
Germania CLINIMIX 5% G-E
---------------------------------------------------------------------------------------------------------------------------
Pagina 89 di 96
Clinimix FI Apr 2021
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
1. COMPOSIZIONE QUANTITATIVA
Dopo miscelazione del contenuto dei due compartimenti, la composizione della miscela binaria, per tutti i formati
disponibili per la sacca ,è la seguente:
2. POSOLOGIA E MODO DI SOMMINISTRAZIONE
Somministrare il prodotto solo dopo la rottura della membrana non permanente tra i due compartimenti e la
miscelazione del contenuto dei due compartimenti.
Dosaggio e velocità di infusione
Il dosaggio deve essere personalizzato in base al fabbisogno nutrizionale / di liquidi del paziente, al dispendio
energetico, allo stato clinico, al peso corporeo e alla capacità di metabolizzare i costituenti di Clinimix, nonché
all'energia o alle proteine aggiuntive somministrate per via orale / enterale. Inoltre, il fabbisogno giornaliero di
liquidi, azoto ed energia diminuisce continuamente con l'età
Negli adulti, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1 g di amminoacidi/kg/die) a 0,32 g di
azoto/kg/die (circa 2 g di amminoacidi/kg/die).
Nei bambini, il fabbisogno varia da 0,16 g di azoto/kg/die (circa 1,0 g di amminoacidi/kg/die) a 0,40 g di
azoto/kg/die (circa 2,5 g di amminoacidi/kg/die).
Negli adulti e nei pazienti di età compresa tra 12 e 18 anni, il fabbisogno calorico varia da 25 kcal/kg/giorno a 40
kcal/g/giorno, a seconda dello stato nutrizionale del paziente e del grado di catabolismo. I pazienti di età inferiore
a 12 anni possono avere requisiti più elevati.Il fabbisogno calorico varia da 25 kcal/kg/die a 40 kcal/kg/die, a
seconda dello stato nutrizionale del paziente e del grado di catabolismo.
Possono esistere situazioni cliniche in cui i pazienti richiedono quantità di nutrienti che variano dalla
composizione di Clinimix. In questa situazione, qualsiasi aggiustamento del volume (dose) deve tenere in
considerazione l'effetto risultante che avrà sul dosaggio di tutti gli altri componenti nutritivi di Clinimix. La
velocità e il volume di infusione devono essere determinati dal medico consulente esperto in fluidoterapia
endovenosa pediatrica.
Questo prodotto non contiene gli aminoacidi cisteina e taurina, considerati condizionatamente essenziali per
neonati e lattanti
Questo medicinale non è raccomandato per neonati pretermine e nati a termine e per bambini di età inferiore a 2
anni.
Pagina 90 di 96
| 1 l | 1,5 l | a 2 l | |
| Azoto (g) Amminoacidi (g) Glucosio(g) | 8,3 50 175 | m 12,4 75 263 | 16,5 100 350 |
| Calorie totali (kcal) Calorie da glucosio (kcal) | 900 700 | r 1350 1050 | 1800 1400 |
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- (mmol) 4 | 35 30 2,5 2,3 75 40 15 | a 53 F 45 3,8 3,4 113 l 60 23 | 70 60 5,0 4,5 150 80 30 |
| pH Osmolarità (mOsm/l) | e 6 1625 | ||
Clinimix FI Apr 2021
La velocità di infusione deve essere adattata a seconda del dosaggio, delle caratteristiche della soluzione infusa,
del volume totale da infondere nelle 24 ore e della durata dell’infusione.
Il tempo di infusione deve essere superiore alle 8 ore. Normalmente, la velocità del flusso viene aumentata
gradualmente durante la prima ora, senza superare i 1,4 ml per chilogrammo di peso corporeo all’ora, e la dose
massima è 30 ml per chilogrammo di peso corporeo al giorno.
Modo di somministrazione
Quando impiegata in bambini di età inferiore a 2 anni, la soluzione (nelle sacche e nei set per la
somministrazione) deve essere protetta dall’esposizione alla luce fino al completamento della somministrazione.
Via di somministrazione
La scelta di una vena centrale o periferica dipende dall’osmolarità finale della miscela. Il limite generale accettato
per un’infusione periferica è di circa 800 mOsm/l ma questo varia considerevolmente con l’età e con le condizioni
generali del paziente e delle caratteristiche delle vene periferiche.
3. AVVERTENZE SPECIALI E PRECAUZIONI DI IMPIEGO
AVVERTENZE
Con le formulazioni di CLINIMIX sono state segnalate reazioni di ipersensibilità all’infusione incluse
ipotensione, ipertensione, cianosi periferica, tachicardia, dispnea, vomito, nausea, orticaria, eruzione cutanea,
prurito, eritema, iperidrosi, piressia e brividi .
Anafilassi è stata segnalata con altri prodotti per nutrizione parenterale.
Prima di intraprendere una infusione endovenosa è necessario effettuare un monitoraggio clinico accurato. In caso
di segnali o sintomi anormali, per es. ipersensibilità o reazione all’infusione, quest’ultima deve essere subito
interrotta.
Le soluzioni contenenti glucosio devono essere usate con cautela, se del tutto, in pazienti con allergia nota al
granturco o suoi derivati.
Sono stati segnalati precipitati vascolari polmonari nei pazienti che ricevono nutrizione parenterale. In alcuni casi
gli esiti sono stati fatali. Un’eccessiva aggiunta di calcio e fosfato aumenta il rischio di formazione di precipitati
di fosfato di calcio. Sono stati segnalati precipitati in soluzione anche in assenza di sale fosfato. Sono stati
segnalati precipitati anche lontano dal filtro in linea e una sospetta formazione di precipitato in vivo. Nei casi in
cui si presentino segni di sofferenza polmonare, l’infusione deve essere interrotta e deve essere avviata una
valutazione medica. In aggiunta all’ispezione della soluzione, anche il set e il catetere di infusione devono essere
periodicamente controllati per la presenza di precipitati.
In pazienti di età superore ai 28 giorni (adulti inclusi) il ceftriaxone non deve essere somministrato
simultaneamente a soluzioni endovenose contenenti calcio incluso CLINIMIX N17G35E attraverso la stessa
linea di infusione (es. attraverso un connettore ad Y).
Se si usa la stessa linea di infusione per la somministrazione sequenziale, la linea deve essere lavata
accuratamente con un liquido compatibile tra le infusioni
Infezione e sepsi possono presentarsi come risultato dell’utilizzo di cateteri endovenosi per la somministrazione
delle formulazioni parenterali, manutenzione dei cateteri inadeguata o soluzioni contaminate.
L’immunosoppressione ed altri fattori quali l’iperglicemia, la malnutrizione e/o il loro stato di malattia latente,
possono predisporre i pazienti a complicazioni da infezione.
Un accurato controllo sintomatico e di laboratorio per febbre/brividi, leucocitosi, complicazioni tecniche
riguardanti il dispositivo di accesso e iperglicemia possono aiutare a riconoscere precocemente le infezioni.
Pagina 91 di 96
Clinimix FI Apr 2021
La comparsa di complicazioni settiche può essere ridotta aumentando l'attenzione ad adottare tecniche asettiche
nel posizionamento e nella manutenzione del catetere, come pure tecniche asettiche nella preparazione della
formula nutritiva.
La rialimentazione di pazienti gravemente sottonutriti può provocare la sindrome da rialimentazione, che è
caratterizzata dallo spostamento intracellulare di potassio, fosforo e magnesio quando il paziente entra in fase
anabolica. Possono svilupparsi anche carenza di tiamina e ritenzione di liquidi. Un monitoraggio attento e un
aumento lento dell'assunzione di nutrienti, oltre a evitare una sovralimentazione, possono prevenire queste
complicazioni.
Le soluzioni ipertoniche se infuse in vena periferica possono causare irritazione venosa. La scelta di una
somministrazione per vena periferica o centrale dipende dalla osmolarità finale della miscela da infondere.
Il limite di osmolarità generalmente accettato per una somministrazione in vena periferica è di 800 mOsm/l ma
può variare considerevolmente in funzione dell’età, delle condizioni generali del soggetto e delle caratteristiche
delle vene periferiche.
Non collegare sacche in serie per evitare l'embolia gassosa dovuta all'eventuale residuo di aria contenuto nella
sacca primaria.
PRECAUZIONI
Prima di iniziare l’infusione, devono essere corretti gravi disordini dell’equilibrio idro-elettrolitico, gravi stati di
sovraccarico di fluidi e gravi disordini metabolici.
Possono verificarsi complicazioni metaboliche se l'assunzione di nutrienti non viene adattata alle esigenze del
paziente o se il valore metabolico di un componente della dieta non viene valutato accuratamente. Effetti
metabolici indesiderati possono derivare dalla somministrazione di nutrienti insufficienti o eccessivi o dalla
composizione di una miscela inadatta alle esigenze di un paziente particolare.
Per un corretto monitoraggio in fase di somministrazione sono necessarie valutazioni cliniche ed esami di
laboratorio frequenti. Questi devono includere lo ionogramma ed i test di funzionalità epatica e renale.
I fabbisogni di elettroliti in pazienti trattati con le soluzioni devono essere accuratamente determinati e monitorati,
specialmente per quanto riguarda le soluzioni prive di elettroliti.
L’intolleranza al glucosio è una complicazione metabolica comune nei pazienti gravemente depleti. A seguito
dell’infusione dei prodotti possono insorgere iperglicemia, glicosuria e sindrome iperosmolare. Il livello di
glucosio nel sangue e nelle urine deve essere monitorato di routine e, per i pazienti diabetici, il dosaggio
dell’insulina, se necessario, deve essere conseguentemente adattato.
Utilizzare con prudenza in pazienti con insufficienza renale, in particolare in presenza di iperkaliemia, a causa del
rischio di sviluppo o aggravamento dell'acidosi metabolica e dell'iperazotemia, se non viene eseguita la rimozione
extrarenale delle scorie. In questi pazienti si deve tenere sotto stretto controllo lo stato dei fluidi e il quadro
elettrolitico. In caso di insufficienza renale grave devono essere preferite soluzioni aminoacidiche adeguatamente
formulate.
Utilizzare con prudenza CLINIMIX in pazienti con insufficienza surrenale.
Evitare sovraccarichi circolatori in particolare in pazienti con edema polmonare, insufficienza e/o scompenso
cardiaco. Lo stato dei fluidi deve essere strettamente controllato.
In pazienti con malattia epatica preesistente o insufficienza epatica, oltre ai test di funzionalità epatica di routine,
devono essere controllati eventuali sintomi di iperammoniemia.
Pagina 92 di 96
Clinimix FI Apr 2021
E’ noto che disordini epatobiliari inclusi colestasi, steatosi epatica, fibrosi e cirrosi che potenzialmente portano
all’insufficienza epatica, come pure la colicistite, la colelitiasi, possono svilupparsi in alcuni pazienti in nutrizione
parenterale. Si ritiene che l’eziologia di questi disordini sia dovuta a più fattori e che possa differire tra pazienti.
Pazienti che mostrano parametri di laboratorio anormali o altri segni di disordini epatobiliari devono essere subito
indirizzati ad un medico specializzato in disfunzioni epatiche che possa identificare i fattori scatenanti e
contribuenti, oltre ad individuare interventi terapeutici e di profilassi.
Un aumento dell’ammoniaca nel sangue ed iperammoniemia possono verificarsi in pazienti che ricevono
soluzioni amminoacidiche. In alcuni pazienti questo può significare la presenza di un disordine congenito del
metabolismo aminoacidico (vedere paragrafo 4.3 dell’RCP) o insufficienza epatica.
L’ammoniaca nel sangue deve essere misurata frequentemente nei neonati e nei bambini per rilevare
iperammoniemia, che potrebbe significare la presenza di una anomalia congenita del metabolismo aminoacidico.
L’iperammoniemia, a seconda dell’entità e dell’eziologia, potrebbe richiedere un intervento immediato.
Un’infusione troppo rapida di amminoacidi può causare nausea, vomito e brividi. In caso di insorgenza di questi
sintomi, interrompere immediatamente l’infusione.
In generale scegliere con cautela la dose per i pazienti anziani, in modo da tenere in considerazione la maggiore
frequenza della diminuzione della funzionalità epatica, renale o cardiaca e la presenza di malattie concomitanti o
di altre terapie farmacologiche.
Popolazione pediatrica
- Non sono stati effettuati studi sulla popolazione pediatrica.
- Vedere sopra circa il monitoraggio della iperammoniemia nei pazienti pediatrici.
L’esposizione alla luce delle soluzioni per nutrizione parenterale endovenosa, specialmente dopo l’aggiunta di
oligoelementi e/o vitamine, può causare la generazione di perossidi e altri prodotti di degradazione. Quando
impiegato in bambini di età inferiore a 2 anni, Clinimix deve essere protetto dalla luce ambientale fino al
completamento della somministrazione.
4. INFORMAZIONI PRATICHE SU PREPARAZIONE E MANIPOLAZIONE
Attenzione: Somministrare il prodotto solo dopo la rottura della membrana di separazione e la miscelazione del
contenuto di entambi i compartimenti.


Strappare dall’alto per
aprire l’involucro esterno.
Strappare la parte
anteriore dell’involucro
esterno per mostrare la
sacca di CLINIMIX.
Gettare l’involucro
esterno e l’assorbitore di
ossigeno.
Collocare la sacca di
piatto, su una superficie
orizzontale e pulita e con
la maniglia rivolta verso
di sé.
Pagina 93 di 96
Clinimix FI Apr 2021

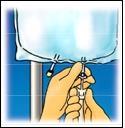
Sollevare l’area
dell’occhiello di
sospensione per rimuovere
la soluzione dalla parte
superiore della sacca.
Arrotolare saldamente la
sacca, finché la membrana
di separazione non sia
completamente aperta
(circa per metà).
Mescolare la sacca
capovolgendola per circa
3 volte.
Appendere la sacca.
Staccare, con un
movimento rotatorio, la
protezione dal punto di
somministrazione.
Collegare saldamente il
connettore dello spike.
Utilizzare solo se la soluzione è limpida, incolore o leggermente gialla e se la sacca non è danneggiata.
CLINIMIX deve essere a temperatura ambiente prima dell’uso.
L’attivazione di CLINIMIX può essere effettuata nell’involucro esterno o dopo la sua rimozione.
Solo per uso singolo.
Non conservare eventuali residui inutilizzati e gettare tutti i dispositivi dopo l’uso.
Non riconnettere sacche parzialmente utilizzate.
Non utilizzare in collegamenti in serie.
Quando impiegato in bambini di età inferiore a 2 anni, proteggere dall’esposizione alla luce fino al
completamento della somministrazione. L’esposizione di Clinimix alla luce ambientale, specialmente dopo
l’aggiunta di oligoelementi e/o vitamine, genera perossidi e altri prodotti di degradazione che possono essere
ridotti con la protezione dall’esposizione alla luce.
Integrazione
Lipidi, vitamine ed oligoelementi devono essere somministrati a pazienti sottoposti a nutrizione parenterale
prolungata.
Se sono necessarie integrazioni, verificarne le compatibilità e controllare la stabilità delle miscele.
L’integrazione può essere effettuata dopo aver rotto la membrana di separazione (dopo che le due soluzioni sono
state miscelate) per tutti gli altri additivi. CLINIMIX può essere integrato con:
- Emulsioni lipidiche (per esempio ClinOleic) in un quantitativo da 50 a 250 ml per litro di CLINIMIX
| n CLINIMIX N17G35E 1 l + 250 ml di lipidi al 20% | CLINIMIX N17G35E 1,5 l + 500 ml di lipidi al 20% | CLINIMIX N17G35E 2 l + 500 ml di lipidi al 20% | |
| e Azoto (g) g Amminoacidi (g) Glucosio (g) Lipidi (g) | 8,3 50 175 50 | 12,4 75 263 100 | 16,5 100 350 100 |
| A Calorie totali (kcal) Calorie da glucosio (kcal) Calorie da lipidi (kcal) Rapporto glucosio/lipidi | 1400 700 500 58/42 | 2350 1050 1000 51/49 | 2800 1400 1000 58/42 |
Pagina 94 di 96
Clinimix FI Apr 2021
- Elettroliti: per litro di CLINIMIX
| Sodio (mmol) Potassio (mmol) Magnesio (mmol) Calcio (mmol) Acetato (mmol) Cloruri (mmol) Fosfati come HPO 2- 4 (mmol) | 35 30 2,5 2,3 75 40 15 | 53 45 3,8 3,4 113 60 23 | 70 60 o 5,0 4,5 c 150 80 a 30 |
| pH Osmolarità (mOsm/l) | 6 1360 | 6 1290 | m 6 1360 |
| Sodio | Potassio | a Magnesio | Calcio | |
| Fino ad una concentrazione finale di | 80 mmol | 60 mmol | F 5,6 mmol | 3,0 mmol |
- Oligoelementi: per litro di CLINIMIX
- Vitamine: per litro di CLINIMIX
I dati di stabilità in seguito a miscelazione di CLINIMIX con altre emulsioni lipidiche in commercio ed altri
additivi o nutrienti sono disponibili su richiesta.
Se si osserva una leggera opalescenza, mescolare accuratamente la miscela, agitando delicatamente, in modo da
ottenere una emulsione omogenea prima dell’infusione.
Le eventuali aggiunte devono essere effettuate in condizioni asettiche.
Le aggiunte devono essere fatte con una siringa o mediante un set di trasferimento.
- Aggiunta con una siringa o set di trasferimento con ago
- Preparare il punto d’iniezione (il punto d’accesso singolo, vedere la figura 1 nell’RCP).
- Perforare la membrana ed iniettare.
- Miscelare la soluzione e gli additivi.
- Aggiunta mediante set di trasferimento munito di punta
- Fare riferimento alle “Istruzioni per l’uso” del set di trasferimento per lipidi utilizzato.
- Connettere la punta al sito di accesso ai lipidi (punto d’accesso più lungo).
Pagina 95 di 96
| Fino ad una concentrazione finale di | Rame | 10 mol | Zinco | 77 mol |
| Cromo | e 0,14 mol | Manganese | 2,5 mol | |
| Fluoro | d 38 mol | Cobalto | 0,0125 mol | |
| Selenio | 0,44 mol | Molibdeno | 0,13 mol | |
| Iodio | 0,5 mol | Ferro | 10 mol |
| Fino ad una concentrazione finale di | Vitamina A | 1750 U.I. | Biotina | 35g |
| Vitamina B6 | a 2,27 mg | Vitamina B1 | 1,76 mg | |
| i Vitamina D | 110 U.I. | Acido folico | 207g | |
| l Vitamina B12 | 3,0 g | Vitamina B2 | 2,07 mg | |
| Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| a Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| t Vitamina K | 75g |
Clinimix FI Apr 2021
Incompatibilità
Alcune integrazioni possono essere incompatibili, fare riferimento al produttore per maggiori dettagli.
Se le integrazioni si rendono necessarie, la compatibilità e la stabilità delle miscele finali devono essere
controllate.
La soluzione non deve essere somministrata prima, contemporaneamente o dopo una infusione di sangue tramite
lo stesso set d’infusione per la possibilità di pseudoagglutinazione.
CLINIMIX N17G35E contiene ioni calcio che aumentano il rischio della formazione di precipitati coagulati nel
sangue o componenti del sangue trattati con citrato come anticoagulante/conservante.
Come per altre miscele per nutrizione parenterale, devono essere considerati i rapporti tra calcio e fosfato. Una
aggiunta eccessiva di calcio e fosfato, specialmente sotto forma di sali minerali, può portare alla formazione di
precipitati di fosfato di calcio.
Come per altre soluzioni per infusione contenenti calcio, il trattamento concomitante di ceftriaxone e CLINIMIX
N17G35E è controindicato nei neonati (≤28 giorni di età), anche in caso di infusione con linee separate (vi è il
rischio di precipitazione fatale del sale di calcio ceftriaxone nel flusso sanguigno del neonato).
In pazienti con età superiore ai 28 giorni (inclusi gli adulti) ceftriaxone non deve essere somministrato
simultaneamente per via endovenosa con soluzioni contenenti calcio, incluso CLINIMIX N17G35E tramite la
stessa linea di infusione (vedere il paragrafo “Avvertenze”).
Se viene utilizzata la stessa linea di infusione per somministrazioni susseguenti, la linea deve essere lavata
internamente con un fluido compatibile tra le infusioni.
5. PERIODO DI VALIDITÀ
2 anni se conservato nell’involucro esterno.
Si raccomanda l’utilizzo del prodotto immediatamente dopo l’apertura della membrana di separazione non
permanente tra i due compartimenti. Comunque una volta ricostituita (membrana di separazione non permanente
interna aperta) è stato dimostrato che l’emulsione ricostituita è stabile a una temperatura compresa tra 2°C e 8°C
per un massimo di 7 giorni, seguita da un massimo di 48 ore a temperature non superiori a 25°C.
Una volta effettuate le integrazioni, da un punto di vista microbiologico, la miscela deve essere utilizzata
immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono
sotto la responsabilità dell’utilizzatore e non dovrebbero eccedere le 24 ore tra 2 e 8 °C, a meno che le
miscelazioni non siano state effettuate in area controllata ed in condizioni asettiche validate. In caso siano
richiesti tempi di conservazione più lunghi in circostanze eccezionali, si può contattare il produttore dato che sono
disponibili informazioni relative alla stabilità chimica e fisica in uso per 7 giorni a una temperatura compresa tra 2
e 8 °C seguita da 48 ore a temperatura inferiore a 25 C per i prodotti elencati nel paragrafo precedente.
Pagina 96 di 96
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a CLINIMIXForma farmaceutica: Soluzione per infusione, 10%Principio attivo: combinationsProduttore: B. BRAUN MELSUNGEN AGPrescrizione richiestaForma farmaceutica: Soluzione per infusione, 1000 MLPrincipio attivo: combinationsProduttore: B. BRAUN MELSUNGEN AGPrescrizione richiestaForma farmaceutica: Emulsione per infusione endovenosa, 1085 MLPrincipio attivo: combinationsProduttore: BAXTER S.P.A.Prescrizione richiesta
Medici online per CLINIMIX
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di CLINIMIX — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














