
GLIADEL

Come usare GLIADEL
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- GLIADEL 7.7 mg Impianto
- Cos'è GLIADEL e a cosa serve
- Cosa deve sapere prima di usare l'impianto GLIADEL
- Come sono usati gli Impianti GLIADEL
- Possibili effetti indesiderati
- Come conservare gli Impianti GLIADEL
- Contenuto della confezione ed altre informazioni
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA
- FORMA FARMACEUTICA
- 2 Posologia e modo di somministrazione
- 3 Controindicazioni
- 4 Avvertenze speciali e precauzioni di impiego
- 5 Interazioni con altri medicinali ed altre forme di interazione
- 6 Fertilità, gravidanza e allattamento
- 7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
- 8 Effetti indesiderati
- 9 Sovradosaggio
- 2 Proprietà farmacocinetiche
- 3 Dati preclinici di sicurezza
- 2 Incompatibilità
- 3 Periodo di validità
- 4 Precauzioni particolari per la conservazione
- 5 Natura e contenuto del contenitore
- 6 Precauzioni particolari per lo smaltimento e altra manipolazione
- TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- DATA DELLA PRIMA AUTORIZZAZIONE/ RINNOVO DELL’ AUTORIZZAZIONE
- DATA DI REVISIONE DEL TESTO
GLIADEL 7.7 mg Impianto
Carmustina
Legga attentamente questo foglio prima di ricevere GLIADEL Impianto, perché contiene
importanti informazioni per lei
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos'è GLIADEL e a cosa serve
- 2. Cosa deve sapere prima di usare l'impianto GLIADEL
- 3. Come sono usati gli impianti GLIADEL
- 4. Possibili effetti indesiderati
- 5. Come conservare GLIADEL
- 6. Contenuto della confezione ed altre informazioni
1. Cos'è GLIADEL e a cosa serve
Gli impianti GLIADEL consentono di diffondere la carmustina direttamente nel sito del tumore
cerebrale. La carmustina appartiene ad un gruppo di sostanze anti-cancerose che consentono di lottare
contro la proliferazione di certe cellule tumorali localizzate nel cervello, come complemento
dell'intervento chirurgico.
L’impianto di GLIADEL può essere usato in combinazione con la radiazione nel trattamento dei
tumori del cervello.
È stato dimostrato che gli impianti GLIADEL prolungano la sopravvivenza di pazienti colpiti da
tumore cerebrale.
2. Cosa deve sapere prima di usare l'impianto GLIADEL
Non usi GLIADELse è allergico alla carmustina o al polifeprosan 20.
Avvertenze e precauzioni
Dopo l'intervento per la rimozione del tumore al cervello e l'inserimento degli impianti GLIADEL, il
Suo medico o chirurgo monitoreranno attentamente la possibile insorgenza di complicanze note. In
alcuni casi il chirurgo potrà dover ri-operare (a causa di complicanze o recidiva tumorale). Le
complicanze includono:
- Convulsioni (crisi convulsive)
- Infezioni del cervello (infezioni all'interno della cavità cranica)
- Edema cerebrale
- Perdite di fluido cerebrospinale
- Problemi di guarigione della ferita chirurgica
Il medico La terrà sotto stretta osservazione nel caso Lei assuma farmaci steroidei per evidare edemi o
ipertensione cerebrale.
Prima di inserire gli impianti, il chirurgo potrebbe dover chiudere un canale interno al cervello per
evitare la penetrazione degli impianti, che potrebbe causare un accumulo di fluido all'interno della
cavità cranica.
Dopo l'inserimento degli impianti Gliadel, le immagini cliniche possono rilevare un edema cerebrale
dovuto ad un accumulo di fluido e all'infiammazione causata dagli impianti di Gliadel o dalla
progressione della patologia tumorale.
Altri medicinali e GLIADEL Impianti
Informi il medico se sta assumendo o ha recentemente assunto qualsiasi altro medicinale, anche quelli
senza prescrizione medica.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di ricevere questo medicinale. GLIADEL Impianti non è
stato studiato nelle donne in gravidanza. È stato osservato che il principio attivo, la carmustina, ha
influenzato negativamente lo sviluppo del feto. GLIADEL Impianti non deve essere usato nelle donne
durante la gravidanza e l’allattamento. Le donne in età fertile devono usare misure contraccettive
efficaci per 6 mesi dopo l’inserimento degli impianti GLIADEL. Gli uomini con partner di sesso
femminile in età fertile devono usare misure contraccettive per 90 giorni dopo l’inserimento degli
impianti GLIADEL.
Guida di veicoli e utilizzo di macchinari
La guida di veicoli e l'uso di macchinari non sono raccomandati dopo il trattamento. Verifichi con il
suo medico se può guidare veicoli o usare attrezzi o macchinari.
3. Come sono usati gli Impianti GLIADEL
L’uso degli impianti GLIADEL è rigorosamente riservato a pazienti adulti.
Il chirurgo o il farmacista si assicurerà che il prodotto sia disponibile al momento dell'operazione.
Dopo l’escissione del tumore cerebrale, il chirurgo inserirà un massimo di otto impianti nello spazio
che il tumore occupava. Gli impianti vengono collocati in modo da coprire il tumore il meglio
possibile. Dopo l'operazione, gli impianti si sciolgono lentamente in circa due o tre settimane,
rilasciando la carmustina sulle cellule circostanti.
Se ha qualsiasi dubbio sull’uso di GLIADEL, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, GLIADEL può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Se nota effetti indesiderati non citati nel presente foglio, o se ritiene grave uno degli effetti citati, ne
informi subito il suo medico.
Gli eventi indesiderati più comuni osservati durante i test sia nel glioma maligno appena diagnosticato
(tumore cerebrale) (120 pazienti) che nel glioma maligno ricorrente diagnosticato (110 pazienti) sono
indicati di seguito.
Le quattro categorie sottostanti di effetti indesiderati sono eventualmente legate all'uso degli impianti
GLIADEL.
- 1.Gli attacchi (epilettici)sono stati molto comuni. La maggior parte di essi aveva un’intensità da lieve a moderata ed è avvenuta entro i 5 giorni successivi all'intervento chirurgico.
- 2.Anche l’edema cerebraleè stato molto comune. L’edema cerebrale significa che è necessario eseguire un nuovo intervento chirurgico, o per rimuovere gli impianti o i resti di essi.
- 3.Anche i problemi di cicatrizzazione della ferita chirurgica da lievi agravi sono stati molto comuni.
- 4.Comuni sono state infezioni al cervello(infezioni all’interno del cranio) come la meningite o ascessi (raccolta di pus). Durante i test, sono stati osservati sui pazienti gli effetti collaterali riportati di seguito. Gli effetti collaterali erano simili a quelli riscontrati sui pazienti con chirurgia per cancro al cervello senza inserimento dell’impianto di GLIADEL.
Molto comuni: possono interessare più di 1 persona su 10
- Disturbi psichiatrici Depressione
- Patologie del sistema nervoso Debolezza, in particolare da un lato del corpo; convulsioni (spasmi); stato confusionale; cefalea; edema cerebrale; sonnolenza; problemi di elocuzione
- Patologie vascolari Infiammazione vascolare.
- Patologie gastrointestinali Nausea; vomito; costipazione.
- Patologie della cute e del tessuto sottocutaneo Eruzione cutanea; caduta di capelli.
- Patologie renali e urinarie Infezione urinaria.
- Patologie sistemiche e condizioni relative alla sede di somministrazione Peggioramento delle condizioni generali; infezione; mal di testa; senso di debolezza; febbre o dolore; cicatrizzazione anormale (lenta) della ferita chirurgica.
Comuni: possono interessare fino a 1 persona su 10
- Patologie del sistema emolinfopoietico Riduzione della quantità di globuli rossi, che può rendere la pelle pallida e causare affaticamento e affanno; riduzione della quantità di piastrine ematiche che aumentano i rischi di sanguinamenti; aumento della quantità di globuli bianchi.
- Patologie endocrine (problemi ormonali) Diabete mellito (concentrazione anormalmente elevata di zuccheri nel sangue).
- Disturbi del metabolismo e della nutrizione Edema periferico (eccesso di liquido nelle braccia o nelle gambe); scarsa concentrazione di sodio nel sangue, che genera affaticamento e stato confusionale, contrazione dei muscoli, spasmi e coma; livelli alti di zucchero nel sangue; scarsa concentrazione di potassio nel sangue, che può generare debolezza muscolare, contrazione o ritmo cardiaco anomalo.
- Disturbi psichiatrici Alterazioni della personalità; ansia eccessiva; pensiero anormale; allucinazioni; insonnia (sonno di non buona qualità).
- Patologie del sistema nervoso Amnesia (perdita di memoria); aumento della pressione arteriosa nel cranio dovuta ad un eccesso di liquido; paralisi del viso; mancanza di coordinazione; insensibilità; sensazioni di bruciore e di pizzicore anomale; difficoltà a camminare, capogiro; crisi epilettiche (spasmi); tremori; meningite (infiammazione alla testa); ascesso ( raccolta di pus); perdita di coscienza.
- Patologie dell'occhio Vista offuscata o anormale; gonfiore del contorno degli occhi; dolore agli occhi.
- Patologie vascolari Sanguinamento; pressione del sangue elevata o bassa
- Patologie respiratorie, toraciche e mediastiniche Infezioni polmonari o polmonite, con affanno, tosse e aumento della temperatura.
- Patologie gastrointestinali Infezione microbica della bocca; diarrea; costipazione; incontinenza fecale (feci incontrollate); difficoltà a deglutire; sanguinamenti nello stomaco o nell'intestino.
- Patologie della cute e del tessuto sottocutaneo Eruzione cutanea
- Patologie del sistema muscoloscheletrico e tessuto connettivo Infezione generale.
- Patologie renali e urinarie Infezioni delle vie urinarie; incontinenza urinaria.
- Patologie sistemiche e condizioni relative alla sede di somministrazione Dolore addominale, alla schiena e al petto; gonfiore al volto; ascesso (raccolta di pus); ferita accidentale; reazione allergica; dolore al collo e infezione del sistema sanguigno.
Effetti indesiderati non comuni (tra 1 e 10 pazienti su 1.000)
Traumatismi, avvelenamenti e complicazioni da procedura
Pneumocefalo (accumulo di aria in sede di impianto)
Segnalazione degli effetti indesiderati:
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione all’indirizzo : https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse . Segnalando
gli effetti indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo
medicinale.
5. Come conservare gli Impianti GLIADEL
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Conservare in congelatore alla temperatura di -20°C o inferiore.
Le buste esterne non aperte possono essere tenute ad una temperatura non superiore a 22°C per un
periodo massimo di sei ore.
Il prodotto può essere ricongelato solo una volta, se le buste non sono state aperte e sono state tenute
per un periodo massimo di 6 ore ad una temperatura non superiore a 22°C. Dopo il ricongelamento, il
prodotto deve essere usato entro 30 giorni.
Non usi GLIADEL dopo la data di scadenza riportata sulla confezione esterna e/o sulla busta. La data
di scadenza si riferisce all’ultimo giorno del mese indicato. Il chirurgo o il farmacista dell'ospedale
verificheranno la data di scadenza prima dell'uso degli impianti.
6. Contenuto della confezione ed altre informazioni
Cosa contengono gli impianti GLIADEL
- Il principio attivo è la carmustina. Ogni impianto contiene 7,7 mg di carmustina
- L'altro ingrediente è polifeprosan 20.
Descrizione dell’aspetto di GLIADEL e contenuto della confezione
GLIADEL è disponibile in confezioni da otto impianti discoidi piatti di colore bianco sporco/giallo
pallido . Ogni impianto è imballato individualmente in una busta coperta da un foglio di alluminio.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Produttore 1 (Importatore)
ALMAC PHARMA SERVICES (IRELAND)
LIMITED
Finnabair Industrial Estate,
Dundalk,
Co. Louth, A91 P9KD
Ireland
Tel: +353 42 932 0718
Fax: +353 42 932 0718
Produttore 2 (Importatore)
ALMAC PHARMA SERVICES LIMITED
20 Seagoe Industrial Estate
Craigavon, BT63 5QD, United Kingdom
Tel: +44 (0)28 3836 3363
Fax: +44 (0)28 3836 3300
<-----------------------------------------------------------------------------------------------------------------------------
Titolare dell’A.I.C
Clinigen Healthcare B.V.
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
Paesi Bassi
NOTA INFORMATIVA PER I PROFESSIONISTI MEDICI O OPERATORI SANITARI
1. DENOMINAZIONE DEL MEDICINALE
GLIADEL 7,7 MG Impianto
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Ciascun impianto contiene 7,7 mg di carmustina.
Per l'elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Impianto.
Impianto discoide piatto color bianco sporco/giallo pallido.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
L’uso di GLIADEL Impianto è indicato nel trattamento di pazienti adulti con recente diagnosi di glioma
ad alto grado di malignità in aggiunta all’intervento chirurgico e alla radioterapia.
L’uso di GLIADEL Impianto è indicato come aggiunta all’intervento chirurgico nel trattamento di
pazienti adulti affetti da glioblastoma multiforme con recidive comprovate mediante esami istologici e
per i quali è indicata la resezione chirurgica.
4.2 Posologia e modo di somministrazione
Posologia
Da utilizzarsi solamente per somministrazione intralesionale
Ciascun GLIADEL Impianto contiene 7,7 mg di carmustina, con una dose totale di 61,6 mg quando
otto impianti vengono posizionati nella cavità di resezione del tumore.
Popolazione pediatrica
La sicurezza ed efficacia di GLIADEL Impianto in pazienti di età inferiore ai 18 anni non sono state
comprovate. Non sono disponibili dati a riguardo.
Modo di somministrazione
Se la dimensione e la morfologia della cavità di resezione lo consentono, si raccomanda di posizionare
un massimo di otto impianti. È possibile usare impianti divisi a metà, ma gli impianti suddivisi in più di
due parti devono essere gettati negli appositi contenitori per lo smaltimento di rifiuti a rischio biologico
(vedere paragrafo 6.6).
Si raccomanda di posizionare gli impianti nella cavità di resezione estraendoli direttamente dalla
confezione sterile interna. Per fissare gli impianti alla superficie della cavità è possibile posizionare su
di essi della cellulosa ossidata rigenerata (vedere paragrafo 6.6).
4.3 Controindicazioni
Ipersensibilità al principio attivo carmustina o a uno qualsiasi degli eccipienti di GLIADEL..
4.4 Avvertenze speciali e precauzioni di impiego
I pazienti sottoposti a craniotomia per glioblastoma e all’applicazione di GLIADEL (Impianto) devono
essere tenuti sotto stretto controllo a causa delle note complicazioni della craniotomia che includono
convulsioni, infezioni intracraniche, anomala cicatrizzazione dell’incisione, edema cerebrale e
pneumocefalo (vedere paragrafo 4.8 “Effetti indesiderati”). In pazienti trattati con GLIADEL Impianto
sono stati osservati casi di effetto massa intracerebrale non sensibili ai corticosteroidi, compreso un caso
in cui si è verificata l’insorgenza di ernia cerebrale. È essenziale monitorare attentamente i pazienti
trattati con GLIADEL Impianto per rilevare l’eventuale edema cerebrale/ipertensione intracranica con
il conseguente uso di steroidi (vedere paragrafo 4.8). La perdita di liquido cerebrospinale (CSF) è stata
più frequente nei pazienti trattati con GLIADEL Impianto. Si raccomanda di eseguire con cautela la
chiusura ermetica della dura madre e delle incisioni locali (vedere paragrafo 4.8).
Sono state osservate modificazioni della parete dei vasi sanguigni cerebrali situati in prossimità del
discoide di Gliadel, inclusi casi di aneurisma con conseguente sanguinamento cerebrale vari mesi dopo
l’impianto di tali discoidi. Deve essere evitato l’impianto dei discoidi di Gliadel in prossimità dei grandi
vasi sanguigni cerebrali.
Lo sviluppo di edema cerebrale con effetto massa (dovuto a recidiva tumorale, infezione intracranica o
necrosi) può richiedere un ulteriore intervento chirurgico e, in alcuni casi, la rimozione di GLIADEL
Impianto o dei suoi residui.
Per impedire la migrazione degli impianti nel sistema ventricolare e la possibilità di conseguente
idrocefalo ostruttivo, deve essere evitata la comunicazione tra la cavità di resezione chirurgica e il
sistema ventricolare. Se esiste una comunicazione con diametro maggiore di quello dell’impianto, essa
va chiusa prima del posizionamento di GLIADEL Impianto .
La tomografia computerizzata e la risonanza magnetica possono mostrare un accrescimento del tessuto
cerebrale circostante la cavità di resezione dopo il posizionamento degli impianti di GLIADEL. Tale
accrescimento può essere indicativo di edema e infiammazione causati dagli impianti di GLIADEL o
dalla progressione tumorale.
Le donne in età fertile devono usare misure contraccettive efficaci per almeno 6 mesi dopo l’inserimento
di GLIADEL Impianto.
È necessario raccomandare ai pazienti di sesso maschile con partner di sesso femminile in età fertile di
usare misure contraccettive efficaci per almeno 90 giorni dopo l’inserimento di GLIADEL Impianto.
4.5 Interazioni con altri medicinali ed altre forme di interazione
Le interazioni di GLIADEL Impianto con altri medicinali o con la chemioterapia non sono state
formalmente valutate.
4.6 Fertilità, gravidanza e allattamento
Gravidanza
Non esistono studi su GLIADEL Impianto in donne in stato di gravidanza né studi per la valutazione
della tossicità riproduttiva di GLIADEL Impianto.
La carmustina, il principio attivo di GLIADEL Impianto, se somministrata sistemicamente, può avere
effetti genotossici e può influenzare negativamente lo sviluppo fetale (vedere paragrafo 5.3). GLIADEL
Impianto, pertanto, non è raccomandato durante la gravidanza e in donne in età fertile che non usano
misure contraccettive. Le donne in età fertile devono usare misure contraccettive efficaci per almeno
6 mesi dopo l’inserimento di GLIADEL Impianto.
È necessario raccomandare ai pazienti di sesso maschile con partner di sesso femminile in età fertile di
usare misure contraccettive efficaci per almeno 90 giorni dopo l’inserimento di GLIADEL Impianto.
Qualora, nonostante tutto, si consideri necessario l’uso di GLIADEL Impianto durante la gravidanza, la
paziente deve essere informata del potenziale rischio per il feto. Le pazienti che rimangono incinte dopo
l’inserimento di GLIADEL Impianto devono richiedere una consulenza genetica.
Allattamento
Non è noto se i componenti di GLIADEL Impianto vengano escreti nel latte umano. Poiché alcuni
farmaci vengono escreti nel latte umano e a causa del rischio potenziale di gravi reazioni indesiderate
alla carmustina in neonati allattati al seno, l’allattamento al seno è controindicato.
Fertilità:
Non sono stati condotti studi sull'impatto di GLIADEL Impianto sulla fertilità.
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
GLIADEL Impianto non influisce sulla capacità di guidare veicoli e di utilizzare macchinari. Tuttavia,
la craniotomia e GLIADEL Impianto possono causare disturbi del sistema nervoso e della vista. Pertanto
il paziente deve essere avvertito del potenziale effetto di questi eventi sulla capacità di guidare veicoli o
di utilizzare macchinari.
4.8 Effetti indesiderati
La gamma di effetti indesiderati osservati in pazienti con recente diagnosi di glioma ad alto grado di
malignità e gliomi maligni ricorrenti è stata in genere coerente con quella osservata in pazienti sottoposti
a craniotomia per gliomi maligni.
Gli effetti indesiderati molto comuni ( 1/10), comuni (da 1/100 a < 1/10) e non comuni (da 1/1,000
a < 1/100) osservati nei pazienti trattati con GLIADEL Impianto durante i trial clinici sono elencati di
seguito.
Nell'ambito di ogni frequenza di gruppo, gli effetti indesiderati devono essere presentati in ordine
decrescente di gravità.
Intervento chirurgico primario
I seguenti dati sono relativi alle reazioni avverse verificatesi più di frequente e osservate nel 5% o più
dei 120 pazienti con recente diagnosi di glioma maligno trattati con GLIADEL Impianto durante lo
studio clinico.
Reazioni avverse comuni osservate in ≥ 5% dei pazienti trattati con GLIADEL Impianto durante
l’intervento chirurgico iniziale
| Classificazione sistemica organica | Reazioni avverse | |
| n Patologie endocrine | comune | Diabete mellito |
| e Disturbi psichiatrici | molto comune | Depressione |
| comune | Disturbo della personalità, ansia, pensiero anormale, allucinazioni, insonnia | |
| g Patologie del sistema nervoso | molto comune | Emiplegia, convulsioni, confusione, edema cerebrale, afasia, sonnolenza, disordini della parola |
| comune | Amnesia, pressione endocranica aumentata, disordini della personalità, ansia, paralisi o facciale, neuropatia, atassia, ipoestesia, parestesia, pensiero anormale, deambulazione anomala, capogiro, convulsione da grande male, allucinazioni, insonnia, tremore | |
| Patologie dell'occhio | comune | c Edema congiuntivale, visione anomala, difetti del campo visivo |
| Patologie vascolari | molto comune | a Tromboflebite |
| comune | Emorragia | |
| Patologie respiratorie, toraciche e mediastiniche | comune | m Embolia polmonare |
| Infezioni ed infestazioni | comune | Polmonite |
| Patologie gastrointestinali | molto comune | Nausea, vomito, stitichezza |
| comune | r Diarrea | |
| Patologie della cute e del tessuto sottocutaneo | molto comune | a Eruzione cutanea, alopecia |
| Patologie renali e urinarie | comune | F Infezione delle vie urinarie, incontinenza urinaria |
| Patologie sistemiche e condizioni relative alla sede di somministrazione | molto comune | Reazione aggravata, cefalea, astenia, infezione, febbre, dolore, guarigione anormale |
| comune | l e Dolore addominale, lombalgia, edema facciale, dolore toracico, ascesso, lesione accidentale, edema periferico |
L’ipertensione intracranica si è manifestata più frequentemente nei pazienti trattati con GLIADEL
Impianto che in quelli trattati con placebo (9,2% rispetto all’1,7%). È stata in genere osservata più tardi,
al momento della recidiva, ed è improbabile che fosse associata all’uso di GLIADEL Impianto (vedere
paragrafo 4.4).
La perdita di liquido cerebrospinale è stata più comune nei pazienti trattati con GLIADEL Impianto che
in quelli trattati con placebo. Tuttavia le infezioni intracraniche e altre anomalie di guarigione non sono
aumentate (vedere paragrafo 4.4).
Intervento chirurgico per recidive
Nel 4% o più dei 110 pazienti trattati con GLIADEL Impianto in interventi chirurgici per recidiva in
uno studio clinico controllato, sono state osservate le reazioni avverse post-operatorie riportate di
seguito. Tranne che per gli effetti sul sistema nervoso, che possono essere stati causati dagli impianti di
placebo, sono elencate solo le reazioni più comuni nel gruppo trattato con GLIADEL Impianto. Queste
reazioni avverse non erano presenti prima dell’intervento chirurgico o sono peggiorate dopo
l’operazione durante il periodo di follow-up, che è stato di un periodo massimo di 71 mesi.
Reazioni avverse comuni osservate in ≥ 4% dei pazienti trattati con GLIADEL Impianto
durante l’intervento chirurgico per recidiva
| z Classificazione sistemica organica | Reazioni avverse | |
| Patologie del sistema emolinfopoietico | comune | Anemia |
| n Disturbi del metabolismo e della nutrizione | comune | Iponatremia |
| e g Patologie del sistema nervoso | molto comune | Convulsioni, emiplegia, cefalea, sonnolenza, confusione |
| comune | Afasia, stupore, edema cerebrale, pressione endocranica aumentata, meningite o ascesso | |
| Patologie vascolari | comune | Tromboflebite |
| A Patologie respiratorie, toraciche e mediastiniche | comune | Embolia polmonare |
| Infezioni ed infestazioni | comune | Polmonite, candidiasi orale |
| Patologie gastrointestinali | comune | Nausea, vomito |
| Patologie della cute e del tessuto sottocutaneo | comune | Eruzione cutanea |
| Patologie renali e urinarie | molto comune | Infezione delle vie urinarie |
| Patologie sistemiche e condizioni relative alla sede di somministrazione | molto comune | Febbre, guarigione anormale |
| comune | o Infezione, dolore |
Nei pazienti trattati con GLIADEL (Impianto), in tutti gli studi, sono stati segnalati i seguenti eventi
avversi, non elencati nella tabella sopra riportata. Gli eventi elencati non erano presenti prima
dell’intervento chirurgico o sono peggiorati nel periodo successivo all’intervento. Non è possibile
determinare se GLIADEL (Impianto) abbia causato tali eventi.
Eventi avversi nei pazienti trattati con GLIADEL (Impianto)
| Classificazione sistemica organica | Reazioni avverse | |
| Patologie del sistema emolinfopoietico | comune | a Trombocitopenia, leucocitosi |
| Disturbi del metabolismo e della nutrizione | comune | Iponatremia, iperglicemia, ipocalemia |
| Patologie del sistema nervoso | comune | F Idrocefalo, atassia, capogiro, emiplegia, coma, amnesia, diplopia |
| non comune | Emorragia cerebrale, infarto cerebrale | |
| Disturbi psichiatrici | comune | l Depressione, pensiero anormale, insonnia, reazione paranoide |
| Patologie dell'occhio | comune | e Difetto della vista, dolore oculare |
| Patologie cardiache, Patologie vascolari | comune | d Ipertensione, ipotensione |
| Patologie respiratorie, toraciche e mediastiniche | comune | Infezione, polmonite da aspirazione |
| Patologie gastrointestinali | a comune | Diarrea, stitichezza, disfagia, emorragia gastrointestinale, incontinenza fecale |
| Patologie della cute e del tessuto sottocutaneo | n comune | Eruzione cutanea |
| Patologie del sistema muscoloscheletrico e del tessuto connettivo | a comune | Infezione |
| Patologie renali e urinarie | comune | Incontinenza urinaria |
| l Patologie sistemiche e condizioni relative alla sede di somministrazione | i comune | Edema periferico, dolore al collo, lesione accidentale, lombalgia, reazione allergica, astenia, dolori toracici, sepsi |
| a Traumatismi, avvelenamenti e complicazioni da procedura | non comune | pneumocefalo |
Con Gliadel, sono stati osservati casi di accumulo di aria in sede di impianto, talvolta associati a sintomi
neurologici (emiplegia, afasia, crisi convulsive)
Le seguenti quattro categorie di reazioni avverse sono possibilmente correlate al trattamento con
GLIADEL Impianto.
Crisi epilettiche
Nell’intervento chirurgico iniziale, l’incidenza di crisi epilettiche entro i primi 5 giorni dopo l’impianto
dei wafer è stata del 2,5% nel gruppo trattato con GLIADEL Impianto.
Nell’intervento chirurgico per lo studio clinico delle recidive, l’incidenza delle crisi epilettiche post-
operatorie è stata del 19% nei pazienti trattati con GLIADEL Impianto. Il 54% dei pazienti (12 su 22)
trattati con GLIADEL Impianto ha manifestato l’insorgenza delle prime crisi epilettiche ex novo o il
peggioramento degli episodi epilettici entro i primi cinque giorni successivi all’intervento chirurgico.
Il tempo mediano di insorgenza delle prime o peggiorate crisi epilettiche post-operatorie è stato di 3,5
giorni nei pazienti trattati con GLIADEL Impianto.
Edema cerebrale
Se si sviluppa l’edema cerebrale con effetto massa (dovuto a ricorrenza tumorale, infezione intracranica
o necrosi) può essere necessario ricorrere ad ulteriore intervento chirurgico e, in alcuni casi, alla
rimozione di GLIADEL Impianto o dei suoi residui (vedere paragrafo 4.4).
Anomalie di guarigione
Negli studi clinici relativi a GLIADEL Impianto sono state riportate le seguenti anomalie di guarigione:
deiscenza dell’incisione, guarigione tardiva dell’incisione, versamenti subdurali, subgaleali o da
incisione e perdita di liquido cerebrospinale.
Nello studio clinico relativo all’intervento chirurgico iniziale, nel 5% dei pazienti trattati con GLIADEL
Impianto si sono verificate perdite di liquido cerebrospinale. Durante l’intervento chirurgico, per ridurre
al minimo il rischio di perdite di liquido cerebrospinale, occorre ottenere una chiusura ermetica della
dura madre (vedere paragrafo 4.4).
Infezione intracranica
Nello studio clinico relativo all’intervento chirurgico iniziale, l’incidenza di ascesso cerebrale o
meningite è stata del 5% nei pazienti trattati con GLIADEL Impianto.
Nel caso degli interventi per recidiva, l’incidenza di ascesso cerebrale o di meningite è stata del 4% nei
pazienti trattati con GLIADEL Impianto.
In uno studio clinico pubblicato, dopo il trattamento con GLIADEL Impianto è stata riportata la
formazione di cisti. Questa reazione si è verificata nel 10% dei pazienti osservati nello studio; la
formazione di cisti è tuttavia possibile dopo la resezione di un glioma maligno.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale
è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del
medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il
sistema nazionale di segnalazione riportato all’indirizzo: https://www.aifa.gov.it/content/segnalazioni-
reazioni-avverse
.
4.9 Sovradosaggio
Non pertinente
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: agenti antineoplastici, codice ATC: L01AD01
Dati preclinici
GLIADEL Impianto rilascia la carmustina direttamente nella cavità chirurgica creata dopo la resezione
tumorale. Con l’esposizione all’ambiente acquoso della cavità, i legami dell’anidride nel copolimero
vengono idrolizzati, rilasciando carmustina, carbossifenossipropano e acido sebacico. La carmustina
rilasciata da GLIADEL Impianto si diffonde nel tessuto cerebrale circostante e produce un effetto
antineoplastico alchilando DNA e RNA.
La carmustina si degrada e viene metabolizzata spontaneamente. La parte alchilante così prodotta,
presumibilmente ione cloroetil carbonio, causa la formazione di legami crociati irreversibili nel DNA.
L’attività tumoricida di GLIADEL Impianto dipende dal rilascio di carmustina nella cavità tumorale in
concentrazioni sufficienti per un’efficace citotossicità.
Più del 70% del copolimero si degrada entro tre settimane. La trasformazione metabolica e l’escrezione
dei monomeri sono differenti. Il carbossifenossipropano viene eliminato principalmente dal rene e
l’acido sebacico, un acido grasso endogeno, viene metabolizzato dal fegato ed espirato sotto forma di
CO negli animali.
Dati clinici
Intervento chirurgico iniziale
In uno studio clinico randomizzato, in doppio cieco e controllato con placebo su 240 adulti con recente
diagnosi di glioma ad alto grado di malignità che dovevano essere sottoposti a craniotomia iniziale per
la resezione tumorale, la sopravvivenza mediana è aumentata da 11,6 mesi con placebo a 13,9 mesi con
GLIADEL Impianto (valore-p = 0,079, test log-rank non stratificato) nella fase dello studio originale. Il
tipo più comune di tumore è stato il Glioblastoma Multiforme (GBM) (n=207), seguito da
oligoastrocitoma anaplastico (n=11), oligodendroglioma anaplastico (n=11) e astrocitoma anaplastico
(n=2). Il rischio relativo per GLIADEL Impianto è stato di 0,77 (IC 95%: 0,57 – 1,03). Nella fase di
follow-up a lungo termine, i pazienti ancora in vita al completamento della fase originale sono stati
seguiti per almeno tre anni o fino alla morte. La sopravvivenza mediana è aumentata da 11,6 mesi con
il placebo a 13,9 mesi con GLIADEL Impianto (valore-p <0,05, test log-rank). Il rischio relativo per il
trattamento con GLIADEL Impianto è stato di 0,73 (IC 95%: 0,56-0,95).
Intervento chirurgico per recidive
In uno studio clinico randomizzato, in doppio cieco, controllato con placebo su 145 adulti con
glioblastoma (GBM) ricorrente, GLIADEL Impianto ha prolungato la sopravvivenza di questi pazienti.
Il novantacinque percento dei pazienti trattati con GLIADEL Impianto ha ricevuto da 7 a 8 impianti.
La percentuale di sopravvivenza a sei mesi è stata del 36% (26 pazienti su 73) con placebo rispetto al
56% (40 pazienti su 72) con il trattamento con GLIADEL Impianto. La sopravvivenza mediana dei
pazienti con GBM è stata di 20 settimane con placebo e di 28 settimane con il trattamento con GLIADEL
Impianto.
5.2 Proprietà farmacocinetiche
L’assorbimento, la distribuzione, il metabolismo e l’escrezione del copolimero negli esseri umani non
sono noti. Le concentrazioni di carmustina somministrate da GLIADEL Impianto nel tessuto cerebrale
umano non sono state determinate. Non è stato possibile stabilire i livelli plasmatici della carmustina
dopo il posizionamento di GLIADEL Impianto. La carmustina non è stata rilevata nel sangue o nel
liquido cerebrospinale di conigli con impianti contenenti il 3,85% di carmustina.
Dopo una infusione endovenosa di carmustina a dosi comprese fra 30 e 170 mg/m , l’emivita terminale
media, la clearance e il volume stazionario di distribuzione sono rispettivamente 22 minuti, 56 ml/min/kg
e 3,25 l/kg. Il 60% circa della dose endovenosa di 200 mg/m di C-carmustina viene escreto nell’urina
in 96 ore e il 6% viene espirato sotto forma di CO .
GLIADEL Impianto è biodegradabile nel cervello umano quando posizionato nella cavità dopo la
resezione tumorale. La rapidità della biodegradazione varia a seconda del paziente. Durante il processo
di biodegradazione, si può osservare un residuo dell’impianto sulle scansioni di imaging o durante nuovi
interventi chirurgici, anche se ha avuto luogo un’ampia degradazione di tutti i componenti.
5.3 Dati preclinici di sicurezza
Non sono stati condotti studi sulla cancerogenità, mutagenicità, tossicità embrio-fetale, tossicità
prenatale e postnatale e compromissione della fertilità con GLIADEL Impianto.
La carmustina, il principio attivo di GLIADEL Impianto, se somministrata sistemicamente, ha effetti
embriotossici, teratogenici, genotossici e cancerogeni e può causare la degenerazione testicolare in
svariati modelli animali.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Polifeprosan 20
6.2 Incompatibilità
Non applicabile.
6.3 Periodo di validità
4 anni
6.4 Precauzioni particolari per la conservazione
Conservare in congelatore alla temperatura di –20 °C o inferiore.
Le buste esterne non aperte possono essere tenute a temperatura non superiore a 22 °C per un periodo
massimo di sei ore.
Il prodotto può essere ricongelato solo una volta se le buste non sono state aperte e sono state tenute per
un periodo massimo di 6 ore ad una temperatura non superiore a 22 °C. Dopo il ricongelamento, il
prodotto deve essere usato entro 30 giorni.
6.5 Natura e contenuto del contenitore
GLIADEL Impianto è disponibile in scatole contenenti otto impianti. Ciascun impianto è confezionato
individualmente in due buste laminate in alluminio.
6.6 Precauzioni particolari per lo smaltimento e altra manipolazione
Gli impianti devono essere maneggiati da personale munito di guanti chirurgici in quanto l’esposizione
alla carmustina può causare grave bruciore e iperpigmentazione della pelle. Si raccomanda di usare due
paia di guanti e di gettare dopo l’utilizzo i guanti esterni in un apposito contenitore per rifiuti a rischio
biologico. Per il posizionamento dell’impianto deve essere usato uno strumento chirurgico adatto al
maneggiamento di impianti. Se è indicato un ulteriore intervento neurochirurgico, qualsiasi impianto o
residuo di impianto deve essere maneggiato come un potenziale agente citotossico. Il prodotto
inutilizzato o i materiali di scarto devono essere smaltiti in conformità alla normativa locale vigente per
gli agenti citotossici.
GLIADEL Impianto deve essere maneggiato con cautela. Le buste contenenti GLIADEL Impianto
devono essere consegnate alla sala operatoria e rimanere chiuse fino a quando si è pronti per il
posizionamento degli impianti nella cavità della resezione. Solo la superficie esterna della busta esterna
non è sterile. Tuttavia, se un impianto viene lasciato cadere, deve essere eliminato nel modo adeguato.
Istruzioni per l’apertura delle buste contenenti l’impianto:
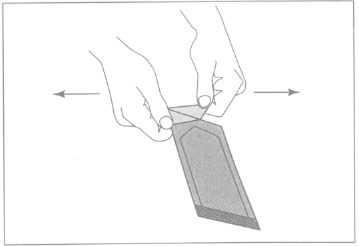
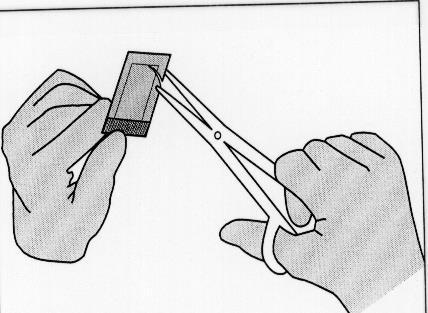
Illustrazione 1:Per aprire la busta esterna, individuare
l’angolo ripiegato e tirare lentamente con un movimento
verso l’esterno.
Illustrazione 2:Non tirare verso il basso evitando di rotolare
le nocche sulla busta, in quanto tale pressione sull’impianto
può causarne la rottura.
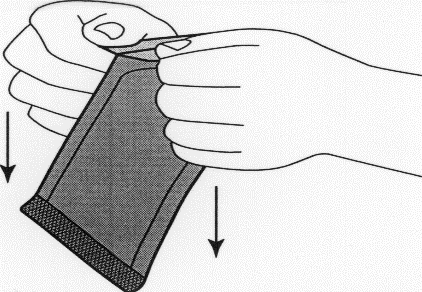
Illustrazione 3:Estrarre la busta interna con l’ausilio
di pinze chirurgiche e tirando verso l’alto.
Illustrazione 4:Per aprire la busta interna, afferrarla
delicatamente e tagliarla a semicerchio intorno all’impianto.
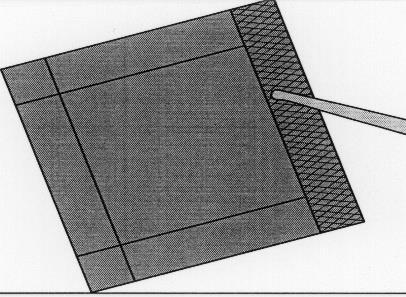
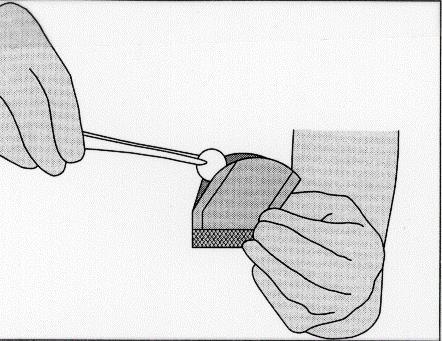
Illustrazione 5:Per estrarre l’impianto, afferrarlo
delicatamente con l’ausilio di pinze chirurgiche
e posizionarlo direttamente nella cavità di resezione.
Tuttavia, se l’impianto viene lasciato cadere, deve essere eliminato nel modo adeguato.
Dopo aver eseguito la resezione del tumore, aver confermato la patologia tumorale e ottenuto l’emostasi,
possono essere posizionati fino a otto impianti in modo da ricoprire la maggior parte possibile della
cavità di resezione. Una leggera sovrapposizione degli impianti è accettabile. È possibile usare impianti
divisi a metà, ma gli impianti suddivisi in più di due parti devono essere gettati in appositi contenitori
per lo smaltimento di rifiuti a rischio biologico.
La cellulosa ossidata rigenerata può essere posizionata sugli impianti per fissarli alla superficie della
cavità. Dopo il posizionamento degli impianti, la cavità di resezione deve essere irrigata e la dura madre
deve essere chiusa ermeticamente.
Qualsiasi prodotto non utilizzato o scartato deve essere gettato in conformità ai requisiti locali per i
rifiuti a rischio biologico.
7. TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
Clinigen Healthcare B.V.
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
Paesi Bassi
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n. 034709016
9. DATA DELLA PRIMA AUTORIZZAZIONE/ RINNOVO DELL’ AUTORIZZAZIONE
Data della prima autorizzazione: 28/05/1999
Data dell’ultimo rinnovo: 10/06/2008
10. DATA DI REVISIONE DEL TESTO
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a GLIADELForma farmaceutica: Polvere e solvente per concentrato per soluzione per infusione, 100 MGPrincipio attivo: carmustineProduttore: TILLOMED ITALIA SRLPrescrizione richiestaForma farmaceutica: Polvere e solvente per concentrato per soluzione per infusione, 100 MGPrincipio attivo: carmustineProduttore: Eugia Pharma (Malta) LimitedPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 100 MGPrincipio attivo: carmustinePrescrizione richiesta
Medici online per GLIADEL
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di GLIADEL — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





