
HEXACIMA


Come usare HEXACIMA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Hexacima sospensione iniettabile in siringa preriempita
Vaccino coniugato (adsorbito) contro difterite, tetano, pertosse (componente acellulare), epatite B
(rDNA), poliomielite (inattivato) ed Haemophilus influenzaedi tipo b
Legga attentamente questo foglio prima che il bambino venga vaccinato poiché contiene
importanti informazioni per lui.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’operatore sanitario
- Se il bambino manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’operatore sanitario. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos’è Hexacima e a cosa serve
- 2. Cosa deve sapere prima che Hexacima sia somministrato al bambino
- 3. Come Hexacima viene somministrato
- 4. Possibili effetti indesiderati
- 5. Come conservare Hexacima
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Hexacima e a cosa serve
Hexacima (DTaP-HB-IPV-Hib) è un vaccino utilizzato per proteggere dalle malattie infettive.
Hexacima contribuisce a proteggere i bambini da difterite (D), tetano (T), pertosse (aP), epatite B
(HB), poliomielite (IPV)e malattie gravi causate dall’ Haemophilus influenzaedi tipo b (Hib).
Hexacima viene somministrato ai bambini a partire da sei settimane di età.
Il vaccino agisce stimolando nell’organismo la produzione degli anticorpi contro i batteri e i virus che
provocano le diverse infezioni descritte di seguito:
- La difterite è una malattia infettiva che di solito all’inizio colpisce la gola causando dolore e gonfiore che può portare al soffocamento. I batteri all’origine della malattia producono anche una tossina (veleno) che può danneggiare il cuore, i reni e i nervi.
- Il tetano (spesso descritto con la definizione “mandibola serrata”) è solitamente causato dai batteri che penetrano in una ferita profonda. I batteri producono una tossina (veleno) che causa contrazioni muscolari con conseguente difficoltà respiratoria e possibile soffocamento.
- La pertosse (spesso detta tosse convulsa) è una malattia altamente contagiosa che colpisce le vie aeree. Il batterio della pertosse provoca una tosse intensa che può portare a problemi di respirazione. La tosse è spesso caratterizzata da un tipico “sibilo”, e può durare per uno o due mesi, o più a lungo. La pertosse può anche causare infezioni dell’orecchio, infezioni bronchiali (bronchite), che possono durare per molto tempo, infezioni polmonari (polmonite), convulsioni, danni cerebrali e anche la morte.
- L’epatite B è causata dal virus dell’epatite B, che provoca l’ingrossamento del fegato (infiammazione). In alcune persone, il virus può rimanere nell’organismo per un lungo periodo, e può portare col tempo a gravi problemi al fegato, tra cui il cancro al fegato.
- La poliomielite (spesso definita semplicemente polio) è dovuta a virus che colpiscono i nervi. Può portare alla paralisi o a debolezza muscolare, il più delle volte delle gambe. La paralisi dei muscoli che controllano la respirazione e la deglutizione può causare la morte.
- Le infezioni da Haemophilus influenzaedi tipo b (spesso dette semplicemente Hib) sono infezioni batteriche gravi e possono causare meningiti (infiammazione del rivestimento esterno del cervello), che possono portare a danni cerebrali, sordità, epilessia, o cecità parziale. L’infezione può anche causare infiammazione e gonfiore della gola portando a difficoltà nella
deglutizione e nella respirazione, e l’infezione può colpire altre parti del corpo come il sangue, i
polmoni, la pelle, le ossa e le articolazioni.
Informazioni importanti relative alla protezione fornita
- Hexacima contribuisce unicamente a prevenire queste malattie se sono causate da batteri o virus bersaglio del vaccino. Il bambino potrebbe contrarre malattie con sintomi simili se causate da altri batteri o virus.
- Il vaccino non contiene batteri o virus vivi e non può provocare alcuna delle malattie infettive che protegge.
- Il vaccino non protegge da infezioni dovute ad altri tipi di Haemophilus influenzaeo da meningiti derivanti da altri microrganismi.
- Hexacima non protegge dalle infezioni del fegato causate da altri agenti come l’epatite A, C ed E.
- Poiché i sintomi dell’epatite B richiedono un lungo periodo per svilupparsi, è possibile che infezioni da epatite B non riconosciute possano essere presenti al momento della vaccinazione. In tali casi il vaccino potrebbe non proteggere contro l’epatite B.
- Come qualsiasi altro vaccino, Hexacima potrebbe non proteggere il 100% dei bambini che ricevono il vaccino.
2. Cosa deve sapere prima che Hexacima sia somministrato al bambino
Per assicurarsi che Hexacima sia adatto per il bambino, è importante che lei informi il medico o
l’operatore sanitario se uno qualsiasi dei punti seguenti lo riguardano. Se c’è qualcosa che non
comprende, chieda spiegazioni al medico, al farmacista o all’operatore sanitario.
Hexacima non deve essere somministrato se il bambino:
- ha avuto disturbi respiratori o gonfiore del viso (reazione anafilattica) dopo la somministrazione di Hexacima
- ha avuto una reazione allergica:
- ai principi attivi
- ad uno qualsiasi degli eccipienti elencati al paragrafo 6
- alla glutaraldeide, formaldeide, neomicina, streptomicina o polimixina B, poiché queste sostanze sono utilizzate durante il processo di produzione del vaccino
- in seguito a somministrazione di Hexacima o di qualsiasi altro vaccino contenente difterite, tetano, pertosse, poliomielite, epatite B o Hib
- ha sofferto di una grave reazione che colpisce il cervello (encefalopatia) entro 7 giorni da una precedente dose di un vaccino anti-pertosse (pertosse acellulare o a cellule intere)
- presenta un disturbo incontrollato o malattia grave che colpisce il cervello (disturbo neurologico incontrollato) oppure un’epilessia incontrollata.
Avvertenze e precauzioni
Prima della vaccinazione, informi il medico, il farmacista o l’operatore sanitario se il bambino:
- presenta febbre moderata o alta o ha una malattia in fase acuta (per es. febbre, mal di gola, tosse, raffreddore o influenza). Potrebbe essere necessario rinviare la vaccinazione con Hexacima fino alla guarigione del bambino.
- abbia manifestato uno qualsiasi dei seguenti eventi in seguito alla somministrazione di un vaccino per la pertosse. In tal caso, la decisione di somministrare dosi ulteriori di vaccino contenente pertosse dovrà essere considerata con molta attenzione:
- febbre a 40°C o superiore entro 48 ore dalla vaccinazione non dovuta ad altra causa identificabile;
- collasso o stato simile a shock con episodi di ipotonia-iporesponsività (diminuzione della forza muscolare) entro 48 ore dalla vaccinazione;
- pianto persistente e inconsolabile di durata uguale o superiore a 3 ore, entro 48 ore dalla vaccinazione;
- convulsioni con o senza febbre, entro 3 giorni dalla vaccinazione.
- ha avuto precedentemente la sindrome di Guillain-Barré (infiammazione temporanea dei nervi che causa dolore, paralisi e alterazione della sensibilità) o una neurite brachiale (dolore intenso e diminuzione della mobilità del braccio e della spalla) dopo aver ricevuto un vaccino contenente il tossoide tetanico (una forma inattivata della tossina tetanica). In tal caso, la decisione di somministrare un qualsiasi altro vaccino contenente il tossoide tetanico deve essere valutata dal medico.
- sta ricevendo un trattamento che abbassa le difese immunitarie naturali dell’organismo o presenta una malattia che indebolisce il sistema immunitario. In questi casi, la risposta immunitaria al vaccino può diminuire. Si raccomanda di norma di attendere fino alla fine del trattamento o alla guarigione della malattia prima di procedere alla vaccinazione. Tuttavia, i bambini con problemi di lunga data al sistema immunitario, come l’infezione da HIV (AIDS) possono ancora ricevere Hexacima, ma la protezione può non essere buona come nei bambini con sistema immunitario sano.
- ha una malattia cronica o acuta come insufficienza renale cronica (incapacità dei reni di funzionare correttamente).
- ha una qualsiasi malattia non diagnosticata del cervello o epilessia incontrollata. Il medico valuterà il potenziale beneficio della vaccinazione.
- ha un qualsiasi disturbo del sangue che provoca facile formazione di lividi o sanguinamento prolungato in seguito a lievi tagli. Il medico le consiglierà se il bambino può ricevere Hexacima.
Può verificarsi svenimento dopo o anche prima di qualsiasi iniezione con ago. Pertanto, informi il
medico o l'infermiere se il bambino è svenuto con una precedente iniezione.
Altri medicinali o vaccini e Hexacima
Informi il medico o l’operatore sanitario se il bambino sta assumendo, ha recentemente assunto o
potrebbe assumere qualsiasi altro medicinale o vaccino.
Hexacima può essere somministrato contemporaneamente ad altri vaccini come i vaccini
pneumococcici, vaccini contro morbillo-parotite-rosolia, vaccini contro la varicella, vaccini contro-
rotavirus o vaccini meningococcici.
Se somministrato contemporaneamente ad altri vaccini, Hexacima sarà somministrato in siti separati
di iniezione.
Hexacima contiene fenilalanina, potassio e sodio
Hexacima contiene 85 microgrammi di fenilalanina in ciascuna dose da 0,5-mL. La fenilalanina può
essere dannosa per gli individui con fenilchetonuria (PKU), una rara malattia genetica in cui la
fenilalanina si accumula perché l’organismo non è in grado di eliminarla correttamente.
Hexacima contiene meno di 1 mmol di potassio (39 mg) e meno di 1 mmol di sodio (23 mg) per dose,
cioè essenzialmente "senza potassio" e "senza sodio".
3. Come Hexacima viene somministrato
Hexacima sarà somministrato al bambino da un medico o da un operatore sanitario con adeguata
formazione sull’uso dei vaccini e attrezzati per fronteggiare qualsiasi reazione allergica grave non
comune (vedere paragrafo 4 Possibili effetti indesiderati).
Hexacima viene somministrato mediante iniezione in un muscolo (via di somministrazione
intramuscolare, IM) nella parte superiore della gamba o del braccio del bambino. Il vaccino non sarà
mai iniettato in un vaso sanguigno, nella cute o sottocute.
La dose raccomandata è la seguente:
Primo ciclo di vaccinazione (vaccinazione primaria)
Il bambino riceverà due iniezioni a intervalli di due mesi o tre iniezioni a intervalli di uno o due mesi
(a distanza di almeno quattro settimane l’una dall’altra). Questo vaccino deve essere utilizzato in
accordo al programma vaccinale locale.
Iniezioni successive (richiamo)
Dopo il primo ciclo di iniezioni, il bambino riceverà una dose di richiamo, in conformità con le
raccomandazioni locali, almeno 6 mesi dopo l’ultima dose del primo ciclo. Il medico le dirà quando
questa dose deve essere somministrata.
Se il bambino non ha ricevuto una dose di Hexacima
Se il bambino non ha ricevuto un’iniezione programmata, è importante informare il medico o
l’operatore sanitario, che deciderà quando somministrarla.
È importante seguire le istruzioni del medico o dell’operatore sanitario affinché il bambino completi
l’intero ciclo di vaccinazioni. In caso contrario, il bambino potrebbe non essere completamente
protetto contro le malattie che Hexacima previene.
Se ha ulteriori domande sull’uso di questo vaccino, si rivolga al medico, al farmacista o all’operatore
sanitario.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo vaccino può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Reazioni allergiche gravi (reazione anafilattica)
Se uno qualsiasi di questi sintomi dovesse manifestarsi dopo aver lasciato il luogo (ad es. ospedale,
ambulatorio) dove è stato somministrato il vaccino al bambino, si rivolga IMMEDIATAMENTE a un
medico:
- difficoltà respiratoria
- lingua o labbra bluastre
- eruzione cutanea
- gonfiore del viso o della gola
- improvvisa e grave sensazione di malessere con abbassamento della pressione sanguigna che causa capogiri e perdita di coscienza, con disturbi respiratori associati a battito cardiaco accelerato.
Quando questi segni o sintomi di reazione anafilattica si manifestano, essi insorgono di solito subito
dopo l’iniezione e mentre il bambino si trova ancora in ospedale o nell’ambulatorio.
Reazioni allergiche gravi rappresentano un’eventualità rara (possono interessare fino ad 1 bambino su
1 000) dopo aver ricevuto questo vaccino.
Altri effetti indesiderati
Se il bambino manifesta uno qualsiasi dei seguenti effetti indesiderati, informi il medico, l’operatore
sanitario o il farmacista.
- Effetti indesiderati molto comuni (possono interessare più di 1 bambino su 10) sono:
- perdita di appetito
- pianto
- sonnolenza
- vomito
- febbre (temperatura pari a 38°C o superiore)
- irritabilità
- dolore, arrossamento o gonfiore al sito di iniezione
- Effetti indesiderati comuni (possono interessare fino a 1 bambino su 10) sono:
- pianto anomalo (prolungato)
- diarrea
- indurimento al sito di iniezione
- Effetti indesiderati non comuni (possono interessare fino a 1 bambino su 100) sono:
- reazioni allergiche
- febbre alta (temperatura pari a 39,6°C o superiore)
- nodulo al sito di iniezione
- Effetti indesiderati rari (possono interessare fino a 1 bambino su 1 000) sono:
- eruzione cutanea
- reazioni estese al sito di iniezione (più di 5 cm), compreso esteso gonfiore dell’arto dal sito di iniezione ad oltre una o entrambe le articolazioni. Tali reazioni insorgono entro 24-72 ore dalla vaccinazione, possono essere associate ad arrossamento, calore, eccessiva sensibilità o dolore al sito di iniezione e migliorano nel giro di 3-5 giorni senza bisogno di trattamenti.
- convulsioni con o senza febbre.
- Effetti indesiderati molto rari (possono interessare fino a 1 bambino su 10 000) sono:
- episodi simili a stato di shock o pallore, debolezza muscolare e diminuita responsività per un certo periodo di tempo (reazioni ipotoniche o episodi di ipotonia-iporesponsività HHE).
Effetti indesiderati potenziali
Altri effetti indesiderati non inclusi nell’elenco sopra riportato sono stati segnalati occasionalmente
con l’utilizzo di altri vaccini contenenti difterite, pertosse, poliomielite, epatite B o Hib e non
direttamente con Hexacima:
- Infiammazioni temporanee dei nervi che causano dolore, paralisi e anomalie nella sensibilità (sindrome di Guillain Barrè), dolore intenso e diminuzione nella mobilità del braccio e della spalla (neurite brachiale) sono stati segnalati in seguito alla somministrazione di vaccini contenenti tetano.
- Infiammazione di alcuni nervi che causa disturbi sensoriali o debolezza degli arti (poliradicoloneurite), paralisi facciale, disturbi visivi, attenuazione o perdita della vista (neurite ottica), malattia infiammatoria del cervello e del midollo spinale (demielinizzazione del sistema nervoso centrale, sclerosi multipla) sono stati segnalati in seguito alla somministrazione di vaccini contenenti l’antigene dell’epatite B.
- Gonfiore o infiammazione del cervello (encefalopatia/encefalite).
- Nei neonati molto prematuri (nati alla 28a settimana di gestazione o prima) si possono verificare interruzioni della respirazione più lunghe del normale che si manifestano per 2-3 giorni dopo la vaccinazione.
- Gonfiore di uno o entrambi i piedi e degli arti inferiori. Questa reazione può verificarsi insieme a una colorazione bluastra della pelle (cianosi), arrossamento, piccole aree emorragiche sotto la cute (porpora transitoria) e pianto grave in seguito alla vaccinazione con vaccini contenenti Haemophilus influenzaedi tipo b. Se queste reazioni si manifestano, esse di solito insorgono dopo le prime iniezioni e si osservano entro le prime ore successive alla vaccinazione. Tutti i sintomi dovrebbero scomparire completamente nelle 24 ore successive senza necessità di trattamenti.
Segnalazione degli effetti indesiderati
Se il bambino manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo
foglio, si rivolga al medico, al farmacista o all’operatore sanitario. Lei può inoltre segnalare gli effetti
indesiderati direttamente tramite il sistema nazionale di segnalazione riportato nell’Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Hexacima
Tenere questo vaccino fuori dalla vista e dalla portata dei bambini.
Non usare questo vaccino dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo
SCAD. La data di scadenza si riferisce all’ultimo giorno del mese.
Conservare in frigorifero (tra 2°C e 8°C).
Non congelare.
Tenere il vaccino nella scatola per proteggere il medicinale dalla luce.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Hexacima
I principi attivi sono, per dose (0,5 mL) :
Tossoide difterico non meno di 20 UI (30 Lf)
Tossoide tetanico non meno di 40 UI (10 Lf)
Antigeni della Bordetellapertussis
Tossoide pertossico 25 microgrammi
Emoagglutinina filamentosa 25 microgrammi
Poliovirus (inattivato)
Tipo 1 (Mahoney) 29 unità di antigene D
Tipo 2 (MEF-1) 7 unità di antigene D
Tipo 3 (Saukett) 26 unità di antigene D
Antigene di superficie dell’epatite B 10 microgrammi
Polisaccaride di Haemophilus influenzaedi tipo b 12 microgrammi
(poliribosilribitol fosfato)
coniugato alla proteina del tetano 22-36 microgrammi
Adsorbito su idrossido di alluminio, idratato (0,6 mg Al)
Come limite inferiore dell’intervallo di confidenza (p = 0,95) e non meno di 30 UI come valore medio
Come limite inferiore dell’intervallo di confidenza (p = 0,95)
O attività equivalente determinata dalla valutazione di immunogenicità
Coltivato su cellule Vero
Queste quantità di antigene sono rigorosamente le stesse di quelle precedentemente espresse come 40-
8-32 unità di antigene D, rispettivamente per il virus di tipo 1, 2 e 3, quando misurate con un altro
metodo immunochimico adatto
Prodotto in cellule di lievito Hansenula polymorpha mediante tecnologia del DNA ricombinante
Gli altri componenti sono:
Sodio fosfato dibasico, potassio fosfato monobasico, trometamolo, saccarosio, aminoacidi essenziali
compresa L-fenilalanina, idrossido di sodio e/o acido acetico e/o acido cloridrico (per la regolazione
del pH), e acqua per preparazioni iniettabili.
Il vaccino può contenere tracce di glutaraldeide, formaldeide, neomicina, streptomicina e polimixina
B.
Descrizione dell’aspetto di Hexacima e contenuto della confezione
Hexacima è fornito in forma di sospensione iniettabile in siringa preriempita (0,5 mL).
Hexacima è disponibile in confezioni da 1 o 10 siringhe preriempite senza ago attaccato.
Hexacima è disponibile in confezioni da 1 o 10 siringhe preriempite con un ago separato.
Hexacima è disponibile in confezioni da 1 o 10 siringhe preriempite con 2 aghi separati.
Hexacima è disponibile in confezioni da 1 o 10 siringhe preriempite con 1 ago di sicurezza separato.
È possibile che non tutte le confezioni siano commercializzate.
Dopo aver agitato la siringa preriempita, il normale aspetto del vaccino è una sospensione omogenea
biancastra torbida.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Sanofi Winthrop Industrie, 82 Avenue Raspail, 94250 Gentilly, Francia
Produttore
Sanofi Pasteur 1541 avenue Marcel Mérieux, 69280 Marcy l’Etoile, Francia
Sanofi Pasteur Parc Industriel d’Incarville, 27100 Val de Reuil, Francia
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
| België/ Belgique /Belgien Sanofi Belgium Tel: +32 2 710.54.00 | Lietuva Swixx Biopharma UAB Tel: +370 5 236 91 40 |
| България Swixx Biopharma EOOD Teл.: +359 (0)2 4942 480 | o c Luxembourg/Luxemburg Sanofi Belgium tel.: +32 2 710.54.00 |
| Česká republika Sanofi s.r.o. Tel: +420 233 086 111 | a Magyarország m sanofi-aventis zrt Tel: +36 1 505 0055 |
| Danmark Sanofi A/S Tel: +45 4516 7000 | Malta r Sanofi S.r.l. a Tel: +39 02 39394 275 |
| Deutschland Sanofi-Aventis Deutschland GmbH Tel.: 0800 54 54 010 Tel. aus dem Ausland: +49 69 305 21 130 | F Nederland Sanofi B.V.Tel: +31 20 245 4000 l |
| Eesti Swixx Biopharma OÜ Tel: +372 640 10 30 | e Norge Sanofi-aventis Norge AS d Tel: + 47 67 10 71 00 |
| Ελλάδα ΒΙΑΝΕΞ Α.Ε. Τηλ: +30.210.8009111 | Österreich a Sanofi-Aventis GmbH Tel: +43 (1) 80185-0 |
| n España a sanofi-aventis, S.A. Tel: +34 93 485 94 00 | Polska Sanofi sp. z o.o. Tel.: +48 22 280 00 00 |
| i l France a Sanofi Winthrop Industrie Tél: 0 800 222 555 t Appel depuis l’étranger : +33 1 57 63 23 23 | Portugal Sanofi – Produtos Farmacêuticos, Lda. Tel: + 351 21 35 89 400 |
| I Hrvatska Swixx Biopharma d.o.o. a Tel: +385 1 2078 500 | România Sanofi Romania SRL Tel.: +40 21 317 31 36 |
| i Ireland z sanofi-aventis Ireland T/A SANOFI Tel: + 353 (0) 1 4035 600 | Slovenija Swixx Biopharma d.o.o Tel: +386 235 51 00 |
| n Ísland e Vistor Tel : +354 535 7000 | Slovenská republika Swixx Biopharma s.r.o. Tel: +421 2 208 33 600 |
| g Italia A Sanofi S.r.l. Tel: 800536389 | Suomi/Finland Sanofi Oy Tel: +358 (0) 201 200 300 |
| Κύπρος C.A. Papaellinas Ltd. Τηλ.: +357 22 741741 | Sverige Sanofi AB Tel: +46 8-634 50 00 |
| Latvija Swixx Biopharma SIA Tel: +371 6 6164 750 | o United Kingdom (Northern Ireland) c sanofi-aventis Ireland Ltd. T/A SANOFI Tel: +44 (0) 800 035 2525 |
Altre fonti di informazione
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu.
Le ultime informazioni approvate su questo vaccino sono disponibili visitando il seguente URL:
https://hexacima.info.sanofi o scansionando il codice QR con uno smartphone:
inserire codice QR
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Agitare la siringa preriempita in modo che il contenuto diventi omogeneo.
- Non mescolare Hexacima con altri medicinali.
- Hexacima deve essere somministrato per via intramuscolare. Il sito raccomandato per l’iniezione è preferibilmente l’area antero-laterale della coscia e il muscolo deltoide nei bambini più grandi (possibilmente dai 15 mesi di età). Non somministrare per via intradermica o endovenosa. Non somministrare mediante iniezione endovascolare: assicurarsi che l’ago non penetri in un vaso sanguigno.
- Non usi le siringhe preriempite se la confezione è danneggiata.
Preparazione per la somministrazione
La siringa con la sospensione iniettabile deve essere ispezionata visivamente prima della
somministrazione. In caso di particelle estranee, perdite, attivazione prematura dello stantuffo o sigillo
difettoso della punta, gettare la siringa preriempita.
La siringa è esclusivamente monouso e non deve essere riutilizzata.
Istruzioni per l'uso della siringa preriempita Luer Lock
Figura A: siringa Luer Lock con cappuccio a punta rigida
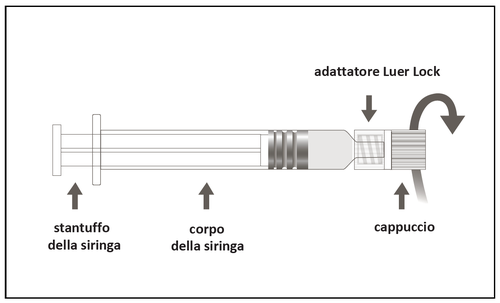
| Passaggio 1: Tenendo l'adattatore Luer Lock in una mano (evitare di tenere lo stantuffo o il corpo della siringa), svitare il cappuccio della punta ruotandolo. | m a c o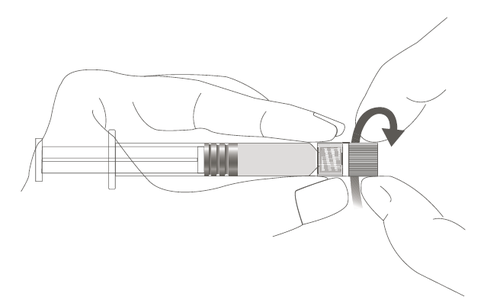 |
| Passaggio 2: Per collegare l'ago alla siringa, ruotare delicatamente l'ago nell'adattatore Luer Lock della siringa finché non si avverte una leggera resistenza. | d e l F a r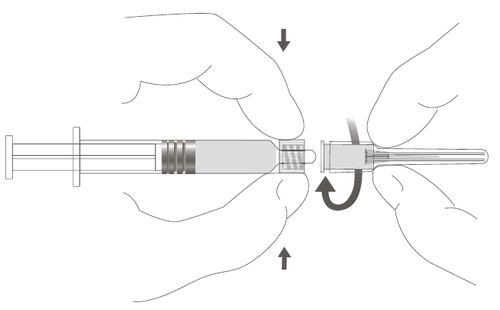 |
Istruzioni per l’uso dell’ago di sicurezza con siringa preriempita con Luer Lock
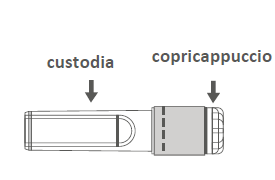
Figura B: Ago di sicurezza
(all'interno della custodia)
Figura C: Componenti dell'ago di sicurezza (predisposti per
l'uso)
Seguire i passaggi 1 e 2 sopra per preparare la siringa Luer Lock e l'ago per il collegamento.
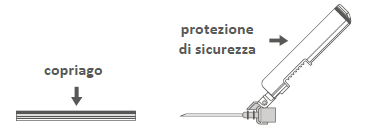
Passaggio 3:Estrarre l'ago di sicurezza dalla
custodia. L'ago è coperto dalla protezione di
sicurezza e dal copriago.
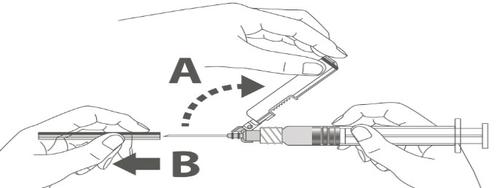
Passaggio 4:
A:Allontanare la protezione di sicurezza dall'ago
e dirigerlo verso il corpo della siringa secondo
l'angolo mostrato.
B:Estrarre il copriago.
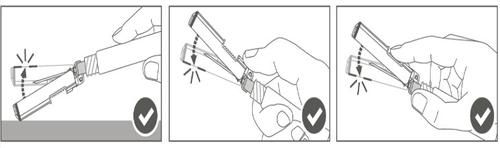
Passaggio 5:Al termine dell'iniezione, bloccare
(attivare) la protezione di sicurezza utilizzando
una delle tre (3) tecniche illustrate di attivazione
con una sola mano: superficie, pollice o dita.
Nota: l'attivazione è verificata da un "click"
acustico e/o tattile.
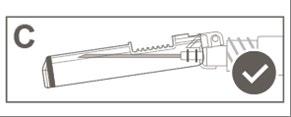
Passaggio 6:Ispezionare visivamente
l'attivazione della protezione di sicurezza. La
protezione di sicurezza deve essere
completamente bloccata (attivata) come
mostrato nell’Immagine C.
Nota: quando è completamente bloccata (attivata)
l'ago deve trovarsi ad angolo rispetto alla
protezione di sicurezza.
L’Immagine D indica che la protezione di
sicurezza NON è completamente bloccata (non
attivata).
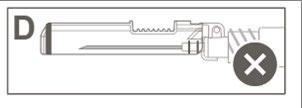
Attenzione: Non tentare di sbloccare (disattivare) il dispositivo di sicurezza forzando l'ago fuori
dalla protezione di sicurezza.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alle normative locali vigenti.
Hexacima sospensione iniettabile
Vaccino coniugato (adsorbito) contro difterite, tetano, pertosse (componente acellulare), epatite B
(rDNA), poliomielite (inattivato) ed Haemophilus influenzaedi tipo b
Legga attentamente questo foglio prima che il bambino venga vaccinato poiché contiene
importanti informazioni per lui.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’operatore sanitario
- Se il bambino manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’operatore sanitario. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos’è Hexacima e a cosa serve
- 2. Cosa deve sapere prima che Hexacima sia somministrato al bambino
- 3. Come Hexacima viene somministrato
- 4. Possibili effetti indesiderati
- 5. Come conservare Hexacima
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Hexacima e a cosa serve
Hexacima (DTaP-HB-IPV-Hib) è un vaccino utilizzato per proteggere dalle malattie infettive.
Hexacima contribuisce a proteggere i bambini da difterite (D), tetano (T), pertosse (aP), epatite B
(HB), poliomielite (IPV) e malattie gravi causate dall’ Haemophilus influenzaedi tipo b (Hib).
Hexacima viene somministrato ai bambini a partire da sei settimane di età.
Il vaccino agisce stimolando nell’organismo la produzione degli anticorpi contro i batteri e i virus che
provocano le diverse infezioni descritte di seguito:
- La difterite è una malattia infettiva che di solito all’inizio colpisce la gola causando dolore e gonfiore che può portare al soffocamento. I batteri all’origine della malattia producono anche una tossina (veleno) che può danneggiare il cuore, i reni e i nervi.
- Il tetano (spesso descritto con la definizione “mandibola serrata”) è solitamente causato dai batteri che penetrano in una ferita profonda. I batteri producono una tossina (veleno) che causa contrazioni muscolari con conseguente difficoltà respiratoria e possibile soffocamento.
- La pertosse (spesso detta tosse convulsa) è una malattia altamente contagiosa che colpisce le vie aeree. Il batterio della pertosse provoca una tosse intensa che può portare a problemi di respirazione. La tosse è spesso caratterizzata da un tipico “sibilo”, e può durare per uno o due mesi, o più a lungo. La pertosse può anche causare infezioni dell’orecchio, infezioni bronchiali (bronchite), che possono durare per molto tempo, infezioni polmonari (polmonite), convulsioni, danni cerebrali e anche la morte.
- L’epatite B è causata dal virus dell’epatite B, che provoca l’ingrossamento del fegato (infiammazione). In alcune persone, il virus può rimanere nell’organismo per un lungo periodo, e può portare col tempo a gravi problemi al fegato, tra cui il cancro al fegato.
- La poliomielite (spesso definita semplicemente polio) è dovuta a virus che colpiscono i nervi. Può portare alla paralisi o a debolezza muscolare, il più delle volte delle gambe. La paralisi dei muscoli che controllano la respirazione e la deglutizione può causare la morte.
- Le infezioni da Haemophilus influenzaedi tipo b (spesso dette semplicemente Hib) sono infezioni batteriche gravi e possono causare meningiti (infiammazione del rivestimento esterno del cervello), che possono portare a danni cerebrali, sordità, epilessia, o cecità parziale. L’infezione può anche causare infiammazione e gonfiore della gola portando a difficoltà nella
deglutizione e nella respirazione, e l’infezione può colpire altre parti del corpo come il sangue, i
polmoni, la pelle, le ossa e le articolazioni.
Informazioni importanti relative alla protezione fornita
- Hexacima contribuisce unicamente a prevenire queste malattie se sono causate da batteri o virus bersaglio del vaccino. Il bambino potrebbe contrarre malattie con sintomi simili se causate da altri batteri o virus.
- Il vaccino non contiene batteri o virus vivi e non può provocare alcuna delle malattie infettive che protegge.
- Il vaccino non protegge da infezioni dovute ad altri tipi di Haemophilus influenzaeo da meningiti derivanti da altri microrganismi.
- Hexacima non protegge dalle infezioni del fegato causate da altri agenti come l’epatite A, C ed E.
- Poiché i sintomi dell’epatite B richiedono un lungo periodo per svilupparsi, è possibile che infezioni da epatite B non riconosciute possano essere presenti al momento della vaccinazione. In tali casi il vaccino potrebbe non proteggere control’epatite B.
- Come qualsiasi altro vaccino, Hexacima potrebbe non proteggere il 100% dei bambini che ricevono il vaccino.
2. Cosa deve sapere prima che Hexacima sia somministrato al bambino
Per assicurarsi che Hexacima sia adatto per il bambino, è importante che lei informi il medico o
l’operatore sanitario se uno qualsiasi dei punti seguenti lo riguardano. Se c’è qualcosa che non
comprende, chieda spiegazioni al medico, al farmacista o all’operatore sanitario.
Hexacima non deve essere somministrato se il bambino:
- ha avuto disturbi respiratori o gonfiore del viso (reazione anafilattica) dopo la somministrazione di Hexacima
- ha avuto una reazione allergica
- ai principi attivi
- ad uno qualsiasi degli eccipienti elencati al paragrafo 6
- alla glutaraldeide, formaldeide, neomicina, streptomicina o polimixina B, poiché queste sostanze sono utilizzate durante il processo di produzione del vaccino
- in seguito a somministrazione di Hexacima o di qualsiasi altro vaccino contenente difterite, tetano, pertosse, poliomielite, epatite B o Hib
- ha sofferto di una grave reazione che colpisce il cervello (encefalopatia) entro 7 giorni da una precedente dose di un vaccino anti-pertosse (pertosse acellulare o a cellule intere)
- presenta un disturbo incontrollato o malattia grave che colpisce il cervello (disturbo neurologico incontrollato) oppure un’epilessia incontrollata.
Avvertenze e precauzioni
Prima della vaccinazione, informi il medico, il farmacista o l’operatore sanitario se il bambino:
- presenta febbre moderata o alta o ha una malattia in fase acuta (per es. febbre, mal di gola, tosse, raffreddore o influenza). Potrebbe essere necessario rinviare la vaccinazione con Hexacima fino alla guarigione del bambino.
- abbia manifestato uno qualsiasi dei seguenti eventi in seguito alla somministrazione di un vaccino per la pertosse. In tal caso, la decisione di somministrare dosi ulteriori di vaccino contenente pertosse dovrà essere considerata con molta attenzione:
- febbre a 40°C o superiore entro 48 ore dalla vaccinazione non dovuta ad altra causa identificabile;
- collasso o stato simile a shock con episodi di ipotonia-iporesponsività (diminuzione della forza muscolare) entro 48 ore dalla vaccinazione;
- pianto persistente e inconsolabile di durata uguale o superiore a 3 ore, entro 48 ore dalla vaccinazione;
- convulsioni con o senza febbre, entro 3 giorni dalla vaccinazione.
- ha avuto precedentemente la sindrome di Guillain-Barré (infiammazione temporanea dei nervi che causa dolore, paralisi e alterazione della sensibilità) o una neurite brachiale (dolore intenso e diminuzione della mobilità del braccio e della spalla) dopo aver ricevuto un vaccino contenente il tossoide tetanico (una forma inattivata della tossina tetanica). In tal caso, la decisione di somministrare un qualsiasi altro vaccino contenente il tossoide tetanico deve essere valutata dal medico.
- sta ricevendo un trattamento che abbassa le difese immunitarie naturali dell’organismo o presenta una malattia che indebolisce il sistema immunitario. In questi casi, la risposta immunitaria al vaccino può diminuire. Si raccomanda di norma di attendere fino alla fine del trattamento o alla guarigione della malattia prima di procedere alla vaccinazione. Tuttavia, i bambini con problemi di lunga data al sistema immunitario, come l’infezione da HIV (AIDS) possono ancora ricevere Hexacima, ma la protezione può non essere buona come nei bambini con sistema immunitario sano.
- ha una malattia cronica o acuta come insufficienza renale cronica (incapacità dei reni di funzionare correttamente).
- ha una qualsiasi malattia non diagnosticata del cervello o epilessia incontrollata. Il medico valuterà il potenziale beneficio della vaccinazione.
- ha un qualsiasi disturbo del sangue che provoca facile formazione di lividi o sanguinamento prolungato in seguito a lievi tagli. Il medico le consiglierà se il bambino può ricevere Hexacima.
Può verificarsi svenimento dopo o anche prima di qualsiasi iniezione con ago. Pertanto, informi il
medico o l'infermiere se il bambino è svenuto con una precedente iniezione.
Altri medicinali o vaccini e Hexacima
Informi il medico o l’operatore sanitario se il bambino sta assumendo, ha recentemente assunto o
potrebbe assumere qualsiasi altro medicinale o vaccino.
Hexacima può essere somministrato contemporaneamente ad altri vaccini come i vaccini
pneumococcici, vaccini contro morbillo-parotite-rosolia, vaccini contro la varicella, vaccini contro-
rotavirus o vaccini meningococcici.
Se somministrato contemporaneamente ad altri vaccini, Hexacima sarà somministrato in siti separati
di iniezione.
Hexacima contiene fenilalanina, potassio e sodio
Hexacima contiene 85 microgrammi di fenilalanina in ciascuna dose da 0,5-mL. La fenilalanina può
essere dannosa per gli individui con fenilchetonuria (PKU), una rara malattia genetica in cui la
fenilalanina si accumula perché l’organismo non è in grado di eliminarla correttamente.
Hexacima contiene meno di 1 mmol di potassio (39 mg) e meno di 1 mmol di sodio (23 mg) per dose,
cioè essenzialmente "senza potassio" e "senza sodio".
3. Come Hexacima viene somministrato
Hexacima sarà somministrato al bambino da un medico o da un operatore sanitario con adeguata
formazione sull’uso dei vaccini e attrezzati per fronteggiare qualsiasi reazione allergica grave non
comune (vedere paragrafo 4 Possibili effetti indesiderati).
Hexacima viene somministrato mediante iniezione in un muscolo (via di somministrazione
intramuscolare, IM) nella parte superiore della gamba o del braccio del bambino. Il vaccino non sarà
mai iniettato in un vaso sanguigno, nella cute o sottocute.
La dose raccomandata è la seguente:
Primo ciclo di vaccinazione (vaccinazione primaria)
Il bambino riceverà due iniezioni a intervalli di due mesi o tre iniezioni a intervalli di uno o due mesi
(a distanza di almeno quattro settimane l’una dall’altra). Questo vaccino deve essere utilizzato in
accordo al programma vaccinale locale.
Iniezioni successive (richiamo)
Dopo il primo ciclo di iniezioni, il bambino riceverà una dose di richiamo, in conformità con le
raccomandazioni locali, almeno 6 mesi dopo l’ultima dose del primo ciclo. Il medico le dirà quando
questa dose deve essere somministrata.
Se il bambino non ha ricevuto una dose di Hexacima
Se il bambino non ha ricevuto un’iniezione programmata, è importante informare il medico o
l’operatore sanitario, che deciderà quando somministrarla.
È importante seguire le istruzioni del medico o dell’operatore sanitario affinché il bambino completi
l’intero ciclo di vaccinazioni. In caso contrario, il bambino potrebbe non essere completamente
protetto contro le malattie che Hexacima previene.
Se ha ulteriori domande sull’uso di questo vaccino, si rivolga al medico, al farmacista o all’operatore
sanitario.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo vaccino può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Reazioni allergiche gravi (reazione a anafilattica)
Se uno qualsiasi di questi sintomi dovesse manifestarsi dopo aver lasciato il luogo (ad es. ospedale,
ambulatorio) dove è stato somministrato il vaccino al bambino, si rivolga IMMEDIATAMENTE a un
medico:
- difficoltà respiratoria
- lingua o labbra bluastre
- eruzione cutanea
- gonfiore del viso o della gola
- improvvisa e grave sensazione di malessere con abbassamento della pressione sanguigna che causa capogiri e perdita di coscienza, con disturbi respiratori associati a battito cardiaco accelerato.
Quando questi segni o sintomi di reazione anafilattica si manifestano, essi insorgono di solito subito
dopo l’iniezione e mentre il bambino si trova ancora in ospedale o nell’ambulatorio.
Reazioni allergiche gravi rappresentano un’eventualità rara (possono interessare fino ad 1 bambino su
1 000) dopo aver ricevuto questo vaccino.
Altri effetti indesiderati
Se il bambino manifesta uno qualsiasi dei seguenti effetti indesiderati, informi il medico, l’operatore
sanitario o il farmacista.
- Effetti indesiderati molto comuni (possono interessare più di 1 bambino su 10) sono:
- perdita di appetito
- pianto
- sonnolenza
- vomito
- febbre (temperatura pari a 38°C o superiore)
- irritabilità
- dolore, arrossamento o gonfiore al sito di iniezione
- Effetti indesiderati comuni (possono interessare fino a 1 bambino su 10) sono:
- pianto anomalo (prolungato)
- diarrea
- indurimento al sito di iniezione
- Effetti indesiderati non comuni (possono interessare fino a 1 bambino su 100) sono:
- reazioni allergiche
- febbre alta (temperatura pari a 39,6°C o superiore)
- nodulo al sito di iniezione
- Effetti indesiderati rari (possono interessare fino a 1 bambino su 1 000) sono:
- eruzione cutanea
- reazioni estese al sito di iniezione (più di 5 cm), compreso esteso gonfiore dell’arto dal sito di iniezione ad oltre una o entrambe le articolazioni. Tali reazioni insorgono entro 24-72 ore dalla vaccinazione, possono essere associate ad arrossamento, calore, eccessiva sensibilità o dolore al sito di iniezione e migliorano nel giro di 3-5 giorni senza bisogno di trattamenti.
- convulsioni con o senza febbre.
- Effetti indesiderati molto rari (possono interessare fino a 1 bambino su 10 000) sono:
- episodi simili a stato di shock o pallore, debolezza muscolare e diminuita responsività per un certo periodo di tempo (reazioni ipotoniche o episodi di ipotonia-iporesponsività HHE).
Effetti indesiderati potenziali
Altri effetti indesiderati non inclusi nell’elenco sopra riportato sono stati segnalati occasionalmente
con l’utilizzo di altri vaccini contenenti difterite, pertosse, poliomielite, epatite B o Hib e non
direttamente con Hexacima:
- Infiammazioni temporanee dei nervi che causano dolore, paralisi e anomalie nella sensibilità (sindrome di Guillain Barrè), dolore intenso e diminuzione nella mobilità del braccio e della spalla (neurite brachiale) sono stati segnalati in seguito alla somministrazione di vaccini contenenti tetano.
- Infiammazione di alcuni nervi che causa disturbi sensoriali o debolezza degli arti (poliradicoloneurite), paralisi facciale, disturbi visivi, attenuazione o perdita della vista (neurite ottica), malattia infiammatoria del cervello e del midollo spinale (demielinizzazione del sistema nervoso centrale, sclerosi multipla) sono stati segnalati in seguito alla somministrazione di vaccini contenenti l’antigene dell’epatite B.
- Gonfiore o infiammazione del cervello (encefalopatia/encefalite).
- Nei neonati molto prematuri (nati alla 28a settimana di gestazione o prima) si possono verificare interruzioni della respirazione più lunghe del normale che si manifestano per 2-3 giorni dopo la vaccinazione.
- Gonfiore di uno o entrambi i piedi e degli arti inferiori. Questa reazione può verificarsi insieme a una colorazione bluastra della pelle (cianosi), arrossamento, piccole aree emorragiche sotto la cute (porpora transitoria) e pianto grave in seguito alla vaccinazione con vaccini contenenti Haemophilus influenzaedi tipo b. Se queste reazioni si manifestano, esse di solito insorgono dopo le prime iniezioni e si osservano entro le prime ore successive alla vaccinazione. Tutti i sintomi dovrebbero scomparire completamente nelle 24 ore successive senza necessità di trattamenti.
Segnalazione degli effetti indesiderati
Se il bambino manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo
foglio, si rivolga al medico, al farmacista o all’operatore sanitario. Lei può inoltre segnalare gli effetti
indesiderati direttamente tramite il sistema nazionale di segnalazione riportato nell’Allegato V.
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Hexacima
Tenere questo vaccino fuori dalla vista e dalla portata dei bambini.
Non usare questo vaccino dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo
SCAD. La data di scadenza si riferisce all’ultimo giorno del mese.
Conservare in frigorifero (tra 2°C e 8°C).
Non congelare.
Tenere il vaccino nella scatola per proteggere il medicinale dalla luce.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Hexacima
I principi attivi sono, per dose (0,5 mL) :
Tossoide difterico non meno di 20 UI (30 Lf)
Tossoide tetanico non meno di 40 UI (10 Lf)
Antigeni della Bordetellapertussis
Tossoide pertossico 25 microgrammi
Emoagglutinina filamentosa 25 microgrammi
Poliovirus (inattivato)
Tipo 1 (Mahoney) 29 unità di antigene D
Tipo 2 (MEF-1) 7 unità di antigene D
Tipo 3 (Saukett) 26 unità di antigene D
Antigene di superficie dell’epatite B 10 microgrammi
Polisaccaride di Haemophilus influenzaedi tipo b 12 microgrammi
(poliribosilribitol fosfato)
coniugato alla proteina del tetano 22-36 microgrammi
Adsorbito su idrossido di alluminio, idratato (0,6 mg Al)
Come limite inferiore dell’intervallo di confidenza (p = 0,95) e non meno di 30 UI come valore medio
Come limite inferiore dell’intervallo di confidenza (p = 0,95)
O attività equivalente determinata dalla valutazione di immunogenicità
Coltivato su cellule Vero
Queste quantità di antigene sono rigorosamente le stesse di quelle precedentemente espresse come
40-8-32 unità di antigene D, rispettivamente per il virus di tipo 1, 2 e 3, quando misurate con un altro
metodo immunochimico adatto
Prodotto in cellule di lievito Hansenula polymorpha mediante tecnologia del DNA ricombinante
Gli altri componenti sono:
Sodio fosfato dibasico, potassio fosfato monobasico, trometamolo, saccarosio, aminoacidi essenziali
compresa L-fenilalanina, idrossido di sodio e / o acido acetico e / o acido cloridrico (per la regolazione
del pH) e acqua per preparazioni iniettabili.
Il vaccino può contenere tracce di glutaraldeide, formaldeide, neomicina, streptomicina e polimixina
B.
Descrizione dell’aspetto di Hexacima e contenuto della confezione
Hexacima è fornito in forma di sospensione iniettabile in flaconcino (0,5 mL).
Hexacima è disponibile in confezioni da 10 flaconcini.
Dopo aver agitato il flaconcino, il normale aspetto del vaccino è una sospensione omogenea biancastra
torbida.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Sanofi Winthrop Industrie, 82 Avenue Raspail, 94250 Gentilly, Francia
Produttore
Sanofi Pasteur 1541 avenue Marcel Mérieux, 69280 Marcy l’Etoile, Francia
Sanofi Pasteur Parc Industriel d’Incarville, 27100 Val de Reuil, Francia
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
| België/ Belgique /Belgien Sanofi Belgium Tel: +32 2 710.54.00 | Lietuva Swixx Biopharma UAB o Tel: +370 5 236 91 40 |
| България Swixx Biopharma EOOD Teл.: +359 (0)2 4942 480 | c Luxembourg/Luxemburg Sanofi Belgium a Tel: +32 2 710.54.00 |
| Česká republika Sanofi s.r.o. Tel: +420 233 086 111 | m Magyarország SANOFI-AVENTIS Zrt Tel: +36 1 505 0055 |
| Danmark Sanofi A/S Tel: +45 4516 7000 | r Malta a Sanofi S.r.l. Tel: +39 02 39394 275 |
| Deutschland Sanofi-Aventis Deutschland GmbH Tel: 0800 54 54 010 Tel. aus dem Ausland: +49 69 305 21 130 | F Nederland Sanofi B.V. l Tel: +31 20 245 4000 |
| Eesti Swixx Biopharma OÜ Tel: +372 640 10 30 | e Norge d Sanofi-aventis Norge AS Tel: + 47 67 10 71 00 |
| Ελλάδα ΒΙΑΝΕΞ Α.Ε. n Τηλ: +30.210.8009111 | a Österreich Sanofi-Aventis GmbH Tel: +43 (1) 80185-0 |
| a España sanofi-aventis, S.A. i Tel: +34 93 485 94 00 | Polska Sanofi sp. z o.o. Tel: +48 22 280 00 00 |
| l a France Sanofi Winthrop Industrie t Tel: 0 800 222 555 I Appel depuis l’étranger : +33 1 57 63 23 23 | Portugal Sanofi – Produtos Farmacêuticos, Lda. Tel: + 351 21 35 89 400 |
| Hrvatska a Swixx Biopharma d.o.o. Tel: +385 1 2078 500 | România Sanofi Romania SRL Tel: +40 21 317 31 36 |
| i z Ireland sanofi-aventis Ireland T/A SANOFI n Tel: + 353 (0) 1 4035 600 | Slovenija Swixx Biopharma d.o.o Tel: +386 235 51 00 |
| e Ísland Vistor g Tel: +354 535 7000 | Slovenská republika Swixx Biopharma s.r.o. Tel: +421 2 208 33 600 |
| A Italia Sanofi S.r.l. Tel: 800536389 | Suomi/Finland Sanofi Oy Tel: +358 (0) 201 200 300 |
| Κύπρος C.A. Papaellinas Ltd. Τηλ.: +357 22 741741 | Sverige Sanofi AB Tel: +46 8-634 50 00 |
| Latvija Swixx Biopharma SIA Tel: +371 6 6164 750 | o c United Kingdom (Northern Ireland) sanofi-aventis Ireland Ltd. T/A SANOFI a Tel: +44 (0) 800 035 2525 |
Altre fonti di informazione
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, http://www.ema.europa.eu.
Le ultime informazioni approvate su questo vaccino sono disponibili visitando il seguente URL:
https://hexacima.info.sanofi o scansionando il codice QR con uno smartphone:
inserire codice QR
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Il flaconcino è esclusivamente monouso e non deve essere riutilizzato.
- Agitare il flaconcino in modo che il contenuto diventi omogeneo.
- Una dose da 0,5 mL viene prelevata con una siringa per l’iniezione.
- Non mescolare Hexacima con altri medicinali.
- Hexacima deve essere somministrato per via intramuscolare. Il sito raccomandato per l’iniezione è preferibilmente l’area antero-laterale della coscia e il muscolo deltoide nei bambini più grandi (possibilmente dai 15 mesi di età). Non somministrare per via intradermica o endovenosa. Non somministrare mediante iniezione endovascolare: assicurarsi che l’ago non penetri in un vaso sanguigno.
- Non usi i flaconcini se la confezione è danneggiata.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alle normative locali vigenti.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaNo
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a HEXACIMAForma farmaceutica: Sospensione iniettabile, 0,5MLProduttore: SANOFI WINTHROP INDUSTRIEPrescrizione non richiestaForma farmaceutica: Polvere e solvente per sospensione iniettabile, 0,5 MLProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiestaForma farmaceutica: Sospensione iniettabile in siringa pre-riempita, 0,5 MLPrincipio attivo: diphtheria-pertussis-poliomyelitis-tetanusProduttore: GLAXOSMITHKLINE S.P.A.Prescrizione non richiesta
Medici online per HEXACIMA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di HEXACIMA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














