
IDELVION

Come usare IDELVION
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
IDELVION 250 UI polvere e solvente per soluzione iniettabile, 500 UI polvere e solvente per soluzione iniettabile, 1 000 UI polvere e solvente per soluzione iniettabile, 2 000 UI polvere e solvente per soluzione iniettabile, 3 500 UI polvere e solvente per soluzione iniettabile
albutrepenonacog alfa (fattore IX della coagulazione ricombinante)
contiene importanti informazioni per lei.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista o all’infermiere. Vedere paragrafo 4.
- 1. Che cos’è IDELVION e a cosa serve
- 2. Cosa deve sapere prima di prendere IDELVION
- 3. Come prendere IDELVION
- 4. Possibili effetti indesiderati
- 5. Come conservare IDELVION
- 6. Contenuto della confezione e altre informazioni
1. Che cos’è IDELVION e a cosa serve
Che cos’è IDELVION?
IDELVION è un medicinale per l’emofilia che sostituisce il fattore IX della coagulazione naturale.
Il principio attivo di IDELVION è albutrepenonacog alfa proteina ricombinante di fusione
costituita dal fattore IX della coagulazione con albumina (rIX-FP)).
Il fattore IX è coinvolto nella coagulazione del sangue. I pazienti affetti da emofilia B presentano una
carenza di questo fattore che fa sì che il sangue non coaguli alla velocità normale e questo provoca una
tendenza alle emorragie. IDELVION agisce sostituendo il fattore IX nei pazienti con emofilia B per
consentire al sangue di coagulare.
A cosa serve IDELVION?
IDELVION viene usato per prevenire o arrestare i sanguinamenti causati dalla carenza del
fattore IX in pazienti di tutti i gruppi di età con emofilia B (nota anche come deficienza
congenita di fattore IX o malattia di Christmas).
2. Cosa deve sapere prima di prendere IDELVION
Non prenda IDELVION
- Se è allergico al principio attivo (albutrepenonacog alfa) o a uno qualsiasi degli altri componenti (elencati nel paragrafo 6).
- Se è allergico alle proteine di criceto.
Avvertenze e precauzioni
È fortemente raccomandato ad ogni utilizzo di IDELVION di registrare il nome ed il numero di lotto
del prodotto per tenere traccia dei prodotti e dei numeri di lotto utilizzati.
Si rivolga al medico o al farmacista o all’infermiere prima di prendere IDELVION.
- Sono possibili reazioni di ipersensibilità di tipo allergico. Il medicinale contiene tracce di proteine di criceto (Vedere anche “Non prenda IDELVION”). In caso di comparsa di sintomidi reazioni allergiche, interrompa immediatamente l’uso del medicinale e si rivolga almedico o al centro di cura dove viene seguito. Il medico la informerà in merito ai primisegni di reazioni di ipersensibilità. Queste includono: orticaria, eruzione cutanea generalizzata, costrizione toracica, respiro sibilante, bassa pressione del sangue (ipotensione) ed anafilassi (grave reazione allergica che causa gravi difficoltà respiratorie o capogiro).
- A causa del rischio di reazioni allergiche con il fattore IX, la prima somministrazione di IDELVION deve essere effettuata sotto stretta osservazione medica nell’eventualità che si debba intervenire con cure appropriate per le reazioni allergiche.
- La formazione di inibitori(anticorpi neutralizzanti) è una complicanza nota che è stata osservata durante il trattamento con IDELVION. Gli inibitori impediscono al trattamento stesso di funzionare correttamente. Se IDELVION non ha efficacia contro gli episodi di sanguinamento, informi immediatamente il medico. Occorre essere regolarmente monitorati per l’eventuale sviluppo di inibitori.
- Se soffre di malattie del fegato o del cuore o se ha recentemente subito interventi di chirurgia maggiore, è pregato di informare il medico, poiché vi è un aumentato rischio di complicanze per formazione di coaguli (coagulazione).
- Se è necessario un dispositivo di accesso venoso centrale (CVAD per l’iniezione di IDELVION), il medico deve considerare il rischio di complicanze tra cui infezioni locali, batteri nel sangue (batteriemia) e formazione di un coagulo di sangue nel vaso sanguigno (trombosi) dove il catetere viene inserito.
Altri medicinali e IDELVION
- Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale.
Gravidanza e allattamento
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno chieda consiglio al medico o al farmacista prima di prendere questo medicinale. Durante la gravidanza e l’allattamento, IDELVION deve essere somministrato solo in caso di effettiva necessità. Guida di veicoli e utilizzo di macchinariIDELVION non influenza la capacità di guidare veicoli e usare macchinari.
IDELVION contiene sodio
Questo medicinale contiene fino a 8,6 mg di sodio (principale componente del sale da cucina) in ogni
flaconcino. Questo equivale allo 0,4% dell'assunzione massima giornaliera raccomandata di sodio per
un adulto.
3. Come prendere IDELVION
Il trattamento deve essere iniziato sotto la supervisione di un medico esperto nel trattamento dei
disturbi della coagulazione.
Prenda sempre questo medicinale seguendo esattamente le istruzioni del medico. Verificare con il
proprio medico se non si è sicuri.
Il medico stabilirà la dose necessaria di IDELVION. La quantità di IDELVION necessaria da
assumere e la durata del trattamento dipende da quanto segue:
- la gravità della malattia
- la sede e l’intensità dell’emorragia
- le condizioni cliniche e la risposta
- il peso corporeo
IDELVION è somministrato dal suo medico o infermiere mediante iniezione in vena (intravenosa, IV)
dopo ricostituzione della polvere con il solvente fornito. Lei stesso o qualcun altro potrebbe
somministrare IDELVION mediante iniezione endovenosa, ma solo dopo aver ricevuto una
formazione adeguata.
Se ha assunto una dose eccessiva di IDELVION
Informi immediatamente il medico in caso di iniezione di una dose di IDELVION superiore a quella
raccomandata dal medico.
Se interrompe l’assunzione di IDELVION
Non interrompa l’assunzione di IDELVION senza consultare il medico.
Ricostituzione e somministrazione
Istruzioni generali
- La polvere deve essere miscelata con il solvente (liquido) ed estratta dal flaconcino mantenendo il medicinale sterile (privo di germi). Il medico le mostrerà come preparare la soluzione e come prelevare correttamente la soluzione dal flaconcino.
- IDELVION non deve essere miscelato con altri medicinali, o solventi ad eccezione di quelli elencati nel paragrafo 6.
- La soluzione deve essere limpida o leggermente opalescente, da gialla a incolore, può presentare un certo scintillio se esposta alla luce ma non deve contenere particelle evidenti. Dopo filtrazione/prelievo (vedere di seguito), la soluzione ricostituita deve essere controllata visivamente prima della somministrazione. Non usare la soluzione se si presenta torbida o se contiene depositi o particelle.
- Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente e secondo le istruzioni del medico.
Ricostituzione
Senza aprire i flaconcini, portare la polvere di IDELVION e il liquido a temperatura ambiente o alla
temperatura corporea. Ciò può essere fatto lasciando i flaconcini a temperatura ambiente per circa
un’ora oppure tenendoli in mano per qualche minuto.
NON esporre i flaconcini al calore diretto. I flaconcini non devono essere portati a temperature
superiori a quella corporea (37 °C).
Rimuovere con cura la ghiera protettiva dai flaconcini e pulire il tappo di gomma esposto con un
tampone imbevuto d’alcool. Lasciar asciugare i flaconcini prima di aprire la confezione del Mix2Vial
(contenente il dispositivo di trasferimento con filtro) e, quindi, seguire le istruzioni sottostanti.
e g 1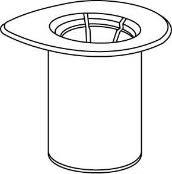 |
|
2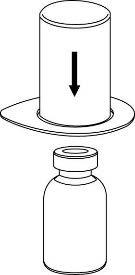 |
|
3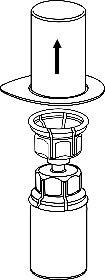 | a
|
4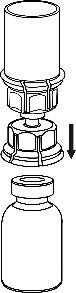 | a F
|
5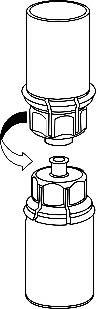 | d
|
6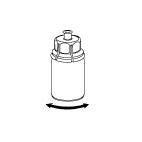 | a i
|
I a i z n 7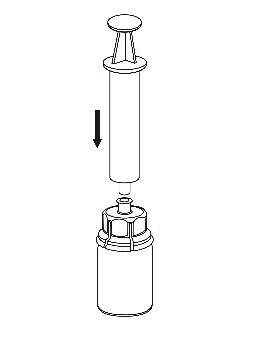 | t
|
Prelievo e somministrazione
8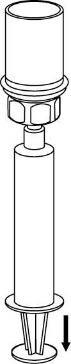 |
|
9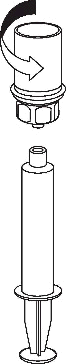 | m
|
Usare il dispositivo per l'iniezione in vena fornito assieme al prodotto, inserendo l’ago in una vena.
Lasciar rifluire il sangue all'estremità del tubo. Applicare la siringa all’estremità filettata di chiusura
del dispositivo per l'iniezione in vena. Iniettare la soluzione ricostituita lentamente (come è più
confortevole, fino a un massimo di 5 mL/min) nella venaseguendo le istruzioni fornite dal medico.
Evitare di far entrare sangue nella siringa contenente il medicinale.
Controlli gli effetti indesiderati che possono presentarsi nell’immediato. Se nota la comparsa di effetti
indesiderati che possono essere legati alla somministrazione di IDELVION, dovrà interrompere le
somministrazioni (vedere anche paragrafi 2 e 4).
Se ha altre domande sull’uso di questo medicinale, consulti il medico o il farmacista o l’infermiere.
4. Possibili effetti indesiderati
Come tutti i farmaci, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino.
Contatti il medico immediatamente:
- se nota sintomi di reazioni allergiche (vedere sotto)
- se nota che il medicinale non funziona più correttamente
I seguenti effetti indesiderati sono stati osservati con i medicinali contenenti fattore IX:
- Reazioni di ipersensibilità di tipo allergico sono possibili (comuni) e possono includere i seguenti sintomi: orticaria, eruzione cutanea (orticaria generalizzata), costrizione toracica, respiro sibilante, bassa pressione sanguigna (ipotensione) ed anafilassi (seria reazione allergica che causa gravi difficoltà respiratorie o capogiri). In questi casi, interrompere immediatamente l’assunzione del medicinale e contattare il medico.
- Inibitori: il medicinale non funziona più correttamente (sanguinamento continuo). È possibile che si sia sviluppato un inibitore (anticorpo neutralizzante) contro il fattore IX (frequenza non nota), nel qual caso il fattore IX non agisce più correttamente. In questi casi, interrompere immediatamente l’assunzione del medicinale e contattare il medico.
I seguenti effetti indesiderati sono stati osservati comunementecon IDELVION (possono colpire 1
persona su 10):
- Cefalea
- Reazioni in sede di iniezione
- Capogiri
- Eruzione cutanea
I seguenti effetti indesiderati si sono presentati non comunemente(possono colpire 1 persona su 100):
- Eczema
Effetti indesiderati nei bambini e negli adolescenti
Gli effetti indesiderati che possono verificarsi nei bambini sono gli stessi degli adulti.
Segnalazione degli effetti indesiderati
Se nota la comparsa di un qualsiasi effetto indesiderato, anche non elencato in questo foglio
illustrativo, informi il medico o il farmacista o l’infermiere. È possibile inoltre segnalare gli effetti
indesiderati direttamente tramite il sistema nazionale di segnalazione riportato all’indirizzo:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Segnalando gli effetti indesiderati, si può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
5. Come conservare IDELVION
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza, indicata sull’etichetta e sulla scatola.
- Non conservare a temperatura superiore a 25 °C.
- Non congelare.
- Conservi il flaconcino nella confezione esterna, al fine di proteggerlo dalla luce.
- Il medicinale ricostituito deve preferibilmente essere usato immediatamente.
- Se il medicinale ricostituito non viene somministrato immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono sotto la responsabilità dell’utilizzatore.
6. Contenuto della confezione e altre informazioni
Cosa contiene IDELVION
Il principio attivo è il seguente:
250 UI per flaconcino; dopo la ricostituzione con 2,5 mL di acqua per preparazioni iniettabili, la
soluzione contiene 100 UI/mL di albutrepenonacog alfa.
500 UI per flaconcino; dopo la ricostituzione con 2,5 mL di acqua per preparazioni iniettabili, la
soluzione contiene 200 UI/mL di albutrepenonacog alfa.
1 000 UI per flaconcino; dopo la ricostituzione con 2,5 mL di acqua per preparazioni iniettabili, la
soluzione contiene 400 UI/mL di albutrepenonacog alfa.
2 000 UI per flaconcino; dopo la ricostituzione con 5 mL di acqua per preparazioni iniettabili, la
soluzione contiene 400 UI/mL di di albutrepenonacog alfa.
3 500 UI per flaconcino; dopo la ricostituzione con 5 mL di acqua per preparazioni iniettabili, la
soluzione contiene 700 UI/mL di di albutrepenonacog alfa.
Gli altri componenti sono i seguenti:
Sodio citrato, Polisorbato 80, Mannitolo, Saccarosio, acido cloridrico (per la regolazione del pH)
Vedere l’ultimo capoverso del paragrafo 2.
Solvente: acqua per preparazioni iniettabili
Come si presenta IDELVION e contenuto della confezione
IDELVION si presenta sotto forma di polvere di colore da giallo pallido a bianco e viene fornito con
acqua per preparazioni iniettabili come solvente.
La soluzione ricostituita appare da trasparente a lievemente opalescente, da gialla a incolore, ovvero
controluce può essere luminosa ma non deve contenere particelle visibili.
Presentazioni
Una confezione da 250, 500 o 1 000 UI contenente:
1 flaconcino con polvere
1 flaconcino con 2,5 mL di acqua per preparazioni iniettabili
1 dispositivo di trasferimento con filtro 20/20
Una scatola interna contenente:
1 siringa monouso da 5 mL
1 set per l’iniezione in vena
2 tamponi imbevuti di alcool
1 cerotto non sterile
Una confezione da 2 000 o 3 500 UI contenente:
1 flaconcino con polvere
1 flaconcino con 5 mL di acqua per preparazioni iniettabili
1 dispositivo di trasferimento con filtro 20/20
Una scatola interna contenente:
1 siringa monouso da 10 mL
1 set per l’iniezione in vena
2 tamponi imbevuti di alcool
1 cerotto non sterile
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’Autorizzazione all’Immissione in Commercio e Produttore
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Germania
Per qualsiasi informazione su questo medicinale, contattare il rappresentante locale del Titolare
dell’Autorizzazione all’Immissione in Commercio:
België/Belgique/Belgien
CSL Behring NV
Tél/Tel: +32 15 28 89 20
Lietuva
CentralPharma Communications UAB
Tel: +370 5 243 0444
България
МагнаФарм България ЕАД
Тел: +359 2 810 3949
Luxembourg/Luxemburg
CSL Behring NV
Tél/Tel: +32 15 28 89 20
Česká republika
CSL Behring s.r.o.
Tel: + 420 702 137 233
Magyarország
CSL Behring Kft.
Tel.: +36 1 213 4290
Danmark
CSL Behring AB
Tel: +46 8 544 966 70
Malta
AM Mangion Ltd.
Tel: +356 2397 6333
Nederland
CSL Behring BV
Tel: + 31 85 111 96 00
Deutschland
CSL Behring GmbH
Tel: +49 69 30584437
Norge
CSL Behring AB
Tlf: +46 8 544 966 70
Eesti
CentralPharma Communications OÜ
Tel: +3726015540
Österreich
CSL Behring GmbH
Tel: +43 1 80101 2463
Ελλάδα
CSL Behring ΕΠΕ
Τηλ: +30 210 7255 660
España
CSL Behring S.A.
Tel: +34 933 67 1870
Polska
CSL Behring Sp.z o.o.
Tel: +48 22 213 22 65
France
CSL Behring S.A.
Tél: + 33 –(0)-1 53 58 54 00
Portugal
CSL Behring Lda
Tel: +351 21 782 62 30
Hrvatska
Marti Farm d.o.o.
Tel: +385 1 5588297
România
Prisum Healthcare srl
Tel: +40 21 322 0171
Ireland
CSL Behring GmbH
Tel: +49 69 30517254
Slovenija
Emmes Biopharma Global s.r.o.-podružnica v
Sloveniji
Tel:+ 386 41 42 0002
Ísland
CSL Behring AB
Sími: +46 8 544 966 70
Slovenská republika
CSL Behring s.r.o.
Tel: + 421 911 653 862
Italia
CSL Behring S.p.A.
Tel: +39 02 34964 200
Suomi/Finland
CSL Behring AB
Puh/Tel: +46 8 544 966 70
Κύπρος
CSL Behring ΕΠΕ
Τηλ: +30 210 7255 660
Sverige
CSL Behring AB
Tel: +46 8 544 966 70
Latvija
CentralPharma Communications SIA
Tel: +371 6 7450497
United Kingdom (Northern Ireland)
CSL Behring GmbH
Tel: +49 69 305 17254
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: http://www.ema.europa.eu.
----------------------------------------------------------------------------------------------------------
Le seguenti informazioni sono destinate esclusivamente agli operatori sanitari:
Posologia
La dose e la durata della terapia sostitutiva dipendono dalla gravità della carenza del fattore IX, dalla
sede ed estensione del sanguinamento e dalle condizioni cliniche del paziente.
Il numero di unità di fattore IX somministrate viene espresso in Unità Internazionali (UI) in
riferimento all'attuale standard WHO per i prodotti a base di fattore IX. L'attività plasmatica del fattore
IX viene espressa in percentuale (relativa al plasma umano normale) o in Unità Internazionali
(secondo uno standard internazionale per il fattore IX nel plasma).
Una Unità Internazionale (UI) di fattore IX è equivalente alla quantità di fattore IX contenuta in un
mL di plasma umano normale.
Trattamento on-demand (al bisogno)
Il calcolo della dose necessaria di fattore IX è basato sul risultato empirico che 1 UI di fattore IX per
kg di peso corporeo aumenta l’attività del fattore IX nel plasma di circa 1,3 UI/dl (1,3% della normale
attività) in pazienti di età uguale o superiore a 12 anni e di 1,0 UI/dl (1,0% della normale attività) in
pazienti con meno di 12 anni d’età. La dose necessaria viene stabilita usando la seguente formula:
Dose richiesta (UI) = peso corporeo (kg) x aumento desiderato del fattore IX (% del normale oppure
UI/dl) x {reciproco del recupero osservato (UI/kg per UI/dl)}
Aumento del fattore IX atteso (UI/dl o % del normale) = Dose (UI) x Recupero (UI/dl per UI/kg)/peso
corporeo (kg)
La quantità e la frequenza di somministrazione devono sempre essere orientate all’efficacia clinica nel
singolo caso.
Pazienti con meno di 12 anni d’età
Per un recupero incrementale di 1 UI/dl per 1 UI/kg, la dose viene calcolata nel modo seguente:
Dose necessaria (UI) = peso corporeo (kg) x aumento desiderato del fattore IX (UI/dl) x 1 dl/kg
Esempio
- 1. Un livello del 50% del normale è richiesto in un paziente di 20 kg con emofilia B grave. La dose appropriata sarebbe 20 kg x 50 UI/dl x 1 dl/kg = 1 000 UI.
- 2. Una dose di 1 000 UI di IDELVION, somministrata a un paziente di 25 kg dovrebbe dar luogo a un livello post-iniezione del fattore IX pari a 1 000 UI/25 kg x 1,0 (UI/dl per UI/kg) = 40 UI/dl (40% del normale).
Pazienti di età uguale o superiore a 12 anni
Per un recupero incrementale di 1,3 UI/dl per 1 UI/kg, la dose viene calcolata nel modo seguente:
Dose necessaria (UI) = peso corporeo (kg) x aumento desiderato del fattore IX (UI/dl) x 0,77 dl/kg
Esempio
- 3. Un livello del 50% del normale è richiesto in un paziente di 80 kg con emofilia B grave. La dose appropriata sarebbe 80 kg x 50 UI/dl x 0,77 dl/kg = 3 080 UI.
- 4. Una dose di 2 000 UI di IDELVION, somministrata a un paziente di 80 kg dovrebbe dar luogo a un livello del picco post-iniezione del fattore IX pari a 2 000 UI x 1,3 (UI/dl per UI/kg)/80 kg = 32,5 UI/dl (32,5% del normale).
Qualora si presentasse uno dei seguenti eventi emorragici, l’attività del fattore IX non dovrà
scendere al di sotto di un dato livello di attività plasmatica (come percentuale della
norma o UI/dl) nel periodo corrispondente. La tabella che segue può essere utilizzata come
guida per la posologia in caso di sanguinamento e di intervento chirurgico:
| Gradi di emorragia / Tipo di intervento chirurgico | Livello del fattore IX richiesto (%) (UI/dl) | Frequenza delle Dosi (ore) / Durata della Terapia (giorni) |
| Emorragie Emartrosi minori o moderate, sanguinamento muscolare (eccetto ileopsoas) o del cavo orale | 30-60 | o Una singola dose deve essere c sufficiente per la maggior parte dei sanguinamenti. a Dose di mantenimento dopo
|
| Emorragie gravi Emorragie a rischio di morte, sanguinamento della muscolatura profonda, incluso ileopsoas | 60-100 | m Ripetere ogni 24 – 72 ore per la prima settimana, poi dose r settimanale di mantenimento a fino alla cessazione del sanguinamento o fino a guarigione. |
| Chirurgia minore Incluse estrazioni dentali senza complicazioni | 50–80 (pre- e post- operatorio) l e d a | F Una singola dose può essere sufficiente per la maggior parte degli interventi chirurgici minori. Se necessario, può essere somministrata una dose di mantenimento dopo
|
| Chirurgia maggiore | n 60-100 (pre- e post-operatorio) a i l | Ripetere ogni 24 – 72 ore per la prima settimana, poi una dose di mantenimento
|
Profilassi
In pazienti affetti da emofilia B grave, la dose abituale per la profilassi a lungo termine dei
sanguinamenti è di 35 – 50 UI/kg, una volta la settimana.
Alcuni pazienti che mostrano un controllo ottimale della patologia con un regime di somministrazione
di un volta alla settimana, possono passare ad una dose fino a 75 UI/kg, ad intervalli di
somministrazione ogni 10 o 14 giorni. Per pazienti di età > ai 18 anni, può essere presa in
considerazione un’ulteriore estensione dell’intervallo di somministrazione (vedere paragrafo 5.1).
In alcuni casi, specialmente nei pazienti più giovani, possono rendersi necessari intervalli più brevi o
dosi più elevate.
A seguito di un episodio di sanguinamento durante la profilassi, i pazienti devono attenersi
strettamente al loro regime di profilassi, con 2 dosi di IDELVION somministrate ad almeno 24 ore
l’una dall’altra o con un intervallo più lungo, se ritenuto adatto per il paziente.
Popolazione pediatrica
Per la profilassi a lungo termine, il regime di dose raccomandato è di 35-50 UI/kg, una volta alla
settimana. Per gli adolescenti di età pari o superiore a 12 anni, le raccomandazioni posologiche sono le
stesse che per gli adulti (vedere sopra).
Avvertenze speciali e precauzioni d’impiego
Inibitori
Dopo ripetuti trattamenti con medicinali contenenti fattore IX della coagulazione umana, i pazienti
devono essere monitorati per l’eventuale sviluppo di anticorpi neutralizzanti (inibitori), i quali devono
essere quantificati in Unità Bethesda (UB), usando appropriati controlli biologici.
In letteratura sono descritti casi in cui si è dimostrata una correlazione fra la comparsa di inibitori del
fattore IX e reazioni allergiche. Per questo motivo, i pazienti che manifestano reazioni allergiche
devono essere sottoposti ad analisi per la presenza di inibitori. Bisogna sottolineare che pazienti con
inibitori del fattore IX possono essere a più alto rischio di anafilassi in seguito a somministrazioni
successive di fattore IX.
Monitoraggio del trattamento
Nel corso del trattamento, è consigliabile un’appropriata determinazione dei livelli di fattore IX per
stabilire la dose da somministrare e la frequenza delle infusioni. Possono esservi differenze tra i
singoli pazienti nella risposta al fattore IX, che indicano emivita e recuperi diversi. Il calcolo della
dose basato sul peso corporeo può richiedere una correzione nei pazienti sottopeso o sovrappeso.
Soprattutto in caso di interventi chirurgici maggiori, è indispensabile un monitoraggio accurato della
terapia di sostituzione attraverso analisi della coagulazione (attività del fattore IX del plasma).
Quando si utilizza un test di coagulazione “one-stage” in vitro,basato sul tempo di tromboplastina
parziale attivata (aPTT) per la determinazione dell’attività del fattore IX nei campioni ematici dei
pazienti, i risultati dell’attività del fattore IX plasmatico possono essere influenzati in maniera
significativa sia dal tipo di reagente aPTT che dallo standard di riferimento utilizzato nel test. La
misura con un test di coagulazione “one-stage” usando un reagente aPTT a base di caolino o un
reagente aPTT a base di Actina FS comporterà probabilmente una sottostima del livello di attività. Ciò
è importante in particolare quando si cambiano il laboratorio e/o i reagenti utilizzati nel test.
* * *
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a IDELVIONForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 500 U.I.Principio attivo: coagulation factor IXProduttore: KEDRION S.P.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione per infusione endovenosa, 500 UI/10 MLPrincipio attivo: coagulation factor IXProduttore: GRIFOLS ITALIA S.P.A.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 IUPrincipio attivo: coagulation factor IXProduttore: SWEDISH ORPHAN BIOVITRUM AB (PUBL)Prescrizione richiesta
Medici online per IDELVION
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di IDELVION — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














