OCREVUS

Come usare OCREVUS
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Ocrevus 300 mg concentrato per soluzione per infusione
ocrelizumab
Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Ocrevus e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Ocrevus
- 3. Come viene somministrato Ocrevus
- 4. Possibili effetti indesiderati
- 5. Come conservare Ocrevus
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Ocrevus e a cosa serve
Cos’è Ocrevus
Ocrevus contiene il principio attivo “ocrelizumab”. Si tratta di un tipo di proteina chiamata “anticorpo
monoclonale”. Gli anticorpi agiscono legandosi a specifici bersagli presenti nel corpo.
A cosa serve Ocrevus
Ocrevus è usato per trattare gli adulti affetti da:
- Forme recidivanti di sclerosi multipla (SMR)
- Sclerosi multipla primariamente progressiva (SMPP) in fase precoce.
Cos’è la sclerosi multipla
La sclerosi multipla (SM) colpisce il sistema nervoso centrale, soprattutto i nervi nel cervello e il
midollo spinale. Nella SM il sistema immunitario (il sistema di difesa dell’organismo) non funziona
correttamente e attacca lo strato protettivo (la cosiddetta guaina mielinica) che circonda le cellule
nervose, provocando infiammazione. La distruzione della guaina mielinica impedisce ai nervi di
continuare a funzionare in modo corretto.
I sintomi della SM dipendono dalla parte del sistema nervoso centrale che viene colpita e possono
includere problemi nel camminare e di equilibrio, debolezza, intorpidimento, visione doppia e
offuscata, scarsa coordinazione e problemi della vescica.
- Nelle forme recidivanti di SM, il paziente ha ripetuti attacchi di sintomi (recidive). I sintomi possono comparire improvvisamente entro qualche ora o lentamente nell’arco di diversi giorni. I sintomi svaniscono o migliorano tra le recidive ma i danni possono accumularsi e portare a una disabilità permanente.
- Nella SM primariamente progressiva, i sintomi generalmente continuano a peggiorare sin dall’inizio della malattia.
Come funziona Ocrevus?
Ocrevus si lega a specifiche cellule B, un tipo di globuli bianchi che fanno parte del sistema
immunitario e svolgono un ruolo nella SM. Ocrevus prende di mira e rimuove queste specifiche
cellule B. Ciò riduce l’infiammazione e gli attacchi a carico della guaina mielinica, riduce le
probabilità di manifestare una recidiva e rallenta la progressione della malattia.
- Nelle forme recidivanti di SM (SMR), Ocrevus aiuta a ridurre significativamente il numero di attacchi (recidive) e rallenta in misura significativa la progressione della malattia. Ocrevus aumenta inoltre significativamente la possibilità di un paziente di non presentare evidenze di attività della malattia (lesioni cerebrali, recidive e peggioramento della disabilità).
- Nella SM primariamente progressiva (SMPP), Ocrevus aiuta a rallentare la progressione della malattia e a ridurre il peggioramento della velocità di camminata.
2. Cosa deve sapere prima che le venga somministrato Ocrevus
Non deve esserle somministrato Ocrevus:
- se è allergico ad ocrelizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se attualmente ha un’infezione.
- se le è stato comunicato che soffre di gravi problemi a carico del sistema immunitario.
- se ha un tumore maligno.
Se ha dubbi, si rivolga al medico prima che le venga somministrato Ocrevus.
Avvertenze e precauzioni
Si rivolga al medico prima di usare Ocrevusse una qualsiasi delle seguenti situazioni la riguarda. Il
medico può decidere di posticipare la somministrazione del trattamento con Ocrevus, oppure può
stabilire che lei non può ricevere Ocrevus se:
- Lei ha un’ infezione. Il medico attenderà fino alla risoluzione dell’infezione prima di somministrarle Ocrevus.
- Lei ha avuto in passato l’ epatite Boppure è un portatore del virus dell’epatite B. Infatti i medicinali come Ocrevus possono provocare una riattivazione del virus dell’epatite B. Prima di trattarla con Ocrevus, il medico verificherà che lei non sia a rischio di sviluppare un’infezione da epatite B. I pazienti che hanno avuto l’epatite B o sono portatori del virus dell’epatite B saranno sottoposti a regolari analisi del sangue e monitorati da parte del medico per rilevare segni di infezione da epatite B.
- Lei ha un tumore malignoo lo ha avuto in passato. Il medico può decidere di posticipare il trattamento con Ocrevus. Effetto sul sistema immunitario:
- Malattie che influiscono sul sistema immunitario: se lei ha un’altra malattia che influisce sul sistema immunitario. Può non essere possibile somministrarle Ocrevus.
- Medicinali che influiscono sul sistema immunitario: se lei ha assunto in passato, sta assumendo o prevede di assumere medicinali che influiscono sul sistema immunitario, come chemioterapia, immunosoppressori o altri medicinali utilizzati per trattare la SM. Il medico può decidere di posticipare il trattamento con Ocrevus o può chiederle di smettere di assumere questi medicinali prima di iniziare il trattamento con Ocrevus. Per maggiori informazioni, vedere di seguito “Altri medicinali e Ocrevus”.
Reazioni correlate all’infusione
- Le reazioni correlate all’infusione sono l’effetto indesiderato più comune di Ocrevus.
- Informi subito l’infermiere o il medico se manifesta una reazione correlataall’infusione(vedere paragrafo 4 per un elenco delle reazioni correlate all’infusione). Le reazioni correlate all’infusione possono avvenire durante l’infusione o fino a 24 ore dopo.
- Per ridurre il rischio di una reazione correlata all’infusione, il medico le somministrerà dei medicinali prima di ogni infusione di Ocrevus (vedere paragrafo 3) e la terrà sotto stretta osservazione durante l’infusione e per almeno un’ora dopo la somministrazione dell’infusione.
Infezioni
- Informi il medico prima che le venga somministrato Ocrevus se sospetta di avere un’infezione. Il medico attenderà fino alla risoluzione dell’infezione prima di somministrarle Ocrevus.
- Può sviluppare infezioni più facilmente con Ocrevus. Infatti le cellule immunitarie che Ocrevus prende di mira aiutano anche a combattere le infezioni.
- Prima di iniziare il trattamento con Ocrevus e prima delle infusioni successive, il medico può chiederle di sottoporsi a un esame del sangue per verificare il sistema immunitario. In caso di gravi problemi a carico del sistema immunitario, è infatti possibile che si sviluppino infezioni con maggiore frequenza.
- Se viene trattato con Ocrevus per la sclerosi multipla primariamente progressiva e manifesta difficoltà di deglutizione, Ocrevus può incrementare il rischio di polmonite grave.
- Informi immediatamente il medico o l’infermiere se durante o dopo il trattamento conOcrevus nota la comparsa di questi segni di infezione:
- febbre o brividi
- tosse che non passa
- herpes (per esempio sulle labbra, fuoco di Sant’Antonio o herpes genitale).
- Informi immediatamente il medico o l’infermiere se ritiene che la sua SM stia peggiorandoo se osserva nuovi sintomi.Esiste infatti un’infezione del cervello molto rara e potenzialmente letale, chiamata “leucoencefalopatia multifocale progressiva” (PML), che può provocare sintomi simili a quelli della SM. La PML può manifestarsi in pazienti trattati con Ocrevus.
- Informi il suo partner o chi si occupa di leidel suo trattamento con Ocrevus, perché può notare dei sintomi di PML che lei non nota, come vuoti di memoria, difficoltà a pensare, difficoltà a camminare, perdita della vista, cambiamenti nel modo di camminare, che il medico può voler approfondire.
Vaccinazioni
- Informi il medico se le è stato somministrato di recente qualsiasi vaccino o le potrebbe essere somministrato un vaccino nel prossimo futuro.
- Durante il trattamento con Ocrevus, non dovrà ricevere vaccini vivi o vivi attenuati (per esempio il vaccino BCG per la tubercolosi o vaccini contro la febbre gialla).
- Il medico potrebbe raccomandare di somministrarle un vaccino antinfluenzale stagionale.
- Il medico verificherà se lei ha bisogno di ricevere vaccini prima di iniziare il trattamento con Ocrevus. Eventuali vaccinazioni dovranno essere somministrate almeno 6 settimane prima di iniziare il trattamento con Ocrevus.
Bambini e adolescenti
Ocrevus non è raccomandato per il trattamento di bambini e adolescenti al di sotto dei 18 anni d’età.
Infatti non è stato studiato ancora in questa fascia d’età.
Altri medicinali e Ocrevus
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
In particolare informi il medico:
- se ha assunto in passato, sta assumendo o prevede di assumere medicinali che influiscono sulsistema immunitario- come chemioterapia, immunosoppressori o altri medicinali usati per trattare la SM. L’effetto di questi medicinali sul sistema immunitario, se somministrati con Ocrevus, può essere troppo forte. Il medico può decidere di posticipare il trattamento con Ocrevus o può chiederle di smettere di assumere questi medicinali prima di iniziare il trattamento con Ocrevus.
- se sta assumendo medicinali per la pressione alta. Infatti Ocrevus può comportare un abbassamento della pressione del sangue. Il medico può chiederle di smettere di prendere i medicinali per la pressione nelle 12 ore precedenti l’infusione di Ocrevus.
Se uno dei casi sopra elencati si riferisce a lei (o non è sicuro), parli con il medico prima che le venga
somministrato Ocrevus.
Gravidanza
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte materno, chieda consiglio al medico prima di prendere questo medicinale. Questo perché Ocrevus può attraversare la placenta e avere effetti sul bambino.
- Non usi Ocrevus se è in stato di gravidanza a meno che ne abbia prima parlato con il medico. Il medico valuterà i benefici del trattamento con Ocrevus e i possibili rischi per il suo bambino.
- Si rivolga al medico prima di vaccinare il suo bambino.
Contraccezione per le donne
Le donne in grado di avere figli dovranno usare delle misure contraccettive:
- durante il trattamento con Ocrevus e
- per 4 mesi dopo l’ultima infusione di Ocrevus.
Allattamento
Non allatti al seno durante il trattamento con Ocrevus. Ocrevus può infatti passare nel latte materno.
Guida di veicoli e utilizzo di macchinari
Non è noto se Ocrevus abbia un effetto sulla sua capacità di guidare o usare attrezzi o macchinari.
Il medico le dirà se la sua SM può influire sulla sua capacità di guidare o usare strumenti e macchinari
in modo sicuro.
Ocrevus contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodioper dose, cioè essenzialmente
“senza sodio”.
3. Come viene somministrato Ocrevus
Ocrevus le verrà somministrato da un medico o un infermiere esperto nell’uso di questo trattamento,
che la terrà sotto stretto controllo durante la somministrazione del medicinale, in modo da rilevare
l’insorgenza di eventuali effetti indesiderati. Ocrevus le verrà sempre somministrato goccia a goccia
(infusione endovenosa).
Medicinali che deve assumere prima di ricevere Ocrevus
Prima di ricevere Ocrevus riceverà altri medicinali per prevenire o ridurre possibili effetti indesiderati,
come le reazioni correlate all’infusione (vedere paragrafi 2 e 4 per informazioni sulle reazioni
correlate all’infusione).
Prima di ogni infusione riceverà un corticosteroide e un antistaminico e può ricevere anche medicinali
per abbassare la febbre.
In che dosi e con quale frequenza riceverà Ocrevus
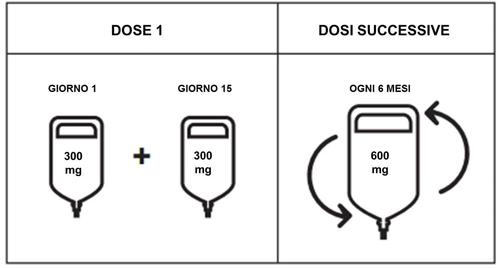
Le sarà somministrata una dose totale di 600 mg di Ocrevus ogni 6 mesi.
- La prima dose da 600 mg di Ocrevus sarà somministrata in due infusioni separate (da 300 mg ciascuna), a distanza di 2 settimane l’una dall’altra. Ogni infusione durerà circa 2 ore e 30 minuti.
- Le dosi successive da 600 mg di Ocrevus saranno somministrate in una singola infusione. A seconda della velocità dell’infusione successiva, ogni infusione durerà circa 3 ore e 30 minuti o 2 ore.
Come viene somministrato Ocrevus
- Ocrevus verrà somministrato da un medico o da un infermiere. Le verrà somministrato mediante infusione in una vena (infusione endovenosa o infusione e.v.).
- Sarà tenuto sotto stretto controllo durante la somministrazione di Ocrevus e per almeno 1 ora dopo la somministrazione dell’infusione, in caso dovesse manifestare effetti indesiderati come reazioni correlate all’infusione. Se dovesse manifestare una reazione correlata all’infusione, l’infusione può essere rallentata, sospesa temporaneamente o interrotta permanentemente in funzione della sua gravità (vedere paragrafi 2 e 4 per informazioni sulle reazioni correlate all’infusione).
Se salta un’infusione di Ocrevus
- Se salta un’infusione di Ocrevus, si accordi con il medico per riceverla il prima possibile. Non attenda fino alla successiva infusione programmata.
- Per ottenere il pieno beneficio da Ocrevus, è importante che riceva ogni infusione nel momento giusto.
Se interrompe il trattamento con Ocrevus
- È importante che prosegua il trattamento fintanto che lei e il medico riterrete che le sarà d’aiuto.
- Alcuni effetti indesiderati possono essere correlati ai bassi livelli di cellule B. Dopo aver interrotto il trattamento con Ocrevus, possono comunque manifestarsi effetti indesiderati fino a quando i livelli di cellule B non saranno rientrati nella norma. Le sue cellule B del sangue ritorneranno gradualmente a livelli normali. Ciò può richiedere da sei mesi a due anni e mezzo, o in rari casi fino a diversi anni.
- Prima di iniziare ad assumere qualsiasi altro medicinale, informi il medico della data dell’ultima infusione di Ocrevus.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Con Ocrevus sono stati riferiti i seguenti effetti indesiderati:
Effetti indesiderati gravi:
Reazioni correlate all’infusione
- Le reazioni correlate all’infusione sono l’effetto indesiderato più comune del trattamento con Ocrevus (molto comune: può interessare più di 1 persona su 10). Nella maggior parte dei casi tali reazioni hanno un’intensità lieve, ma possono verificarsi anche alcune reazioni gravi.
- Informi subito il medico o l’infermiere se manifesta uno qualsiasi dei segni o sintomi diuna reazione correlata all’infusione durante l’infusione o fino a 24 ore dopo l’infusione.I sintomi includono i seguenti, ma non si tratta di un elenco completo:
- prurito alla pelle
- eruzione cutanea
- orticaria
- arrossamento della pelle
- irritazione o dolore alla gola
- respiro affannoso
- rigonfiamento della gola
- rossore
- pressione del sangue bassa
- febbre
- senso di stanchezza
- mal di testa
- capogiri
- malessere (nausea)
- battito del cuore accelerato.
- Se dovesse manifestare una reazione correlata all’infusione, le saranno somministrati dei medicinali per trattarla e può essere necessario rallentare o interrompere l’infusione. Una volta che la reazione si sarà arrestata, l’infusione potrà proseguire. Se la reazione correlata all’infusione comporterà una minaccia per la sua vita, il medico interromperà il trattamento con Ocrevus in modo permanente.
Infezioni
- Può sviluppare infezioni più facilmente con Ocrevus. Le seguenti infezioni sono state osservate in pazienti trattati con Ocrevus per la SM:
- Molto comune(può interessare più di 1 persona su 10)
- mal di gola e naso che cola (infiammazione del tratto respiratorio superiore)
- influenza.
- Comune(può interessare fino a 1 persona su 10)
- infezione dei seni nasali
- bronchite (infiammazione dei bronchi)
- infezioni da herpes (herpes labiale o herpes zoster)
- infezione dello stomaco e dell’intestino (gastroenterite)
- infezione delle vie respiratorie
- infezione virale
- infezione della pelle (cellulite).
Alcune di queste possono essere gravi.
- Informi immediatamente il medico o l’infermiere se nota la comparsa di uno qualsiasi diquesti segni di infezione:
- febbre o brividi
- tosse che non passa
- herpes (per esempio sulle labbra, fuoco di Sant’Antonio e herpes genitale).
Altri effetti indesiderati:
Molto comuni(possono interessare più di 1 persona su 10)
- riduzione di specifiche proteine nel sangue (immunoglobuline) che aiutano a proteggere dalle infezioni.
Comuni(possono interessare fino a 1 persona su 10)
- secrezione dall’occhio con prurito, arrossamento e gonfiore (congiuntivite)
- tosse
- un accumulo di muco denso nel naso, nella gola o nel torace
- bassi livelli di un tipo di globuli bianchi (neutropenia).
Non noti(non è noto con quale frequenza si verificano questi effetti indesiderati)
- una riduzione dei globuli bianchi che può comparire tardivamente.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ Allegato V . Segnalando gli effetti indesiderati lei può
contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Ocrevus
Ocrevus sarà conservato dagli operatori sanitari presso l’ospedale o la clinica alle seguenti condizioni:
- Questo medicinale deve essere tenuto fuori dalla vista e dalla portata dei bambini.
- Questo medicinale non deve essere usato dopo la data di scadenza che è riportata sulla scatola e sull’etichetta del flaconcino dopo “Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Questo medicinale deve essere conservato in frigorifero (2 °C - 8 °C). Non deve essere congelato. I flaconcini devono essere conservati nella confezione esterna per proteggerli dalla luce.
Ocrevus deve essere diluito prima di esserle somministrato. La diluizione sarà eseguita da un
operatore sanitario. Si raccomanda di utilizzare il prodotto immediatamente dopo la diluizione. Se non
usato immediatamente, tempi e condizioni di conservazione prima dell’utilizzo sono responsabilità
dell’operatore sanitario e non devono di norma superare le 24 ore a 2-8 °C e successivamente le 8 ore
a temperatura ambiente.
Non getti alcun medicinale nell’acqua di scarico. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Ocrevus
- Il principio attivo è ocrelizumab. Ogni flaconcino contiene 300 mg di ocrelizumab in 10 mL, a una concentrazione di 30 mg/mL.
- Gli altri componenti sono sodio acetato triidrato (vedere paragrafo 2 “Ocrevus contiene sodio”), acido acetico glaciale, trealosio diidrato, polisorbato 20 e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Ocrevus e contenuto della confezione
- Ocrevus è una soluzione di aspetto da limpido a leggermente opalescente, da incolore a marrone chiaro.
- È fornito come concentrato per soluzione per infusione.
- Questo medicinale è disponibile in confezioni contenenti 1 o 2 flaconcini (flaconcini di 10 mL di concentrato). È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Germania
Produttore
Roche Pharma AG
Emil-Barell-Strasse 1
D-79639 Grenzach-Wyhlen
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Lietuva
UAB “Roche Lietuva”
Tel: +370 5 2546799
България
Рош България ЕООД
Тел: +359 2 818 44 44
Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Magyarország
Roche (Magyarország) Kft.
Tel: +36 - 1 279 4500
Danmark
Roche Pharmaceuticals A/S
Tlf: +45 - 36 39 99 99
Malta
(see Ireland)
Deutschland
Roche Pharma AG
Tel: +49 (0) 7624 140
Nederland
Roche Nederland B.V.
Tel: +31 (0) 348 438050
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 177 380
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Österreich
Roche Austria GmbH
Tel: +43 (0) 1 27739
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Polska
Roche Polska Sp.z o.o.
Tel: +48 - 22 345 18 88
France
Roche
Tél: +33 (0) 1 47 61 40 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
Hrvatska
Roche d.o.o.
Tel: +385 1 4722 333
România
Roche România S.R.L.
Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd.
Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o.
Tel: +386 - 1 360 26 00
Ísland
Roche Pharmaceuticals A/S
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o.
Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 10 554 500
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA
Tel: +371 - 6 7039831
United Kingdom (Northern Ireland)
Roche Products (Ireland) Ltd.
Tel: +44 (0) 1707 366000
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia Europea
per i Medicinali: http://www.ema.europa.eu .
Le seguenti informazioni sono destinate esclusivamente agli operatori sanitari:
Per maggiori informazioni, consultare il Riassunto delle Caratteristiche del Prodotto.
Al fine di migliorare la tracciabilità dei medicinali biologici devono essere registrati chiaramente la
denominazione e il numero di lotto del medicinale somministrato.
Posologia
- Dose iniziale
La dose iniziale di 600 mg è somministrata in due infusioni endovenose distinte: la prima infusione da
300 mg è seguita 2 settimane più tardi da una seconda infusione da 300 mg.
- Dosi successive
Le dosi successive di ocrelizumab vengono somministrate mediante singola infusione endovenosa da
600 mg ogni 6 mesi (vedere Tabella 1). La prima dose successiva da 600 mg deve essere
somministrata sei mesi dopo la prima infusione della dose iniziale. Si deve mantenere un intervallo
minimo di 5 mesi tra le dosi di ocrelizumab.
Figura 1. Posologia di Ocrevus
Gestione delle IRR prima dell’infusione
- Il trattamento deve essere iniziato e supervisionato da un operatore sanitario esperto, in grado di accedere a idonee misure di supporto medico per gestire reazioni gravi, come le reazioni correlate all’infusione (IRR), le reazioni di ipersensibilità e/o le reazioni anafilattiche.
- Premedicazione per le IRR
Prima di ogni infusione di ocrelizumab si devono somministrare le seguenti due premedicazioni
allo scopo di ridurre la frequenza e la gravità delle IRR:
- 100 mg di metilprednisolone (o un equivalente) per via endovenosa circa 30 minuti prima di ciascuna infusione;
- antistaminico circa 30-60 minuti prima di ciascuna infusione. Si può inoltre valutare l’opportunità di somministrare una premedicazione con un antipiretico (per es. paracetamolo) circa 30-60 minuti prima di ciascuna infusione.
- Durante le infusioni può manifestarsi, come sintomo di IRR, l’ipotensione. Pertanto, nelle 12 ore precedenti ciascuna infusione di Ocrevus e durante l’infusione stessa si deve valutare l’opportunità di sospendere i trattamenti antipertensivi. I pazienti con anamnesi di insufficienza cardiaca congestizia (New York Heart Association III e IV) non sono stati studiati.
Istruzioni per la diluizione
- Il prodotto deve essere preparato da un operatore sanitario con una tecnica asettica. Non agitare il flaconcino. Utilizzare un ago e una siringa sterili per preparare la soluzione per infusione diluita.
- Il prodotto è solo monouso.
- Il concentrato può contenere piccole particelle traslucide e/o riflettenti associate ad aumentata opalescenza. Non usare il concentrato se presenta alterazioni del colore o se il concentrato contiene particelle estranee.
- Il medicinale deve essere diluito prima della somministrazione. Le soluzioni per somministrazione endovenosa vengono preparate diluendo il concentrato in una sacca per infusione contenente una soluzione iniettabile isotonica di cloruro di sodio 9 mg/mL (0,9%) (300 mg/250 mL o 600 mg/500 mL), fino a raggiungere una concentrazione finale di ocrelizumab pari a circa 1,2 mg/mL.
- La soluzione per infusione diluita deve essere somministrata mediante un set per infusione con un filtro in linea da 0,2 o 0,22 micron.
- Prima di iniziare l’infusione endovenosa, il contenuto della sacca per infusione deve essere a temperatura ambiente, al fine di evitare una reazione all’infusione dovuta alla somministrazione della soluzione a temperature basse.
Modo di somministrazione
- Dopo diluizione, il trattamento viene somministrato mediante infusione endovenosa attraverso una linea dedicata.
- Le infusioni non devono essere somministrate mediante infusione rapida endovenosa o bolo endovenoso.
Tabella 1: posologia
| Quantità di ocrelizumab da somministrare | o Istruzioni per l’infusione | ||
| Dose iniziale (600 mg) suddivisa in 2 infusioni | Infusione 1 | 300 mg in 250 mL | c
|
| Infusione 2 (2 settimane più tardi) | 300 mg in 250 mL | ||
| Dosi successive (600 mg) Infusione singola Una volta ogni 6 mesi | Opzione 1 Infusione di durata pari a circa 3,5 ore | 600 mg in 500 mL d a | F
|
| n OPPURE | |||
| Opzione 2 Infusione di durata pari a circa 2 ore I a i z n | a 600 mg in 500 mL i l a t |
| |
Gestione delle IRR durante e dopo l’infusione
I pazienti devono essere posti sotto osservazione durante l’infusione e per almeno un’ora dopo il
completamento dell’infusione.
Durante l’infusione
- Modifiche dell’infusione in caso di IRR
In caso di IRR durante una qualsiasi infusione, consultare le seguenti indicazioni di modifica.
IRR potenzialmente letali
Se si osservano segni di una IRR potenzialmente letale o invalidante durante un’infusione, come
ipersensibilità acuta o sindrome da distress respiratorio acuta, l’infusione deve essere interrotta
immediatamente e il paziente deve ricevere un trattamento appropriato. In questi pazienti l’infusione
deve essere sospesa in modo permanente (vedere paragrafo 4.3).
IRR grave
Se un paziente manifesta una IRR grave (per es. dispnea) o un insieme di sintomi che includono
rossore, febbre e mal di gola, l’infusione deve essere interrotta immediatamente e il paziente deve
ricevere un trattamento sintomatico. L’infusione può essere ripresa soltanto dopo che tutti i sintomi si
sono risolti. La velocità di infusione iniziale deve essere la metà della velocità di infusione utilizzata al
momento dell’insorgenza della reazione. Per le successive nuove infusioni non è necessario attuare
alcuna modifica dell’infusione, a meno che il paziente manifesti una IRR.
IRR da lievi a moderate
Se un paziente manifesta una IRR da lieve a moderata (per es. cefalea), la velocità di infusione deve
essere ridotta e portata a metà della velocità utilizzata al momento dell’insorgenza dell’evento. Questa
velocità ridotta deve essere mantenuta per almeno 30 minuti. Se tollerata, la velocità di infusione potrà
essere aumentata in base alla velocità di infusione iniziale del paziente. Per le successive nuove
infusioni non è necessario attuare alcuna modifica dell’infusione, a meno che il paziente manifesti una
IRR.
- I pazienti che manifestano sintomi polmonari severi, come broncospasmo o riacutizzazione dell’asma, devono interrompere immediatamente e in via permanente l’infusione. Dopo aver somministrato il trattamento sintomatico, si deve monitorare il paziente fino alla risoluzione dei sintomi polmonari poiché un iniziale miglioramento dei sintomi clinici può essere seguito da un peggioramento.
- In termini di sintomi, l’ipersensibilità può essere clinicamente indistinguibile da una IRR. In caso di sospetta reazione di ipersensibilità durante l’infusione, l’infusione deve essere interrotta immediatamente e in via definitiva.
Dopo l’infusione
- I pazienti devono essere posti sotto osservazione per almeno un’ora dopo il completamento dell’infusione per rilevare eventuali sintomi di una IRR.
- I medici devono avvisare i pazienti della possibilità che una IRR si verifichi nelle 24 ore successive all’infusione.
Periodo di validità
Flaconcino integro
2 anni
Soluzione diluita per infusione endovenosa
- La stabilità chimica e fisica in uso è stata dimostrata per 24 ore alla temperatura di 2-8 °C e successivamente per 8 ore a temperatura ambiente.
- Da un punto di vista microbiologico, la soluzione per l’infusione preparata deve essere utilizzata immediatamente. Se non viene utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono sotto la responsabilità dell’utilizzatore e non si devono normalmente superare le 24 ore a temperatura compresa tra 2-8 °C e successivamente per 8 ore a temperatura ambiente, a meno che la diluizione avvenga in condizioni asettiche controllate e validate.
- Qualora non fosse possibile effettuare l’infusione endovenosa il giorno stesso, la soluzione rimanente deve essere scartata.
Ocrevus 920 mg soluzione iniettabile
ocrelizumab
Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
Contenuto di questo foglio
- 1. Cos’è Ocrevus e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Ocrevus
- 3. Come viene somministrato Ocrevus
- 4. Possibili effetti indesiderati
- 5. Come conservare Ocrevus
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Ocrevus e a cosa serve
Cos’è Ocrevus
Ocrevus contiene il principio attivo “ocrelizumab”. Si tratta di un tipo di proteina chiamata “anticorpo
monoclonale”. Gli anticorpi agiscono legandosi a specifici bersagli presenti nel corpo.
A cosa serve Ocrevus
Ocrevus è usato per trattare gli adulti affetti da:
- Forme recidivanti di sclerosi multipla (SMR)
- Sclerosi multipla primariamente progressiva (SMPP) in fase precoce.
Cos’è la sclerosi multipla
La sclerosi multipla (SM) colpisce il sistema nervoso centrale, soprattutto i nervi nel cervello e il
midollo spinale. Nella SM il sistema immunitario (il sistema di difesa dell’organismo) non funziona
correttamente e attacca lo strato protettivo (la cosiddetta guaina mielinica) che circonda le cellule
nervose, provocando infiammazione. La distruzione della guaina mielinica impedisce ai nervi di
continuare a funzionare in modo corretto.
I sintomi della SM dipendono dalla parte del sistema nervoso centrale che viene colpita e possono
includere problemi nel camminare e di equilibrio, debolezza, intorpidimento, visione doppia e
offuscata, scarsa coordinazione e problemi della vescica.
- Nelle forme recidivanti di SM, il paziente ha ripetuti attacchi di sintomi (recidive). I sintomi possono comparire improvvisamente entro qualche ora o lentamente nell’arco di diversi giorni. I sintomi svaniscono o migliorano tra le recidive ma i danni possono accumularsi e portare a una disabilità permanente.
- Nella SM primariamente progressiva, i sintomi generalmente continuano a peggiorare sin dall’inizio della malattia.
Come funziona Ocrevus?
Ocrevus si lega a specifiche cellule B, un tipo di globuli bianchi che fanno parte del sistema
immunitario e svolgono un ruolo nella SM. Ocrevus prende di mira e rimuove queste specifiche
cellule B. Ciò riduce l’infiammazione e gli attacchi a carico della guaina mielinica, riduce le
probabilità di manifestare una recidiva e rallenta la progressione della malattia.
- Nelle forme recidivanti di SM (SMR), Ocrevus aiuta a ridurre significativamente il numero di attacchi (recidive) e rallenta in misura significativa la progressione della malattia. Ocrevus aumenta inoltre significativamente la possibilità di un paziente di non presentare evidenze di attività della malattia (lesioni cerebrali, recidive e peggioramento della disabilità).
- Nella SM primariamente progressiva (SMPP), Ocrevus aiuta a rallentare la progressione della malattia e a ridurre il peggioramento della velocità di camminata.
2. Cosa deve sapere prima che le venga somministrato Ocrevus
Non deve esserle somministrato Ocrevus:
- se è allergico ad ocrelizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se attualmente ha un’infezione.
- se le è stato comunicato che soffre di gravi problemi a carico del sistema immunitario.
- se ha un tumore maligno.
Se ha dubbi, si rivolga al medico prima che le venga somministrato Ocrevus.
Avvertenze e precauzioni
Si rivolga al medico prima di usare Ocrevusse una qualsiasi delle seguenti situazioni la riguarda. Il
medico può decidere di posticipare la somministrazione del trattamento con Ocrevus, oppure può
stabilire che lei non può ricevere Ocrevus se:
- Lei ha un’ infezione. Il medico attenderà fino alla risoluzione dell’infezione prima di somministrarle Ocrevus.
- Lei ha avuto in passato l’ epatite Boppure è un portatore del virus dell’epatite B. Infatti i medicinali come Ocrevus possono provocare una riattivazione del virus dell’epatite B. Prima di trattarla con Ocrevus, il medico verificherà che lei non sia a rischio di sviluppare un’infezione da epatite B. I pazienti che hanno avuto l’epatite B o sono portatori del virus dell’epatite B saranno sottoposti a regolari analisi del sangue e monitorati da parte del medico per rilevare segni di infezione da epatite B.
- Lei ha un tumore malignoo lo ha avuto in passato. Il medico può decidere di posticipare il trattamento con Ocrevus. Effetto sul sistema immunitario:
- Malattie che influiscono sul sistema immunitario: se lei ha un’altra malattia che influisce sul sistema immunitario. Può non essere possibile somministrarle Ocrevus.
- Medicinali che influiscono sul sistema immunitario: se lei ha assunto in passato, sta assumendo o prevede di assumere medicinali che influiscono sul sistema immunitario, come chemioterapia, immunosoppressori o altri medicinali utilizzati per trattare la SM. Il medico può decidere di posticipare il trattamento con Ocrevus o può chiederle di smettere di assumere questi medicinali prima di iniziare il trattamento con Ocrevus. Per maggiori informazioni, vedere di seguito “Altri medicinali e Ocrevus”.
Reazioni correlate all’iniezione
- Le reazioni correlate all’iniezione sono l’effetto indesiderato più comune di Ocrevus, quando somministrato sotto forma di iniezione sottocutanea (sotto la pelle).
- Informi subito l’infermiere o il medico se manifesta una reazione correlataall’inieizione(vedere paragrafo 4 per un elenco delle reazioni correlate all’iniezione). Le reazioni correlate all’iniezione possono avvenire durante l’iniezione o fino a 24 ore dopo.
- Per ridurre il rischio di una reazione correlata all’iniezione, il medico le somministrerà dei medicinali prima di ogni iniezione di Ocrevus (vedere paragrafo 3) e la terrà sotto stretta osservazione durante l’iniezione e per almeno un’ora dopo l’iniezione iniziale.
Infezioni
- Informi il medico prima che le venga somministrato Ocrevus se sospetta di avere un’infezione. Il medico attenderà fino alla risoluzione dell’infezione prima di somministrarle Ocrevus.
- Può sviluppare infezioni più facilmente con Ocrevus. Infatti le cellule immunitarie che Ocrevus prende di mira aiutano anche a combattere le infezioni.
- Prima di iniziare il trattamento con Ocrevus e prima delle iniezioni successive, il medico può chiederle di sottoporsi a un esame del sangue per verificare il sistema immunitario. In caso di gravi problemi a carico del sistema immunitario, è infatti possibile che si sviluppino infezioni con maggiore frequenza.
- Se viene trattato con Ocrevus per la sclerosi multipla primariamente progressiva e manifesta difficoltà di deglutizione, Ocrevus può incrementare il rischio di polmonite grave.
- Informi immediatamente il medico o l’infermiere se durante o dopo il trattamento conOcrevus nota la comparsa di questi segni di infezione:
- febbre o brividi
- tosse che non passa
- herpes (per esempio sulle labbra, fuoco di Sant’Antonio o herpes genitale).
- Informi immediatamente il medico o l’infermiere se ritiene che la sua SM stia peggiorandoo se osserva nuovi sintomi. Esiste infatti un’infezione del cervello molto rara e potenzialmente letale, chiamata “leucoencefalopatia multifocale progressiva” (PML), che può provocare sintomi simili a quelli della SM. La PML può manifestarsi in pazienti trattati con Ocrevus.
- Informi il suo partner o chi si occupa di leidel suo trattamento con Ocrevus, perché può notare dei sintomi di PML che lei non nota, come vuoti di memoria, difficoltà a pensare, difficoltà a camminare, perdita della vista, cambiamenti nel modo di camminare, che il medico può voler approfondire.
Vaccinazioni
- Informi il medico se le è stato somministrato di recente qualsiasi vaccino o le potrebbe essere somministrato un vaccino nel prossimo futuro.
- Durante il trattamento con Ocrevus, non dovrà ricevere vaccini vivi o vivi attenuati (per esempio il vaccino BCG per la tubercolosi o vaccini contro la febbre gialla).
- Il medico potrebbe raccomandare di somministrarle un vaccino antinfluenzale stagionale.
- Il medico verificherà se lei ha bisogno di ricevere vaccini prima di iniziare il trattamento con Ocrevus. Eventuali vaccinazioni dovranno essere somministrate almeno 6 settimane prima di iniziare il trattamento con Ocrevus.
Bambini e adolescenti
Ocrevus non è raccomandato per il trattamento di bambini e adolescenti al di sotto dei 18 anni d’età.
Infatti non è stato studiato ancora in questa fascia d’età.
Altri medicinali e Ocrevus
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
In particolare informi il medico:
- se ha assunto in passato, sta assumendo o prevede di assumere medicinali che influiscono sulsistema immunitario- come chemioterapia, immunosoppressori o altri medicinali usati per trattare la SM. L’effetto di questi medicinali sul sistema immunitario, se somministrati con Ocrevus, può essere troppo forte. Il medico può decidere di posticipare il trattamento con Ocrevus o può chiederle di smettere di assumere questi medicinali prima di iniziare il trattamento con Ocrevus.
Se uno dei casi sopra elencati si riferisce a lei (o non è sicuro), parli con il medico prima che le venga
somministrato Ocrevus.
Gravidanza
- Se è in corso una gravidanza, o se sta allattando con latte materno, oppure se sospetta o sta pianificando una gravidanza, chieda consiglio al medico prima di prendere questo medicinale. Questo perché Ocrevus può attraversare la placenta e avere effetti sul bambino.
- Non usi Ocrevus se è in stato di gravidanza a meno che ne abbia prima parlato con il medico. Il medico valuterà i benefici del trattamento con Ocrevus e i possibili rischi per il suo bambino.
- Si rivolga al medico prima di vaccinare il suo bambino.
Contraccezione per le donne
Le donne in grado di avere figli dovranno usare delle misure contraccettive:
- durante il trattamento con Ocrevus e
- per 4 mesi dopo l’ultima dose di Ocrevus.
Allattamento
Non allatti al seno durante il trattamento con Ocrevus. Ocrevus può infatti passare nel latte materno.
Guida di veicoli e utilizzo di macchinari
Non è noto se Ocrevus abbia un effetto sulla sua capacità di guidare o usare attrezzi o macchinari.
Il medico le dirà se la sua SM può influire sulla sua capacità di guidare o usare strumenti e macchinari
in modo sicuro.
Ocrevus contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodioper dose, cioè essenzialmente
“senza sodio”.
3. Come viene somministrato Ocrevus
Medicinali che deve assumere prima di ricevere Ocrevus
Prima di ricevere Ocrevus riceverà altri medicinali per prevenire o ridurre possibili effetti indesiderati,
come le reazioni correlate all’iniezione (vedere paragrafi 2 e 4 per informazioni sulle reazioni correlate
all’iniezione).
Prima di ogni iniezione riceverà un corticosteroide e un antistaminico e può ricevere anche medicinali
per abbassare la febbre.
In che dosi e con quale frequenza riceverà Ocrevus
Le sarà somministrata una dose totale di 920 mg di Ocrevus ogni 6 mesi.
Come viene somministrato Ocrevus
- Ocrevus verrà somministrato da un medico o da un infermiere. Le verrà somministrato mediante iniezione sotto la pelle (iniezione sottocutanea).
- Le iniezioni verranno effettuate a livello dell’addome nell’arco di circa 10 minuti.
- Il medico o l’infermiere si assicureranno che ogni iniezione venga effettuata in corrispondenza dell’addome, in aree in cui la pelle non risulti arrossata, livida, delicata o dura, o in aree in cui siano presenti nei o cicatrici.
- Sarà tenuto sotto stretto controllo durante la somministrazione di Ocrevus e per almeno 1 ora dopo la somministrazione dell’iniezione iniziale, in caso dovesse manifestare effetti indesiderati come reazioni correlate all’iniezione. Se dovesse manifestare una reazione correlata all’iniezione, l’iniezione può essere sospesa temporaneamente o interrotta permanentemente in funzione della sua gravità (vedere paragrafi 2 e 4 per informazioni sulle reazioni correlate all’iniezione).
Se salta un’iniezione di Ocrevus
- Se salta un’iniezione di Ocrevus, si accordi con il medico per riceverla il prima possibile. Non attenda fino alla successiva iniezione programmata.
- Per ottenere il pieno beneficio da Ocrevus, è importante che riceva ogni iniezione nel momento giusto.
Se interrompe il trattamento con Ocrevus
- È importante che prosegua il trattamento fintanto che lei e il medico riterrete che le sarà d’aiuto.
- Alcuni effetti indesiderati possono essere correlati ai bassi livelli di cellule B. Dopo aver interrotto il trattamento con Ocrevus, possono comunque manifestarsi effetti indesiderati fino a quando i livelli di cellule B non saranno rientrati nella norma. Le sue cellule B del sangue ritorneranno gradualmente a livelli normali. Ciò può richiedere da sei mesi a due anni e mezzo, o in rari casi fino a diversi anni.
- Prima di iniziare ad assumere qualsiasi altro medicinale, informi il medico della data dell’ultima dose di Ocrevus.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Con Ocrevus sono stati riferiti i seguenti effetti indesiderati:
Effetti indesiderati gravi:
Reazioni correlate all’iniezione
- Le reazioni correlate all’iniezione sono l’effetto indesiderato più comune del trattamento con
Ocrevus somministrato come iniezione sottocutanea (molto comune: può interessare più di
1 persona su 10). Nella maggior parte dei casi tali reazioni hanno un’intensità lieve o moderata,
ma si sono verificate anche alcune reazioni gravi con Ocrevus somministrato mediante infusione
in vena (infusione endovenosa).
- Informi subito il medico o l’infermiere se manifesta uno qualsiasi dei segni o sintomi diuna reazione correlata all’iniezione durante l’iniezione o fino a 24 ore dopo.I sintomi includono i seguenti, ma non si tratta di un elenco completo:
- prurito alla pelle
- eruzione cutanea
- orticaria
- arrossamento della pelle
- dolore o gonfiore nel sito di iniezione
- irritazione o dolore alla gola
- respiro affannoso
- rigonfiamento della gola
- rossore
- pressione del sangue bassa
- febbre
- senso di stanchezza
- mal di testa
- capogiri
- malessere (nausea)
- battito del cuore accelerato.
- Se dovesse manifestare una reazione correlata all’iniezione, le saranno somministrati dei medicinali per trattarla e può essere necessario interrompere l’iniezione. Se la reazione correlata all’iniezione comporterà una minaccia per la sua vita, il medico interromperà il trattamento con Ocrevus in modo permanente.
Infezioni
- Può sviluppare infezioni più facilmente con Ocrevus. Le seguenti infezioni sono state osservate in pazienti trattati con Ocrevus per la SM:
- Molto comune(può interessare più di 1 persona su 10)
- mal di gola e naso che cola (infiammazione del tratto respiratorio superiore)
- influenza.
- Comune(può interessare fino a 1 persona su 10)
- infezione dei seni nasali
- bronchite (infiammazione dei bronchi)
- infezioni da herpes (herpes labiale o herpes zoster)
- infezione dello stomaco e dell’intestino (gastroenterite)
- infezione delle vie respiratorie
- infezione virale
- infezione della pelle (cellulite).
Alcune di queste possono essere gravi.
- Informi immediatamente il medico o l’infermiere se nota la comparsa di uno qualsiasi diquesti segni di infezione:
- febbre o brividi
- tosse che non passa
- herpes (per esempio sulle labbra, fuoco di Sant’Antonio e herpes genitale).
Altri effetti indesiderati:
Molto comuni(possono interessare più di 1 persona su 10)
- riduzione di specifiche proteine nel sangue (immunoglobuline) che aiutano a proteggere dalle infezioni.
Comuni(possono interessare fino a 1 persona su 10)
- secrezione dall’occhio con prurito, arrossamento e gonfiore (congiuntivite)
- tosse
- un accumulo di muco denso nel naso, nella gola o nel torace
- bassi livelli di un tipo di globuli bianchi (neutropenia).
Non noti(non è noto con quale frequenza si verificano questi effetti indesiderati)
- una riduzione dei globuli bianchi che può comparire tardivamente.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il
sistema nazionale di segnalazione riportato nell’ Allegato V . Segnalando gli effetti indesiderati lei può
contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Ocrevus
Ocrevus sarà conservato dagli operatori sanitari presso l’ospedale o la clinica alle seguenti condizioni:
- Questo medicinale deve essere tenuto fuori dalla vista e dalla portata dei bambini.
- Questo medicinale non deve essere usato dopo la data di scadenza che è riportata sulla scatola e sull’etichetta del flaconcino dopo “Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Questo medicinale deve essere conservato in frigorifero (2 °C - 8 °C). Non deve essere congelato. I flaconcini devono essere conservati nella confezione esterna per proteggerli dalla luce e non devono essere agitati.
Non getti alcun medicinale nell’acqua di scarico. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Ocrevus
- Il principio attivo è ocrelizumab. Ogni flaconcino contiene 920 mg di ocrelizumab in 23 mL (40 mg/mL).
- Gli altri componenti sono ialuronidasi umana ricombinante (rHuPH20), sodio acetato triidrato (vedere paragrafo 2 “Ocrevus contiene sodio”), acido acetico glaciale, α,α-trealosio diidrato, polisorbato 20, L-metionina e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Ocrevus e contenuto della confezione
- Ocrevus è una soluzione di aspetto da limpido a leggermente opalescente, da incolore a marrone chiaro.
- È fornito come soluzione iniettabile.
- Ocrevus è disponibile in confezioni contenenti 1 flaconcino di vetro.
Titolare dell’autorizzazione all’immissione in commercio
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Germania
Produttore
Roche Pharma AG
Emil-Barell-Strasse 1
D-79639 Grenzach-Wyhlen
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Lietuva
UAB “Roche Lietuva”
Tel: +370 5 2546799
България
Рош България ЕООД
Тел: +359 2 818 44 44
Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Magyarország
Roche (Magyarország) Kft.
Tel: +36 - 1 279 4500
Danmark
Roche Pharmaceuticals A/S
Tlf: +45 - 36 39 99 99
Malta
(see Ireland)
Deutschland
Roche Pharma AG
Tel: +49 (0) 7624 140
Nederland
Roche Nederland B.V.
Tel: +31 (0) 348 438050
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 177 380
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Österreich
Roche Austria GmbH
Tel: +43 (0) 1 27739
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Polska
Roche Polska Sp.z o.o.
Tel: +48 - 22 345 18 88
France
Roche
Tél: +33 (0) 1 47 61 40 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
Hrvatska
Roche d.o.o.
Tel: +385 1 4722 333
România
Roche România S.R.L.
Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd.
Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o.
Tel: +386 - 1 360 26 00
Ísland
Roche Pharmaceuticals A/S
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o.
Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 10 554 500
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA
Tel: +371 - 6 7039831
United Kingdom (Northern Ireland)
Roche Products (Ireland) Ltd.
Tel: +44 (0) 1707 366000
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia Europea
per i Medicinali: http://www.ema.europa.eu .
Le seguenti informazioni sono destinate esclusivamente agli operatori sanitari:
Per maggiori informazioni, consultare il Riassunto delle Caratteristiche del Prodotto.
Al fine di migliorare la tracciabilità dei medicinali biologici devono essere registrati chiaramente la
denominazione e il numero di lotto del medicinale somministrato.
Al fine di evitare errori di somministrazione, è importante controllare le etichette del medicinale per
assicurarsi che al paziente venga somministrata la formulazione corretta (endovenosa o sottocutanea),
come prescritto.
Prima della somministrazione, il medicinale deve essere ispezionato visivamente per verificare
l’assenza di particelle o di alterazioni del colore.
Il medicinale è esclusivamente monouso e deve essere preparato da un operatore sanitario mediante
tecnica asettica.
Non sono state osservate incompatibilità tra questo medicinale e polipropilene (PP), policarbonato
(PC), polietilene (PE), cloruro di polivinile (PVC), poliuretano (PUR) e acciaio inossidabile.
Preparazione della siringa
- Prima dell’uso, il flaconcino deve essere rimosso dal frigorifero per consentire che la soluzione raggiunga la temperatura ambiente.
- Prelevare l’intero contenuto di Ocrevus soluzione iniettabile dal flaconcino mediante una siringa e un ago di trasferimento (si raccomanda un ago da 21G).
- Rimuovere l’ago di trasferimento e collegare un set di infusione sottocutanea (per es. con alette/a farfalla) contenente un ago da 24-26G per l’iniezione. Utilizzare un set di infusione sottocutanea con un volume residuo NON superiore a 0,8 mL per la somministrazione.
- Riempire la linea di infusione sottocutanea con la soluzione iniettabile del farmaco per eliminare l’aria nella linea di infusione e fermarsi prima che il liquido raggiunga l’ago.
- Assicurarsi che la siringa contenga esattamente 23 mL di soluzione di prodotto medicinale dopo l’inserimento e l’espulsione di qualsiasi volume in eccesso dalla siringa.
- Somministrare immediatamente per evitare che l’ago si occluda. Non conservare la siringa preparata collegata al set di infusione sottocutaneo riempito in precedenza.
Se la dose non viene somministrata immediatamente, fare riferimento alla sezione di seguito
“Conservazione della siringa”.
Conservazione della siringa
- Qualora la dose non debba essere somministrata immediatamente, utilizzare una tecnica asettica per prelevare l’intero contenuto di Ocrevus soluzione iniettabile dal flaconcino alla siringa, in modo che il volume della dose (23 mL) e quello di riempimento del set di infusione sottocutanea siano rispettati. Sostituire l’ago di trasferimento con un tappo di chiusura della siringa. Non collegare un set di infusione sottocutanea per la conservazione.
- La stabilità chimica e fisica in uso è stata dimostrata per 30 giorni a una temperatura compresa tra 2 °C e 8 °C e, inoltre, per 8 ore senza protezione dalla luce a ≤30 °C.
- Da un punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente una volta trasferito dal flaconcino alla siringa. Qualora non venga utilizzato immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono sotto la responsabilità dell’utilizzatore e normalmente non si dovrebbero superare le 24 ore a una temperatura compresa tra 2 °C e 8 °C, a meno che la preparazione non sia avvenuta in condizioni asettiche controllate e validate.
- Se la siringa è stata conservata in frigorifero, lasciare che raggiunga la temperatura ambiente prima della somministrazione.
Modo di somministrazione
Ocrevus 920 mg soluzione iniettabile non è destinato alla somministrazione endovenosa e deve essere
somministrato sempre come iniezione sottocutanea da parte di un operatore sanitario.
I pazienti possono iniziare il trattamento con ocrelizumab somministrato per via endovenosa o
sottocutanea. I pazienti attualmente in trattamento con ocrelizumab somministrato per via endovenosa
possono continuare il trattamento con ocrelizumab endovenoso o passare a Ocrevus 920 mg soluzione
iniettabile.
Prima della somministrazione, il medicinale deve essere rimosso dal frigorifero per consentire che la
soluzione raggiunga la temperatura ambiente. Per le istruzioni relative all’uso e alla manipolazione del
medicinale prima della somministrazione, consultare il paragrafo 6.6.
La dose da 920 mg deve essere somministrata mediante iniezione sottocutanea nell’addome in circa 10
minuti. Si raccomanda l’uso di un set di infusione sottocutaneo (per es. con alette/a farfalla). Non
somministrare al paziente il volume residuo trattenuto nel set di infusione sottocutanea.
La sede di iniezione deve essere l’addome, a eccezione dell’area di 5 cm intorno all’ombelico. Le
iniezioni non devono mai essere effettuate in aree in cui la pelle presenta segni di arrossamento, lividi,
è delicata o dura, né in aree in cui sono presenti nei o cicatrici.
Ocrevus soluzione iniettabile deve sempre essere somministrato da un operatore sanitario. Alla prima
dose si raccomanda, per almeno un’ora dopo l’iniezione, il monitoraggio del paziente con accesso a
strumenti medici appropriati per gestire reazioni gravi come le IR. Per le dosi successive, la necessità
di un monitoraggio successivo all’iniezione è da considerarsi a discrezione del medico curante (vedere
paragrafo 4.4).
ALLEGATO IV
CONCLUSIONI SCIENTIFICHE E MOTIVAZIONI PER LA VARIAZIONE DEI TERMINI
DELL’AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) dei Rapporti periodici di aggiornamento
sulla sicurezza ( Periodic Safety Update Report, PSUR) per ocrelizumab, le conclusioni scientifiche del
PRAC sono le seguenti:
Alla luce dei dati disponibili che non sollevano preoccupazioni su un aumento del rischio di esiti
avversi della gravidanza nelle donne esposte a ocrelizumab nei 3 mesi precedenti l'ultimo periodo
mestruale e delle informazioni disponibili sulla farmacocinetica di ocrelizumab, compresa l’emivita
terminale di 26 giorni, il PRAC ha concluso che le informazioni del prodotto dei medicinali contenenti
ocrelizumab devono essere modificate di conseguenza.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
(Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione.
Motivazioni per la variazione dei termini dell’autorizzazione all’immissione in commercio
Sulla base delle conclusioni scientifiche relative a ocrelizumab, il CHMP ritiene che il rapporto
beneficio/rischio del medicinale contenente ocrelizumab sia invariato fatte salve le modifiche proposte
alle informazioni del prodotto.
Il CHMP raccomanda la variazione dei termini dell’autorizzazione all’immissione in commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a OCREVUSForma farmaceutica: Polvere per soluzione per infusione endovenosa, 120 MGPrincipio attivo: belimumabProduttore: GLAXOSMITHKLINE (IRELAND) LIMITEDPrescrizione richiestaForma farmaceutica: Concentrato per soluzione per infusione, 150 mgPrincipio attivo: ublituximabProduttore: NEURAXPHARM PHARMACEUTICALS, S.LPrescrizione richiestaForma farmaceutica: Polvere per soluzione per infusione endovenosa, 300 MGPrincipio attivo: vedolizumabProduttore: TAKEDA PHARMA A/SPrescrizione richiesta
Medici online per OCREVUS
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di OCREVUS — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.