
PANACEF

Come usare PANACEF
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
PANACEF 375 mg compresse a rilascio modificato, 500 mg compresse a rilascio modificato, 750 mg compresse a rilascio modificato
Cefacloro
CATEGORIA FARMACOTERAPEUTICA
Antibiotico appartenente alla classe delle cefalosporine.
INDICAZIONI TERAPEUTICHE
Trattamento delle seguenti infezioni sostenute da germi sensibili:
Bronchite acuta e riacutizzazione di bronchite cronica
Faringite e Tonsillite
Infezioni non complicate delle basse vie urinarie
Infezioni della cute e dei tessuti molli
CONTROINDICAZIONI
Il Panacef compresse a rilascio modificato è controindicato nei pazienti con ipersensibilità al
principio attivo, ad altri antibiotici cefalosporinici o ad uno qualsiasi degli eccipienti.
PRECAUZIONI PER L’USO
Prima di istituire una terapia con Panacef compresse a rilascio modificato, deve essere indagato con
attenzione se il paziente abbia avuto precedenti reazioni di ipersensibilità alle cefalosporine, penicilline o
ad altri farmaci.
Vi sono stati pazienti che hanno avuto gravi reazioni (compresa l’anafilassi) in seguito alla
somministrazione di penicilline o cefalosporine incluso Cefacloro, reazioni IgE mediate che si
manifestano solitamente a livello cutaneo, gastroenterico, respiratorio e cardiocircolatorio.
I sintomi possono essere: ipotensione grave ed improvvisa, accelerazione e rallentamento del battito
cardiaco, stanchezza o debolezza insolite, ansia, agitazione, vertigine, perdita di coscienza, difficoltà
della respirazione o della deglutizione, prurito generalizzato specialmente alle piante dei piedi e alle
palme delle mani, orticaria con o senza angioedema (aree cutanee gonfie e pruriginose localizzate più fre-
quentemente alle estremità, ai genitali esterni e al viso, soprattutto nella regione degli occhi e delle
labbra), arrossamento della cute specialmente intorno alle orecchie, cianosi, sudorazione abbondante,
nausea, vomito, dolori addominali crampiformi, diarrea.
Se si dovesse verificare una reazione allergica al Panacef compresse a rilascio modificato, sospendere la
somministrazione del farmaco.
Il trattamento con antibiotici ad ampio spettro, incluso il Panacef compresse a rilascio modificato, altera
la normale flora del colon e determina un aumento numerico dei clostridi. E' stato dimostrato da vari
studi che una tossina prodotta dal Clostridium difficile è la principale causa della diarrea grave associata
alla terapia antibiotica, inclusa la colite pseudomembranosa. La colite pseudomembranosa è stata
riportata con l'impiego di antibiotici ad ampio spettro (inclusi i macrolidi, le penicilline semisintetiche e
le cefalosporine); pertanto, è importante considerare questa diagnosi nei pazienti in cui insorge la diarrea
durante antibiotico-terapia.
I casi di colite di gravità lieve solitamente rispondono alla sola sospensione del farmaco. Nei casi di
gravità moderata o severa devono essere prese le opportune misure terapeutiche che dovrebbero
includere l'effettuazione di appropriati studi batteriologici e la somministrazione di liquidi, elettroliti e
proteine.
Se la colite non migliora dopo la sospensione del farmaco o se i sintomi non sono gravi, la vancomicina
per via orale è il trattamento di scelta.
Come con altri antibiotici, durante il trattamento con Panacef compresse a rilascio modificato, deve
essere tenuta in considerazione la possibile insorgenza di microrganismi resistenti che può esitare in una
superinfezione per la quale si dovranno adottare le opportune misure del caso.
Il Panacef compresse a rilascio modificato dovrebbe essere somministrato con cautela ai pazienti con
funzionalità renale fortemente ridotta. In tali condizioni il dosaggio dovrebbe essere inferiore a quello
generalmente consigliato.
INTERAZIONI
L'entità di assorbimento del Panacef compresse a rilascio modificato diminuisce se entro un'ora
dall'assunzione dell'antibiotico vengono somministrati antiacidi contenenti idrossido di magnesio o
alluminio, mentre gli H2-bloccanti non alterano la velocità e l'entità dell'assorbimento del Panacef
compresse a rilascio modificato.
Similmente agli altri antibiotici beta-lattamici, l'escrezione renale del Panacef (e presumibilmente
del Panacef compresse a rilascio modificato) è inibita dalla somministrazione di probenecid
(farmaco antigottoso in grado di favorire l'eliminazione dell'acido urico); nel corso degli studi
clinici non sono state osservate altre interazioni significative con farmaci.
Dopo somministrazione di cefacloro si possono osservare delle reazioni falsamente positive al
glucosio urinario con le soluzioni di Benedict e Fehling e con il test al solfato di rame.
AVVERTENZE SPECIALI
Gravidanza e allattamento
Chiedere consiglio al medico o al farmacista prima di prendere qualsiasi medicinale.
La tollerabilità del cefacloroo durante la gravidanza non è stata sufficientemente provata.
Non vi sono studi specifici e ben controllati in donne gravide e, poiché gli studi sulla riproduzione
animale non sempre sono predittivi della risposta nell'uomo, questo farmaco durante la gravidanza
dovrebbe essere usato solo se chiaramente necessario e sotto controllo medico.
L'uso di Panacef compresse a rilascio modificato durante il travaglio ed il parto non è stato
studiato; pertanto il farmaco dovrebbe essere somministrato solo in caso di accertato bisogno.
Piccole quantità di cefacloro sono state ritrovate nel latte materno dopo la somministazione di dosi singole
di 500 mg. Non si conoscono gli effetti del Panacef nel lattante. Durante l'allattamento si raccomanda
cautela nell'uso del farmaco.
Uso nei bambini
L'efficacia e la tollerabilità del Panacef compresse a rilascio modificato nei bambini non è stata
ben stabilita.
Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Il Panacef compresse a rilascio modificato non ha effetti sulla capacità di guida e sull'uso di
macchinari.
DOSE, MODO E TEMPO DI SOMMINISTRAZIONE
Il Panacef compresse a rilascio modificato viene somministrato per via orale e può essere assunto
indipendentemente dai pasti. Comunque, l'assunzione contemporanea di cibo aumenta
l'assorbimento di Panacef compresse a rilascio modificato. Le compresse devono essere assunte
intere, e quindi non spezzate, frantumate o masticate.
Si consigliano i seguenti schemi posologici:
- Faringiti, tonsilliti ed infezioni della cute e dei tessuti molli: 375 mg 2 volte al giorno.
- Infezioni non complicate delle basse vie urinarie: 375 mg 2 volte al giorno.
- Bronchiti: 375 mg 2 volte al giorno. Nelle infezioni più gravi possono essere necessari dosaggi più elevati (750 mg 2 volte al giorno). Nel trattamento delle infezioni causate da S. pyogenes (streptococchi di gruppo A) la terapia con Panacef compresse a rilascio modificato dovrebbe essere continuata fino a 10 giorni.
SOVRADOSAGGIO
Segni e sintomi:possono includere la nausea, il vomito, disturbi epigastrici e diarrea; la gravità
dei disturbi gastrici e della diarrea è in relazione alla dose assunta. Se sono presenti altri sintomi, è
probabile che questi siano secondari ad una malattia di base preesistente, ad una reazione allergica
o ad un altro stato tossico.
Trattamento:nel trattamento del sovradosaggio, considerare la possibilità di sovradosaggio
dovuto a più farmaci, a interazioni tra farmaci o ad una insolita farmacocinetica nel paziente.
Garantire una adeguata ventilazione e perfusione delle vie respiratorie del paziente.
Controllare attentamente e mantenere entro limiti accettabili i segni vitali del paziente (frequenza
cardiaca e pressione arteriosa), l'emogasanalisi, gli elettroliti sierici etc.
L'assorbimento intestinale dei farmaci potrebbe essere diminuito mediante la somministrazione di
carbone attivo che, in molti casi, è più efficace del vomito indotto o del lavaggio gastrico; si
consideri quindi il carbone attivo come trattamento alternativo o in aggiunta allo svuotamento
gastrico. La somministrazione ripetuta del carbone attivo può facilitare l'eliminazione di altri
farmaci che potrebbero essere stati assorbiti.
E' necessario proteggere le vie respiratorie del paziente quando viene effettuato lo svuotamento
gastrico o nell'uso del carbone attivo.
Non è noto se la diuresi forzata, la dialisi peritoneale, l'emodialisi o l'emoperfusione con carbone
siano di beneficio al paziente per il trattamento del sovradosaggio di Panacef.
EFFETTI INDESIDERATI
Dopo somministrazione orale di Panacef compresse a rilascio modificato in studi clinici è stato
osservato un basso numero di effetti indesiderati (con percentuale d’incidenza generalmente
inferiore all’1%), la maggior parte dei quali furono di natura lieve e transitoria.
Manifestazioni gastro-intestinali:diarrea, nausea, vomito e dispepsia (disturbo digestivo).
Manifestazioni allergiche:sono stati riscontrati eruzione cutanea, orticaria e prurito. Nel corso di
studi clinici controllati, su 3.272 pazienti trattati con Panacef compresse a rilascio modificato è
stata riscontrata una reazione simile alla malattia da siero (0,03%), caratterizzata dalla comparsa di
eritema multiforme, eruzione cutanea ed altre manifestazioni a carico della cute accompagnate da
artriti/artralgie (disturbi a carico delle articolazioni di natura infiammatoria o dolorosa), con o
senza febbre. Tali manifestazioni insorgono più spesso durante o dopo un ciclo di trattamento con
cefacloro e sono state osservate più frequentemente nei bambini che negli adulti. I segni ed i
sintomi si manifestano generalmente pochi giorni dopo l’inizio della terapia e cessano pochi giorni
dopo la fine del trattamento. Antistaminici e cortisonici favoriscono la guarigione. Non sono state
osservate gravi complicazioni.
Sistema linfatico e circolatorio:eosinofilia.
Sistema genito-urinario:moniliasi vaginale e vaginite.
I seguenti eventi avversi, la cui relazione causale con il farmaco è peraltro incerta, sono stati
osservati nei pazienti trattati con Panacef compresse a rilascio modificato: mal di testa, capogiro,
sonnolenza, aumenti transitori delle transaminasi e della fosfatasi alcalina, aumento transitorio
dell’azotemia e della creatininemia, transitorie trombocitopenia, leucopenia, linfocitosi,
neutropenia ed anormalità dell’esame delle urine.
In pazienti trattati con cefacloro sono stati talvolta osservati: eritema multiforme, febbre, anafilassi
(più frequente nei pazienti con precedenti di allergia alla penicillina), Sindrome di Stevens-
Johnson, positività al test diretto di Coombs, prurito ai genitali, necrolisi tossica epidermica,
nefrite interstiziale reversibile, alterata funzionalità del fegato comprendente la colestasi, aumento
del tempo di protrombina in pazienti che ricevono contemporaneamente cefacloro e warfarin
(farmaco antitrombotico), iperattività reversibile, nervosismo, insonnia, stato confusionale,
ipertonia (aumento del tono muscolare), anemia aplastica, agranulocitosi ed anemia emolitica.
Il trattamento con antibiotici ad ampio spettro può alterare la flora batterica intestinale, dando
talora luogo a manifestazioni di colite pseudomembranosa.
Reazioni anafilattoidi possono essere rappresentate da manifestazioni isolate, compreso
l’angioedema (anormale ritenzione di liquidi nei tessuti, di origine allergica), l’astenia (mancanza
di forza), l’edema (sia facciale che agli arti), la dispnea (difficoltà nel respiro), le parestesie
(sensazione di formicolio), la sincope (improvvisa perdita di forze) e la vasodilatazione.
E’ importante segnalare al medico o al farmacista la comparsa di qualsiasi effetto indesiderato
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione all’indirizzo:
http://www.agenziafarmaco.gov.it/content/come-segnalare-una-sospetta-reazione-avversa
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla
sicurezza di questo medicinale.
SCADENZA E CONSERVAZIONE
Scadenza: vedere la data di scadenza indicata sulla confezione.
ATTENZIONE: NON UTILIZZARE IL MEDICINALE DOPO LA DATA DI SCADENZA
INDICATA SULLA CONFEZIONE
La datadi scadenza si riferisce al prodotto in confezionamento integro, correttamente conservato.
Conservare a temperatura inferiore a 30°C.
TENERE IL MEDICINALE FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI
COMPOSIZIONE
Panacef 375 mg compresse a rilascio modificato
Ogni compressa a rilascio modificato contiene:
Principio attivo:Cefacloro monoidrato equivalente a cefacloro 375 mg
Eccipienti:Mannitolo, ipromellosa, idrossipropilcellulosa, copolimero dell'acido metacrilico,
acido stearico, stearato di magnesio.
Rivestimento:Miscela colorante blu,propilenglicole.
Panacef 500 mg compresse a rilascio modificato
Ogni compressa a rilascio modificato contiene:
Principio attivo:Cefacloro monoidrato equivalente a cefacloro 500 mg
Eccipienti:Mannitolo, ipromellosa, idrossipropilcellulosa, copolimero dell'acido metacrilico,
acido stearico, stearato di magnesio.
Rivestimento:Miscela colorante blu, propilenglicole.
Panacef 750 mg compresse a rilascio modificato
Ogni compressa a rilascio modificato contiene:
Principio attivo:Cefacloro monoidrato equivalente a cefacloro 750 mg
Eccipienti:Mannitolo, ipromellosa, idrossipropilcellulosa, copolimero dell'acido metacrilico,
acido stearico, stearato di magnesio.
Rivestimento:Miscela colorante blu, propilenglicole.
FORMA FARMACEUTICA E CONTENUTO
Panacef 375 mg compresse a rilascio modificato in confezione da 12
Panacef 500 mg compresse a rilascio modificato in confezione da 8
Panacef 750 mg compresse a rilascio modificato in confezione da 6
Panacef 750 mg compresse a rilascio modificato in confezione da 12
Uso orale.
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
NEOPHARMED GENTILI S.p.A – Via San Giuseppe Cottolengo 15 – 20143 Milano
PRODUTTORE
ACS Dobfar Spa– Via Laurentina Km 24,730 – Pomezia (Roma)
Farmaco:
PANACEF 500 mg, capsule rigide
PANACEF 250 mg/5 ml, granulato per sospensione orale
Cefacloro
CATEGORIA FARMACOTERAPEUTICA
Antibiotico per uso orale (cefalosporine).
INDICAZIONI TERAPEUTICHE
Trattamento delle seguenti infezioni causate da germi sensibili:
- Infezioni dell'apparato respiratorio, quali le polmoniti, le bronchiti, le riacutizzazioni delle bronchiti croniche, le faringiti e le tonsilliti.
- Otiti medie (processi infiammatori di origine batterica a carico dell'orecchio medio).
- Infezioni della cute e dei tessuti molli.
- Infezioni del tratto urinario, incluse le pielonefriti e le cistiti.
- Sinusiti.
- Uretrite gonococcica.
CONTROINDICAZIONI
Il Panacef è controindicato nei pazienti con ipersensibilità al principio attivo, ad altre cefalosporine o ad uno
qualsiasi degli eccipienti.
PRECAUZIONI PER L’USO
Prima di iniziare la terapia con il Panacef, si raccomanda di indagare su precedenti reazioni di
ipersensibilità alle cefalosporine ed alle penicilline.
Vi sono stati pazienti che hanno avuto gravi reazioni (compresa l’anafilassi) in seguito alla
somministrazione di penicilline o cefalosporine incluso Cefacloro, reazioni IgE mediate che si
manifestano solitamente a livello cutaneo, gastroenterico, respiratorio e cardiocircolatorio.
I sintomi possono essere: ipotensione grave ed improvvisa, accelerazione e rallentamento del battito
cardiaco, stanchezza o debolezza insolite, ansia, agitazione, vertigine, perdita di coscienza, difficoltà
della respirazione o della deglutizione, prurito generalizzato specialmente alle piante dei piedi e alle
palme delle mani, orticaria con o senza angioedema (aree cutanee gonfie e pruriginose localizzate più fre-
quentemente alle estremità, ai genitali esterni e al viso, soprattutto nella regione degli occhi e delle
labbra), arrossamento della cute specialmente intorno alle orecchie, cianosi, sudorazione abbondante,
nausea, vomito, dolori addominali crampiformi, diarrea.
In caso di reazioni allergiche la somministrazione del farmaco deve essere interrotta ed il paziente
opportunamente trattato
Poichè durante il trattamento con antibiotici ad ampio spettro (inclusi i macrolidi, le penicilline
semisintetiche e le cefalosporine) è possibile la comparsa di colite pseudomembranosa, la sua insorgenza
deve essere tenuta presente nel corso del trattamento con questi farmaci
Il Panacef va somministrato con cautela ai pazienti con funzionalità renale fortemente ridotta. In questi casi,
il dosaggio dovrebbe essere inferiore a quello generalmente consigliato.
Gli antibiotici ad ampio spettro devono essere somministrati con cautela a soggetti che hanno avuto in
precedenza disturbi intestinali, per la possibilità che possano svilupparsi coliti associate a terapia antibiotica.
L'uso prolungato del Panacef può dare luogo ad una proliferazione di germi non sensibili; se durante la
terapia con Panacef interviene una superinfezione batterica, essa deve essere opportunamente trattata.
Uso nei neonati
L'efficacia e la tollerabilità del Panacef nei neonati con meno di un mese di vita non sono note.
INTERAZIONI
Informare il medico o il farmacista se si è recentemente assunto qualsiasi altro medicinale, anche quelli
senza prescrizione medica.
Vi sono prove di una parziale allergenicità crociata tra le penicilline e le cefalosporine.
Dopo somministrazione di Panacef si possono avere delle reazioni falsamente positive al glucosio urinario
sia con le soluzioni di Benedict e Fehling che con il Clinitest ma non con il Tes-Tape (cartina per le analisi
del glucosio nelle urine, Lilly).
Sono state segnalate, in corso di trattamento con cefalosporine, positività dei tests di Coombs (talora false).
L'eliminazione renale del cefacloro è inibita dal probenecid (farmaco antigottoso in grado di favorire
l'eliminazione dell'acido urico).
AVVERTENZE SPECIALI
Pazienti allergici all’amido (non affetti da morbo celiaco) non dovrebbero assumere il medicinale.
Il granulato per sospensione orale e le gocce orali, sospensione contengono saccarosio, in caso di accertata
intolleranza agli zuccheri contattare il medico curante prima di assumere il medicinale.
Il Panacef non ha effetti sulla capacità di guidare veicoli o sull'uso di macchinari.
Gravidanza e allattamento
Chiedere consiglio al medico o al farmacista prima di prendere qualsiasi medicinale.
La tollerabilità del cefacloro durante la gravidanza non è stata sufficientemente provata.
Nelle donne in stato di gravidanza il farmaco va usato in caso di effettiva necessità e sotto il diretto controllo
medico.
Piccole quantità di cefacloro sono state ritrovate nel latte materno dopo la somministrazione di dosi singole
di 500 mg. Durante l'allattamento si raccomanda cautela nell'uso del farmaco.
DOSE, MODO E TEMPO DI SOMMINISTRAZIONE
Il Panacef si somministra per via orale e può essere assunto indipendentemente dai pasti.
Adulti:250 mg ogni 8 ore; nelle infezioni più gravi possono essere necessari dosaggi più elevati. La dose
massima raccomandata è di 2 g al giorno.
Per il trattamento dell'uretrite gonococcica acuta in ambo i sessi, è consigliata un'unica somministrazione di
3 g di cefacloro eventualmente in associazione ad 1 g di probenecid.
Bambini:20 mg/kg al giorno in dosi frazionate ogni 8 ore; nelle infezioni più gravi (come nell'otite media),
si raccomanda un dosaggio di 40 mg/Kg al giorno fino ad una dose massima giornaliera di 1 g.
Nel trattamento delle infezioni causate da streptococco beta-emolitico, il dosaggio terapeutico con cefacloro
deve essere mantenuto per almeno 10 giorni.
MISURINO E SIRINGA PER PANACEF 250 mg/5 ml granulato per sospensione
orale
A titolo esemplicativo, per una dose giornaliera di 40 mg/Kg
| 500 mg 400 mg 300 mg 200 mg 100 mg | |
(Panacef 250 mg/5 ml granulato per sospensione orale)
Fino a 8 kgDa 8 a 16 KgDa 16 a 21 KgOltre 21 Kg
siringasiringa o
misurino
siringa o
misurino
misurino
Schema di somministrazione alternativa: nell'otite media e nella faringite, la dose totale giornaliera
può essere somministrata in dosi frazionate ogni 12 ore; la quantità di prodotto ricostituito dovrà
essere assunta secondo il seguente schema:
A titolo esemplicativo, per una dose giornaliera di 40 mg/Kg
(Panacef 250 mg/5 ml granulato per sospensione orale)
Fino a 8 kgDa 8 a 16 KgDa 16 a 21 KgOltre 21 Kg
misurino
Nota: le tabelle si riferiscono al dosaggio massimo giornaliero di 40 mg/Kg; le dosi da 20 mg/Kg
siringamisurinomisurino
| 3 volte al dì (dose unitaria) | 100 mg (2 ml) | 200 mg (4 ml) | e d 250 mg (5 ml) | 300 mg (6 ml) |
| 2 volte al dì (dose unitaria) | a 150 mg (3 ml) | 300 mg (6 ml) | 400 mg (8 ml) | 500 mg (10 ml) |
corrispondono alla metà dei valori sopra riportati.
Istruzioni per preparare la sospensione
Agitare bene il flacone prima della preparazione; quindi aggiungere acqua fino al livello indicato dalla
freccia sull'etichetta, tappare ed agitare bene la sospensione. Aggiungere acqua nuovamente, fino al livello
indicato dalla freccia, ed agitare bene fino ad ottenere una sospensione uniforme.
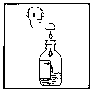

Se preparata secondo queste istruzioni, 5 ml di sospensione contengono cefacloro monoidrato equivalente a
250 mg di cefacloro.
Agitare bene prima di ogni somministrazione.
SOVRADOSAGGIO
Segni e sintomi:possono includere nausea, vomito, disturbi epigastrici e diarrea, la cui gravità è in relazione
alla dose assunta. Se sono presenti altri sintomi, è probabile che essi siano secondari ad una malattia
preesistente, ad una reazione allergica o ad un altro stato tossico.
Trattamento:tenere sempre presente la possibilità che il sovradosaggio sia causato da più farmaci, da
interazione fra farmaci o dalla particolare farmacocinetica nel paziente.
Il lavaggio gastrico non è necessario quando il paziente non ha ingerito una dose di Panacef 5 volte
superiore alla dose consigliata.
Il paziente va seguito attentamente, controllando in particolar modo lo stato delle vie aeree assicurando la
ventilazione e la perfusione, i segni vitali (frequenza cardiaca e pressione arteriosa), la emogasanalisi, gli
elettroliti sierici etc.
L'assorbimento intestinale può essere ridotto somministrando carbone attivo che, in molti casi, è più efficace
del vomito indotto o del lavaggio gastrico; si consideri quindi il carbone come trattamento alternativo o in
aggiunta allo svuotamento gastrico. La somministrazione ripetuta del carbone attivo può facilitare
l'eliminazione di altri farmaci che potrebbero essere stati assunti. Controllare attentamente le vie aeree del
paziente durante lo svuotamento gastrico e nell'uso del carbone.
Non è noto se la diuresi forzata, la dialisi peritoneale, l'emodialisi o l'emoperfusione con carbone siano di
beneficio al paziente.
EFFETTI INDESIDERATI
Come tutti i medicinali, Panacef può causare effetti indesiderati sebbene non tutte le persone li manifestino.
Reazioni avverse considerate correlabili al trattamento con Panacef sono le seguenti:
Manifestazioni allergiche: sono state osservate reazioni di ipersensibilità (1,5%) comprese le eruzioni
morbilliformi (1%); prurito, orticaria e test di Coombs positivo si osservano in meno di 1 paziente su 200
trattati.
Sono state inoltre riferite reazioni generalizzate chiamate "malattie da siero-simili", caratterizzate dalla
presenza di eritema multiforme, eruzione cutanea ed altre manifestazioni a carico della cute accompagnate
da artriti e/o artralgie (disturbi a carico delle articolazioni di natura infiammatoria o dolorosa), con o senza
febbre. Le reazioni "malattie da siero-simili" avvengono più spesso durante e dopo un ciclo di trattamento
con il cefacloro e, con maggior frequenza, nei bambini che negli adulti.
I segni ed i sintomi si manifestano pochi giorni dopo l'inizio della terapia e cessano pochi giorni dopo la sua
conclusione. Gli antistaminici ed i cortisonici favoriscono la guarigione. Non sono state osservate gravi
complicazioni.
Reazioni di ipersensibilità più gravi (quali la sindrome di Stevens-Johnson, la necrolisi tossica epidermica e
l'anafilassi) sono state osservate raramente.
Manifestazioni gastro-intestinali: si possono presentare in circa il 2,5% dei pazienti, anche con la comparsa
di diarrea.
La colite pseudomembranosa può essere osservata durante e dopo il trattamento antibiotico. Raramente si
osservano nausea e vomito. Con alcune penicilline ed altre cefalosporine raramente sono state osservate
epatite transitoria e ittero colestatico.
Altre manifestazioni: angioedema (anormale ritenzione di liquidi nei tessuti, di origine allergica),
eosinofilia, prurito ai genitali, moniliasi vaginale, vaginite e, raramente, trombocitopenia e nefrite
interstiziale reversibile.
Sono stati segnalati casi di anemia emolitica in seguito a trattamento con cefalosporine.
Effetti per i quali non è certa la correlabilità con il trattamento:
Sistema nervoso centrale: raramente iperattività reversibile, irrequietezza, insonnia, confusione mentale,
ipertonia (aumento del tono muscolare), allucinazioni, senso di instabilità e barcollamento, sonnolenza.
Sistema digerente: lievi aumenti dei valori delle transaminasi (SGOT e SGPT) o della fosfatasi alcalina.
Sistema emolinfatico: linfocitosi transitoria, leucopenia e, raramente, anemia emolitica, anemia aplastica,
agranulocitosi e neutropenia reversibile. Ci sono state rare segnalazioni di aumento del tempo di
protrombina, con o senza conseguenze cliniche (ad es. sanguinamento), in pazienti che ricevevano
contemporaneamente cefacloro e Warfarin sodico (farmaco antitrombotico).
Apparato genito-urinario: lievi aumenti dell'azotemia, della creatininemia ed alterazioni dell'analisi delle
urine.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione all’indirizzo:
http://www.agenziafarmaco.gov.it/content/come-segnalare-una-sospetta-reazione-avversa
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
SCADENZA E CONSERVAZIONE
Scadenza: vedere la data di scadenza indicata sulla confezione.
Attenzione: non utilizzare il medicinale dopo la data di scadenza indicata sulla confezione.
La data di scadenza si riferisce al prodotto in confezionamento integro, correttamente conservato.
Conservare a temperatura non superiore a 30°C.
Una volta preparata la sospensione orale, conservare in frigorifero (fra +2 e +8°C) e usare entro 14 giorni.
Tenere il medicinale fuori dalla vista e dalla portata dei bambini
COMPOSIZIONE
PANACEF 500 mg capsule rigide
Ogni capsula contiene:
Principio attivo:
Cefacloro monoidrato equivalente a cefacloro 500 mg
Eccipienti:
Amido pregelatinizzato; magnesio stearato; dimeticone 350 c.s.
PANACEF 250 mg/5ml granulato per sospensione orale
5 ml di sospensione contengono:
Principio attivo:
Cefacloro monoidrato equivalente a cefacloro 250 mg
Eccipienti:
Eritrosina E-127 lacca di alluminio; metilcellulosa 15; sodio laurilsolfato; dimeticone 350 cs; gomma
polisaccaride; amido pregelatinizzato; aroma fragola; saccarosio.
FORMA FARMACEUTICA E CONTENUTO
PANACEF 500 mg capsule rigide - 8 capsule
PANACEF 250 mg/5 ml granulato per sospensione orale - flacone da 100 ml
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
NEOPHARMED GENTILI S.p.A – Via San Giuseppe Cottolengo 15 – 20143 Milano
PRODUTTORE
ACS Dobfar Spa – Pomezia (Roma)
FARMACO:
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a PANACEFForma farmaceutica: Compressa a rilascio modificato, 750 MGPrincipio attivo: cefaclorProduttore: BIOMED PHARMA S.R.L.Prescrizione richiestaForma farmaceutica: Granulato per sospensione orale, 250 MG/5 MLPrincipio attivo: cefaclorPrescrizione non richiesta
Medici online per PANACEF
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di PANACEF — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














