
TYSABRI

Come usare TYSABRI
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Tysabri 300 mg concentrato per soluzione per infusione
natalizumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
contiene importanti dati di sicurezza che deve conoscere prima e durante il trattamento con Tysabri.
- Conservi questo foglio e la scheda di allerta per il paziente. Potrebbe aver bisogno di leggerli di nuovo. Tenga la scheda di allerta per il paziente con sé durante il trattamento e per sei mesi dopo l'ultima dose di questo medicinale, poiché possono verificarsi effetti indesiderati anche dopo la sospensione del trattamento.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Tysabri e a cosa serve
- 2. Cosa deve sapere prima di ricevere Tysabri
- 3. Come viene somministrato Tysabri
- 4. Possibili effetti indesiderati
- 5. Come conservare Tysabri
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Tysabri e a cosa serve
Tysabri viene usato per trattare la sclerosi multipla (SM). Contiene il principio attivo natalizumab.
Questo viene denominato anticorpo monoclonale.
La SM provoca un'infiammazione nel cervello che danneggia le cellule nervose. Tale infiammazione
si verifica quando i globuli bianchi penetrano nel cervello e nel midollo spinale. Questo medicinale
impedisce ai globuli bianchi di raggiungere il cervello. Ciò riduce il danno ai nervi provocato dalla
SM.
Sintomi della sclerosi multipla
I sintomi della SM variano da un paziente all'altro e lei potrà presentarne qualcuno oppure non
presentarne affatto.
Possono comprendere: problemi nel camminare, una sensazione di intorpidimento al viso, alle
braccia o alle gambe, problemi della visione, spossatezza, perdita dell’equilibrio o intontimento,
problemi a carico della vescica e dell'intestino, difficoltà nel pensiero e nella concentrazione,
depressione, dolori acuti o cronici, problemi sessuali, rigidità e spasmi muscolari. In caso di
riacutizzazione dei sintomi, si parla di recidiva (detta anche esacerbazione o attacco). Quando si
verifica una recidiva potrà notare che i suoi sintomi progrediscono improvvisamente, nel giro di poche
ore, oppure lentamente, nel corso di alcuni giorni. Di norma, poi i sintomi miglioreranno gradualmente
(in questo caso si parla di remissione).
Come Tysabri può aiutare
Negli studi, questo medicinale ha ridotto di circa la metà l’aumento della disabilità causata dalla SM,
ed ha ridotto, di circa i due terzi, il numero degli attacchi di SM. Durante il trattamento con questo
medicinale, potrebbe non notare alcun effetto sulla SM, ma può aiutare ad impedire che la malattia
peggiori.
2. Cosa deve sapere prima di ricevere Tysabri
Prima di iniziare il trattamento con questo medicinale, è importante che discuta con il medico dei
possibili benefici che potrà avere a seguito del trattamento e i rischi che vi sono associati.
Tysabri non deve esserle somministrato
- Se è allergicoa natalizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- Se le è stata diagnosticata leucoencefalopatia multifocale progressiva(PML). La PML è una infezione non comune del cervello.
- Se ha un problema serio a carico del sistema immunitario. Questo potrebbe essere causato da una malattia (come l'HIV), o da qualche medicinale che sta prendendo, o che ha preso in passato (vedere di seguito).
- Se sta prendendo medicinali che agiscono sul sistema immunitario, inclusi alcuni medicinali usati per il trattamento della SM. Questi medicinali non possono essere utilizzati con Tysabri.
- Se ha un cancro(a meno che non si tratti di un tipo di cancro della pelle chiamato carcinoma basocellulare).
Avvertenze e precauzioni
Deve discutere con il medicose Tysabri è il trattamento più adatto per lei.
Ciò deve essere fatto prima di iniziare a prendere Tysabri, e quando avrà ricevuto Tysabri per più di 2
anni.
Possibile infezione cerebrale (PML)
Alcune persone che ricevevano questo farmaco (meno di 1 su 100) hanno avuto un’infezione
cerebrale non comune denominata leucoencefalopatia multifocale progressiva (PML). La PML può
provocare grave disabilità o risultare fatale.
- Prima di iniziare il trattamento, tutti i pazienti saranno sottoposti ad esami del sanguepredisposti dal medico per l'infezione da virus JC. Il virus JC è un virus comune che normalmente non fa ammalare. Tuttavia, la PML è legata ad un aumento del virus JC nel cervello. Il motivo di questo aumento in alcuni pazienti trattati con Tysabri non è chiaro. Prima e durante il trattamento, il medico la sottoporrà ad esami del sangue per verificare se ha anticorpi contro il virus JC, che sono un segno che lei ha un’infezione da virus JC.
- Il medico pianificherà una risonanza magnetica (RM)che sarà ripetuta durante il trattamento per escludere la PML.
- I sintomi della PMLpossono essere simili a quelli di una recidiva di SM (vedere paragrafo 4, Possibili effetti indesiderati). È possibile ammalarsi di PML fino a 6 mesi dopo l'interruzione del trattamento con Tysabri.
Parli con il medico appena possibilese nota un peggioramento della SM, se nota qualche sintomo
nuovo durante il periodo di trattamento con Tysabri o fino a 6 mesi dopo.
- Parli con il partner o con coloro che l'assistonoriguardo a cosa bisogna controllare (vedere anche paragrafo 4, Possibili effetti indesiderati). Alcuni sintomi possono essere difficili da individuare personalmente, come cambiamenti di umore o del comportamento, confusione,
difficoltà del linguaggio e di comunicazione. Se sviluppa uno qualsiasi di questi, potrebbe aver
bisogno di ulteriori esami. Continui a prestare attenzione ai sintomi nei 6 mesi dopo
l’interruzione del trattamento con Tysabri.
- Conservi la scheda di allerta per il paziente che le ha consegnato il medico. Include queste informazioni. La mostri al partner o a coloro che l’assistono.
Tre elementi possono far aumentare il rischio di PMLcon Tysabri. Se ha due o più di questi
fattori di rischio, il rischio aumenta ulteriormente:
- se ha anticorpi per il virus JC nel sangue. Questi sono un segno che il virus si trova nel suo organismo. Lei sarà sottoposto a esame prima e durante il trattamento con Tysabri.
- Se è stato trattato per lungo tempo con Tysabri,specialmente se per più di due anni.
- se ha assunto un medicinale chiamato immunosoppressoreche riduce l’attività del sistema immunitario.
Un’altra condizione, chiamata neuropatia granulare da virus JC ( JC virus granule cell neuronopathy
- JCV GCN) è anche causata dal virus JC e si è verificata in alcuni pazienti trattati con Tysabri. I sintomi della JCV GCN sono simili ai sintomi di PML.
Il medico potrà ripetere il test regolarmente per chi è a minor rischio di PML, per valutare che:
- continua a non avere anticorpi anti-virus JC nel sangue
- se ha ricevuto il trattamento per oltre 2 anni, presenta un livello ancora basso di anticorpi anti- virus JC nel sangue.
Se qualcuno si ammala di PML
La PML può essere trattata e il trattamento con Tysabri verrà interrotto. Tuttavia, alcune persone
manifestano una reazionequando Tysabri viene rimosso dall’organismo. Questa reazione (nota
come IRISo sindrome infiammatoria da immunoricostituzione) può provocare un peggioramento
delle sue condizioni, incluso un peggioramento della funzionalità cerebrale.
Monitorare l’insorgere di altre infezioni
Alcune infezioni diverse dalla PML possono anch’esse essere serie e possono essere causate da virus,
batteri e altre cause.
Parli con un medico o un infermierese pensa di avere un’infezione (vedere anche paragrafo 4,
Possibili effetti indesiderati).
Alterazioni delle piastrine ematiche
Natalizumab può ridurre la quantità di piastrine, che sono responsabili della coagulazione, nel sangue.
Ciò potrebbe provocare una condizione chiamata trombocitopenia (vedere paragrafo 4) che causa
l’incapacità del sangue di coagularsi ad una velocità sufficiente ad arrestare i sanguinamenti. Tale
condizione può a sua volta causare la comparsa di lividi e altri problemi più gravi quali sanguinamenti
eccessivi. Consulti immediatamente un medico se nota la comparsa di lividi non spiegabili, macchie
cutanee rosse o viola (dette petecchie), sanguinamento da tagli cutanei che non si ferma o trasuda,
sanguinamento gengivale o nasale prolungato, sangue nelle urine o nelle feci, sanguinamento nel
bianco degli occhi.
Bambini e adolescenti
Non somministrare il medicinale a bambini e adolescenti di età inferiore ai 18 anni.
Altri medicinali e Tysabri
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
- Non deveesserle somministrato questo medicinale se sta attualmente prendendo medicinali che agiscono sul sistema immunitario, compresi alcuni altri medicinali per il trattamento della SM.
- È possibile che non possa usare questo medicinale se ha preso in passatomedicinali che agiscono sul sistema immunitario.
Gravidanza e allattamento
- Non usi questo medicinale in caso di gravidanzaa meno che non ne abbia parlato con il medico. Informi immediatamente il medico se inizia una gravidanza, se sospetta di essere incinta oppure se intende intraprendere una gravidanza.
- Non allatti al seno durante il trattamento con Tysabri. Il medico la aiuterà a decidere se deve smettere di allattare al seno o se interrompere l’uso del medicinale.
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale. Il rischio per il bambino e il
beneficio per la madre saranno presi in considerazione dal medico.
Guida di veicoli e utilizzo di macchinari
I capogiri sono un effetto indesiderato molto comune. Se li manifesta, non guidi veicoli e non utilizzi
macchinari.
Tysabri contiene sodio
Ogni flaconcino di questo medicinale contiene 2,3 mmol (o 52 mg) di sodio. Dopo la diluizione, il
medicinale contiene 17,7 mmol (406 mg) di sodio per dose. Lei deve tenere presente questa
informazione se segue una dieta a basso contenuto di sodio.
3. Come viene somministrato Tysabri
L’infusione endovenosa di Tysabri le sarà somministrata da un medico specializzato nel trattamento
della SM. Il medico può prescriverle il passaggio diretto da un altro medicinale per la SM a Tysabri, se
non vi sono problemi causati dal trattamento precedente.
- Il medico ordinerà un esame del sangueper gli anticorpi al virus JC e altri possibili problemi.
- Il medico la sottoporrà a una RMche sarà ripetuta durante il trattamento.
- Per passare da alcuni medicinali per la SM, il medico può consigliarle di attendere un certo periodo per assicurare che la maggior parte del medicinale precedente sia stata eliminata dall’organismo.
- Per gli adulti, la dose raccomandata è di 300 mg, da somministrare una volta ogni 4 settimane.
- Prima della somministrazione, Tysabri deve essere diluito. Viene somministrato in una vena con una flebo (un'infusione endovenosa), generalmente in un braccio. L'infusione dura circa 1 ora.
- Le informazioni per i medici ed il personale sanitario sulla modalità di preparazione e di
Se interrompe il trattamento con Tysabri
L’assunzione regolare di Tysabri è importante, soprattutto nei primi mesi di trattamento. È importante
che prosegua il trattamento fino a quando lei e il medico riteniate che questo le giovi. I pazienti che
hanno ricevuto una o due dosi di Tysabri e hanno successivamente interrotto il trattamento per tre mesi
o più hanno dimostrato una maggior probabilità di sviluppare una reazione allergica se il trattamento
viene ripreso.
Controllo delle reazioni allergiche
Alcuni pazienti hanno manifestato una reazione allergica verso questo medicinale. Il medico potrà
controllare eventuali reazioni allergiche che si possono manifestare durante l'infusione e nell’ora
successiva. Vedere anche il paragrafo 4, Possibili effetti indesiderati.
Se dimentica di prendere Tysabri
Se salta la dose abituale di Tysabri, si metta d'accordo con il medico per riceverla il più presto
possibile. Successivamente dovrà continuare a ricevere la dose di Tysabri ogni 4 settimane.
Tysabri funzionerà sempre?
In alcuni pazienti trattato con Tysabri, con il passare del tempo le difese naturali dell'organismo
possono impedire che il medicinale agisca correttamente. Il medico potrà stabilire se questo
medicinale non agisce come dovrebbe mediante esami del sangue e, se necessario, sospenderà il
trattamento.
Per ulteriori informazioni sull’uso di Tysabri, si rivolga al medico. Usi questo medicinale seguendo
sempre esattamente quanto riportato in questo foglio o le istruzioni del medico. Se ha dubbi consulti il
medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Informi immediatamente il medico o l’infermierese nota quanto segue
Segni di un’infezione cerebrale grave:
- cambiamenti nella personalità e nel comportamento quali confusione, delirium (stato confusionale) o perdita di coscienza
- crisi epilettiche (convulsioni)
- mal di testa
- nausea/vomito
- rigidità del collo
- estrema sensibilità alla luce intensa
- febbre
- eruzione cutanea (in qualsiasi parte del corpo).
Tali sintomi possono essere causati da un’infezione del cervello ( encefalite oppure PML) o del suo
strato di rivestimento ( meningite).
Segni di altre infezioni gravi:
- febbre inspiegabile
- grave diarrea
- respiro corto
- capogiri prolungati
- mal di testa
- perdita di peso
- apatia
- compromissione della vista
- dolore o arrossamento di uno o di entrambi gli occhi
Segni di una reazione allergica
- eruzione cutanea ( orticaria)
- gonfiore al viso, alle labbra o della lingua
- difficoltà respiratoria
- dolore o malessere al torace
- aumento o diminuzione della pressione sanguigna (che sarà notata dal medico o dall’infermiere se la pressione sanguigna è tenuta sotto controllo).
Questi sono più probabili durante o subito dopo l’infusione.
Segni di un possibile problema al fegato:
- ingiallimento della pelle o del bianco degli occhi
- urine di colore scuro insolito
- esami di funzionalità epatica anomali
Parli immediatamente con un medico o un infermierese manifesta uno degli effetti indesiderati
sopra elencati o se pensa di avere un'infezione. Mostri la sua scheda di allerta per il pazientee
suo neurologo.
Altri effetti indesiderati
Molto comuni(possono interessare più di 1 persona su 10):
- infezione delle vie urinarie
- mal di gola e ipersecrezione o congestione nasale
- mal di testa
- capogiri
- sensazione di vomito imminente (nausea)
- dolori alle articolazioni
- stanchezza
- capogiri, sensazione di vomito imminente (nausea), sensazione di prurito e brividi durante o subito dopo l’infusione
Comuni(possono interessare fino a 1 persona su 10):
- anemia (diminuzione dei globuli rossi che può rendere la pelle pallida e farla sentire senza fiato o senza energia)
- allergia ( ipersensibilità)
- brividi di freddo
- orticaria
- sensazione di malessere (v omito)
- febbre
- respirazione difficoltosa (dispnea)
- rossore del viso e del corpo (rossore)
- infezione erpetica
- fastidio nel posto in cui ha fatto l'infusione. Potrebbe manifestare lividura, arrossamento, dolore, prurito o gonfiore
Non comuni(possono interessare fino a 1 persona su 100):
- allergia grave (reazione anafilattica)
- leucoencefalopatia multifocale progressiva (PML)
- disturbo infiammatorio dopo l’interruzione del medicinale
- gonfiore della faccia
- aumento del numero di globuli bianchi ( eosinofilia)
- riduzione delle piastrine nel sangue
- comparsa di lividi con facilità (porpora)
Rari(possono interessare fino a 1 persona su 1 000):
- infezione erpetica nell'occhio
- grave anemia (diminuzione dei globuli rossi che può rendere la pelle pallida e farla sentire senza fiato o privo di energia).
- grave gonfiore sotto la pelle
- alti livelli di bilirubina nel sangue ( iperbilirubinemia) che possono causare sintomi come ingiallimento degli occhi o della pelle, febbre e stanchezza
Non nota(la frequenza non può essere definita sulla base dei dati disponibili)
- infezioni insolite (le cosiddette " infezioni opportunistiche")
- danni al fegato
Si rivolga al medico al più presto possibilese pensa di avere un'infezione.
Troverà queste informazioni anche sulla scheda di allerta per il paziente che le ha dato il medico.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Tysabri
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull'etichetta e sulla scatola. La data
di scadenza si riferisce all’ultimo giorno di quel mese.
Flaconcino integro:
Conservare in frigorifero.
Non congelare.
Tenere il flaconcino nell'imballaggio esterno per proteggere il medicinale dalla luce.
Soluzione diluita:
Dopo la diluizione, si raccomanda l'uso immediato. Se non utilizzata immediatamente, la soluzione
diluita deve essere conservata ad una temperatura compresa tra 2 °C e 8 °C e somministrata entro
24 ore dalla diluizione.
Non usi questo medicinale se nota particelle nel liquido e/o se il liquido nel flaconcino presenta
un'alterazione nel colore.
6. Contenuto della confezione e altre informazioni
Cosa contiene Tysabri
Il principio attivo è natalizumab. Ogni flaconcino da 15 mL di concentrato contiene 300 mg di
natalizumab (20 mg/mL). Dopo la diluizione, la soluzione per infusione contiene all’incirca 2,6
mg/mL di natalizumab.
Gli altri componenti sono:
sodio fosfato, monobasico, monoidrato,
sodio fosfato, dibasico, eptaidrato,
sodio cloruro (vedere paragrafo 2 ‘Tysabri contiene sodio’),
polisorbato 80 (E 433)
acqua per preparazioni iniettabili
Descrizione dell’aspetto di Tysabri e contenuto della confezione
Tysabri è un liquido da incolore e limpido a leggermente opalescente.
Ogni scatola contiene un flaconcino di vetro.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Biogen Netherlands B.V.
Prins Mauritslaan 13
1171 LP Badhoevedorp
Paesi Bassi
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Biogen Belgium N.V./S.A.
Tél/Tel: +32 2 219 12 18
Lietuva
Biogen Lithuania UAB
Tel: +370 5 259 6176
България
ТП ЕВОФАРМА
Teл.: +359 2 962 12 00
Luxembourg/Luxemburg
Biogen Belgium N.V./S.A.
Tél/Tel: +352 2 219 12 18
Česká republika
Biogen (Czech Republic) s.r.o.
Tel: +420 255 706 200
Magyarország
Biogen Hungary Kft.
Tel.: +36 (1) 899 9883
Malta
Pharma MT limited
Tel: +356 213 37008/9
Danmark
Biogen (Denmark) A/S
Tlf.: +45 77 41 57 57
Deutschland
Biogen GmbH
Tel: +49 (0) 89 99 6170
Nederland
Biogen Netherlands B.V.
Tel: +31 20 542 2000
Norge
Biogen Norway AS
Tlf: +47 23 40 01 00
Eesti
Biogen Estonia OÜ
Tel: +372 618 9551
Ελλάδα
Genesis Pharma SA
Τηλ: +30 210 8771500
Österreich
Biogen Austria GmbH
Tel: +43 1 484 46 13
España
Biogen Spain SL
Tel: +34 91 310 7110
Polska
Biogen Poland Sp. z o.o.
Tel.: +48 22 351 51 00
France
Biogen France SAS
Tél: +33 (0)1 41 37 95 95
Portugal
Biogen Portugal Sociedade Farmacêutica
Unipessoal, Lda
Tel: +351 21 318 8450
România
Johnson & Johnson Romania S.R.L.
Tel: +40 21 207 18 00
Hrvatska
Biogen Pharma d.o.o.
Tel: +358 (0) 1 775 73 22
Ireland
Biogen Idec (Ireland) Ltd.
Tel: +353 (0)1 463 7799
Slovenija
Biogen Pharma d.o.o.
Tel: +386 1 511 02 90
Ísland
Icepharma hf
Sími: +354 540 8000
Slovenská republika
Biogen Slovakia s.r.o.
Tel: +421 2 323 340 08
Italia
Biogen Italia s.r.l.
Tel: +39 02 584 9901
Suomi/Finland
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Κύπρος
Genesis Pharma (Cyprus) Ltd
Τηλ: +357 22 76 57 15
Sverige
Biogen Sweden AB
Tel: +46 8 594 113 60
Latvija
Biogen Latvia SIA
Tel: +371 68 688 158
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, https://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- 1. Prima della diluizione e della somministrazione, ispezionare il flaconcino di Tysabri per verificare l’assenza di particelle. In caso di presenza di particelle e/o se il liquido nel flaconcino non appare incolore, limpido o leggermente opalescente, il flaconcino non deve essere utilizzato.
- 2. Utilizzare una tecnica asettica per la preparazione del medicinale. Rimuovere la capsula flip-top dal flaconcino. Inserire l’ago della siringa nel flaconcino attraverso il centro del tappo di gomma e prelevare 15 mL di concentrato per soluzione per infusione.
- 3. Aggiungere i 15 mL di concentrato per soluzione per infusione a 100 mL di soluzione di cloruro di sodio 9 mg/mL (0,9 ) per uso iniettabile. Capovolgere delicatamente la soluzione per miscelare completamente. Non agitare.
- 4. Tysabri non deve essere miscelato con altri medicinali o diluenti.
- 5. Prima della somministrazione ispezionare visivamente il prodotto diluito per verificare l’assenza di particelle e di alterazione del colore. Non utilizzare il medicinale se appare di colore alterato o in caso di presenza di particelle sospese.
- 6. Il medicinale diluito deve essere utilizzato al più presto possibile ed entro 24 ore dalla diluizione. Se il medicinale diluito viene conservato ad una temperatura compresa tra 2 °C e 8 C (non congelare), riportare la soluzione a temperatura ambiente prima dell’infusione.
- 7. La soluzione diluita deve essere infusa per via endovenosa nell’arco di 1 ora, ad una velocità di circa 2 mL al minuto.
- 8. Dopo il completamento dell’infusione, lavare la linea endovenosa con una soluzione di cloruro di sodio 9 mg/mL (0,9 ) per uso iniettabile.
- 9. Ciascun flaconcino è monouso.
- 10. Per migliorare la tracciabilità dei medicinali biologici, il nome (Tysabri) e il numero di lotto del prodotto somministrato devono essere registrati chiaramente.
- 11. Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
Tysabri 150 mg soluzione iniettabile in siringa preriempita
natalizumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
contiene importanti dati di sicurezza che deve conoscere prima e durante il trattamento con Tysabri.
- Conservi questo foglio e la scheda di allerta per il paziente. Potrebbe aver bisogno di leggerli di nuovo. Tenga la scheda di allerta per il paziente con sé durante il trattamento e per sei mesi dopo l'ultima dose di questo medicinale, poiché possono verificarsi effetti indesiderati anche dopo la sospensione del trattamento.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Tysabri e a cosa serve
- 2. Cosa deve sapere prima di ricevere Tysabri
- 3. Come viene somministrato Tysabri
- 4. Possibili effetti indesiderati
- 5. Come conservare Tysabri
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Tysabri e a cosa serve
Tysabri è usato per trattare la sclerosi multipla (SM). Contiene il principio attivo natalizumab. Questo
viene denominato anticorpo monoclonale.
La SM provoca un'infiammazione nel cervello che danneggia le cellule nervose. Tale infiammazione
si verifica quando i globuli bianchi penetrano nel cervello e nel midollo spinale. Questo medicinale
impedisce ai globuli bianchi di raggiungere il cervello. Ciò riduce il danno ai nervi provocato dalla
SM.
Sintomi della sclerosi multipla
I sintomi della SM variano da un paziente all'altro e lei potrà presentarne qualcuno oppure non
presentarne affatto.
Possono comprendere:problemi nel camminare, una sensazione di intorpidimento al viso, alle
braccia o alle gambe, problemi della visione, spossatezza, perdita dell’equilibrio o intontimento,
problemi a carico della vescica e dell'intestino, difficoltà nel pensiero e nella concentrazione,
depressione, dolori acuti o cronici, problemi sessuali, rigidità e spasmi muscolari. In caso di
riacutizzazione dei sintomi, si parla di recidiva (detta anche esacerbazione o attacco). Quando si
verifica una recidiva potrà notare che i suoi sintomi progrediscono improvvisamente, nel giro di poche
ore, oppure lentamente, nel corso di alcuni giorni. Di norma, poi i sintomi miglioreranno gradualmente
(in questo caso si parla di remissione).
Come Tysabri può aiutare
Negli studi, questo medicinale ha ridotto di circa la metà l’aumento della disabilità causata dalla SM,
ed ha ridotto, di circa i due terzi, il numero degli attacchi di SM. Durante il trattamento con questo
medicinale, potrebbe non notare alcun effetto sulla SM, ma può aiutare ad impedire che la malattia
peggiori.
2. Cosa deve sapere prima di ricevere Tysabri
Prima di iniziare il trattamento con questo medicinale, è importante che discuta con il medico dei
possibili benefici che potrà avere a seguito del trattamento e i rischi che vi sono associati.
Tysabri non deve esserle somministrato
- Se è allergicoa natalizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- Se le è stata diagnosticata leucoencefalopatia multifocale progressiva(PML). La PML è una infezione non comune del cervello.
- Se ha un problema serio a carico del sistema immunitario.Questo potrebbe essere causato da una malattia (come l'HIV), o da qualche medicinale che sta prendendo o che ha preso in passato (vedere di seguito).
- Se sta prendendo medicinali che agiscono sul sistema immunitario, inclusi alcuni medicinali usati per il trattamento della SM. Questi medicinali non possono essere utilizzati con Tysabri.
- Se ha un cancro (a meno che non si tratti di un tipo di cancro della pelle chiamato carcinoma basocellulare).
Avvertenze e precauzioni
Deve discutere con il medicose Tysabri è il trattamento più adatto per lei. Ciò deve essere fatto
prima di iniziare a prendere questo medicinale, e quando avrà ricevuto questo medicinale per più di 2
anni.
Possibile infezione cerebrale (PML)
Alcune persone che ricevevano questo farmaco (meno di 1 su 100) hanno avuto un’infezione
cerebrale non comune denominata leucoencefalopatia multifocale progressiva(PML). La PML può
provocare grave disabilità o risultare fatale.
- Prima di iniziare il trattamento, tutti i pazienti saranno sottoposti ad esami del sanguepredisposti dal medico per l'infezione da virus JC. Il virus JC è un virus comune che normalmente non fa ammalare. Tuttavia, la PML è legata ad un aumento del virus JC nel cervello. Il motivo di questo aumento in alcuni pazienti trattati con Tysabri non è chiaro. Prima e durante il trattamento, il medico la sottoporrà ad esami del sangue per verificare se ha anticorpi contro il virus JC, che sono un segno che lei ha un’infezione da virus JC.
- Il medico pianificherà una risonanza magnetica (RM)che sarà ripetuta durante il trattamento per escludere la PML.
- I sintomidella PML possono essere simili a quelli di una recidiva di SM (vedere paragrafo 4, Possibili effetti indesiderati). È possibile ammalarsi di PML fino a 6 mesi dopo l'interruzione del trattamento con Tysabri.
Parli con il medico appena possibilese nota un peggioramento della SM, se nota qualche sintomo
nuovo durante il periodo di trattamento con Tysabri o fino a 6 mesi dopo.
- Parli con il partner o con coloro che l'assistonoriguardo a cosa bisogna controllare (vedere anche paragrafo 4, Possibili effetti indesiderati). Alcuni sintomi possono essere difficili da
individuare personalmente, come cambiamenti di umore o del comportamento, confusione,
difficoltà del linguaggio e di comunicazione. Se sviluppa uno di qualsiasi di questi, potrebbe
aver bisogno di ulteriori esami. Continui a prestare attenzione ai sintomi nei 6 mesi dopo
l’interruzione del trattamento con Tysabri.
- Conservi la scheda di allerta per il paziente che le ha consegnato il medico. Include queste informazioni. La mostri al partner o a coloro che l’assistono.
Tre elementi possono far aumentare il rischio di PMLcon Tysabri. Se ha due o più di questi
fattori di rischio, il rischio aumenta ulteriormente:
- se ha anticorpi per il virus JCnel sangue. Questi sono un segno che il virus si trova nel suo organismo. Lei sarà sottoposto a esame prima e durante il trattamento con Tysabri.
- se è stato trattato per lungo tempocon Tysabri, specialmente se per più di due anni.
- se ha assunto un medicinale chiamato immunosoppressoreche riduce l’attività del sistema immunitario.
Un’altra condizione, chiamata neuropatia granulare da virus JC ( JC virus granule cell neuronopathy
- JCV GCN) è anche causata dal virus JC e si è verificata in alcuni pazienti trattati con questo medicinale. I sintomi della JCV GCN sono simili ai sintomi di PML.
Il medico potrà ripetere il test regolarmente per chi è a minor rischio di PML, per valutare che:
- continua a non avere anticorpi anti-virus JC nel sangue
- se ha ricevuto il trattamento per oltre 2 anni, presenta un livello ancora basso di anticorpi anti- virus JC nel sangue.
Se qualcuno si ammala di PML
La PML può essere trattata e il trattamento con Tysabri verrà interrotto. Tuttavia, alcune persone
manifestano una reazionequando Tysabri viene rimosso dall’organismo. Questa reazione (nota
come IRISo sindrome infiammatoria da immunoricostituzione) può provocare un peggioramento
delle sue condizioni, incluso un peggioramento della funzionalità cerebrale.
Monitorare l’insorgere di altre infezioni
Alcune infezioni diverse dalla PML possono anch’esse essere serie e possono essere causate da virus,
batteri e altre cause.
Parli con un medico o un infermierese pensa di avere un’infezione (vedere anche paragrafo 4,
Possibili effetti indesiderati).
Alterazioni delle piastrine ematiche
Natalizumab può ridurre la quantità di piastrine, che sono responsabili della coagulazione, nel sangue.
Ciò potrebbe provocare una condizione chiamata trombocitopenia (vedere paragrafo 4) che causa
l’incapacità del sangue di coagularsi ad una velocità sufficiente ad arrestare i sanguinamenti. Tale
condizione può a sua volta causare la comparsa di lividi e altri problemi più gravi quali sanguinamenti
eccessivi. Consulti immediatamente un medico se nota la comparsa di lividi non spiegabili, macchie
cutanee rosse o viola (dette petecchie), sanguinamento da tagli cutanei che non si ferma o trasuda,
sanguinamento gengivale o nasale prolungato, sangue nelle urine o nelle feci, sanguinamento nel
bianco degli occhi.
Bambini e adolescenti
Non somministrare il medicinale a bambini e adolescenti di età inferiore ai 18 anni.
Altri medicinali e Tysabri
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
- Non deve esserle somministrato questo medicinalese sta attualmente prendendo medicinali che agiscono sul sistema immunitario, compresi alcuni altri medicinali per il trattamento della SM.
- È possibile che non possa usare questo medicinale se ha preso in passatomedicinali che agiscono sul sistema immunitario.
Gravidanza e allattamento
- Non usi questo medicinale in caso di gravidanzaa meno che non ne abbia parlato con il medico. Informi immediatamente il medico se inizia una gravidanza, se sospetta di essere incinta oppure se intende intraprendere una gravidanza.
- Non allatti al seno durante il trattamento con Tysabri. Il medico la aiuterà a decidere se deve smettere di allattare al seno o se interrompere l’uso del medicinale.
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale. Il rischio per il bambino e il
beneficio per la madre saranno presi in considerazione dal medico.
Guida di veicoli e utilizzo di macchinari
I capogiri sono un effetto indesiderato molto comune. Se li manifesta, non guidi veicoli e non utilizzi
macchinari.
Tysabri contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio per dose da 300 mg, ossia è essenzialmente
privo di sodio.
3. Come viene somministrato Tysabri
Le iniezioni di Tysabri le saranno prescritte da un medico specializzato nel trattamento della SM. Il
medico può prescriverle il passaggio diretto da un altro medicinale a Tysabri, se non vi sono segni di
problemi causati dal trattamento precedente. Le iniezioni di Tysabri saranno somministrate da un
operatore sanitario.
- Il medico ordinerà un esame del sangueper gli anticorpi al virus JC e altri possibili problemi.
- Il medico la sottoporrà a una RMche sarà ripetuta durante il trattamento.
- Per passare da alcuni medicinali per la SM, il medico può consigliarle di attendere un certo periodo per assicurare che la maggior parte del medicinale precedente sia stata eliminata dall’organismo.
- Se le sue condizioni lo consentono, il medico può discutere con lei la possibilità di ricevere iniezioni fuori da un ambiente ospedaliero (ad esempio, a casa).
- Per gli adulti, la dose raccomandata è di 300 mg, da somministrare una volta ogni 4 settimane.
- Ogni dose viene somministrata sotto forma di due iniezionisotto la pelle, nella coscia, nella pancia o nella parte posteriore del braccio. Questo richiede fino a 30 minuti.
- Le informazioni per i medici ed il personale sanitario sulla modalità di preparazione e di
Se interrompe il trattamento con Tysabri
L’assunzione regolare di questo medicinale è importante, soprattutto nei primi mesi di trattamento. È
importante che prosegua il trattamento fino a quando lei e il medico riteniate che questo le giovi. I
pazienti che hanno ricevuto una o due dosi di Tysabri e hanno successivamente interrotto il
trattamento per tre mesi o più hanno dimostrato una maggior probabilità di sviluppare una reazione
allergica se il trattamento viene ripreso.
Controllo delle reazioni allergiche
Alcuni pazienti hanno manifestato una reazione allergica verso questo medicinale. Il medico potrà
controllare eventuali reazioni allergiche che si possono manifestare durante l'infusione e nell’ora
successiva. Vedere anche il paragrafo 4, Possibili effetti indesiderati.
Se dimentica di prendere Tysabri
Se salta la dose abituale di Tysabri, si metta d'accordo con il medico per riceverla il più presto
possibile. Successivamente dovrà continuare a ricevere la dose di Tysabri ogni 4 settimane.
Tysabri funzionerà sempre?
In qualche paziente trattato con Tysabri, con il passare del tempo le difese naturali dell'organismo
possono impedire che il medicinale agisca correttamente, poiché il corpo sviluppa anticorpi per
farmaco. Il medico potrà stabilire se questo medicinale non agisce come dovrebbe mediante esami del
sangue e, se necessario, sospenderà il trattamento.
Per ulteriori informazioni sull’uso di Tysabri, si rivolga al medico. Usi questo medicinale seguendo
sempre esattamente quanto riportato in questo foglio o le istruzioni del medico. Se ha dubbi consulti il
medico.
Il termine sottocutaneo viene abbreviato in SC sull’etichetta della siringa.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Informi immediatamente il medico o l’infermiere se nota quanto segue
Segni di un’infezione cerebrale grave:
- cambiamenti nella personalità e nel comportamento quali confusione, delirium (stato confusionale) o perdita di coscienza
- crisi epilettiche (convulsioni)
- mal di testa
- nausea/vomito
- rigidità del collo
- estrema sensibilità alla luce intensa
- febbre
- eruzione cutanea (in qualsiasi parte del corpo).
Tali sintomi possono essere causati da un’infezione del cervello ( encefalite oppure PML) o del suo
strato di rivestimento ( meningite).
Segni di altre infezioni serie:
- febbre inspiegabile
- grave diarrea
- respiro corto
- capogiri prolungati
- mal di testa
- perdita di peso
- apatia
- compromissione della vista
- dolore o arrossamento di uno o di entrambi gli occhi
Segni di una reazione allergica
- eruzione cutanea ( orticaria)
- gonfiore al viso, alle labbra o della lingua
- difficoltà respiratoria
- dolore o malessere al torace
- aumento o diminuzione della pressione sanguigna (che sarà notata dal medico o dall’infermiere se la pressione sanguigna è tenuta sotto controllo).
Questi sono più probabili durante o subito dopo l’iniezione
Segni di un possibile problema al fegato:
- ingiallimento della pelle o del bianco degli occhi
- urine di colore scuro insolito
- esami di funzionalità epatica anomali
Parli immediatamente con un medico o un infermierese manifesta uno degli effetti indesiderati
sopra elencati o se pensa di avere un'infezione. Mostri la sua scheda di allerta per il paziente e questo
neurologo.
Altri effetti indesiderati
Molto comuni(possono interessare più di 1 persona su 10):
- infezione delle vie urinarie
- mal di gola e ipersecrezione o congestione nasale
- mal di testa
- capogiri
- sensazione di vomito imminente ( nausea)
- dolori alle articolazioni
- stanchezza
Comuni(possono interessare fino a 1 persona su 10):
- anemia (diminuzione dei globuli rossi che può rendere la pelle pallida e farla sentire senza fiato o senza energia)
- allergia ( ipersensibilità)
- brividi di freddo
- orticaria
- sensazione di malessere (vomito)
- febbre
- respirazione difficoltosa (dispnea)
- rossore del viso e del corpo (rossore)
- infezione erpetica
- fastidio nel posto in cui ha fatto l'iniezione. Potrebbe manifestare dolore, lividura, arrossamento, Sensazione di prurito o gonfiore
Non comuni(possono interessare fino a 1 persona su 100):
- allergia grave ( reazione anafilattica)
- leucoencefalopatia multifocale progressiva (PML)
- disturbo infiammatorio dopo l’interruzione del medicinale
- gonfiore della faccia
- un aumento del numero di globuli bianchi ( eosinofilia)
- Riduzione delle piastrine nel sangue
- Comparsa di lividi con facilità (porpora)
Rari(possono interessare fino a 1 persona su 1 000):
- infezione erpetica nell'occhio
- grave anemia (diminuzione dei globuli rossi che può rendere la pelle pallida e farla sentire senza fiato o privo di energia).
- grave gonfiore sotto la pelle
- alti livelli di bilirubina nel sangue ( iperbilirubinemia) che possono causare sintomi quali ingiallimento degli occhi o della pelle, febbre e stanchezza
Non noti(la frequenza non può essere definita sulla base dei dati disponibili)
- infezioni insolite al cervello e agli occhi
- danni al fegato
Si rivolga al medico al più presto possibilese pensa di avere un'infezione.
Troverà queste informazioni anche sulla scheda di allerta per il paziente che le ha dato il medico.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Tysabri
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull'etichetta e sulla scatola. La data
di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero.
Non congelare.
Le siringhe possono essere conservate nella loro confezione originale per un massimo di 24 ore a
temperatura ambiente (fino a 25 °C). Le siringhe non devono essere rimesse in frigorifero.
Tenere le siringhe nell'imballaggio esterno per proteggere il medicinale dalla luce.
Non usi questo medicinale se nota particelle nel liquido e/o se il liquido nella siringa presenta
un'alterazione nel colore.
6. Contenuto della confezione e altre informazioni
Cosa contiene Tysabri
Il principio attivo è natalizumab.
Ogni siringa preriempita da 1 mL contiene 150 mg di natalizumab.
Gli altri componenti sono:
sodio fosfato, monobasico, monoidrato,
sodio fosfato, dibasico, eptaidrato,
sodio cloruro (vedere paragrafo 2 ‘Tysabri contiene sodio’),
polisorbato 80 (E 433)
acqua per preparazioni iniettabili
Descrizione dell’aspetto di Tysabri e contenuto della confezione
Tysabri è un liquido daincolore a leggermente giallo, da leggermente opalescente a opalescente.
Ogni scatola contiene due siringhe.
Tysabri è disponibile in confezioni contenenti 2 siringhe preriempite
Titolare dell’autorizzazione all’immissione in commercio e produttore
Biogen Netherlands B.V.
Prins Mauritslaan 13
1171 LP Badhoevedorp
Paesi Bassi
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Biogen Belgium N.V./S.A.
Tél/Tel: +32 2 219 12 18
Lietuva
Biogen Lithuania UAB
Tel: +370 5 259 6176
България
ТП ЕВОФАРМА
Teл.: +359 2 962 12 00
Luxembourg/Luxemburg
Biogen Belgium N.V./S.A.
Tél/Tel: +352 2 219 12 18
Česká republika
Biogen (Czech Republic) s.r.o.
Tel: +420 255 706 200
Magyarország
Biogen Hungary Kft.
Tel.: +36 (1) 899 9883
Danmark
Biogen (Denmark) A/S
Tlf.: +45 77 41 57 57
Malta
Pharma MT limited
Tel: +356 213 37008/9
Nederland
Biogen Netherlands B.V.
Tel: +31 20 542 2000
Deutschland
Biogen GmbH
Tel: +49 (0) 89 99 6170
Eesti
Biogen Estonia OÜ
Tel: +372 618 9551
Norge
Biogen Norway AS
Tlf: +47 23 40 01 00
Ελλάδα
Genesis Pharma SA
Τηλ: +30 210 8771500
Österreich
Biogen Austria GmbH
Tel: +43 1 484 46 13
España
Biogen Spain SL
Tel: +34 91 310 7110
Polska
Biogen Poland Sp. z o.o.
Tel.: +48 22 351 51 00
France
Biogen France SAS
Tél: +33 (0)1 41 37 95 95
Portugal
Biogen Portugal Sociedade Farmacêutica
Unipessoal, Lda
Tel: +351 21 318 8450
România
Johnson & Johnson Romania S.R.L.
Tel: +40 21 207 18 00
Hrvatska
Biogen Pharma d.o.o.
Tel: +358 (0) 1 775 73 22
Ireland
Biogen Idec (Ireland) Ltd.
Tel: +353 (0)1 463 7799
Slovenija
Biogen Pharma d.o.o.
Tel: +386 1 511 02 90
Ísland
Icepharma hf
Sími: +354 540 8000
Slovenská republika
Biogen Slovakia s.r.o.
Tel: +421 2 323 340 08
Italia
Biogen Italia s.r.l.
Tel: +39 02 584 9901
Suomi/Finland
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Κύπρος
Genesis Pharma (Cyprus) Ltd
Τηλ: +357 22 76 57 15
Sverige
Biogen Sweden AB
Tel: +46 8 594 113 60
Latvija
Biogen Latvia SIA
Tel: +371 68 688 158
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, https://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari
Prima di somministrare l’iniezione sottocutanea di Tysabri al di fuori del contesto clinico ad esempio,
a casa, l’operatore sanitario deve compilare la checklist per la somministrazione al di fuori
dell’ambiente ospedaliero per ciascun paziente, prima di ogni somministrazione, per assicurare che
l’iniezione possa essere effettuata.
La dose raccomandata di 300 mg deve essere somministrata utilizzando due siringhe preriempite da
150 mg, vedere il paragrafo 3 di seguito.
Istruzioni per la somministrazione
La siringa preriempita è dotata di un sistema di protezione dell'ago che si attiva automaticamente
quando lo stantuffo è completamente premuto. Quando si lascia andare lo stantuffo, il copri-ago
coprirà l'ago esposto.
C A E C D
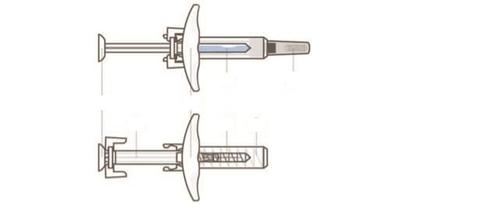
Prima della
somministrazione
C D
A B
- A. Stantuffo
- B. Flangia per le dita
- C. Siringa preriempita (vetro)
- D. Protezione dell’ago
- E. Ago
- F. Copri-ago C E F Dopo la somministrazione
- 1. Rimuovere la confezione della dose dal frigorifero e lasciare che raggiunga la temperatura ambiente (fino a 25 °C) prima di somministrare le iniezioni. Il tempo raccomandato per il raggiungimento della temperatura ambiente è di 30 minuti.
La data e l'ora di rimozione della confezione della dose dal frigorifero devono essere registrate
sulla scatola.
○ Non usare fonti di calore esternecome ad esempio l’acqua calda per riscaldare le siringhe
preriempite.
o Non toccareo richiudere l’ago in nessun passaggio. Questo per evitare una lesione derivante da
puntura accidentale da ago.
- 2. Estrarre entrambe le siringhe del prodottodal vassoio. Controllare che il medicinale in ciascuna siringa preriempita sia una soluzione da incolore a leggermente gialla e leggermente opalescente che è essenzialmente priva di particelle visibili. Potrà vedere bolle d’aria attraverso il vetro. Questo è normale e non influisce sulla dose.
- Controllare entrambele siringhe preriempite. Nonusarle se: o sono oltre la data di scadenza indicata sull'etichetta della siringa (EXP). oppureo sono state conservate a temperatura ambiente (fino a 25 °C) per più di 24 ore. o il colore e la limpidezza del liquido non sono coerenti con quanto descritto sopra o se il liquido contiene particelle sospese. o ci sono segni di danni (crepe, scheggiature, ecc.).
- Se nota uno di questi elementi, contatti immediatamentela farmacia.
- 3. Una dose completa equivale a due siringhe somministrate consecutivamente ed entro 30 minuti l'una dall'altra.
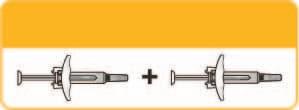
Utilizzare due siringhe da 150 mg
Dose completa = 300 mg.
- 4. Utilizzare una tecnica asettica (pulita e priva di germi) e una superficie di lavoro piana durante la procedura di iniezione.
- 5. Scegliere il primo punto di iniezione sottocutanea nella coscia, nell'addome o nella parte posteriore del braccio.
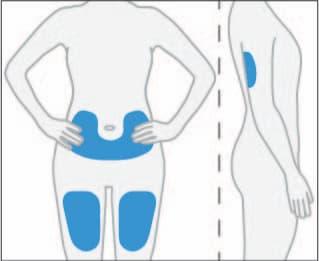
- Noniniettare in un'area del corpo in cui la pelle è irritata, arrossata, contusiva, infetta o sfregiata in alcun modo.
- 6. Somministrare la prima iniezione.
- Scegliere un sito di iniezione e pulire la pelle con una salviettina alcolica. o Lasciare asciugare il sito di iniezione da solo prima di iniettare. o Nontoccare o soffiare di nuovo su questa zona prima di effettuare l'iniezione. o Rimuovere la protezione dell’ago. o Pizzicare delicatamente la pelle intorno al sito di iniezione pulito usando il pollice e l'indice per creare una leggera protuberanza. o Tenere la siringa preriempita ad un angolo di 45°-90° rispetto al sito di iniezione. Inserire rapidamente l'ago direttamente nella piega cutanea fino a quando l'ago non è completamente sotto la pelle.
- 7. Spingere lentamente lo stantuffo con un unico movimento fluido fino a quando la siringa è completamente vuota. Non tirare indietro lo stantuffo.
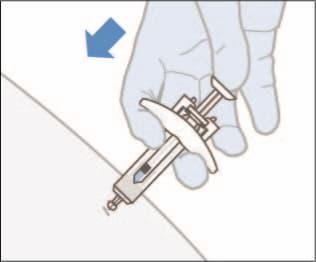
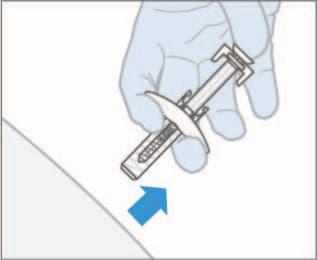
- 8. Prima di rimuovere la siringa, verificare che la siringa sia vuota. Se si vede del sangue, premere con un batuffolo di cotone o una garza sul sito di iniezione. Non strofinare la pelle dopo l'iniezione. Quando si rimuove la siringa dal sito di iniezione, lasciare andare lo stantuffo MENTRE si estrae l'ago. Quando si lascia andare lo stantuffo, il copri-ago coprirà l'ago esposto.
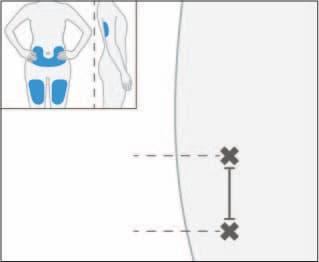
- 9. Somministrare le iniezioni una dopo l'altra senza ritardi significativi. Nel caso in cui la seconda iniezione non possa essere somministrata immediatamente dopo la prima, la seconda iniezione deve essere somministrata non oltre 30 minuti dopo la prima. La seconda iniezione deve trovarsi ad almeno 3 cm di distanza dal punto in cui è stata effettuata la prima iniezione.
I pazienti devono essere tenuti sotto osservazione durante le iniezioni sottocutanee e per 1 ora
dopoper verificare eventuali segni e sintomi delle reazioni all’iniezione, compresa l'ipersensibilità.
Dopo le prime 6 dosi di Tysabri, indipendentemente dalla via di somministrazione, i pazienti devono
essere tenuti sotto osservazione dopo l'iniezione sottocutanea secondo il giudizio clinico.
Interrompere tempestivamente l'iniezione alla prima osservazione di qualsiasi segno o sintomo
coerente con una reazione allergica [vedere RCP paragrafo 4.4].
1° iniezione


Almeno
3 cm

2° iniezione
- 10. Smaltire la siringa usata in conformità con i requisiti locali.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a TYSABRIForma farmaceutica: Concentrato per soluzione per infusione, 300 mgPrincipio attivo: natalizumabProduttore: SANDOZ GMBHPrescrizione richiestaForma farmaceutica: Polvere per soluzione per infusione endovenosa, 120 MGPrincipio attivo: belimumabProduttore: GLAXOSMITHKLINE (IRELAND) LIMITEDPrescrizione richiestaForma farmaceutica: Concentrato per soluzione per infusione, 150 mgPrincipio attivo: ublituximabProduttore: NEURAXPHARM PHARMACEUTICALS, S.LPrescrizione richiesta
Medici online per TYSABRI
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di TYSABRI — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





