
XIMLUCI

Come usare XIMLUCI
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Ximluci 10 mg/mL soluzione iniettabile
ranibizumab
ADULTI
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos'è Ximluci e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Ximluci
- 3. Come le verrà somministrato Ximluci
- 4. Possibili effetti indesiderati
- 5. Come conservare Ximluci
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Ximluci e a cosa serve
Cos’è Ximluci
Ximluci è una soluzione che deve essere iniettata nell’occhio. Ximluci fa parte di un gruppo di
medicinali chiamati agenti antineovascolarizzazione. Contiene un principio attivo chiamato
ranibizumab.
A che cosa serve Ximluci
Ximluci è usato negli adulti per trattare diverse patologie dell’occhio che causano una diminuzione della
visione.
Queste patologie derivano da un danno alla retina (strato sensibile alla luce nella parte posteriore
dell’occhio) causato da:
- Crescita di vasi sanguigni anormali che lasciano fuoriuscire liquidi. Questo si osserva in patologie come la degenerazione maculare correlata all’età (AMD) e la retinopatia diabetica proliferante (PDR, una patologia causata dal diabete) . Può essere associato con neovascolarizzazione coroideale (CNV) dovuta a miopia patologica (PM), strie angioidi, corioretinopatia sierosa centrale o CNV infiammatoria.
- Edema maculare (gonfiore al centro della retina). Questo gonfiore può essere causato dal diabete (una patologia chiamata edema maculare diabetico (DME)) o dal blocco delle vene retiniche (una patologia chiamata occlusione venosa retinica (RVO)).
Come funziona Ximluci
Ximluci riconosce e lega specificatamente una proteina chiamata fattore di crescita vascolare endoteliale
umano A (VEGF-A) presente nell’occhio. Quando in eccesso, VEGF-A causa una crescita anormale dei
vasi sanguigni e gonfiore nell’occhio che possono portare ad una diminuzione della visione in patologie
come AMD, DME, PDR, RVO, PM e CNV. Legando il VEGF-A, il Ximluci può bloccare la sua azione
e prevenire la crescita anormale e il gonfiore.
In queste patologie, Ximluci può aiutare a stabilizzare e in molti casi a migliorare la visione.
2. Cosa deve sapere prima che le venga somministrato Ximluci
Non deve ricevere Ximluci
- se è allergico al ranibizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione in un occhio o nella zona circostante.
- se ha dolore o rossore (grave infiammazione intraoculare) in un occhio.
Avvertenze e precauzioni
Si rivolga al medico prima di ricevere Ximluci.
- Ximluci viene somministrato mediante un’iniezione nell’occhio. Occasionalmente, dopo il trattamento con Ximluci possono verificarsi un’infezione nella parte interna dell’occhio, dolore o arrossamento (infiammazione) distacco o lacerazione di uno degli strati nella parte posteriore dell’occhio (distacco o lacerazione retinica e distacco o lacerazione dell’epitelio pigmentato retinico), o offuscamento del cristallino (cataratta). E’ importante identificare e trattare un’infezione o distacco retinico appena possibile. Informi immediatamente il medico se si verificano segni quali dolore all’occhio o aumento del fastidio, peggioramento dell’arrossamento dell’occhio, offuscamento o calo della visione, un aumento del numero di corpuscoli nella visione o aumento della sensibilità alla luce.
- In alcuni pazienti, subito dopo l’iniezione può aumentare la pressione dell’occhio per un breve periodo. Questo evento è qualcosa di cui può non accorgersi, pertanto il medico deve eseguire un controllo dopo ogni iniezione.
- Informi il medico se ha avuto precedenti problemi o trattamenti agli occhi, o se ha avuto un ictus o segni di attacchi ischemici transitori (debolezza o paralisi degli arti o della faccia, difficoltà nel parlare o capire). Queste informazioni saranno prese in considerazione per valutare se Ximluci è il trattamento appropriato per lei.
Vedere paragrafo 4 ("Possibili effetti indesiderati") per informazioni più dettagliate sugli effetti
indesiderati che possono verificarsi durante la terapia con Ximluci.
Bambini e adolescenti (sotto i 18 anni di età)
Non è stato stabilito l’uso di Ximluci nei bambini e adolescenti e pertanto non è raccomandato.
Altri medicinali e Ximluci
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
- Le donne in età fertile devono usare un metodo contraccettivo efficace durante il trattamento e per almeno i tre mesi successivi dopo l’ultima iniezione di Ximluci.
- Non vi sono esperienze sull’uso di Ximluci in donne in gravidanza. Ximluci non deve essere usato durante la gravidanza a meno che il potenziale beneficio non superi il potenziale rischio per il feto. Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza ne parli con il medico prima di prendere Ximluci.
- Non è raccomandato l’uso di Ximluci durante l’allattamento in quanto non è noto se Ximluci venga escreto nel latte umano. Chieda consiglio al medico o al farmacista prima del trattamento con Ximluci.
Guida di veicoli e utilizzo di macchinari
Dopo il trattamento con Ximluci può manifestarsi un temporaneo offuscamento della visione. Se ciò
accade, non guidi e non usi macchinari fino a quando questa condizione non si sia risolta.
3. Come le verrà somministrato Ximluci
Ximluci è somministrato dal medico oculista come una singola iniezione nell’occhio sotto anestesia
locale. La dose usuale di un’iniezione è di 0,05 mL (che contengono 0,5 mg di principio attivo).
L’intervallo tra due dosi iniettate nello stesso occhio deve essere almeno di quattro settimane. Tutte le
iniezioni le saranno somministrate dal medico oculista.
Prima dell’iniezione, il medico pulirà accuratamente l’occhio per prevenire un’infezione. Il medico le
darà anche un anestetico locale per ridurre o prevenire qualsiasi dolore possa insorgere con l’iniezione.
Il trattamento è iniziato con una iniezione di Ximluci al mese. Il medico monitorerà le condizioni
dell’occhio e, sulla base della risposta al trattamento, deciderà se e quando è necessario un ulteriore
trattamento.
preparare e somministrare Ximluci agli adulti”.
Anziani (65 anni di età ed oltre)
Ximluci può essere usato per pazienti di 65 anni di età ed oltre senza aggiustamenti della dose.
Prima di interrompere il trattamento con Ximluci
Se sta considerando di interrompere il trattamento con Ximluci, si rechi alla successiva visita e ne
discuta con il medico. Il medico la consiglierà e deciderà per quanto tempo lei dovrà essere trattato con
Ximluci.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Gli effetti indesiderati associati alla somministrazione di Ximluci sono dovuti sia al medicinale stesso
sia alla procedura d’iniezione e per la maggior parte interessano l’occhio.
Gravi effetti indesiderati:
Comuni(possono interessare fino a 1 persona su 10):
- distacco o lacerazione nella parte posteriore dell’occhio (distacco o lacerazione retinica), che si manifesta con lampi di luce con corpi mobili fino ad arrivare ad una temporanea riduzione della vista, o ad opacità del cristallino (cataratta)
Non comuni(possono interessare fino a 1 persona su 100):
- cecità
- infezione del globo oculare (endoftalmite) con infiammazione all’interno dell’occhio
I sintomi che può provare sono
- dolore all’occhio o aumentato fastidio dell’occhio
- peggioramento dell’arrossamento oculare
- offuscamento o calo della visione
- aumento del numero di corpuscoli nella visione
- aumento della sensibilità alla luce
Si rivolga immediatamente al medico se uno di questi effetti indesiderati si manifesta.
Altri effetti indesiderati:
Molto comuni(possono interessare più di 1 persona su 10)
Gli effetti indesiderati visivi comprendono:
- infiammazione dell’occhio
- emorragia nella parte posteriore dell’occhio (emorragia della retina)
- disturbi visivi
- dolore oculare
- corpuscoli o macchie nella visione (corpi mobili)
- arrossamento oculare localizzato
- irritazione oculare
- sensazione di corpo estraneo nell’occhio
- aumentata produzione di lacrime
- infiammazione o infezione del margine palpebrale
- secchezza oculare
- arrossamento o prurito dell’occhio
- aumento della pressione all’interno dell’occhio
Gli effetti indesiderati non visivi comprendono:
- mal di gola, congestione nasale, naso che cola
- cefalea
- dolore alle articolazioni
Comuni(possono interessare fino a 1 persona su 10):
Gli effetti indesiderati visivi comprendono:
- diminuzione dell’acuità visiva
- gonfiore di una parte dell’occhio (uvea, cornea)
- infiammazione della cornea (parte anteriore dell’occhio)
- piccoli segni sulla superficie dell’occhio
- visione offuscata
- sanguinamento nel sito di iniezione
- sanguinamento nell’occhio
- secrezione dall’occhio con prurito, arrossamento e gonfiore (congiuntivite)
- sensibilità alla luce
- fastidio all’occhio
- gonfiore della palpebra
- dolore palpebrale
Gli effetti indesiderati non visivi comprendono:
- infezione del tratto urinario
- diminuzione dei globuli rossi (con sintomi come stanchezza, affanno, capogiri, pallore)
- ansia
- tosse
- nausea
- reazioni allergiche come rash, orticaria, prurito e arrossamento della cute
Non comuni(possono interessare fino a 1 persona su 100):
Gli effetti indesiderati visivi comprendono:
- infiammazione ed emorragia nella parte anteriore dell’occhio
- raccolta di pus nell’occhio
- modificazioni della parte centrale della superficie oculare
- dolore o irritazione nel sito di iniezione
- sensazione anormale nell’occhio
- irritazione palpebrale
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Ximluci
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta del flaconcino dopo scad. e dopo EXP. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Conservare in frigorifero (2 ° C - 8 ° C). Non congelare.
- Prima dell’uso, il flaconcino chiuso può essere conservato a temperatura ambiente (25°C) per un massimo di 48 ore.
- Tenere il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce.
- Non usi una confezione che sia danneggiata.
6. Contenuto della confezione e altre informazioni
Cosa contiene Ximluci
- Il principio attivo è ranibizumab. Ogni mL contiene 10 mg di ranibizumab. Ogni flaconcino contiene 2,3 mg di ranibizumab in 0,23 mL di soluzione. Questo fornisce una quantità utile alla somministrazione di una dose singola di 0,05 mL contenente 0,5 mg di ranibizumab.
- Gli altri componenti sono trealosio diidrato; istidina cloridrato, monoidrato; istidina; polisorbato 20; acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Ximluci e contenuto della confezione
Ximluci è una soluzione iniettabile da limpida a leggermente opalescente, da incolore a leggermente
brunastra in un flaconcino (0,23 mL).
Sono disponibili 2 diverse confezioni:
Flaconcino da solo
Confezione contenente un flaconcino di vetro di ranibizumab con tappo di gomma bromobutilica. Il
flaconcino è monouso.
Flaconcino + ago filtro
Confezione contenente solo un flaconcino di vetro di ranibizumab con tappo di gomma bromobutilica e
un ago-filtro sterile smussato 5 µm (18G x 1½″, 1,2 mm x 40 mm) per il prelievo del contenuto del
flaconcino. Tutti i componenti sono monouso.
Titolare dell’autorizzazione all’immissione in commercio eProduttore
STADA Arzneimittel AG
Stadastrasse 2-18
61118 Bad Vilbel
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentate locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
EG (Eurogenerics) NV
Tél/Tel: + 32 4797878
Lietuva
UAB „STADA Baltics“
Tel: + 370 52603926
България
STADA Bulgaria EOOD
Тел.: + 359 29624626
Luxembourg/Luxemburg
EG (Eurogenerics) NV
Tél/Tel: + 32 4797878
Česká republika
STADA PHARMA CZ s.r.o.
Tel: + 420 257888111
Magyarország
STADA Hungary Kft
Tel.: + 36 18009747
Danmark
STADA Nordic ApS
Tlf: + 45 44859999
Malta
Pharma MT Ltd
Tel: + 356 21337008
Deutschland
STADAPHARM GmbH
Tel: + 49 61016030
Nederland
Centrafarm B.V.
Tel: + 31 765081000
Eesti
UAB „STADA Baltics“
Tel: + 370 52603926
Norge
STADA Nordic ApS
Tlf: + 45 44859999
Ελλάδα
RAFARM A.E.B.E.
Τηλ: +30 2106776550
Österreich
STADA Arzneimittel GmbH
Tel: + 43 136785850
España
Laboratorio STADA, S.L.
Tel: + 34 934738889
Polska
STADA Poland Sp. z.o o.
Tel.: + 48 227377920
France
EG LABO - Laboratoires EuroGenerics
Tél: + 33 146948686
Portugal
Stada, Lda.
Tel: + 351 211209870
Hrvatska
STADA d.o.o.
Tel. + 385 13764111
România
STADA M&D SRL
Tel: + 40 213160640
Ireland
Clonmel Healthcare Ltd.
Tel: + 353 526177777
Slovenija
Stada d.o.o.
Tel: + 386 15896710
Ísland
STADA Arzneimittel AG
Sími: + 49 61016030
Slovenská republika
STADA PHARMA Slovakia, s.r.o.
Tel: + 421 252621933
Italia
EG SpA
Tel: + 39 028310371
Suomi/Finland
STADA Nordic ApS, Suomen sivuliike
Puh/Tel: + 358 207416888
Κύπρος
STADA Arzneimittel AG
Τηλ: +30 2106664667
Sverige
STADA Nordic ApS
Tel: + 45 44859999
Latvija
UAB „STADA Baltics“
Tel: + 370 52603926
United Kingdom (Northern Ireland)
STADA Arzneimittel AG
Tel: +49 61016030
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei
medicinali: http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
LE INFORMAZIONI SEGUENTI SONO DESTINATE ESCLUSIVAMENTE AGLI
OPERATORI SANITARI:
Si prega di far riferimento anche al paragrafo 3 “Come le verrà somministrato Ximluci”.
Come preparare e somministare Ximluci agli adulti
Flaconcini monouso, solo per uso intravitreo.
Ximluci deve essere somministrato da un oculista qualificato, esperto in iniezioni intravitreali.
Nell’AMD essudativa, nella CNV, nella PDR e nella diminuzione visiva dovuta a DME, o nell’edema
maculare secondario ad RVO, la dose raccomandata di Ximluci è di 0,5 mg in una singola iniezione
intravitreale. Questa corrisponde ad un volume iniettato di 0,05 mL. L’intervallo tra due dosi iniettate
nello stesso occhio deve essere almeno di quattro settimane.
Il trattamento è iniziato con una iniezione al mese fino a che è ottenuta la massima acuità visiva e/o non
ci sono segni di attività della patologia quali variazioni nell’acuità visiva e alterazioni di altri segni e
sintomi della patologia durante il trattamento continuativo. Nei pazienti con AMD essudativa, DME,
PDR e RVO, può essere necessario iniziare la terapia con tre o più iniezioni mensili consecutive.
Pertanto, gli intervalli di monitoraggio e di trattamento devono essere decisi dal medico e devono essere
basati sull’attività della patologia, come accertato mediante valutazione dell’acuità visiva e/o dei
parametri anatomici.
Se, secondo l’opinione del medico, l’acuità visiva e i parametri anatomici indicano che il paziente non
trae beneficio dal trattamento continuativo, Ximluci deve essere interrotto.
Il monitoraggio dell’attività della patologia può comprendere l'esame clinico, valutazioni funzionali o
tecniche di imaging (ad esempio tomografia a coerenza ottica o angiografia con fluoresceina).
Se i pazienti sono in trattamento secondo un regime “treat-and-extend”, al raggiungimento della
massima acuità visiva e/o in assenza di segni di attività della patologia, gli intervalli di trattamento
possono essere gradualmente estesi fino a che non si ripresentino i segni della patologia o si evidenzi un
peggioramento della funzione visiva. L'intervallo di trattamento deve essere gradualmente esteso di al
massimo due settimane in pazienti con AMD essudativa e può essere esteso fino ad un mese nei pazienti
con DME. Gli intervalli di trattamento possono anche essere gradualmente estesi anche nel trattamento
dell’RVO e della PDR, tuttavia non ci sono dati sufficienti per stabilire la durata di questi intervalli. Al
reinsorgere dell’attività di malattia, l'intervallo di trattamento deve essere ridotto di conseguenza.
Il trattamento della diminuzione visiva causata da CNV deve essere determinata individualmente per
ogni paziente sulla base dell’attività della malattia. Alcuni pazienti possono aver bisogno solo di una
iniezione durante i primi 12 mesi; altri possono avere bisogno di un trattamento più frequente, fino a una
iniezione mensile. Per CNV secondaria a miopia patologica (PM), molti pazienti possono aver bisogno
solo di una o due iniezioni durante il primo anno.
Ximluci e fotocoagulazione laser nel DME e nell’edema maculare secondario a BRVO
C’è una certa esperienza di Ximluci somministrato in concomitanza con la fotocoagulazione laser.
Quando impiegato nello stesso giorno, Ximluci deve essere somministrato almeno 30 minuti dopo la
fotocoagulazione laser. Ximluci può essere somministrato a pazienti che hanno ricevuto in precedenza
una fotocoagulazione laser.
Ximluci e terapia fotodinamica con verteporfina nella CNV secondaria a PM
Non ci sono esperienze sulla somministrazione di Ximluci in associazione a verteporfina.
Prima della somministrazione Ximluci deve essere controllato visivamente per evidenziare la presenza
di particelle e alterazioni cromatiche.
La procedura per l’iniezione deve essere effettuata in condizioni asettiche, che includono la disinfezione
chirurgica delle mani, guanti sterili, un telino sterile e un blefarostato sterile (o equivalente) e la
possibilità di eseguire una paracentesi sterile (se necessaria). Prima di effettuare la procedura
intravitreale si deve valutare attentamente l’anamnesi del paziente per quanto riguarda le reazioni di
ipersensibilità. Prima dell’iniezione deve essere somministrata un’anestesia adeguata ed un
antimicrobico topico ad ampio spettro per disinfettare la superficie perioculare, oculare e palpebrale,
come da pratica clinica.
Flaconcino da solo
Il flaconcino è monouso. Dopo l’iniezione il prodotto non utilizzato deve essere gettato. Ogni flaconcino
che mostra segni di danneggiamento o manomissione non deve essere usato. La sterilità non può essere
garantita se il sigillo della confezione non è intatto.
Per la preparazione e l’iniezione intravitreale sono necessari i dispositivi medici monouso sotto riportati:
- un ago filtro sterile da 5 µm (18G x 1½″, 1,2 mm x 40 mm)
- una siringa sterile da 1 mL (con un segno a 0,05 mL)
- un ago per iniezione (30G x ½″, 0,3 mm x 13 mm). Questi dispositivi non sono inclusi nella confezione di Ximluci.
Flaconcino + ago filtro
Tutti i componenti sono sterili e monouso. Ogni componente con confezione che mostra segni di
danneggiamento o manomissione non deve essere usato. La sterilità non può essere garantita se il sigillo
della confezione del componente non è intatto. Il riutilizzo può causare infezione o altra
malattia/lesione.
Per la preparazione e l’iniezione intravitreale sono necessari i seguenti dispositivi medici monouso:
- un ago filtro sterile da 5 µm (18G x 1½″, 1,2 mm x 40 mm, fornito)
- una siringa sterile da 1 mL (con un segno a 0,05 mL non inclusa all’interno della confezione di Ximluci)
- un ago per iniezione (30G x½″, 0,3 mm x 13 mm; non incluso all’interno della confezione di Ximluci)
Per preparare Ximluci per l’iniezione intravitreale nei pazienti adulti, si prega di seguire le seguenti
istruzioni:
- 1. Prima del prelievo, rimuovere il tappo del flaconcino e pulire il setto del flaconcino (ad esempio con un tampone di alcol al 70%).
- 2. Montare su di una siringa da 1 mL un ago filtro da 5 µm (18G x 1½″, 1,2 mm x 40 mm, 5 µm) in asepsi. Inserire l’ago filtro spuntato al centro del tappo fino a che non tocchi il fondo del flaconcino.
- 3. Prelevare tutto il liquido dal flaconcino tenendolo in posizione verticale, leggermente inclinato per facilitare il completo prelievo.
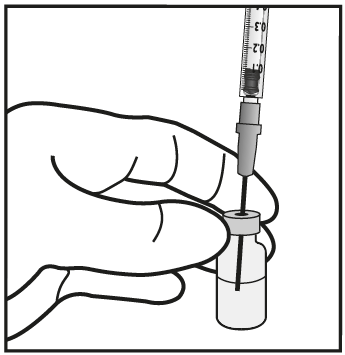
- 4. Assicurarsi che lo stantuffo della siringa sia tirato sufficientemente indietro quando si svuota il flaconcino in modo da svuotare completamente l’ago filtro.
- 5. Lasciare l’ago filtro spuntato nel flaconcino e staccare la siringa da questo. Eliminare l’ago filtro dopo aver prelevato il contenuto del flaconcino e non utilizzarlo per l’iniezione intravitreale.
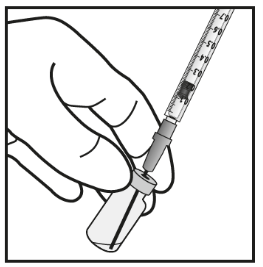
- 6. Montare saldamente ed in asepsi un ago per iniezione (30G x ½″, 0,3 mm x 13 mm) sulla siringa.
- 7. Rimuovere attentamente il cappuccio dall’ago per iniezione senza disconnettere l’ago per iniezione dalla siringa.
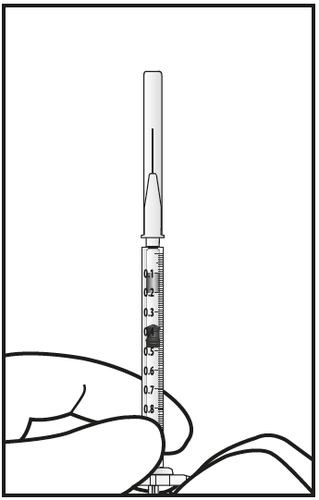
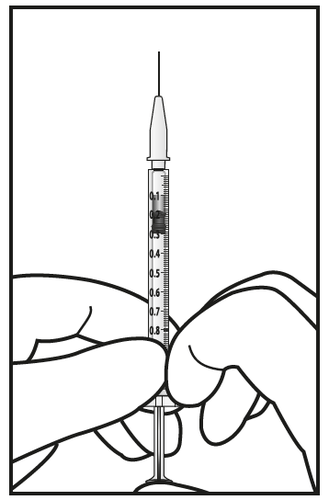
Nota: Tenere la base dell’ago per
iniezione mentre si rimuove il
cappuccio.
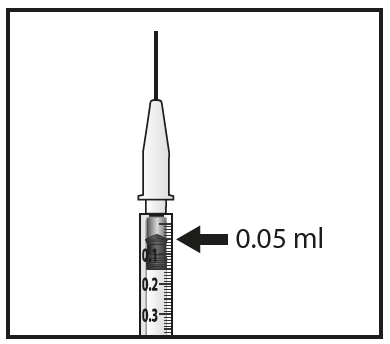
- 8. Espellere attentamente l’aria e la soluzione in eccesso dalla siringa e aggiustare la dose a 0,05 mL contrassegnati sulla siringa. La siringa è pronta per l’iniezione.
Nota :Non pulire l’ago per
iniezione. Non tirare indietro lo
stantuffo.
Inserire l’ago per iniezione 3,5-4,0 mm posteriormente al limbus, in camera vitreale, evitando il
meridiano orizzontale e dirigendo l’ago verso il centro del globo oculare. Iniettare il volume d’iniezione
di 0,05 mL; cambiare la sede sclerale per le iniezioni successive.
Dopo l’iniezione, non ricoprire l’ago o staccarlo dalla siringa. Smaltire la siringa usata insieme con
l’ago in un apposito contenitore o in conformità alla normativa locale vigente.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a XIMLUCIForma farmaceutica: Soluzione iniettabile, 10 mg/mlPrincipio attivo: ranibizumabProduttore: SAMSUNG BIOEPIS NL B.V.Prescrizione richiestaForma farmaceutica: Soluzione iniettabile, 0.5MG/0.05MLPrincipio attivo: ranibizumabProduttore: NOVARTIS EUROPHARM LIMITEDPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 10 mg/mlPrincipio attivo: ranibizumabProduttore: MIDAS PHARMA GMBHPrescrizione richiesta
Medici online per XIMLUCI
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di XIMLUCI — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














