
BRIUMVI

Come usare BRIUMVI
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
Briumvi 150 mg concentrato per soluzione per infusione
ublituximab
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché
contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Briumvi e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Briumvi
- 3. Come viene somministrato Briumvi
- 4. Possibili effetti indesiderati
- 5. Come conservare Briumvi
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Briumvi e a cosa serve
Cos’è Briumvi
Briumvi contiene il principio attivo ublituximab, un tipo di proteina chiamato anticorpo monoclonale.
Gli anticorpi agiscono legandosi a bersagli specifici nell’organismo.
A cosa serve Briumvi
Briumvi è usato per trattare pazienti adulti con forme recidivanti di sclerosi multipla (RMS), in cui il
paziente presenta riacutizzazioni (recidive) seguite da periodi con sintomi più lievi o assenti.
Cos’è la sclerosi multipla
La sclerosi multipla (SM) colpisce il sistema nervoso centrale, soprattutto i nervi nel cervello e il
midollo spinale. Nella SM, alcuni globuli bianchi del sangue chiamati cellule B, che fanno parte del
sistema immunitario (il sistema di difesa dell’organismo), non funzionano correttamente e attaccano lo
strato protettivo (la cosiddetta guaina mielinica) che circonda le cellule nervose, causando danni e
infiammazione. La distruzione della guaina mielinica impedisce ai nervi di funzionare in modo
corretto e causa i sintomi della SM. I sintomi della SM dipendono dalla parte del sistema nervoso
centrale interessata e possono comprendere problemi di equilibrio e nel camminare, debolezza
muscolare, intorpidimento, visione doppia, offuscamento della vista, scarsa coordinazione e problemi
alla vescica.
Nelle forme recidivanti di SM, il paziente ha attacchi ripetuti di sintomi (recidive), che possono
comparire improvvisamente, nel giro di poche ore, oppure lentamente, nel corso di diversi giorni. Tra

una recidiva e l’altra, i sintomi svaniscono o migliorano, ma i danni possono accumularsi e portare a
una disabilità permanente.
Come agisce Briumvi?
Briumvi agisce legandosi a un bersaglio presente sulla superficie delle cellule B, chiamato CD20. Le
cellule B sono un tipo di globuli bianchi che fanno parte del sistema immunitario. Nella sclerosi
multipla, il sistema immunitario attacca lo strato protettivo che circonda le cellule nervose. Le
cellule B sono coinvolte in questo processo. Briumvi colpisce ed elimina le cellule B e quindi riduce la
possibilità di avere una ricaduta, allevia i sintomi e rallenta la progressione della malattia.
2. Cosa deve sapere prima che le venga somministrato Briumvi
Non deve esserle somministrato Briumvi:
- se è allergicoa ublituximab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6),
- se soffre di un’infezione grave,
- se le è stato comunicato che ha gravi problemi al sistema immunitario, oppure
- se ha un tumore.
Se non è sicuro, si rivolga al medico prima che le venga somministrato Briumvi.
Avvertenze e precauzioni
Si rivolga al medico prima che le venga somministrato Briumvise una qualsiasi delle condizioni
seguenti la riguarda. Il medico può decidere di posticipare il trattamento con Briumvi, oppure stabilire
che lei non può ricevere Briumvi se:
- ha un’ infezione. Il medico aspetterà che l’infezione si sia risolta prima di somministrarle Briumvi;
- ha avuto in passato l’ epatite Boppure è portatore del virus dell’epatite B. Questo perché i medicinali come Briumvi possono causare la riattivazione del virus dell’epatite B. Prima del trattamento con Briumvi, il medico controllerà che non sia a rischio di sviluppare un’infezione da epatite B. I pazienti che hanno avuto l’epatite B o sono portatori del virus dell’epatite B saranno sottoposti a esami del sangue e saranno monitorati da parte del medico per rilevare eventuali segni di infezione da epatite B;
- se le è stato recentemente somministrato qualsiasi vaccino o potrebbe esserle somministrato un vaccino nell’immediato futuro;
- ha un tumoreo lo ha avuto in passato. Il medico può decidere di posticipare il trattamento.
Reazioni correlate all’infusione
- Le reazioni correlate all’infusione sono l’effetto indesiderato più comune del trattamento con Briumvi. Si tratta di reazioni allergiche che si sviluppano mentre il medicinale viene somministrato, oppure poco dopo. Queste reazioni possono essere gravi.
- I sintomi di una reazione correlata all’infusione possono comprendere:
- prurito della pelle
- orticaria
- arrossamento del viso o della pelle
- irritazione della gola
- difficoltà a respirare
- gonfiore della lingua o della gola
- respiro sibilante
- brividi
- febbre
- mal di testa
- capogiro
- sensazione di svenimento
- nausea
- dolore addominale (mal di pancia)
- battito del cuore accelerato.
- Informi immediatamente il medico o l’infermiere se ha o sospetta di avere una reazionecorrelata all’infusione.Le reazioni correlate all’infusione possono verificarsi durante l’infusione o fino a 24 ore dopo l’infusione.
- Per ridurre il rischio di reazioni correlate all’infusione, il medico le somministrerà altri medicinali prima di ciascuna infusione di Briumvi (vedere paragrafo 3) e la terrà sotto stretta osservazione durante l’infusione.
- In caso di reazione correlata all’infusione, potrebbe essere necessario interrompere l’infusione o rallentare la velocità di infusione.
Infezioni
- Si rivolga al medico prima che le venga somministrato Briumvi se ha o sospetta di avere un’infezione. Il medico aspetterà che l’infezione si sia risolta prima di somministrarle Briumvi.
- Se le viene somministrato Briumvi, può sviluppare più facilmente infezioni, perché le cellule immunitarie bersaglio dell’azione di Briumvi aiutano anche a combattere le infezioni.
- Informi immediatamente il medico o l’infermiere se sviluppa un’infezione o se osserva unoqualsiasi di questi segni di infezione, durante o dopo il trattamento con Briumvi:
- febbre o brividi
- tosse che non passa
- herpes (ad es. herpes labiale, fuoco di Sant’Antonio o herpes genitale)
- Informi immediatamente il medico o l’infermiere se ritiene che la SM stia peggiorando o senota la comparsa di nuovi sintomi,in quanto esiste un’infezione del cervello molto rara e potenzialmente letale, chiamata “leucoencefalopatia multifocale progressiva” (PML), che può causare sintomi simili a quelli della SM. La PML può verificarsi in pazienti che assumono medicinali come Briumvi e altri medicinali usati per trattare la SM.
- Informi il suo partner o chi si occupa di leidel suo trattamento con Briumvi, perché potrebbe notare sintomi della PML di cui lei non si accorge, come vuoti di memoria, difficoltà nel pensare, difficoltà a camminare, perdita della vista o cambiamenti nel modo di parlare, che il medico potrebbe voler approfondire.
Vaccinazioni
- Informi il medico se le è stato recentemente somministrato qualsiasi vaccino o potrebbe esserle somministrato un vaccino nell’immediato futuro.
- Il medico controllerà se ha bisogno di vaccinazioni prima di iniziare il trattamento con Briumvi. Eventuali vaccinazioni con vaccino vivo o vivo attenuato devono essere somministrate almeno 4 settimane prima di iniziare il trattamento con Briumvi. Durante il trattamento con Briumvi non le devono essere somministrati vaccini vivi o vivi attenuati fino a quando il medico non le avrà comunicato che il suo sistema immunitario non è più indebolito.
- Eventuali vaccinazioni con vaccini inattivati devono essere somministrate almeno 2 settimane prima di iniziare il trattamento con Briumvi, quando possibile. Se desidera sottoporsi a vaccinazione con vaccini inattivati durante il trattamento con Briumvi, si rivolga al medico.
Bambini e adolescenti
Briumvi non è destinato all’uso nei bambini e negli adolescenti di età inferiore a 18 anni, poiché non è
stato ancora studiato in questa fascia di età.
Altri medicinali e Briumvi
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale. In particolare, informi il medico:
- se sta assumendo, ha recentemente assunto o potrebbe assumere medicinali che influiscono sul sistema immunitario, come chemioterapici, immunosoppressori (ad eccezione dei corticosteroidi) o altri medicinali usati per trattare la SM, poiché potrebbero avere un effetto additivo sul sistema immunitario;
- se prevede di sottoporsi a vaccinazioni (vedere sopra il paragrafo “Avvertenze e precauzioni”).
Se una di queste condizioni la riguarda (o se non è sicuro), si rivolga al medico prima che le venga
somministrato Briumvi.
Gravidanza e allattamento
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza informi il medico prima che le venga somministrato Briumvi. Questo perché Briumvi può attraversare la placenta e avere effetti sul bambino.
- Se è in corso una gravidanza, non usi Briumvi a meno che non ne abbia parlato con il medico. Il medico valuterà il rapporto tra il beneficio del trattamento con Briumvi per lei e il rischio per il bambino.
- Se ha avuto un figlio dopo avere ricevuto Briumvi durante la gravidanza, è importante che ne informi il pediatra, di modo che possa consigliarle quando suo figlio potrà essere vaccinato.
- Non è noto se Briumvi passi nel latte materno. Si rivolga al medico per conoscere il modo migliore di alimentare il bambino se usa Briumvi.
Contraccezione nelle donne
Se è in grado di avere figli (concepire), dovrà usare misure contraccettive:
- durante il trattamento con Briumvi e
- per almeno 4 mesi dopo l’ultima infusione di Briumvi.
Guida di veicoli e utilizzo di macchinari
È improbabile che Briumvi influenzi la capacità di guidare veicoli e di usare macchinari.
Briumvi contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè è essenzialmente ‘senza
sodio’.
3. Come viene somministrato Briumvi
Briumvi le sarà somministrato da un medico o da un infermiere esperto nell’uso di questo trattamento,
che la terrà sotto stretta osservazione durante la somministrazione del medicinale nel caso in cui
dovesse manifestare eventuali effetti indesiderati. Briumvi le sarà sempre somministrato tramite flebo
(infusione endovenosa).
Medicinali somministrati prima del trattamento con Briumvi
Prima di ricevere Briumvi, le saranno somministrati altri medicinali per prevenire o ridurre i possibili
effetti indesiderati, come le reazioni correlate all’infusione (per informazioni sulle reazioni correlate
all’infusione, vedere paragrafi 2 e 4).
Prima di ogni infusione riceverà un corticosteroide e un antistaminico e potrà ricevere anche
medicinali per ridurre la febbre.
In quali dosi e con quale frequenza le verrà somministrato Briumvi
- La prima dose di Briumvi sarà di 150 mg. Questa infusione durerà 4 ore.
- La seconda dose di Briumvi sarà di 450 mg e sarà somministrata 2 settimane dopo la prima dose. Questa infusione durerà 1 ora.
- Le dosi successive di Briumvi saranno di 450 mg e saranno somministrate 24 settimane dopo la prima dose e, in seguito, ogni 24 settimane. Queste infusioni dureranno 1 ora.
Come viene somministrato Briumvi
- Briumvi le sarà somministrato da un medico o da un infermiere. Prima della somministrazione, Briumvi deve essere diluito. La diluizione sarà effettuata da un operatore sanitario. Il medicinale le sarà somministrato tramite infusione in una vena (infusione endovenosa).
- Sarà tenuto sotto stretta osservazione durante l’infusione di Briumvi e per almeno 1 ora dopo la somministrazione delle prime due infusioni, nel caso in cui dovesse manifestare eventuali effetti indesiderati, come reazioni correlate all’infusione. In caso di reazione correlata all’infusione, l’infusione può essere rallentata, sospesa temporaneamente o interrotta definitivamente in funzione della sua gravità (per informazioni sulle reazioni correlate all’infusione, vedere paragrafi 2 e 4).
Se salta un’infusione di Briumvi
- Se salta un’infusione di Briumvi, si metta d’accordo con il medico per riceverla il prima possibile. Non attenda fino alla successiva infusione programmata.
- Per trarre pieno beneficio da Briumvi, è importante che riceva ogni infusione al momento in cui è prevista.
Se interrompe il trattamento con Briumvi
- È importante che prosegua il trattamento fino a quando lei e il medico riterrete che questo le apporti un beneficio.
- Alcuni effetti indesiderati possono essere correlati a bassi livelli di cellule B. Tali effetti indesiderati potrebbero continuare a manifestarsi anche dopo l’interruzione del trattamento con Briumvi, fino a quando i livelli di cellule B non saranno tornati al normale.
- Prima di iniziare ad assumere qualsiasi altro medicinale, informi il medico della data dell’ultima infusione di Briumvi.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Sono stati segnalati i seguenti effetti indesiderati per Briumvi:
Effetti indesiderati gravi
Reazioni correlate all’infusione
- Le reazioni correlate all’infusione sono l’effetto indesiderato più comune del trattamento con Briumvi (molto comune: può interessare più di 1 persona su 10). Nella maggior parte dei casi si tratta di reazioni lievi, ma possono verificarsi anche alcune reazioni gravi.
- Informi immediatamente il medico o l’infermiere se manifesta uno qualsiasi dei segni osintomi di una reazione correlata all’infusione, durante l’infusione o fino a 24 ore dopol’infusione.I sintomi possono comprendere, ma non si limitano a:
- prurito della pelle
- orticaria
- arrossamento del viso o della pelle
- irritazione della gola
- difficoltà a respirare
- gonfiore della lingua o della gola
- respiro sibilante
- brividi
- febbre
- mal di testa
- capogiro
- sensazione di svenimento
- nausea
- dolore addominale (mal di pancia)
- battito del cuore accelerato.
- Se manifesta una reazione correlata all’infusione, le saranno somministrati dei medicinali per trattarla e potrebbe essere necessario rallentare o interrompere l’infusione. Quando la reazione sarà cessata, l’infusione potrà proseguire. Se la reazione correlata all’infusione dovesse rappresentare un pericolo per la sua vita, il medico interromperà definitivamente il trattamento con Briumvi.
Infezioni
- Se le viene somministrato Briumvi, può sviluppare più facilmente infezioni, alcune delle quali possono essere gravi. In pazienti trattati con Briumvi per la SM sono state osservate le seguenti infezioni:
- Molto comune(può interessare più di 1 persona su 10)
- infezioni delle vie respiratorie superiori (infezioni del naso e della gola)
- infezioni delle vie respiratorie
- Comune(può interessare fino a 1 persona su 10)
- infezioni delle vie respiratorie inferiori (infezione dei polmoni come bronchite o polmonite)
- infezioni da herpes (herpes labiale o fuoco di Sant’Antonio)
- Non comune(può interessare fino a 1 persona su 100)
- infezione delle membrane di rivestimento che avvolgono il cervello e il midollo spinale (meningite), infezione del cervello (encefalite) o di entrambi (meningoencefalite)
- Informi immediatamente il medico o l’infermiere se nota uno qualsiasi di questi segni di infezione:
- febbre o brividi
- tosse che non passa
- herpes (ad es. herpes labiale, fuoco di Sant’Antonio o herpes genitale)
- mal di testa con febbre, collo rigido, sensibilità alla luce, nausea, confusione, crisi convulsive, alterazione della personalità, incoordinazione (atassia), alterazione della coscienza a/o coma. Questi possono essere sintomi di un’infezione delle membrane di rivestimento che avvolgono il cervello e il midollo spinale (meningite), di un’infezione del cervello (encefalite) o di entrambi (meningoencefalite), che possono essere fatali.
Il medico aspetterà che l’infezione si sia risolta prima di somministrarle Briumvi.
Altri effetti indesiderati
Comune(può interessare fino a 1 persona su 10)
- neutropenia (bassi livelli di neutrofili, un tipo di globuli bianchi del sangue)
- dolore agli arti (braccia o gambe)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a
fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Briumvi
Conservare in frigorifero (2 C – 8 °C).
Briumvi sarà conservato dagli operatori sanitari presso l’ospedale o la clinica nelle seguenti
condizioni:
- Questo medicinale non deve essere usato dopo la data di scadenza che è riportata sulla scatola esterna e sull’etichetta del flaconcino dopo ‘Scad’. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Questo medicinale deve essere conservato in frigorifero (2 °C - 8 °C). Non deve essere congelato. Il flaconcino deve essere tenuto nell’imballaggio esterno per proteggere il medicinale dalla luce.
Si raccomanda di utilizzare il medicinale immediatamente dopo la diluizione. Se non utilizzato
immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono di responsabilità
dell’operatore sanitario e di norma non devono superare le 24 ore a una temperatura compresa tra 2 °C
e 8 °C e, successivamente, le 8 ore a temperatura ambiente.
Non getti alcun medicinale nell’acqua di scarico. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Briumvi
- Il principio attivo è ublituximab. Ogni flaconcino contiene 150 mg di ublituximab in 6 mL a una concentrazione di 25 mg/mL.
- Gli altri componenti sono sodio cloruro, sodio citrato, polisorbato 80, acido cloridrico e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Briumvi e contenuto della confezione
- Briumvi è una soluzione da limpida a opalescente, da incolore a leggermente gialla.
- È fornito come concentrato per soluzione per infusione.
- Questo medicinale è disponibile in confezioni da 1 o 3 flaconcini (flaconcini di vetro contenente 6 mL di concentrato). È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Neuraxpharm Pharmaceuticals, S.L.
Avda. Barcelona 69
08970 Sant Joan Despí - Barcelona
Spagna
Produttore
Neuraxpharm Pharmaceuticals, S.L.
Avda. Barcelona 69
08970 Sant Joan Despí
Barcellona - Spagna
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Neuraxpharm Belgium
Tél/Tel: +32 (0)2 732 56 95
Lietuva
Neuraxpharm Pharmaceuticals, S.L.
Tel:+34 93 475 96 00
България
Neuraxpharm Pharmaceuticals, S.L.
Teл.: +34 93 475 96 00
Luxembourg/Luxemburg
Neuraxpharm France
Tél/Tel: +32 474 62 24 24
Česká republika
Neuraxpharm Bohemia s.r.o.
Tel: +420 739 232 258
Magyarország
Neuraxpharm Hungary Kft.
Tel.: +3630 464 6834
Danmark
Neuraxpharm Sweden AB
Tlf.: +46 (0)8 30 91 41
(Sverige)
Malta
Neuraxpharm Pharmaceuticals, S.L.
Tel.:+34 93 475 96 00
Deutschland
neuraxpharm Arzneimittel GmbH
Tel: +49 2173 1060 0
Nederland
Neuraxpharm Netherlands B.V.
Tel.: +31 70 208 5211
Eesti
Neuraxpharm Pharmaceuticals, S.L.
Tel: +34 93 475 96 00
Norge
Neuraxpharm Sweden AB
Tlf:+46 (0)8 30 91 41
(Sverige)
Österreich
Neuraxpharm Austria GmbH
Tel.:+ 43 (0) 1 208 07 40
España
Neuraxpharm Spain, S.L.U.
Tel: +34 93 475 96 00
Ελλάδα
Brain Therapeutics IKE
Τηλ: +302109931458
Polska
Neuraxpharm Polska Sp. z.o.o.
Tel.: +48 783 423 453
FrancePortugal
Neuraxpharm Portugal, Unipessoal Lda
Tel: +351 910 259 536
Hrvatska
Neuraxpharm Pharmaceuticals, S.L.
Tel: +34 93 475 96 00
Ireland
Neuraxpharm Ireland Ltd
Tel: +353 (0)1 428 7777
Neuraxpharm France
Tél: +33 1.53.62.42.90
România
Neuraxpharm Pharmaceuticals, S.L.
Tel: +34 93 475 96 00
Slovenija
Neuraxpharm Pharmaceuticals, S.L.
Tel: +34 93 475 96 00
Ísland
Neuraxpharm Sweden AB
Sími: +46 (0)8 30 91 41
(Svíþjóð)
Slovenská republika
Neuraxpharm Slovakia a.s.
Tel: +421 255 425 562
Italia
Neuraxpharm Italy S.p.A.
Tel: +39 0736 980619
Suomi/Finland
Neuraxpharm Sweden AB
Puh/Tel: +46 (0)8 30 91 41
(Ruotsi/Sverige)
Κύπρος
Brain Therapeutics IKE
Τηλ: +302109931458
Sverige
Neuraxpharm Sweden AB
Tel: +46 (0)8 30 91 41
Latvija
Neuraxpharm Pharmaceuticals, S.L.
Tel: +34 93 475 96 00
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu .
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Leggere il RCP per ulteriori informazioni.
Posologia
- Prima e seconda dose
La prima dose viene somministrata come infusione endovenosa da 150 mg (prima infusione), seguita
da un’infusione endovenosa da 450 mg 2 settimane più tardi (seconda infusione).
- Dosi successive
Le dosi successive di Briumvi vengono somministrate come singola infusione endovenosa da 450 mg
ogni 24 settimane (Tabella 1). La prima dose successiva da 450 mg deve essere somministrata
24 settimane dopo la prima infusione. Tra una dose di Briumvi e quella successiva deve essere
mantenuto un intervallo minimo di 5 mesi.
Figura 1: Dose e schema posologico di Briumvi
| Prima infusione | Seconda infusione | Infusioni successive |
Giorno 1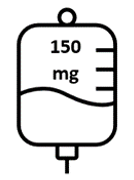 | e d Giorno 15 a n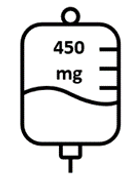 | Ogni 6 mesi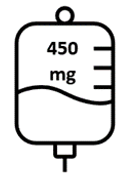 |
Gestione delle IRR prima dell’infusione
- Il trattamento con Briumvi deve essere avviato e supervisionato da un operatore sanitario esperto che abbia accesso a un adeguato supporto medico per la gestione di eventuali reazioni severe, come reazioni correlate all’infusione ( infusion-related reactions, IRR) gravi.
- Premedicazione per le IRR
Prima di ogni infusione di Briumvi, devono essere somministrate le due premedicazioni
seguenti al fine di ridurre la frequenza e la severità delle IRR:
- 100 mg di metilprednisolone o 10-20 mg di desametasone (o equivalente) circa 30-60 minuti prima di ogni infusione di Briumvi;
- difenidramina circa 30-60 minuti prima di ogni infusione di Briumvi. Inoltre, si può prendere in considerazione la premedicazione con un antipiretico (ad es. paracetamolo).
Istruzioni per la diluizione
- Briumvi deve essere preparato da un operatore sanitario adottando una tecnica asettica. Non agitare il flaconcino.
- Il prodotto è solo per uso singolo.
- Non usare la soluzione se il colore appare alterato o in presenza di particelle estranee.
- Il medicinale Briumvi deve essere diluito prima della somministrazione. Le soluzioni di Briumvi per somministrazione endovenosa sono preparate diluendo il medicinale in una sacca per infusione contenente una soluzione isotonica di sodio cloruro allo 0,9%. Per la prima
infusione, diluire un flaconcino di medicinale nella sacca per infusione (150 mg/250 mL) fino a
raggiungere una concentrazione finale di circa 0,6 mg/mL. Per le infusioni successive, diluire
tre flaconcini di medicinale nella sacca per infusione (450 mg/250 mL) fino a raggiungere una
concentrazione finale di circa 1,8 mg/mL.
- Prima di iniziare l’infusione endovenosa, il contenuto della sacca per infusione deve essere a temperatura ambiente.
Modo di somministrazione
- Dopo diluizione, Briumvi è somministrato mediante infusione endovenosa attraverso una linea dedicata.
- Le infusioni di Briumvi non devono essere somministrate mediante infusione endovenosa rapida o in bolo.
Tabella 1: Dose e schema posologico di Briumvi
| Quantità e volume | F Velocità di infusione | Durata1 | |
| Prima infusione | 150 mg in 250 mL | l
| 4 ore |
| Seconda infusione (2 settimane più tardi) | 450 mg in 250 mL | n
| 1 ora |
| Infusioni successive (una volta ogni 24 settimane)2 | a 450 mg in 250 mL | i
| 1 ora |
La durata dell’infusione può essere maggiore se l’infusione viene interrotta o rallentata.
La prima infusione successiva deve essere somministrata 24 settimane dopo la prima infusione.
Gestione delle IRR durante e dopo l’infusione
I pazienti devono essere tenuti sotto osservazione durante l’infusione e per almeno un’ora dopo il
completamento delle prime due infusioni.
Durante l’infusione
- Modifiche dell’infusione in caso di IRR
In caso di IRR durante l’infusione, adottare le modifiche seguenti.
IRR potenzialmente letali
Se si manifestano segni di una IRR potenzialmente letale o invalidante durante un’infusione,
l’infusione deve essere interrotta immediatamente e il paziente deve ricevere un trattamento
appropriato. In questi pazienti, Briumvi deve essere interrotto definitivamente (vedere paragrafo 4.3).
IRR severe
Se il paziente manifesta una IRR severa, l’infusione deve essere interrotta immediatamente e il
paziente deve ricevere un trattamento sintomatico. L’infusione deve essere ripresa solo dopo la
risoluzione di tutti i sintomi. Alla ripresa dell’infusione, iniziare a una velocità di infusione pari alla
metà di quella utilizzata al momento della comparsa della IRR. Se tollerata, la velocità di infusione
potrà essere aumentata come indicato nella Tabella 1.
IRR da lievi a moderate
Se il paziente manifesta una IRR da lieve a moderata, la velocità di infusione deve essere ridotta della
metà rispetto a quella utilizzata al momento della comparsa dell’evento. Questa velocità ridotta deve
essere mantenuta per almeno 30 minuti. Se tollerata, la velocità di infusione potrà successivamente
essere aumentata come indicato nella Tabella 1.
Dopo l’infusione
- I pazienti trattati con Briumvi devono essere tenuti sotto osservazione per almeno un’ora dopo il completamento delle prime due infusioni per identificare eventuali sintomi di IRR.
- I medici devono avvertire i pazienti che una IRR si può manifestare entro le 24 ore successive all’infusione.
Periodo di validità
Flaconcino non aperto
3 anni
Soluzione diluita per infusione endovenosa
- La stabilità chimica e fisica in uso è stata dimostrata per 24 ore a una temperatura compresa tra 2 e 8 °C e, successivamente, per 8 ore a temperatura ambiente.
- Da un punto di vista microbiologico, l’infusione preparata deve essere utilizzata immediatamente. Se non utilizzata immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono di responsabilità dell’utilizzatore e di norma non devono superare le 24 ore a una temperatura compresa tra 2 e 8 °C e, successivamente, le 8 ore a temperatura ambiente, a meno che la diluizione non sia avvenuta in condizioni asettiche controllate e convalidate.
- Nel caso in cui non sia possibile completare l’infusione endovenosa nel corso della stessa giornata, la soluzione rimanente deve essere eliminata.
Allegato IV
Conclusioni scientifiche e motivazioni per la variazione dei termini della/e autorizzazione/i
all’immissione in commercio
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) del/i Rapporto/i periodico/i di
aggiornamento sulla sicurezza ( Periodic Safety Update Report, PSUR) per ublituximab, le conclusioni
scientifiche del PRAC sono le seguenti:
Sulla base dei dati disponibili su encefalite/meningite/meningoencefalite derivanti da sperimentazioni
cliniche e da segnalazioni spontanee, inclusa, in sette casi, una stretta relazione temporale, e sulla base
di un plausibile meccanismo d’azione, il PRAC considera che una relazione causale tra ublituximab e
encefalite/meningite/meningoencefalite sia almeno una possibilità ragionevole e conclude pertanto che
le informazioni di prodotto dei medicinali contenenti ublituximab debbano essere aggiornate in
accordo a quanto riportato.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
( Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione.
Motivazioni per la variazione dei termini della/e autorizzazione all’immissione in commercio
Sulla base delle conclusioni scientifiche su ublituximab, il CHMP ritiene che il rapporto
beneficio/rischio del/i medicinale/i contenente/i ublituximab sia invariato fatte salve le modifiche
proposte alle informazioni del prodotto.
Il CHMP raccomanda la variazione dei termini della/e autorizzazione/i all’immissione in commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a BRIUMVIForma farmaceutica: Polvere per soluzione per infusione endovenosa, 120 MGPrincipio attivo: belimumabProduttore: GLAXOSMITHKLINE (IRELAND) LIMITEDPrescrizione richiestaForma farmaceutica: Polvere per soluzione per infusione endovenosa, 300 MGPrincipio attivo: vedolizumabProduttore: TAKEDA PHARMA A/SPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 20 MGPrincipio attivo: ofatumumabProduttore: NOVARTIS EUROPHARM LIMITEDPrescrizione richiesta
Medici online per BRIUMVI
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di BRIUMVI — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





