
SPIKEVAX JN.1

Come usare SPIKEVAX JN.1
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Spikevax JN.1 0,1 mg/mL dispersione per preparazione iniettabile, 50 microgrammi dispersione per preparazione iniettabile, 50 microgrammi dispersione iniettabile in siringa preriempita
Vaccino a mRNA anti-COVID-19
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di ricevere questo vaccino perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Spikevax JN.1 e a cosa serve
- 2. Cosa deve sapere prima di ricevere Spikevax JN.1
- 3. Come viene somministrato Spikevax JN.1
- 4. Possibili effetti indesiderati
- 5. Come conservare Spikevax JN.1
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Spikevax JN.1 e a cosa serve
Spikevax JN.1 è un vaccino usato per prevenire il COVID-19, malattia causata dal coronavirus SARS-
CoV-2. Viene somministrato ad adulti e bambini di età pari o superiore a 6 mesi. Il principio attivo di
Spikevax JN.1 è l’mRNA che codifica per la proteina spike del SARS-CoV-2. L’mRNA è inserito in
nanoparticelle lipidiche SM-102.
Poiché Spikevax JN.1 non contiene il virus, non può provocare il COVID-19.
Come funziona il vaccino
Spikevax JN.1 stimola le naturali difese dell’organismo (il sistema immunitario). Il vaccino induce
l’organismo a produrre una protezione (anticorpi) contro il virus che causa il COVID-19. Spikevax
JN.1 utilizza una sostanza chiamata acido ribonucleico messaggero (mRNA) per trasportare una serie
di istruzioni che le cellule del corpo possono utilizzare per creare la proteina spike presente anche sul
virus. Le cellule producono quindi anticorpi contro la proteina spike per contribuire a combattere il
virus. Questo aiuta a proteggersi dal COVID-19.
2. Cosa deve sapere prima di ricevere Spikevax JN.1
Il vaccino non deve essere somministratose è allergicoal principio attivo o ad uno qualsiasi degli
altri componenti di questo vaccino (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima di ricevere Spikevax JN.1 se:
- ha già avuto in passato una reazione allergicagrave, potenzialmente letale, dopo qualsiasi altra iniezione di un vaccino o dopo la somministrazione di Spikevax (originale)
- ha un sistema immunitario molto debole o compromesso
- ha avuto in precedenza uno svenimento a seguito di un’iniezione con un ago
- soffre di un disturbo della coagulazione
- ha febbre alta o un’infezione grave; tuttavia può ricevere la vaccinazione se ha una leggera febbre o una leggera infezione delle vie respiratore come ad esempio un raffreddore
- ha una malattia grave
- soffre di ansia associata alle iniezioni
Dopo la vaccinazione con Spikevax esiste un maggiore rischio di miocardite (infiammazione del
cuore) e pericardite (infiammazione del rivestimento esterno del cuore) (vedere paragrafo 4).
Queste condizioni possono svilupparsi pochi giorni dopo la vaccinazione e si sono verificate
principalmente entro 14 giorni. Sono state osservate più spesso in maschi giovani, e più spesso dopo la
seconda dose rispetto alla prima dose.
La maggior parte dei casi di miocardite e pericardite si risolve. Alcuni casi hanno richiesto una terapia
intensiva e si sono osservati casi fatali.
Dopo la vaccinazione presti particolare attenzione ai segni di miocardite e pericardite, quali respiro
corto, palpitazioni e dolore toracico, e si rivolga immediatamente al medico in caso di comparsa di tali
sintomi.
Se rientra in una qualsiasi delle condizioni sopra descritte (o se ha dei dubbi) si rivolga al medico, al
farmacista o all’infermiere prima di ricevere Spikevax JN.1.
Riacutizzazioni della sindrome da perdita capillare (CLS)
Sono stati segnalati alcuni casi di riacutizzazioni della sindrome da perdita capillare a seguito della
vaccinazione con Spikevax (originale). Tale affezione provoca perdita di liquido da piccoli vasi
sanguigni (capillari) con conseguente rapido gonfiore delle braccia e delle gambe, aumento
improvviso del peso e sensazione di svenimento, bassa pressione sanguigna. Se in precedenza ha
manifestato episodi di CLS, si rivolga al medico prima della somministrazione di Spikevax JN.1.
Durata della protezione
Come con qualsiasi vaccino, l’ulteriore dose di Spikevax JN.1 potrebbe non proteggere
completamente tutti coloro che la ricevono, né è nota la durata del periodo di copertura.
Bambini
Spikevax JN.1 non è raccomandato nei bambini di età inferiore a 6 mesi.
Altri medicinali e Spikevax JN.1
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale. Spikevax JN.1 può influenzare la modalità di azione di altri medicinali e
altri medicinali possono influenzare la modalità di azione di Spikevax JN.1.
Soggetti immunocompromessi
L’efficacia di Spikevax JN.1 potrebbe essere inferiore nelle persone immunocompromesse. In tal
caso, dovrà continuare a prendere le precauzioni fisiche per contribuire a prevenire COVID-19. Se
opportuno, inoltre, i suoi contatti stretti dovranno essere vaccinati. Parli con il medico delle
raccomandazioni più adatte a lei.
Gravidanza e allattamento
Se è in corso una gravidanza o se sospetta una gravidanza, informi il medico, l’infermiere o il
farmacista prima di ricevere questo vaccino. Non sono ancora disponibili dati riguardanti l’uso di
Spikevax JN.1 durante la gravidanza. Tuttavia, un ampio numero di dati relativi a donne in gravidanza
vaccinate con Spikevax (originale) durante il secondo e terzo trimestre di gestazione non ha mostrato
effetti negativi sulla gravidanza o sul neonato. Sebbene i dati relativi agli effetti sulla gravidanza o sul
neonato dopo la somministrazione del vaccino durante il primo trimestre di gestazione siano limitati,
non è stato osservato alcun aumento del rischio di aborti spontanei. Poiché le differenze tra i due
prodotti riguardano solo la proteina spike nel vaccino, e non sussistono differenze cliniche di rilievo,
Spikevax JN.1 può essere utilizzato durante la gravidanza.
Non sono ancora disponibili dati riguardanti l’uso di Spikevax JN.1 durante l’allattamento.
Tuttavia, non si prevedono effetti sui neonati/lattanti allattati con latte materno. I dati provenienti da
donne che allattavano con latte materno dopo la vaccinazione con Spikevax (originale) non hanno
mostrato un rischio di eventi avversi nei neonati/lattanti allattati con latte materno. Spikevax JN.1 può
essere somministrato durante l’allattamento.
Guida di veicoli e utilizzo di macchinari
Eviti di guidare o di utilizzare macchinari se non si sente bene dopo la vaccinazione. Aspetti che
eventuali effetti del vaccino siano scomparsi prima di guidare o utilizzare macchinari.
Spikevax JN.1contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per dose, cioè essenzialmente “senza
sodio”.
3. Come viene somministrato Spikevax JN.1
Tabella 1. Posologia di Spikevax JN.1
| Età | a Dose | Altre raccomandazioni |
| Bambini di età compresa tra 6 mesi e 4 anni, precedentemente non vaccinati e senza anamnesi nota di infezione da S ARS-CoV-2 | n Due dosi da 0,25 mL a ciascuna, somministrate per via intramuscolare* i l a t | Somministrare la seconda dose 28 giorni dopo la prima. Se un bambino ha ricevuto una dose precedente di un qualsiasi vaccino Spikevax, somministrare una dose di Spikevax JN.1 per completare la serie di due dosi. |
| Bambini di età compresa tra 6 mesi e 4 anni, a precedentemente vaccinati o con anamnesi nota di i infezione da SARS-CoV-2 z | I Una dose da 0,25 mL, somministrata per via intramuscolare* | Spikevax JN.1 deve essere somministrato almeno 3 mesi dopo la dose più recente di un vaccino anti-COVID-19. |
| n Bambini di età compresa tra 5 e 11 anni, precedentemente e vaccinati o non vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* | |
| g Soggetti di età pari o superiore a 12 anni, A precedentemente vaccinati o non vaccinati | Una dose da 0,5 mL, somministrata per via intramuscolare | |
| Soggetti di età pari o s uperiore a 65 anni | Una dose da 0,5 mL, somministrata per via i ntramuscolare | Un’ulteriore dose può essere somministrata almeno 3 mesi dopo la dose più recente di un vaccino anti-COVID-19. |
* Non utilizzare il flaconcino monodose o la siringa preriempita per somministrare un volume parziale
di 0,25 mL.
Tabella 2. Posologia di Spikevax JN.1 in soggetti immunocompromessi
* Non utilizzare il flaconcino monodose o la siringa preriempita per somministrare un volume parziale
di 0,25 mL.
Il medico, il farmacista o l’infermiere inietterà il vaccino in un muscolo (iniezione intramuscolare)
nella parte superiore del braccio.
Dopoogni iniezione del vaccino il medico, il farmacista o l’infermiere la terrà sotto osservazione per
almeno 15 minutiper monitorare eventuali segni di reazione allergica.
Se ha qualsiasi dubbio sull’uso di questo vaccino, si rivolga al medico, al farmacista o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo vaccino può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Si rivolga urgentementea un medico se manifesta uno qualsiasi dei seguenti segni e sintomi di una
reazione allergica:
- sensazione di svenimento o stordimento;
- alterazioni del battito cardiaco;
- respiro affannoso;
- respiro sibilante;
- gonfiore della lingua, del viso o della gola;
- orticaria o eruzione cutanea;
- nausea o vomito;
- dolore allo stomaco.
| Età | Dose | c Altre raccomandazioni |
| Bambini immunocompromessi di età compresa tra 6 mesi e 4 anni, precedentemente non vaccinati | Due dosi da 0,25 mL, somministrate per via intramuscolare* | a Una terza dose può essere m somministrata nei soggetti severamente immunocompromessi almeno 28 giorni dopo la seconda. |
| Bambini immunocompromessi di età compresa tra 6 mesi e 4 anni, precedentemente vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* | r a F Ulteriori dosi adatte all’età possono essere somministrate nei soggetti severamente immunocompromessi l almeno 2 mesi dopo la dose più recente di un vaccino anti-COVID-19 a discrezione del professionista sanitario, tenendo in considerazione le condizioni cliniche del soggetto. |
| Bambini immunocompromessi di età compresa tra 5 e 11 anni, precedentemente vaccinati o non vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* e | |
| Soggetti immunocompromessi di età pari o superiore a 12 anni, precedentemente vaccinati o non vaccinati | d Una dose da 0,5 mL, somministrata per via intramuscolare a |
Si rivolga al medico o all’infermiere se dovesse manifestarsi qualsiasi altro effetto indesiderato. Questi
possono includere:
Molto comuni(possono riguardare più di 1 persona su 10)
- gonfiore/dolorabilità sotto le ascelle
- appetito ridotto (osservato nei bambini di età compresa tra 6 mesi e 5 anni)
- irritabilità/pianto (osservati nei bambini di età compresa tra 6 mesi e 5 anni)
- mal di testa
- sonnolenza (osservata nei bambini di età compresa tra 6 mesi e 5 anni)
- nausea
- vomito
- dolore ai muscoli, alle articolazioni e rigidità
- dolore o gonfiore in corrispondenza del sito di iniezione
- arrossamento in corrispondenza del sito di iniezione (in alcuni casi può verificarsi all’incirca da 9 a 11 giorni dopo l’iniezione)
- sensazione di estrema stanchezza
- brividi
- febbre
Comuni(possono riguardare fino a 1 persona su 10)
- diarrea
- eruzione cutanea
- eruzione cutanea o orticaria in corrispondenza del sito di iniezione (in alcuni casi possono verificarsi all’incirca da 9 a 11 giorni dopo l’iniezione)
Non comuni(possono riguardare fino a 1 persona su 100)
- prurito in corrispondenza del sito di iniezione
- capogiro
- dolore allo stomaco
- pomfi sulla pelle accompagnati da prurito (orticaria) (che possono comparire subito dopo l’iniezione e fino a un massimo di due settimane circa dopo l’iniezione)
Rari (possono riguardare fino a 1 persona su 1 000)
- paralisi temporanea di un lato del viso (paralisi di Bell)
- gonfiore del viso (può manifestarsi gonfiore del viso nei soggetti che si sono precedentemente sottoposti a iniezioni cosmetiche facciali)
- diminuzione del senso del tatto o della sensibilità
- sensazione insolita sulla pelle, come sensazione di formicolio o pizzicore (parestesia)
Molto rari(possono riguardare fino a 1 persona su 10 000)
- infiammazione del cuore (miocardite) o infiammazione del rivestimento esterno del cuore (pericardite) che possono causare respiro corto, palpitazioni o dolore toracico
Frequenza non nota
- reazioni allergiche gravi con difficoltà respiratorie (anafilassi)
- reazione del sistema immunitario di aumentata sensibilità o intolleranza (ipersensibilità)
- reazione cutanea che causa macchie o chiazze rosse sulla pelle, che possono avere l’aspetto di un bersaglio o “occhio di bue” con un nucleo rosso scuro circondato da anelli rosso chiaro (eritema multiforme)
- gonfiore esteso dell’arto vaccinato
- flusso mestruale abbondante (la maggior parte dei casi appariva di natura non grave e transitoria)
- irritazione cutanea indotta da stimoli esterni quali strofinio, prurito o pressione sulla pelle (orticaria meccanica)
- irritazione cutanea pruriginosa, in rilievo, di durata superiore alle sei settimane (orticaria cronica)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo vaccino.
5. Come conservare Spikevax JN.1
Conservi questo vaccino fuori dalla vista e dalla portata dei bambini.
Non usi questo vaccino dopo la data di scadenza che è riportata sull’etichetta dopo Scad. La data di
scadenza si riferisce all’ultimo giorno di quel mese.
Le informazioni sulla conservazione, la scadenza, l’impiego e la manipolazione sono descritte nella
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Spikevax JN.1
Tabella 3. Composizione per tipo di contenitore
| Dosaggio | i l Contenitore a | Dose(i) | Composizione |
| Spikevax JN.1 0,1 mg/mL dispersione per preparazione iniettabile z n e | t Flaconcino I multidose da 2,5 mL a i | 5 dosi da 0,5 mL ciascuna o un massimo di 10 dosi da 0,25 mL ciascuna | Una dose (0,5 mL) contiene 50 microgrammi di SARS-CoV-2 JN.1 mRNA, un vaccino a mRNA anti-COVID 19 (modificato a livello dei nucleosidi) (inserito in nanoparticelle lipidiche SM-102). Una dose (0,25 mL) contiene 25 microgrammi di SARS-CoV-2 JN.1 mRNA, un vaccino a mRNA anti-COVID 19 (modificato a livello dei nucleosidi) (inserito in nanoparticelle lipidiche SM-102). |
| g Spikevax JN.1 A 50 mcg dispersione per preparazione iniettabile | Flaconcino monodose da 0,5 mL | 1 dose da 0,5 mL Esclusivamente monouso | Una dose (0,5 mL) contiene 50 microgrammi di SARS-CoV-2 JN.1 mRNA, un vaccino a mRNA anti-COVID 19 (modificato a livello dei nucleosidi) (inserito in nanoparticelle lipidiche SM-102). |
| Dosaggio | Contenitore | Dose(i) | Composizione |
| Spikevax JN.1 50 mcg dispersione iniettabile in siringa preriempita | Siringa preriempita | 1 dose da 0,5 mL Esclusivamente monouso | o Una dose (0,5 mL) contiene c 50 microgrammi di SARS-CoV-2 JN.1 mRNA, un vaccino a mRNA a anti-COVID 19 (modificato a livello dei nucleosidi) (inserito in nanoparticelle lipidiche SM-102). |
SARS-CoV-2 JN.1 mRNA è un RNA messaggero (mRNA) a singola elica con cappingin 5’, prodotto
mediante trascrizione in vitrosenza l’ausilio di cellule dai corrispondenti DNA stampo, che codifica
per la proteina virale spike (S) del SARS-CoV-2 (JN.1).
Gli altri componenti sono SM-102 (eptadecano-9-il 8-{(2-idrossietil)[6-osso-6-
(undecilossi)esil]ammino}ottanoato), colesterolo, 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC), 1,2-
dimiristoil-rac-glicero-3-metossipolietilenglicole-2000 (PEG2000-DMG), trometamolo, trometamolo
cloridrato, acido acetico, sodio acetato triidrato, saccarosio, acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Spikevax JN.1 e contenuto della confezione
Spikevax JN.1 0,1 mg/mL dispersione per preparazione iniettabile
Spikevax JN.1 è una dispersione di colore da bianco a biancastro, fornita in un flaconcino multidose di
vetro con tappo di gomma e capsula di chiusura rimovibile in plastica blu con sigillo in alluminio.
Dimensioni della confezione: 10 flaconcini multidose. Ogni flaconcino contiene 2,5 mL.
Spikevax JN.1 50 microgrammi dispersione per preparazione iniettabile
Spikevax JN.1 è una dispersione di colore da bianco a biancastro, fornita in un flaconcino monodose
di vetro con tappo di gomma e capsula di chiusura rimovibile in plastica blu con sigillo in alluminio.
Dimensioni della confezione:
1 flaconcino monodose
10 flaconcini monodose
Ogni flaconcino contiene 0,5 mL.
È possibile che non tutte le confezioni siano commercializzate.
Spikevax JN.1 50 microgrammi dispersione iniettabile in siringa preriempita
Spikevax JN.1 è una dispersione di colore da bianco a biancastro, fornita in una siringa preriempita
(copolimero olefinico ciclico) con tappo a stantuffo e capsula di chiusura (senza ago).
La siringa preriempita è confezionata in un vassoio di carta all’interno di una scatola o in 1 blister
trasparente contenente 1 siringa preriempita o in 5 blister trasparenti, contenenti ciascuno 2 siringhe
preriempite.
Dimensioni della confezione:
1 siringa preriempita
10 siringhe preriempite
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
MODERNA BIOTECH SPAIN, S.L.
C/ Julián Camarillo nº 31
28037 Madrid
Spagna
Produttori
Rovi Pharma Industrial Services, S.A.
Paseo de Europa, 50
28703, San Sebastián de los Reyes
Madrid
Spagna
Moderna Biotech Spain S.L.
C/ Julián Camarillo nº 31
28037 Madrid
Spagna
Rovi Pharma Industrial Services, S.A.
Calle Julián Camarillo n°35
28037 Madrid
Spagna
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio.
België/Belgique/Belgien
Tél/Tel: 0800 81 460
Lietuva
Tel: 88 003 1114
България
Teл: 0800 115 4477
Luxembourg/Luxemburg
Tél/Tel: 800 85 499
Česká republika
Tel: 800 050 719
Magyarország
Tel: 06 809 87488
Danmark
Tlf.: 80 81 06 53
Malta
Tel: 8006 5066
Deutschland
Tel: 0800 100 9632
Nederland
Tel: 0800 409 0001
Eesti
Tel: 800 0044 702
Norge
Tlf: 800 31 401
Ελλάδα
Τηλ: 008004 4149571
Österreich
Tel: 0800 909636
España
Tel: 900 031 015
Polska
Tel: 800 702 406
France
Tél: 0805 54 30 16
Portugal
Tel: 800 210 256
Hrvatska
Tel: 08009614
România
Tel: 0800 400 625
Ireland
Tel: 1800 800 354
Slovenija
Tel: 080 083082
Ísland
Sími: 800 4382
Slovenská republika
Tel: 0800 191 647
Italia
Tel: 800 928 007
Suomi/Finland
Puh/Tel: 0800 774198
Κύπρος
Τηλ: 80091080
Sverige
Tel: 020 10 92 13
Latvija
Tel: 80 005 898
Eseguire la scansione con un dispositivo mobile per ottenere il foglio informativo in altre lingue.

Oppure visitare il sito https://www.ModernaCovid19Global.com
Informazioni più dettagliate su questo vaccino sono disponibili sul sito web dell’Agenzia europea per i
medicinali, https://www.ema.europa.eu .
Questo foglio è disponibile in tutte le lingue dell’Unione europea/dello Spazio economico europeo sul
sito web dell’Agenzia europea per i medicinali.
------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Spikevax JN.1 deve essere somministrato da un operatore sanitario addestrato.
Una volta scongelato il vaccino è pronto per l’uso.
Non agitare né diluire.
Il vaccino deve essere controllato visivamente per la presenza di particelle e scolorimento prima della
somministrazione.
Spikevax JN.1 è una dispersione di colore da bianco a biancastro. Può contenere particelle bianche o
traslucide correlate al prodotto. Non somministrare il vaccino se presenta scolorimento o contiene altro
particolato.
Vaccino congelato
I flaconcini sono conservati in congelatore ad una temperatura compresa tra -50 ºC e -15 ºC.
Spikevax JN.1 0,1 mg/mL dispersione per preparazione iniettabile (flaconcini multidose con capsula
di chiusura rimovibile blu)
Da ogni flaconcino multidose possono essere prelevate cinque (5) dosi (da 0,5 mL ciascuna) o un
massimo di dieci (10) dosi (da 0,25 mL ciascuna).
Si consiglia di perforare il tappo ogni volta in un punto diverso.
Verificare che il flaconcino abbia la capsula di chiusura rimovibile blu e che il nome del prodotto sia
Spikevax JN.1. Se il flaconcino ha la capsula di chiusura rimovibile blu e il nome del prodotto è
Spikevax 0,1 mg/mL, Spikevax bivalent Original/Omicron BA.1, Spikevax bivalent Original/Omicron
BA.4-5 o Spikevax XBB.1.5, si prega di consultare il riassunto delle caratteristiche del prodotto per
tale formulazione.
Vaccino scongelato
Il vaccino viene trasportato e consegnato congelato o scongelato. Se è congelato, scongelare ogni
flaconcino multidose prima dell’uso seguendo le istruzioni riportate di seguito (Tabella 4).
Tabella 4. Istruzioni per lo scongelamento dei flaconcini multidose prima dell’uso
| Configurazione | d Istruzioni per lo scongelamento e durata dello scongelamento | |||
| Temperatura di scongelamento (in frigorifero) | a Durata dello n scongelamen t o a | Temperatura di scongelament o (a temperatura ambiente) | Durata dello s congelamento | |
| Flaconcino multidose | i 2° – 8°C | 2 ore e 30 minuti | 15°C – 25°C | 1 ora |
Se si riceve il vaccino a una temperatura compresa tra 2°C e 8°C, il vaccino va conservato a
temperatura tra 2°C e 8°C. Sull’imballaggio esterno va riportata la nuova data di smaltimento a
temperatura tra 2°C e 8°C.
Durante questo periodo è consentito il trasporto per un massimo di 36 ore a una temperatura compresa
tra 2 °C e 8 °C.

Spikevax JN.1 50 microgrammi dispersione per preparazione iniettabile (flaconcino monodose)
Una volta scongelato, il vaccino è pronto per l’uso.
Non agitare né diluire. Far roteare delicatamente il flaconcino dopo lo scongelamento e prima del
prelievo.
Verificare che il flaconcino abbia la capsula di chiusura rimovibile blu e che il nome del prodotto sia
Spikevax JN.1. Se il flaconcino ha la capsula di chiusura rimovibile blu e il nome del prodotto è
Spikevax bivalent Original/Omicron BA.1, Spikevax bivalent Original/Omicron BA.4-5 o Spikevax
XBB.1.5, si prega di consultare il riassunto delle caratteristiche del prodotto per tale formulazione.
Vaccino scongelato
Il vaccino viene trasportato e consegnato congelato o scongelato. Se è congelato, scongelare ogni
flaconcino monodose prima dell’uso seguendo le istruzioni riportate di seguito. Ciascun flaconcino
monodose oppure l’intera scatola contenente 1 o 10 flaconcini possono essere scongelati in frigorifero
o a temperatura ambiente (Tabella 5).
Tabella 5. Istruzioni per lo scongelamento dei flaconcini monodose e delle scatole prima dell’uso
| Configurazione | a Istruzioni per lo scongelamento e durata dello scongelamento | |||
| i z Temperatura di n scongelamento (in frigorifero) | Durata dello scongelamento | Temperatura di scongelamento (a temperatura ambiente) | Durata dello scongelamento | |
| e Flaconcino monodose | Da 2 °C a 8 °C | 45 minuti | Da 15 °C a 25 °C | 15 minuti |
| g Scatola | Da 2 °C a 8 °C | 1 ora e 45 minuti | Da 15 °C a 25 °C | 45 minuti |
Se si riceve il vaccino a una temperatura compresa tra 2°C e 8°C, il vaccino va conservato a
temperatura tra 2°C e 8°C. Sull’imballaggio esterno va riportata la nuova data di smaltimento a
temperatura tra 2°C e 8°C.
Durante questo periodo è consentito il trasporto per un massimo di 36 ore a una temperatura compresa
tra 2 °C e 8 °C.
Spikevax JN.1 50 microgrammi dispersione iniettabile in siringa preriempita
Non agitare né diluire il contenuto della siringa preriempita.
Ogni siringa preriempita è esclusivamente monouso. Una volta scongelato, il vaccino è pronto per
l’uso.
Da ogni siringa preriempita può essere somministrata una (1) dose da 0,5 mL.
Spikevax JN.1 viene fornito in una siringa preriempita monodose (senza ago) contenente 0,5 mL
(50 microgrammi di SARS-CoV-2 JN.1 mRNA) e deve essere scongelato prima della
somministrazione.
Durante la conservazione, ridurre al minimo l’esposizione a luce ambiente ed evitare l’esposizione alla
luce solare diretta e alla luce ultravioletta.
Vaccino scongelato
Il vaccino viene trasportato e consegnato congelato o scongelato. Se è congelato, scongelare ogni
siringa preriempita prima dell’uso seguendo le istruzioni seguenti. Le siringhe possono essere
scongelate nei blister (ogni blister contiene 1 o 2 siringhe preriempite, a seconda della confezione) o
nella scatola stessa, in frigorifero o a temperatura ambiente (Tabella 6)
Tabella 6. Istruzioni per lo scongelamento delle siringhe preriempite Spikevax JN.1 e delle
scatole prima dell’uso
| Configurazione | n Istruzioni per lo scongelamento e durata dello scongelamento | |||
| Temperatura di scongelamento (in frigorifero) (°C) | a Durata dello i scongelamento l (min uti) | Temperatura di scongelamento (a temperatura ambiente) (°C) | Durata dello scongelamento (min uti) | |
| Siringa preriempita nel blister | t
| a 55 |
| 45 |
| Scatola | I
| 155 |
| 140 |
Se si riceve il vaccino a una temperatura compresa tra 2°C e 8°C, il vaccino va conservato a
temperatura tra 2°C e 8°C. Sull’imballaggio esterno va riportata la nuova data di smaltimento a
temperatura tra 2°C e 8°C.
La durata del trasporto delle siringhe preriempite è dipendente dal tempo di trasporto convalidato nell’
idoneo contenitore.
Verificare che il nome del prodotto della siringa preriempita sia Spikevax JN.1. Se il nome del
prodotto è Spikevax 50 microgrammi, Spikevax bivalent Original/Omicron BA.1, Spikevax bivalent
Original/Omicron BA.4-5 o Spikevax XBB.1.5, si prega di consultare il riassunto delle caratteristiche
del prodotto per tale formulazione.
Istruzioni per la manipolazione delle siringhe preriempite
- Non agitare.
- La siringa preriempita deve essere controllata visivamente per la presenza di particelle e scolorimento prima della somministrazione.
- Spikevax JN.1 è una dispersione di colore da bianco a biancastro. Può contenere particelle bianche o traslucide correlate al prodotto. Non somministrare il vaccino se presenta scolorimento o contiene altro particolato.
- Gli aghi non sono inclusi nelle scatole delle siringhe preriempite.
- Usare un ago sterile della misura adatta per l’iniezione intramuscolare (aghi da 21 gauge o più sottili).
- Rimuovere la capsula di chiusura in posizione verticale, ruotando in senso antiorario fino a quando non si sgancia. Rimuovere la capsula di chiusura con un movimento lento e uniforme. Non tirare la capsula di chiusura mentre la si ruota.
- Inserire l’ago girando in senso orario fino a fissarlo saldamente alla siringa.
- Togliere il cappuccio dall’ago quando si è pronti per la somministrazione.
- Somministrare l’intera dose per via intramuscolare.
- Dopo lo scongelamento, non ricongelare.
Smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
Dosaggio e programma
Tabella 7.Posologia diSpikevax JN.1
| Età | d Dose | Altre raccomandazioni |
| Bambini di età compresa tra 6 mesi e 4 anni, precedentemente non vaccinati e senza anamnesi nota di infezione da S ARS-CoV-2 | a Due dosi da 0,25 mL n ciascuna, somministrate per via intramuscolare* a i l | Somministrare la seconda dose 28 giorni dopo la prima. Se un bambino ha ricevuto una dose precedente di Spikevax, somministrare una dose di Spikevax JN.1 per completare la serie di due dosi. |
| Bambini di età compresa tra 6 mesi e 4 anni, precedentemente vaccinati o con anamnesi nota di infezione da SARS-CoV-2 | a Una dose da 0,25 mL, t somministrata per via I intramuscolare* | Spikevax JN.1 deve essere somministrato almeno 3 mesi dopo la dose più recente di un vaccino anti-COVID-19. |
| a Bambini di età compresa tra i 5 e 11 anni, precedentemente z vaccinati o non vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* | |
| n Soggetti di età pari o e superiore a 12 anni, precedentemente vaccinati o non vaccinati | Una dose da 0,5 mL, somministrata per via intramuscolare | |
| g A Soggetti di età pari o s uperiore a 65 anni | Una dose da 0,5 mL, somministrata per via i ntramuscolare | Un’ulteriore dose può essere somministrata almeno 3 mesi dopo la dose più recente di un vaccino anti-COVID-19. |
* Non utilizzare il flaconcino monodose o la siringa preriempita per somministrare un volume parziale
di 0,25 mL.
Tabella 8. Posologia di Spikevax JN.1 in soggetti immunocompromessi
* Non utilizzare il flaconcino monodose o la siringa preriempita per somministrare un volume parziale
di 0,25 mL.
Come per tutti i vaccini iniettabili, devono essere sempre prontamente disponibili una supervisione
medica e trattamenti medici adeguati in caso di reazione anafilattica a seguito della somministrazione
di Spikevax JN.1.
I soggetti vaccinati devono essere tenuti sotto osservazione da un operatore sanitario per almeno
15 minuti dopo la vaccinazione.
Spikevax (tutte le diverse varianti) può essere somministrato in concomitanza con i vaccini
antinfluenzali (standard e ad alto dosaggio) e con il vaccino a subunità anti-herpes zoster (fuoco di
Sant’Antonio).
I diversi vaccini iniettabili devono essere somministrati in sedi di iniezione differenti.
Spikevax JN.1 non deve essere miscelato nella stessa siringa con altri vaccini o medicinali.
Somministrazione
Il vaccino deve essere somministrato per via intramuscolare. Il sito preferito è la regione deltoidea del
braccio. Non iniettare questo vaccino per via intravascolare, sottocutanea o intradermica.
| Età | Dose | Altre raccomandazioni |
| Bambini immunocompromessi di età compresa tra 6 mesi e 4 anni, precedentemente non vaccinati | Due dosi da 0,25 mL, somministrate per via intramuscolare* | o c Una terza dose può essere somministrata nei soggetti a severamente immunocompromessi almeno 28 giorni dopo la seconda. |
| Bambini immunocompromessi di età compresa tra 6 mesi e 4 anni, precedentemente vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* | m r a Ulteriori dosi adatte all’età possono essere somministrate nei soggetti F severamente immunocompromessi almeno 2 mesi dopo la dose più recente di un vaccino l anti-COVID-19 a discrezione del professionista sanitario, tenendo in considerazione le condizioni cliniche del soggetto |
| Bambini immunocompromessi di età compresa tra 5 e 11 anni, precedentemente vaccinati o non vaccinati | Una dose da 0,25 mL, somministrata per via intramuscolare* | |
| Soggetti immunocompromessi di età pari o superiore a 12 anni, precedentemente vaccinati o non vaccinati | e d Una dose da 0,5 mL, somministrata per via intramuscolare |
Flaconcini multidose
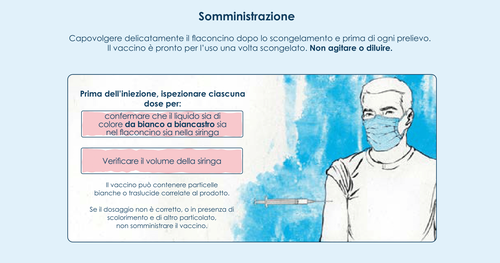
Siringhe preriempite
Usare un ago sterile della misura adatta per l’iniezione intramuscolare (da 21 gauge o più sottile).
Rimuovere la capsula di chiusura in posizione verticale, ruotando in senso antiorario fino a quando
non si sgancia. Rimuovere la capsula di chiusura con un movimento lento e uniforme. Non tirare la
capsula di chiusura mentre la si ruota. Inserire l’ago girando in senso orario fino a fissarlo saldamente
alla siringa. Togliere il cappuccio dall’ago quando si è pronti per la somministrazione. Somministrare
l’intera dose per via intramuscolare. Gettare la siringa dopo l’uso. Esclusivamente monouso.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a SPIKEVAX JN.1Forma farmaceutica: Dispersione per preparazione iniettabile, 30 mcgPrincipio attivo: covid-19, RNA-based vaccineProduttore: BIONTECH MANUFACTURING GMBHPrescrizione richiestaForma farmaceutica: Dispersione per preparazione iniettabile, 30 mcgPrincipio attivo: covid-19, RNA-based vaccineProduttore: BIONTECH MANUFACTURING GMBHPrescrizione richiestaForma farmaceutica: Dispersione per preparazione iniettabile, 30 mcgPrincipio attivo: covid-19, RNA-based vaccineProduttore: BIONTECH MANUFACTURING GMBHPrescrizione richiesta
Medici online per SPIKEVAX JN.1
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di SPIKEVAX JN.1 — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














