
ABRYSVO

Come usare ABRYSVO
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Abrysvo polvere e solvente per soluzione iniettabile
Vaccino per il virus respiratorio sinciziale (bivalente, ricombinante)

Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di ricevere questo vaccino perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Abrysvo e a cosa serve
- 2. Cosa deve sapere prima di ricevere Abrysvo
- 3. Come viene somministrato Abrysvo
- 4. Possibili effetti indesiderati
- 5. Come conservare Abrysvo
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Abrysvo e a cosa serve
Abrysvo è un vaccino per prevenire la malattia polmonare (delle vie respiratorie) causata da un virus
chiamato virus respiratorio sinciziale (RSV). Abrysvo viene somministrato a:
- donne in gravidanza per proteggere i loro neonati dalla nascita fino ai 6 mesi di età oppure
- soggetti di età pari o superiore a 18 anni.
Il RSV è un virus comune che, nella maggior parte dei casi, provoca sintomi lievi, simil-influenzali,
come mal di gola, tosse o naso chiuso. Tuttavia, nei bambini piccoli, il RSV può causare gravi
problemi polmonari. Negli anziani e nei soggetti con patologie croniche, il RSV può peggiorare
malattie come la malattia polmonare ostruttiva cronica (BPCO) e l’insufficienza cardiaca congestizia
(ICC). Nei casi più gravi RSV può richiedere il ricovero in ospedale e in alcuni casi può essere fatale.
Come funziona Abrysvo
Questo vaccino aiuta il sistema immunitario (le difese naturali dell’organismo) a produrre anticorpi
(sostanze nel sangue che aiutano l’organismo a combattere le infezioni) che proteggono dalla malattia
polmonare causata dal RSV. Nelle donne in gravidanza che sono state vaccinate tra la 24 e 36
settimana di gravidanza, questi anticorpi vengono trasmessi al neonato attraverso la placenta prima
della nascita, il che lo protegge quando è più a rischio per il RSV.
2. Cosa deve sapere prima di ricevere Abrysvo
Abrysvo non deve esserle somministrato
- se è allergico ai principi attivi o ad uno qualsiasi degli altri componenti di questo vaccino (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima che le venga somministrato questo vaccino
- se in precedenza ha avuto una grave reazione allergica o problemi respiratori dopo aver ricevuto l’iniezione di un qualsiasi altro vaccino o dopo che le è stato somministrato Abrysvo in passato;
- se l’idea di ricevere il vaccino le provoca uno stato di nervosismo o se ha avuto in precedenza uno svenimento dopo un’iniezione. Lo svenimento può verificarsi prima o dopo qualsiasi iniezione;
- se ha un’infezione con febbre alta. In tal caso, la vaccinazione sarà rinviata. Non è necessario rimandare la vaccinazione per un’infezione minore, come un raffreddore, tuttavia, è opportuno rivolgersi al medico;
- se soffre di problemi di sanguinamento o se le si formano lividi con facilità;
- se il suo sistema immunitario è indebolito, il che potrebbe impedirle di ottenere il massimo beneficio da Abrysvo;
- se è in gravidanza da meno di 24 settimane.
Se una delle condizioni descritte sopra si applica a lei (o non è sicuro), parli con il medico, il
farmacista o l’infermiere prima di ricevere Abrysvo.
Come per tutti i vaccini, Abrysvo può non proteggere completamente tutte le persone vaccinate.
Bambini e adolescenti
Abrysvo non è raccomandato nei bambini e nei giovani di età inferiore a 18 anni, tranne che nelle
adolescenti durante la gravidanza (vedere il paragrafo “Gravidanza” di seguito).
Altri medicinali e Abrysvo
Informi il medico o il farmacista se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro
medicinale o se ha recentemente ricevuto un altro vaccino.
Abrysvo può essere somministrato in concomitanza a un vaccino antinfluenzale o un vaccino per il
COVID-19. Si raccomanda un intervallo di almeno due settimane tra la vaccinazione con Abrysvo e
quella con un vaccino per tetano, difterite e pertosse acellulare (pertosse).
Gravidanza e allattamento
Le donne in gravidanza possono ricevere questo vaccino alla fine del secondo o nel terzo trimestre
(settimane da 24 a 36). Se sta allattando al seno chieda consiglio al medico o all’infermiere prima che
le venga somministrato questo vaccino.
Guida di veicoli e utilizzo di macchinari
È improbabile che Abrysvo influenzi la capacità di guidare veicoli o di usare macchinari.
Abrysvo contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente “senza
sodio”.
Abrysvo contiene polisorbato 80
Una dose di Abrysvo contiene 0,08 mg di polisorbato 80. I polisorbati possono causare reazioni
allergiche. Informi il medico se ha una qualsiasi allergia nota.
3. Come viene somministrato Abrysvo
Le verrà somministrata un’iniezione da 0,5 mL in un muscolo della parte superiore del braccio.
Se ha qualsiasi dubbio sull’uso di Abrysvo, si rivolga al medico, al farmacista o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i vaccini, questo vaccino può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Effetti indesiderati gravi
Molto raro(possono interessare fino a 1 persona su 10 000)
- reazioni allergiche gravi: i segni di una reazione allergica grave includono gonfiore del viso, delle labbra, della lingua o della gola, respirazione o deglutizione difficoltosa e capogiro. Vedere anche paragrafo 2.
- sindrome di Guillain-Barré (un disturbo neurologico che di solito inizia con formicolio e debolezza degli arti e può progredire fino alla paralisi di una parte o dell’intero corpo).
Informi immediatamente il medico se nota segni di questi gravi effetti indesiderati.
I seguenti effetti indesiderati sono stati riportati in donne in gravidanza
Molto comune(possono interessare più di 1 persona su 10)
- dolore nel punto in cui viene praticata l’iniezione
- mal di testa
- dolore muscolare (mialgia)
Comune(possono interessare fino a 1 persona su 10)
- arrossamento nel punto in cui viene praticata l’iniezione
- gonfiore nel punto in cui viene praticata l’iniezione
Raro(possono interessare fino a 1 persona su 1 000)
- reazioni allergiche come eruzione cutanea o orticaria
- gonfiore delle ghiandole (linfoadenopatia)
Non sono stati segnalati effetti indesiderati nei neonati nati da madri vaccinate.
I seguenti effetti indesiderati sono stati riportati in soggetti di età pari o superiore a 18 anni
Molto comune(possono interessare più di 1 persona su 10)
- stanchezza
- mal di testa
- dolore nel punto in cui viene praticata l’iniezione
- dolore muscolare (mialgia)
Comune(possono interessare fino a 1 persona su 10)
- dolore articolare (artralgia)
- arrossamento nel punto in cui viene praticata l’iniezione
- gonfiore nel punto in cui viene praticata l’iniezione
Non comune(possono interessare fino a 1 persona su 100)
- febbre (piressia)
Raro(possono interessare fino ad 1 persona su 1 000)
- reazioni allergiche come eruzione cutanea o orticaria
- gonfiore delle ghiandole (linfoadenopatia)
- lividi nel punto in cui viene praticata l’iniezione (ematoma)
- prurito nel punto in cui viene praticata l’iniezione (prurito)
Molto raro(possono interessare fino a 1 persona su 10 000)
- reazioni allergiche gravi (vedere sopra “Effetti indesiderati gravi”)
- sindrome di Guillain-Barré (vedere sopra “Effetti indesiderati gravi”).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Abrysvo
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo
“Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 ºC–8 ºC).
Non congelare. Gettare via se la scatola è stata congelata.
Dopo la ricostituzione Abrysvo deve essere somministrato immediatamente o entro 4 ore se
conservato a una temperatura compresa tra 15 °C e 30 °C. Non congelare.
6. Contenuto della confezione e altre informazioni
Cosa contiene Abrysvo
I principi attivi sono:
Antigene F di prefusione stabilizzato del sottogruppo A del RSV 60 microgrammi
Antigene F di prefusione stabilizzato del sottogruppo B del RSV 60 microgrammi
(Antigeni RSV)
glicoproteina F stabilizzata nella conformazione di prefusione
prodotto nelle cellule ovariche di criceto cinese mediante la tecnologia del DNA ricombinante.
Gli altri componenti sono:
Polvere
- trometamolo
- trometamolo cloridrato
- saccarosio
- mannitolo (E421)
- polisorbato 80 (E433)
- sodio cloruro
- acido cloridrico Solvente
- acqua per preparazioni iniettabili
Descrizione dell’aspetto di Abrysvo e contenuto della confezione
Abrysvo è fornito in forma di:
- una polvere bianca in un flaconcino di vetro
- un solvente per disciogliere la polvere contenuto in una siringa preriempita o in un flaconcino
Dopo aver disciolto la polvere nel solvente, la soluzione risulta trasparente e incolore.
Abrysvo è disponibile nei seguenti formati:
- una scatola contenente 1 flaconcino di polvere, 1 siringa preriempita di solvente e 1 adattatore per flaconcino, con 1 ago o senza aghi (confezione da 1 dose).
- Una scatola contenente 5 flaconcini di polvere, 5 siringhe preriempite di solvente e 5 adattatori per flaconcino, con 5 aghi o senza aghi (confezione da 5 dosi).
- Una scatola contenente 10 flaconcini di polvere, 10 siringhe preriempite di solvente e 10 adattatori per flaconcino, con 10 aghi o senza aghi (confezione da 10 dosi).
- Una scatola contenente 5 flaconcini di polvere e 5 flaconcini di solvente (confezione da 5 dosi).
- Una scatola contenente 10 flaconcini di polvere e 10 flaconcini di solvente (confezione da 10 dosi).
È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgio
Produttore
Pfizer Manufacturing Belgium NV
Rijksweg 12
2870 Puurs-Sint-Amands
Belgio
Pfizer Ireland Pharmaceuticals
Grange Castle Business Park
Clondalkin, Dublin 22
Irlanda
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
Lietuva
Pfizer Luxembourg SARL
filialas Lietuvoje
Tel: +370 5 251 4000
België/Belgique/Belgien
Luxembourg/Luxemburg
Pfizer NV/SA
Tél/Tel: + 32 (0)2 554 62 11
България
Пфайзер Люксембург САРЛ,
Клон България
Teл: +359 2 970 4333
Magyarország
Pfizer Kft
Tel: + 36 1 488 37 00
Česká republika
Pfizer, spol. s r.o.
Tel: +420 283 004 111
Malta
Vivian Corporation Ltd.
Tel: + 356 21344610
Danmark
Pfizer ApS
Tlf: + 45 44 20 11 00
Nederland
Pfizer bv
Tel: +31 (0)800 63 34 636
Deutschland
PFIZER PHARMA GmbH
Tel: +49 (0)30 550055-51000
Norge
Pfizer AS
Tlf: +47 67 52 61 00
Eesti
Pfizer Luxembourg SARL Eesti
filiaal
Tel: +372 666 7500
Österreich
Pfizer Corporation Austria
Ges.m.b.H
Tel: +43 (0)1 521 15-0
Ελλάδα
Pfizer Ελλάς A.E.
Τηλ.: +30 210 6785800
Polska
Pfizer Polska Sp. z o.o.
Tel.: +48 22 335 61 00
España
Pfizer, S.L.
Télf: +34 91 490 99 00
Portugal
Laboratórios Pfizer, Lda.
Tel: +351 21 423 5500
France
Pfizer
Tél +33 (0)1 58 07 34 40
România
Pfizer Romania S.R.L
Tel: +40 (0) 21 207 28 00
Hrvatska
Pfizer Croatia d.o.o.
Tel: + 385 1 3908 777
Slovenija
Pfizer Luxembourg SARL
Pfizer, podružnica za
svetovanje s področja
farmacevtske dejavnosti,
Ljubljana
Tel.: +386 (0)1 52 11 400
Ireland
Pfizer Healthcare Ireland Unlimited
Company
Tel: +1800 633 363 (toll free)
Tel: +44 (0)1304 616161
Slovenská republika
Pfizer Luxembourg SARL,
organizačná zložka
Tel: + 421 2 3355 5500
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 430 040
Ísland
Icepharma hf.
Simi: + 354 540 8000
Italia
Pfizer S.r.l.
Tel: +39 06 33 18 21
Sverige
Pfizer AB
Tel: +46 (0)8 550 520 00
Kύπρος
Pfizer Ελλάς Α.Ε. (Cyprus Branch)
Tηλ: +357 22817690
United Kingdom (Northern
Ireland)
Pfizer Limited
Tel: + 44 (0) 1304 616161
Latvija
Pfizer Luxembourg SARL filiāle
Latvijā
Tel.: + 371 670 35 775
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Somministrazione
Abrysvo è solo per uso intramuscolare.
Il flaconcino non aperto è stabile per 5 giorni se conservato a temperature comprese tra 8 °C e 30 °C.
Al termine di questo periodo Abrysvo deve essere adoperato o smaltito. Queste informazioni
costituiscono delle linee guida per gli operatori sanitari solo in caso di escursioni termiche temporanee.
Conservazione del vaccino ricostituito
Abrysvo deve essere adoperato immediatamente dopo la ricostituzione o entro 4 ore. Conservare il
vaccino ricostituito a una temperatura compresa tra 15 ºC e 30 ºC. Non congelare il vaccino
ricostituito.
La stabilità chimica e fisica durante l’uso è stata dimostrata per 4 ore a una temperatura compresa tra
15 °C e 30 °C. Da un punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente.
In caso contrario, i tempi e le condizioni di conservazione prima dell’uso sono responsabilità
dell’utilizzatore.
Preparazione per la somministrazione
Per l’uso del flaconcino di antigeni per Abrysvo (polvere), siringa preriempita di solvente e adattatore
per flaconcino
La polvere deve essere ricostituita unicamente con il solvente in dotazione nella siringa preriempita
utilizzando l’adattatore per flaconcino.
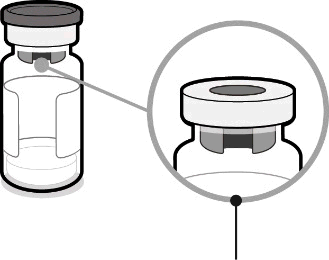
Flaconcino contenente gli
antigeni per Abrysvo
(polvere)
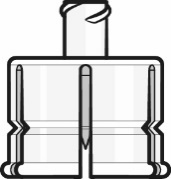
Adattatore
per
flaconcino
Siringa preriempita contenente il solvente per
Abrysvo
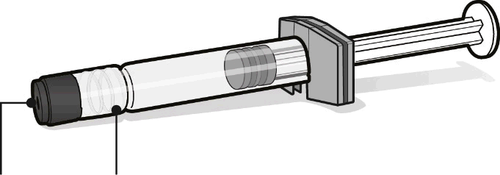
Cappuccio
della
siringa
Adattatore Luer Lock Tappo del flaconcino (con cappuccio
rimovibile rimosso)
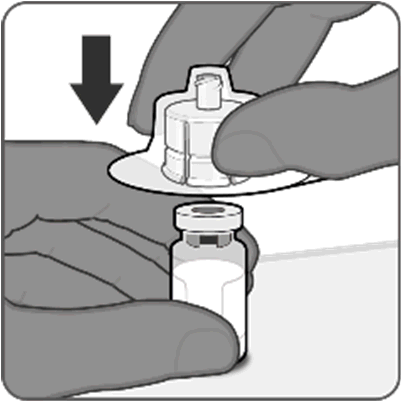
Punto 1. Collegare l’adattatore per flaconcino
- Staccare la copertura superiore dalla confezione dell’adattatore per flaconcino e rimuovere il cappuccio rimovibile dal flaconcino.
- Mantenendo l’adattatore per flaconcino nella sua confezione, centrarlo sul tappo del flaconcino e collegarlo spingendo verso il basso. Non spingere l’adattatore per flaconcino inclinato in quanto si possono verificare perdite. Rimuovere la confezione.
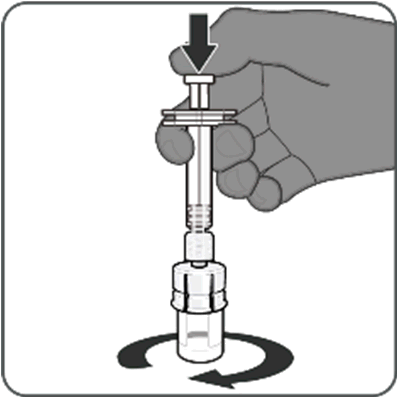
Punto 2. Ricostituire il componente in polvere (antigeni) per preparare Abrysvo
- Per tutte le fasi di assemblaggio della siringa, tenere la siringa solo dall’adattatore Luer Lock in modo da impedirne il distacco durante l’uso.
- Ruotare il cappuccio della siringa per rimuoverlo, poi continuare a ruotare per collegare la siringa all’adattatore per flaconcino. Smettere di ruotare quando si avverte una resistenza.
- Iniettare l’intero contenuto della siringa nel flaconcino. Tenere premuto lo stantuffo e ruotare delicatamente il flaconcino fino a quando la polvere non si sarà completamente disciolta. Non agitare.
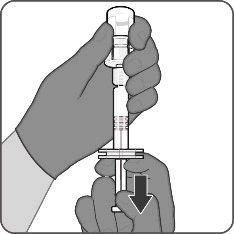
Punto 3. Prelevare il vaccino ricostituito
- Capovolgere completamente il flaconcino e prelevare lentamente l’intero contenuto nella siringa per garantire una dose di Abrysvo da 0,5 mL.
- Ruotare per scollegare la siringa dall’adattatore per flaconcino.
- Collegare un ago sterile adatto per l’iniezione intramuscolare.
Il vaccino preparato si presenta come una soluzione limpida e incolore. Prima della somministrazione
ispezionare visivamente il vaccino per escludere la presenza di particolato di grandi dimensioni e
alterazioni del colore. Non utilizzare se si riscontra una di queste caratteristiche.
Per l’uso del flaconcino di antigeni per Abrysvo (polvere) e del flaconcino di solvente
La polvere deve essere ricostituita unicamente con il flaconcino di solvente in dotazione.
- 1. Con un ago e una siringa sterili, prelevare l’intero contenuto del flaconcino contenente il solvente e iniettare l’intero contenuto della siringa nel flaconcino contenente la polvere.
- 2. Ruotare delicatamente il flaconcino con un movimento circolare fino a quando la polvere non si sarà completamente disciolta. Non agitare.
- 3. Prelevare 0,5 mL dal flaconcino contenente il vaccino ricostituito.
Il vaccino preparato si presenta come una soluzione limpida e incolore. Prima della somministrazione
ispezionare visivamente il vaccino per escludere la presenza di particolato di grandi dimensioni e
alterazioni del colore. Non utilizzare se si riscontra una di queste caratteristiche.
Smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
ALLEGATO IV
CONCLUSIONI RELATIVE ALLA RICHIESTA DI PROTEZIONE DELLA PROPRIETA’
COMMERCIALE CON VALIDITA’ ANNUALE PRESENTATA DALL’AGENZIA
EUROPEA PER I MEDICINALI
Conclusioni presentate dall’Agenzia europea per i medicinali su:
- protezione della proprietà commerciale della durata di un anno
Tenendo conto delle disposizioni contenute nell’articolo 14(11) del Regolamento 726/2004/CE, il
Comitato dei medicinali per uso umano ( Committee for Human Medicinal Products,CHMP) ha
esaminato i dati presentati dal titolare dell’autorizzazione all’immissione in commercio, e ritiene che
la nuova indicazione terapeutica apporti un beneficio clinico rilevante rispetto alle terapie attualmente
esistenti, come ulteriormente descritto nella relazione pubblica di valutazione europea ( European
Public Assessment Report, EPAR).
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a ABRYSVOForma farmaceutica: Polvere e sospensione per sospensione iniettabile, 0,5 mlPrincipio attivo: respiratory syncytial virus vaccinesProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiestaForma farmaceutica: Dispersione per preparazione iniettabile, 50 mcgPrincipio attivo: respiratory syncytial virus vaccinesProduttore: MODERNA BIOTECH SPAIN, S.L.Prescrizione richiestaForma farmaceutica: Sospensione iniettabile, 0,5 MLPrincipio attivo: smallpox and monkeypox vaccinesProduttore: BAVARIAN NORDIC A/SPrescrizione non richiesta
Medici online per ABRYSVO
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di ABRYSVO — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














