ADYNOVI

Come usare ADYNOVI
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- ADYNOVI 250 UI / 5 mL polvere e solvente per soluzione iniettabile, 500 UI / 5 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 2 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 3 000 UI / 5 mL polvere e solvente per soluzione iniettabile
- ADYNOVI 250 UI / 5 mL polvere e solvente per soluzione iniettabile, 500 UI / 5 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 2 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 3 000 UI / 5 mL polvere e solvente per soluzione iniettabile
- ADYNOVI 250 UI / 2 mL polvere e solvente per soluzione iniettabile, 500 UI / 2 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 2 mL polvere e solvente per soluzione iniettabile
- ADYNOVI 250 UI / 2 mL polvere e solvente per soluzione iniettabile, 500 UI / 2 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 2 mL polvere e solvente per soluzione iniettabile
ADYNOVI 250 UI / 5 mL polvere e solvente per soluzione iniettabile, 500 UI / 5 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 2 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 3 000 UI / 5 mL polvere e solvente per soluzione iniettabile
rurioctocog alfa pegol (fattore VIII della coagulazione umano ricombinante peghilato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia mai ad altri. anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos’è ADYNOVI e a cosa serve
- 2. Cosa deve sapere prima di usare ADYNOVI
- 3. Come usare ADYNOVI
- 4. Possibili effetti indesiderati
- 5. Come conservare ADYNOVI
- 6. Contenuto della confezione e altre informazioni
1. Cos’è ADYNOVI e a cosa serve
ADYNOVI contiene il principio attivo rurioctocog alfa pegol, il fattore VIII della coagulazione umano
peghilato. Il fattore VIII della coagulazione umano è stato modificato per prolungare la sua durata
d'azione. Il fattore VIII è necessario affinché il sangue coaguli e fermi i sanguinamenti. Nei pazienti
affetti da emofilia A (mancanza congenita del fattore VIII) esso non è presente o non agisce
correttamente.
ADYNOVI viene utilizzato per il trattamento e la prevenzione del sanguinamento nei pazienti dai 12
anni di età affetti da emofilia A (un disturbo ereditario della coagulazione causato da una mancanza di
fattore VIII).
2. Cosa deve sapere prima di usare ADYNOVI
Non usi ADYNOVI:
- se è allergico a rurioctocog alfa pegol, a octocog alfa o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se è allergico alle proteine di topo o di criceto
Se ha dei dubbi a riguardo, si rivolga al medico.
Avvertenze e precauzioni
È importante tenere traccia del numero di lotto di ADYNOVI. Quindi, ogni volta che prende una
nuova confezione di ADYNOVI, annoti la data e il numero di lotto (che si trova sulla confezione dopo
“Lotto”) conservi queste informazioni in un luogo sicuro.
Si rivolga al medico prima di usare ADYNOVI.
Esiste un raro rischio che lei possa sviluppare una reazione anafilattica (una reazione allergica
improvvisa e grave) ad ADYNOVI. Deve essere a conoscenza dei segni iniziali delle reazioni
allergiche, come eruzione cutanea, orticaria, pomfi, prurito generalizzato, gonfiore delle labbra e della
lingua, difficoltà di respirazione, respiro sibilante, costrizione toracica, sentirsi poco bene e capogiro.
Questi potrebbero essere sintomi iniziali di shock anafilattico; altre manifestazioni possono includere
capogiro forte, perdita di coscienza ed estrema difficoltà di respirazione.
In presenza di uno qualsiasi di questi sintomi, interrompa immediatamente l'iniezione e si rivolga al
medico. Sintomi gravi, compresi difficoltà a respirare e svenimento (o la sensazione di svenimento)
richiedono un immediato trattamento di emergenza.
Se soffre di una malattia del cuore informi il medico perché vi è un rischio più elevato di
complicazioni della coagulazione del sangue.
Pazienti che sviluppano inibitori del fattore VIII
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento
con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al
trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per
verificare lo sviluppo di questi inibitori. Se ADYNOVI non mantiene sotto controllo l’emorragia sua o
di suo figlio, informi il medico immediatamente.
Complicanze da catetere
Se ha bisogno di un dispositivo di accesso venoso centrale (CVAD, central venous access device), si
deve considerare il rischio di complicanze legate al CVAD, comprese infezioni locali, la presenza di
batteri nel sangue e la trombosi della sede del catetere.
Bambini e adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Le avvertenze e
le precauzioni elencate si applicano anche agli adolescenti.
Altri medicinali e ADYNOVI
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale. L’emofilia A si verifica
solo raramente nelle donne. Non è dunque disponibile alcuna esperienza sull’uso di ADYNOVI
durante la gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
ADYNOVI non altera o altera in modo trascurabile la capacità di guidare veicoli o di utilizzare
macchinari.
ADYNOVI contiene sodio
Questo medicinale contiene fino a 12,42 mg di sodio (componente principale del sale da cucina) per
flaconcino. Questo equivale a 0,62% dell’assunzione massima giornaliera raccomandata con la dieta di
un adulto. A seconda del suo peso corporeo e della dose di ADYNOVI, è possibile che le vengano
somministrati più flaconcini. Questo deve essere preso in considerazione se segue una dieta a basso
contenuto di sale.
3. Come usare ADYNOVI
Il trattamento con ADYNOVI deve essere iniziato e supervisionato da un medico con esperienza nella
cura dei pazienti affetti da emofilia A.
Il medico calcolerà la sua dose di ADYNOVI in base alla sua condizione, al suo peso e alla finalità per
cui viene usato, cioè prevenzione o trattamento del sanguinamento. La frequenza della
somministrazione dipenderà da quanto sarà efficace ADYNOVI nel suo caso. In genere la terapia
sostitutiva con ADYNOVI è un trattamento che dura per tutta la vita.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico.
Prevenzione del sanguinamento
La dose normale di ADYNOVI varia da 40 a 50 UI per kg di peso corporeo, somministrato 2 volte alla
settimana.
Trattamento del sanguinamento
La dose di ADYNOVI è calcolata in base al peso corporeo e ai livelli di fattore VIII che si devono
raggiungere. I livelli del fattore VIII da raggiungere dipendono dalla gravità e dalla sede del
sanguinamento.
Se ritiene che l'effetto di ADYNOVI sia insufficiente, si rivolga al medico.
Il medico eseguirà gli esami di laboratorio necessari per verificare se i suoi livelli di fattore VIII sono
adeguati. Ciò è particolarmente importante se Lei sarà sottoposto a un intervento di chirurgia
maggiore.
Uso nei bambini e negli adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Anche negli
adolescenti la dose viene calcolata in base al peso corporeo ed è la stessa usata per gli adulti.
Come si somministra ADYNOVI
ADYNOVI in genere è iniettato in una vena (via endovenosa) dal medico o dall'infermiere.
ADYNOVI può essere somministrato anche da lei o da un’altra persona per iniezione, ma solo dopo
dettagliate per l'autosomministrazione.
Se usa più ADYNOVI di quanto deve
Usi ADYNOVI seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il suo
medico. Se inietta più ADYNOVI della quantità raccomandata, contatti il medico appena possibile.
Se dimentica di usare ADYNOVI
Non inietti una dose doppia per compensare la dimenticanza della dose. Proceda con l’iniezione
successiva programmata e continui secondo le istruzioni del medico.
Se interrompe il trattamento con ADYNOVI
Non interrompa l’uso di ADYNOVI senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Qualora si verificasse una reazione allergica improvvisa e grave(reazione anafilattica), interrompa
immediatamentel'iniezione. Si rivolga immediatamente al medico, se manifesta uno qualsiasi dei
seguenti sintomi iniziali di reazioni allergiche:
- eruzione cutanea, orticaria, pomfi, prurito generalizzato,
- gonfiore delle labbra e della lingua,
- difficoltà di respirazione, respiro sibilante, costrizione toracica,
- sentirsi poco bene,
- capogiro e perdita di coscienza.
Sintomi gravi, compresi difficoltà respiratoria e svenimento (o la sensazione di svenimento),
richiedono un immediato trattamento di emergenza.
Per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di
trattamento) possono formarsi anticorpi inibitori (vedere paragrafo 2) con frequenza non comune
(meno di 1 paziente su 100). Se ciò accade il medicinale potrebbe smettere di agire correttamente e lei
potrebbe riscontrare un sanguinamento persistente. Se ciò accade, deve contattare il medico
immediatamente.
Effetti indesiderati molto comuni(possono colpire più di 1 persona su 10)
Mal di testa
Effetti indesiderati comuni(possono colpire fino a 1 persona su 10)
Nausea
Diarrea
Euzione cutanea
Capogiri
Orticaria
Effetti indesiderati non comuni(possono colpire fino a 1 persona su 100)
Rossore, reazione allergica (ipersensibilità)
Inibitori del fattore VIII (per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII
(più di 150 giorni di trattamento))
Aumento di qualche tipo di globuli bianchi
Reazione all’infusione
Occhi rossi
Reazione cutanea avversa da farmaco
Effetti indesiderati con frequenza non nota(la frequenza non può essere definita sulla base dei dati
disponibili)
Reazioni potenzialmente rischiose per la vita (anafilassi)
Effetti indesiderati aggiuntivi nei bambini
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelli
negli adulti.
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico o all'infermiere. Può inoltre
segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato
nell' allegato V . Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare ADYNOVI
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all'ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C)
Non congelare.
Tenere il flaconcino nell'imballaggio esterno per proteggere il medicinale dalla luce.
Durante il periodo di validità il flaconcino di polvere può essere conservato a temperatura ambiente
(fino a un massimo di 30 °C) per un singolo periodo che non deve superare i 3 mesi. In tal caso il
medicinale scadrà al termine di questo periodo di 3 mesi o alla data di scadenza stampata sul
flaconcino del prodotto, qualunque evento si verifichi per primo. Registrare il termine del periodo di 3
mesi a temperatura ambiente sulla scatola del prodotto. Il prodotto non può essere conservato di nuovo
nel frigorifero dopo averlo conservato a temperatura ambiente. Non refrigerare la soluzione dopo la
preparazione.
Utilizzare il prodotto entro 3 ore dalla completa dissoluzione della polvere.
Il prodotto è esclusivamente monouso. Smaltire appropriatamente la soluzione non utilizzata.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene ADYNOVI
- Il principio attivo è rurioctocog alfa pegol (fattore VIII della coagulazione umano peghilato prodotto con la tecnologia del DNA ricombinante). Ogni flaconcino di polvere contiene nominalmente 250, 500, 1 000, 2 000, o 3 000 UI di rurioctocog alfa pegol.
- Il flaconcino di solvente contiene 5 mL di acqua per preparazioni iniettabili.
- Gli altri componenti sono mannitolo, trealosio diidrato, istidina, glutatione, cloruro di sodio, cloruro di calcio diidrato, tris(idrossimetil)aminometano e polisorbato 80. Vedere paragrafo 2 “ADYNOVI contiene sodio”.
Descrizione dell'aspetto di ADYNOVI e contenuto della confezione
ADYNOVI viene fornito sotto forma di polvere e solvente per soluzione iniettabile (polvere per
soluzione iniettabile). La polvere è una polvere friabile da bianca a biancastra. Il solvente è una
soluzione limpida e incolore. Dopo la ricostituzione la soluzione appare limpida, incolore e priva di
corpi estranei.
Ogni confezione contiene un flaconcino di polvere, un flaconcino di solvente e un dispositivo per la
ricostituzione (BAXJECT II Hi-Flow).
Titolare dell'autorizzazione all'immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Vienna
Produttore
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Τakeda HELLAS S.A.
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell'Agenzia europea
per i medicinali: http://www.ema.europa.eu/
Istruzioni per la preparazione e la somministrazione
Per la preparazione della soluzione utilizzare solo il solvente e il dispositivo di ricostituzione forniti
con ogni confezione di ADYNOVI. La polvere non deve essere miscelata con altri medicinali o
solventi o utilizzata con altri dispositivi di ricostituzione.
Ogni volta che viene somministrato ADYNOVI, si raccomanda vivamente di registrare il nome e il
numero di lotto del prodotto. Il flaconcino di polvere è fornito di etichette staccabili.
Istruzioni per la ricostituzione
- Non utilizzare dopo la data di scadenza riportata sull'etichetta e sulla scatola.
- Non utilizzare, se il dispositivo BAXJECT II Hi-Flow, la sua barriera sterile o la sua confezione sono danneggiati o mostrano segni di deterioramento.
- 1. Durante la procedura di ricostituzione utilizzare una tecnica antisettica (condizioni di pulizia e bassissimo contenuto di germi) e una superficie di lavoro piatta.
- 2. Prima dell’uso lasciare che tutti i flaconcini di polvere e di solvente raggiungano la temperatura ambiente (tra 15 °C e 25 °C).
- 3. Togliere la capsula di chiusura di plastica dai flaconcini di polvere e di solvente.
- 4. Pulire i tappi di gomma con un tampone imbevuto d'alcol e lasciarli asciugare prima di utilizzarli.
- 5. Aprire la confezione del dispositivo BAXJECT II Hi-Flow togliendo la parte superiore senza toccare la parte interna (Figura A). Non estrarre il dispositivo dalla confezione.
- 6. Capovolgere la confezione. Premere verticalmente verso il basso per inserire completamente la punta di plastica trasparente attraverso il tappo del flaconcino di solvente (Figura B).
- 7. Afferrare il bordo della confezione del BAXJECT II Hi-Flow e allontanare la confezione dal dispositivo (Figura C). Non togliere la capsula di chiusura blu dal dispositivo BAXJECT II Hi- Flow. Non toccare la punta di plastica viola esposta.
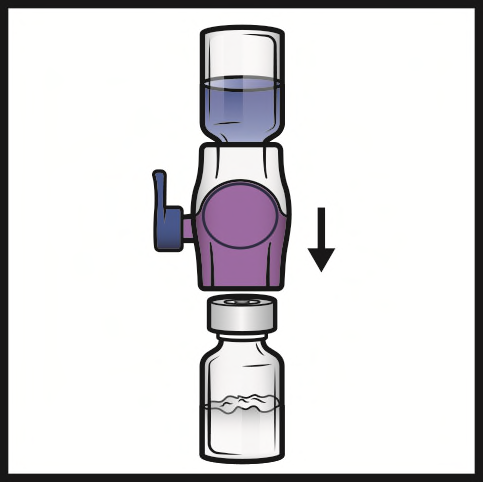
- 8. Capovolgere il sistema in modo che il flaconcino di solvente sia in alto. Inserire rapidamente e completamente la punta di plastica viola nel tappo del flaconcino di polvere premendo verticalmente verso il basso (Figura D). Il vuoto aspirerà il solvente nel flaconcino di polvere.
- 9. Agitare delicatamente fino alla completa dissoluzione della polvere. Non refrigerare dopo la ricostituzione.
Figura AFigura BFigura C
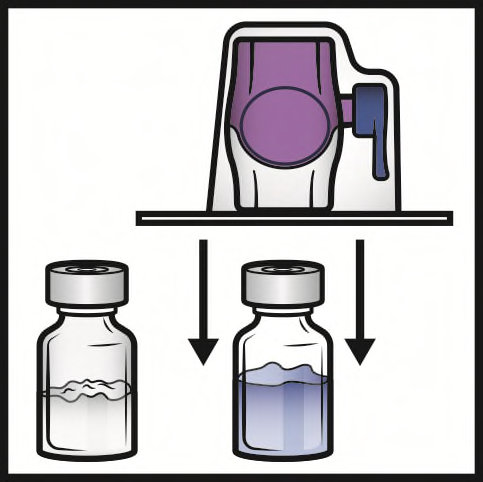
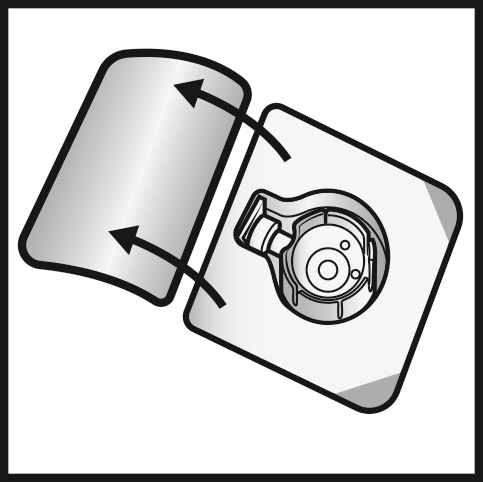
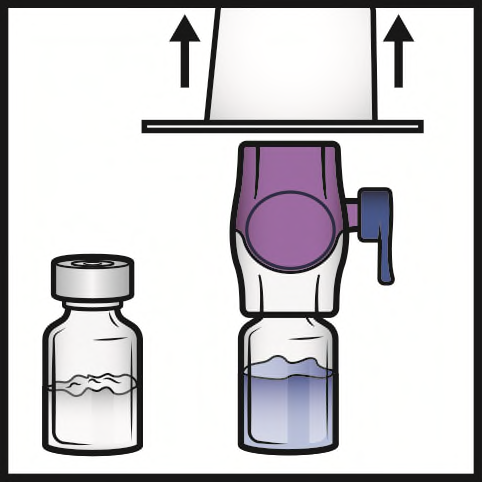
Figura DFigura EFigura F
Istruzioni per l'iniezione.
Nota importante:
- Prima della somministrazione ispezionare la soluzione preparata per rilevare l'eventuale presenza di particolato e alterazione del colore (la soluzione deve essere limpida, incolore e priva di particelle).
Non utilizzare ADYNOVI se la soluzione non è completamente limpida o dissolta.
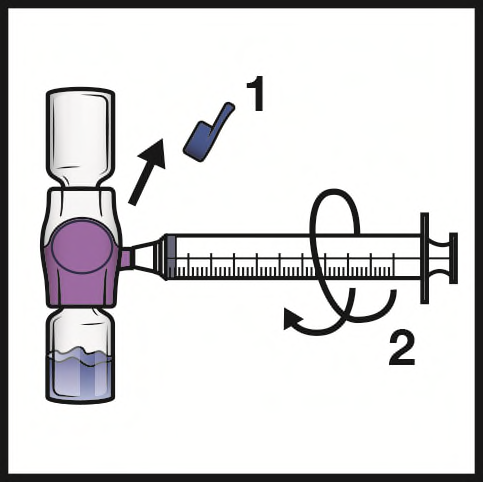
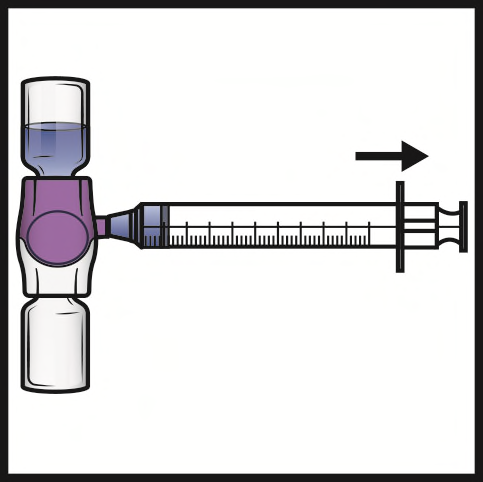
- 1. Togliere la capsula di chiusura blu dal dispositivo BAXJECT II Hi-Flow (Figura E). Nonaspirare aria nella siringa.Collegare la siringa al dispositivo BAXJECT II Hi-Flow. Si consiglia di utilizzare una siringa Luer-lock.
- 2. Capovolgere il sistema (il flaconcino di polvere ora si trova in alto). Aspirare la soluzione ricostituita nella siringa tirando lentamente indietro lo stantuffo (Figura F).
- 3. Scollegare la siringa; attaccare un ago idoneo e iniettare per via endovenosa. Se un paziente deve ricevere più di un flaconcino di ADYNOVI, il contenuto di più flaconcini può essere prelevato nella stessa siringa. Per ricostituire ogni flaconcino di ADYNOVI con il solvente, si deve utilizzare un dispositivo BAXJECT II Hi-Flow separato.
- 4. Somministrare per un periodo di tempo non superiore a 5 minuti (velocità massima di infusione 10 mL/min).
- 5. Smaltire appropriatamente la soluzione non utilizzata.
-------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Trattamento al bisogno
Nell’eventualità dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto
del livello di attività plasmatica determinato (in % del valore normale o in UI/dL) nel periodo
corrispondente. La seguente tabella può essere utilizzata come riferimento per il dosaggio negli
episodi di sanguinamento e negli interventi chirurgici.
Tabella 1: Guida per il dosaggio negli episodi di sanguinamento e negli interventi chirurgici
| Grado di emorragia/Tipo di procedura chirurgica | n Livello di fattore VIII necessario (% o UI/dL) | Frequenza delle dosi (ore)/durata della terapia (giorni) |
| Emorragia Emartrosi precoce, sanguinamento muscolare o del cavo orale. Emartrosi più estesa, sanguinamento muscolare o a ematoma i Emorragie potenzialmente letali. | a i
| Ripetere le iniezioni ogni 12 – 24 ore. Almeno 1 giorno, fino alla risoluzione dell’episodio di sanguinamento, indicato dal dolore, o al raggiungimento della guarigione. Ripetere le iniezioni ogni 12 – 24 ore per 3 – 4 giorni o più fino alla risoluzione del dolore e della disabilità acuta. Ripetere le iniezioni ogni 8 – 24 ore fino alla risoluzione della minaccia. |
| z n Intervento chirurgico Minore e Compresa estrazione dentaria. g Maggiore A |
| Ogni 24 ore almeno 1 giorno, fino alla guarigione. Ripetere le iniezioni ogni 8 – 24 ore fino a un’adeguata guarigione della ferita, quindi proseguire la terapia per almeno altri 7 giorni per mantenere un’attività del fattore VIII tra il 30% e il 60% (UI/dL). |
Profilassi
Per la profilassi a lungo termine, la dose raccomandata è di 40 – 50 UI di ADYNOVI per
chilogrammo di peso corporeo due volte alla settimana con intervalli di 3 – 4 giorni.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
Popolazione pediatrica
Il dosaggio del trattamento al bisogno nei pazienti pediatrici (da 12 a 18 anni) è lo stesso dei pazienti
adulti. Il trattamento profilattico per i pazienti da 12 anni a < 18 anni è lo stesso dei pazienti adulti. La
sicurezza a lungo termine di ADYNOVI nei bambini al di sotto dei 12 anni non è stata ancora stabilita.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
ADYNOVI 250 UI / 5 mL polvere e solvente per soluzione iniettabile, 500 UI / 5 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 2 000 UI / 5 mL polvere e solvente per soluzione iniettabile, 3 000 UI / 5 mL polvere e solvente per soluzione iniettabile
rurioctocog alfa pegol (fattore VIII della coagulazione umano ricombinante peghilato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia mai ad altri. anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è ADYNOVI e a cosa serve
- 2. Cosa deve sapere prima di usare ADYNOVI
- 3. Come usare ADYNOVI
- 4. Possibili effetti indesiderati
- 5. Come conservare ADYNOVI
- 6. Contenuto della confezione e altre informazioni
1. Cos’è ADYNOVI e a cosa serve
ADYNOVI contiene il principio attivo rurioctocog alfa pegol, il fattore VIII della coagulazione umano
peghilato. Il fattore VIII della coagulazione umano è stato modificato per prolungare la sua durata
d'azione. Il fattore VIII è necessario affinché il sangue coaguli e fermi i sanguinamenti. Nei pazienti
affetti da emofilia A (mancanza congenita del fattore VIII) esso non è presente o non agisce
correttamente.
ADYNOVI viene utilizzato per il trattamento e la prevenzione del sanguinamento nei pazienti dai 12
anni di età affetti da emofilia A (un disturbo ereditario della coagulazione causato da una mancanza di
fattore VIII).
2. Cosa deve sapere prima di usare ADYNOVI
Non usi ADYNOVI
- se è allergico a rurioctocog alfa pegol, a octocog alfa o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se è allergico alle proteine di topo o di criceto
Se ha dei dubbi a riguardo, si rivolga al medico.
Avvertenze e precauzioni
È importante tenere traccia del numero di lotto di ADYNOVI. Quindi, ogni volta che prende una
nuova confezione di ADYNOVI, annoti la data e il numero di lotto (che si trova sulla confezione dopo
“Lotto”) conservi queste informazioni in un luogo sicuro.
Si rivolga al medico prima di usare ADYNOVI.
Esiste un raro rischio che lei possa sviluppare una reazione anafilattica (una reazione allergica
improvvisa e grave) ad ADYNOVI. Deve essere a conoscenza dei segni iniziali delle reazioni
allergiche, come eruzione cutanea, orticaria, pomfi, prurito generalizzato, gonfiore delle labbra e della
lingua, difficoltà di respirazione, respiro sibilante, costrizione toracica, sentirsi poco bene e capogiro.
Questi potrebbero essere sintomi iniziali di shock anafilattico; altre manifestazioni possono includere
capogiro forte, perdita di coscienza ed estrema difficoltà di respirazione.
In presenza di uno qualsiasi di questi sintomi, interrompa immediatamente l'iniezione e si rivolga al
medico. Sintomi gravi, compresi difficoltà a respirare e svenimento (o la sensazione di svenimento)
richiedono un immediato trattamento di emergenza.
Se soffre di una malattia del cuore informi il medico perché vi è un rischio più elevato di
complicazioni della coagulazione del sangue.
Pazienti che sviluppano inibitori del fattore VIII
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento
con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al
trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per
verificare lo sviluppo di questi inibitori. Se ADYNOVI non mantiene sotto controllo l’emorragia sua o
di suo figlio, informi il medico immediatamente.
Complicanze da catetere
Se ha bisogno di un dispositivo di accesso venoso centrale (CVAD, central venous access device), si
deve considerare il rischio di complicanze legate al CVAD, comprese infezioni locali, la presenza di
batteri nel sangue e la trombosi della sede del catetere.
Bambini e adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Le avvertenze e
le precauzioni elencate si applicano anche agli adolescenti.
Altri medicinali e ADYNOVI
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale. L’emofilia A si verifica
solo raramente nelle donne. Non è dunque disponibile alcuna esperienza sull’uso di ADYNOVI
durante la gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
ADYNOVI non altera o altera in modo trascurabile la capacità di guidare veicoli o di utilizzare
macchinari.
ADYNOVI contiene sodio
Questo medicinale contiene fino a 12,42 mg di sodio (componente principale del sale da cucina) per
flaconcino. Questo equivale a 0,62% dell’assunzione massima giornaliera raccomandata con la dieta di
un adulto. A seconda del suo peso corporeo e della dose di ADYNOVI, è possibile che le vengano
somministrati più flaconcini. Questo deve essere preso in considerazione se segue una dieta a basso
contenuto di sale.
3. Come usare ADYNOVI
Il trattamento con ADYNOVI deve essere iniziato e supervisionato da un medico con esperienza nella
cura dei pazienti affetti da emofilia A.
Il medico calcolerà la sua dose di ADYNOVI in base alla sua condizione, al suo peso e alla finalità per
cui viene usato, cioè prevenzione o trattamento del sanguinamento. La frequenza della
somministrazione dipenderà da quanto sarà efficace ADYNOVI nel suo caso. In genere la terapia
sostitutiva con ADYNOVI è un trattamento che dura per tutta la vita.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico.
Prevenzione del sanguinamento
La dose normale di ADYNOVI varia da 40 a 50 UI per kg di peso corporeo, somministrato 2 volte alla
settimana.
Trattamento del sanguinamento
La dose di ADYNOVI è calcolata in base al peso corporeo e ai livelli di fattore VIII che si devono
raggiungere. I livelli del fattore VIII da raggiungere dipendono dalla gravità e dalla sede del
sanguinamento.
Se ritiene che l'effetto di ADYNOVI sia insufficiente, si rivolga al medico.
Il medico eseguirà gli esami di laboratorio necessari per verificare se i suoi livelli di fattore VIII sono
adeguati. Ciò è particolarmente importante se Lei sarà sottoposto a un intervento di chirurgia
maggiore.
Uso nei bambini e negli adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Anche negli
adolescenti la dose viene calcolata in base al peso corporeo ed è la stessa usata per gli adulti.
Come si somministra ADYNOVI
ADYNOVI in genere è iniettato in una vena (via endovenosa) dal medico o dall'infermiere.
ADYNOVI può essere somministrato anche da lei o da un’altra persona per iniezione, ma solo dopo
dettagliate per l'autosomministrazione.
Se usa più ADYNOVI di quanto deve
Usi ADYNOVI seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il suo
medico. Se inietta più ADYNOVI della quantità raccomandata, contatti il medico appena possibile.
Se dimentica di usare ADYNOVI
Non inietti una dose doppia per compensare la dimenticanza della dose. Proceda con l’iniezione
successiva programmata e continui secondo le istruzioni del medico.
Se interrompe il trattamento con ADYNOVI
Non interrompa l’uso di ADYNOVI senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Qualora si verificasse una reazione allergica improvvisa e grave(reazione anafilattica), interrompa
immediatamentel'iniezione. Si rivolga immediatamente al medico, se manifesta uno qualsiasi dei
seguenti sintomi iniziali di reazioni allergiche:
- eruzione cutanea, orticaria, pomfi, prurito generalizzato,
- gonfiore delle labbra e della lingua,
- difficoltà di respirazione, respiro sibilante, costrizione toracica,
- sentirsi poco bene,
- capogiro e perdita di coscienza.
Sintomi gravi, compresi difficoltà respiratoria e svenimento (o la sensazione di svenimento),
richiedono un immediato trattamento di emergenza.
Per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di
trattamento) possono formarsi anticorpi inibitori (vedere paragrafo 2) con frequenza non comune
(meno di 1 paziente su 100). Se ciò accade il medicinale potrebbe smettere di agire correttamente e lei
potrebbe riscontrare un sanguinamento persistente. Se ciò accade, deve contattare il medico
immediatamente.
Effetti indesiderati molto comuni(possono colpire più di 1 persona su 10)
Mal di testa
Effetti indesiderati comuni(possono colpire fino a 1 persona su 10)
Nausea
Diarrea
Eruzione cutanea
Capogiri
Orticaria
Effetti indesiderati non comuni(possono colpire fino a 1 persona su 100)
Rossore, reazione allergica (ipersensibilità)
Inibitori del fattore VIII (per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII
(più di 150 giorni di trattamento))
Aumento di qualche tipo di globuli bianchi
Reazione all’infusione
Occhi rossi
Reazione cutanea avversa da farmaco
Effetti indesiderati con frequenza non nota(la frequenza non può essere definita sulla base dei dati
disponibili)
Reazioni potenzialmente rischiose per la vita (anafilassi)
Effetti indesiderati aggiuntivi nei bambini
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelli
negli adulti.
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico o all'infermiere. Può inoltre
segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato
nell’allegato V. Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare ADYNOVI
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all'ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C)
Non congelare.
Tenere il blister nell'imballaggio esterno per proteggere il medicinale dalla luce.
Durante il periodo di validità il flaconcino di polvere può essere conservato a temperatura ambiente
(fino a un massimo di 30 °C) per un singolo periodo che non deve superare i 3 mesi. In tal caso il
medicinale scadrà al termine di questo periodo di 3 mesi o alla data di scadenza stampata sul
flaconcino del prodotto, qualunque evento si verifichi per primo. Registrare il termine del periodo di 3
mesi a temperatura ambiente sulla scatola del prodotto. Il prodotto non può essere conservato di nuovo
nel frigorifero dopo averlo conservato a temperatura ambiente. Non refrigerare la soluzione dopo la
preparazione.
Utilizzare il prodotto entro 3 ore dalla completa dissoluzione della polvere.
Il prodotto è esclusivamente monouso. Smaltire appropriatamente la soluzione non utilizzata.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene ADYNOVI
- Il principio attivo è rurioctocog alfa pegol (fattore VIII della coagulazione umano peghilato prodotto con la tecnologia del DNA ricombinante). Ogni flaconcino di polvere contiene nominalmente 250, 500, 1 000, 2 000, o 3 000 UI di rurioctocog alfa pegol.
- Il flaconcino di solvente contiene 5 mL di acqua per preparazioni iniettabili.
- Gli altri componenti sono mannitolo, trealosio diidrato, istidina, glutatione, cloruro di sodio, cloruro di calcio diidrato, tris(idrossimetil)aminometano e polisorbato 80. Vedere paragrafo 2, “ADYNOVI contiene sodio”.
Descrizione dell'aspetto di ADYNOVI e contenuto della confezione
ADYNOVI viene fornito sotto forma di polvere e solvente per soluzione iniettabile (polvere per
soluzione iniettabile). La polvere è una polvere friabile da bianca a biancastra. Il solvente è una
soluzione limpida e incolore. Dopo la ricostituzione la soluzione appare limpida, incolore e priva di
corpi estranei.
Titolare dell'autorizzazione all'immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Vienna
Produttore
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Τakeda HELLAS S.A.
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell'Agenzia europea
per i medicinali: http://www.ema.europa.eu/
Istruzioni per la preparazione e la somministrazione
ADYNOVI non deve essere miscelato con altri medicinali o solventi.
Ogni volta che viene somministrato ADYNOVI, si raccomanda vivamente di registrare il nome e il
numero di lotto del prodotto. Il blister è fornito di etichette staccabili.
Istruzioni per la ricostituzione
- Non utilizzare dopo la data di scadenza riportata sull'etichetta e sulla scatola.
- Non utilizzare se la parte superiore non è completamente sigillata sul blister.
- Non refrigerare la soluzione dopo la preparazione.
- 1. Se il prodotto è ancora conservato in frigorifero, estrarre dal frigorifero il blister sigillato (contenente i flaconcini di polvere e solvente preassemblati con il sistema per la ricostituzione) e tenerlo a temperatura ambiente (15 °C – 25 °C).
- 2. Lavarsi accuratamente le mani usando sapone e acqua calda.
- 3. Aprire il blister di ADYNOVI togliendo la parte superiore. Rimuovere il sistema BAXJECT III dal blister.
- 4. Porre il flaconcino di polvere su una superficie piatta con il flaconcino di solvente in alto (Figura 1). Sul flaconcino di solvente è presente una striscia blu. Non rimuovere la capsula di chiusura blu fino a quando indicato in un passaggio successivo.
- 5. Tenendo con una mano il flaconcino di polvere nel sistema BAXJECT III, premere con decisione il flaconcino di solvente con l'altra mano fino a quando il sistema non sia completamente rientrato e il solvente scorra nel flaconcino di polvere (Figura 2). Non inclinare il sistema fino al termine del trasferimento.
- 6. Verificare che il trasferimento del solvente sia stato completato. Agitare delicatamente fino alla dissoluzione completa della sostanza (Figura 3). Assicurarsi che la polvere sia dissolta completamente, altrimenti non tutta la soluzione ricostituita passerà attraverso il filtro del dispositivo. Il prodotto si dissolve rapidamente (in genere in meno di 1 minuto). Dopo la ricostituzione la soluzione appare limpida, incolore e priva di corpi estranei.
Figura 1Figura 2Figura 3
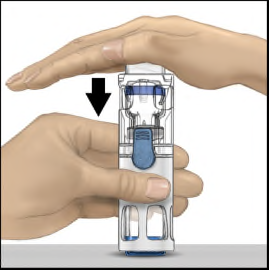
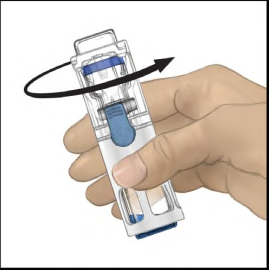
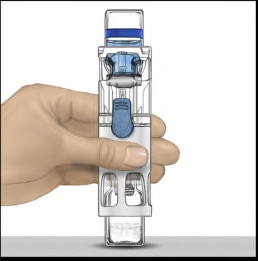
Figura 4Figura 5
Istruzioni per l’iniezione
Durante la somministrazione si deve utilizzare una tecnica antisettica (condizioni di pulizia e
bassissimo contenuto di germi).
Nota importante:
- Prima della somministrazione ispezionare la soluzione preparata per rilevare l'eventuale presenza di particolato e alterazione del colore (la soluzione deve essere limpida, incolore e priva di particelle). Non utilizzare, se la soluzione non è completamente limpida o dissolta.
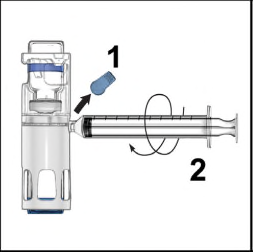
- 1. Togliere la capsula di chiusura blu dal dispositivo BAXJECT III (Figura 4). Non aspirare arianella siringa. Collegare la siringa al dispositivo BAXJECT III. Si consiglia di utilizzare una siringa Luer-lock.
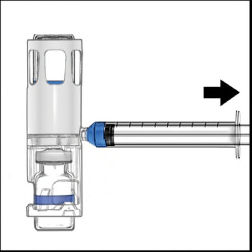
- 2. Capovolgere il sistema (il flaconcino di polvere ora si trova in alto). Aspirare la soluzione ricostituita nella siringa tirando lentamente indietro lo stantuffo (Figure 5).
- 3. Scollegare la siringa; attaccare un ago a farfalla alla siringa e iniettare la soluzione ricostituita in una vena. La soluzione deve essere somministrata lentamente, a una velocità determinata dal livello di comfort del paziente, senza superare 10 mL/min. (Vedere il paragrafo 4 “Possibili effetti indesiderati“.)
- 4. Smaltire appropriatamente la soluzione non utilizzata.
-------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Trattamento al bisogno
Nell’eventualità dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto
del livello di attività plasmatica determinato (in % del valore normale o in UI/dL) nel periodo
corrispondente. La seguente tabella può essere utilizzata come riferimento per il dosaggio negli
episodi di sanguinamento e negli interventi chirurgici.
Tabella 1: Guida per il dosaggio negli episodi di sanguinamento e negli interventi chirurgici
| Grado di emorragia/Tipo di procedura chirurgica | d Livello di fattore VIII necessario (% o UI/dL) | Frequenza delle dosi (ore)/durata della terapia (giorni) |
| Emorragia Emartrosi precoce, sanguinamento muscolare o del cavo orale. Emartrosi più estesa, sanguinamento muscolare o ematoma Emorragie potenzialmente letali. | a
| Ripetere le iniezioni ogni 12 – 24 ore. Almeno 1 giorno, fino alla risoluzione dell’episodio di sanguinamento, indicato dal dolore, o al raggiungimento della guarigione. Ripetere le iniezioni ogni 12 – 24 ore per 3 – 4 giorni o più fino alla risoluzione del dolore e della disabilità acuta. Ripetere le iniezioni ogni 8 – 24 ore fino alla risoluzione della minaccia. |
| a Intervento chirurgico Minore i Compresa estrazione dentaria. z Maggiore n e |
| Ogni 24 ore almeno 1 giorno, fino alla guarigione. Ripetere le iniezioni ogni 8 – 24 ore fino a un’adeguata guarigione della ferita, quindi proseguire la terapia per almeno altri 7 giorni per mantenere un’attività del fattore VIII tra il 30% e il 60% (UI/dL). |
Profilassi
Per la profilassi a lungo termine, la dose raccomandata è di 40 – 50 UI di ADYNOVI per
chilogrammo di peso corporeo due volte alla settimana con intervalli di 3 – 4 giorni.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
Popolazione pediatrica
Il dosaggio del trattamento al bisogno nei pazienti pediatrici (da 12 a 18 anni) è lo stesso dei pazienti
adulti. Il trattamento profilattico per i pazienti da 12 anni a < 18 anni è lo stesso dei pazienti adulti. La
sicurezza a lungo termine di ADYNOVI nei bambini al di sotto dei 12 anni non è stata ancora stabilita.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
ADYNOVI 250 UI / 2 mL polvere e solvente per soluzione iniettabile, 500 UI / 2 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 2 mL polvere e solvente per soluzione iniettabile
rurioctocog alfa pegol (fattore VIII della coagulazione umano ricombinante peghilato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia mai ad altri. anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è ADYNOVI e a cosa serve
- 2. Cosa deve sapere prima di usare ADYNOVI
- 3. Come usare ADYNOVI
- 4. Possibili effetti indesiderati
- 5. Come conservare ADYNOVI
- 6. Contenuto della confezione e altre informazioni
1. Cos’è ADYNOVI e a cosa serve
ADYNOVI contiene il principio attivo rurioctocog alfa pegol, il fattore VIII della coagulazione umano
peghilato. Il fattore VIII della coagulazione umano è stato modificato per prolungare la sua durata
d'azione. Il fattore VIII è necessario affinché il sangue coaguli e fermi i sanguinamenti. Nei pazienti
affetti da emofilia A (mancanza congenita del fattore VIII) esso non è presente o non agisce
correttamente.
ADYNOVI viene utilizzato per il trattamento e la prevenzione del sanguinamento nei pazienti dai 12
anni di età affetti da emofilia A (un disturbo ereditario della coagulazione causato da una mancanza di
fattore VIII).
2. Cosa deve sapere prima di usare ADYNOVI
Non usi ADYNOVI
- se è allergico a rurioctocog alfa pegol, a octocog alfa o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se è allergico alle proteine di topo o di criceto
Se ha dei dubbi a riguardo, si rivolga al medico.
Avvertenze e precauzioni
È importante tenere traccia del numero di lotto di ADYNOVI. Quindi, ogni volta che prende una
nuova confezione di ADYNOVI, annoti la data e il numero di lotto (che si trova sulla confezione dopo
“Lotto”) conservi queste informazioni in un luogo sicuro.
Si rivolga al medico prima di usare ADYNOVI.
Esiste un raro rischio che lei possa sviluppare una reazione anafilattica (una reazione allergica
improvvisa e grave) ad ADYNOVI. Deve essere a conoscenza dei segni iniziali delle reazioni
allergiche, come eruzione cutanea, orticaria, pomfi, prurito generalizzato, gonfiore delle labbra e della
lingua, difficoltà di respirazione, respiro sibilante, costrizione toracica, sentirsi poco bene e capogiro.
Questi potrebbero essere sintomi iniziali di shock anafilattico; altre manifestazioni possono includere
capogiro forte, perdita di coscienza ed estrema difficoltà di respirazione.
In presenza di uno qualsiasi di questi sintomi, interrompa immediatamente l'iniezione e si rivolga al
medico. Sintomi gravi, compresi difficoltà a respirare e svenimento (o la sensazione di svenimento)
richiedono un immediato trattamento di emergenza.
Se soffre di una malattia del cuore informi il medico perché vi è un rischio più elevato di
complicazioni della coagulazione del sangue.
Pazienti che sviluppano inibitori del fattore VIII
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento
con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al
trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per
verificare lo sviluppo di questi inibitori. Se ADYNOVI non mantiene sotto controllo l’emorragia sua o
di suo figlio, informi il medico immediatamente.
Complicanze da catetere
Se ha bisogno di un dispositivo di accesso venoso centrale (CVAD, central venous access device), si
deve considerare il rischio di complicanze legate al CVAD, comprese infezioni locali, la presenza di
batteri nel sangue e la trombosi della sede del catetere.
Bambini e adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Le avvertenze e
le precauzioni elencate si applicano anche agli adolescenti.
Altri medicinali e ADYNOVI
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale. L’emofilia A si verifica
solo raramente nelle donne. Non è dunque disponibile alcuna esperienza sull’uso di ADYNOVI
durante la gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
ADYNOVI non altera o altera in modo trascurabile la capacità di guidare veicoli o di utilizzare
macchinari.
ADYNOVI contiene sodio
Questo medicinale contiene fino a 12,42 mg di sodio (componente principale del sale da cucina) per
flaconcino. Questo equivale a 0,62% dell’assunzione massima giornaliera raccomandata con la dieta di
un adulto. A seconda del suo peso corporeo e della dose di ADYNOVI, è possibile che le vengano
somministrati più flaconcini. Questo deve essere preso in considerazione se segue una dieta a basso
contenuto di sale..
3. Come usare ADYNOVI
Il trattamento con ADYNOVI deve essere iniziato e supervisionato da un medico con esperienza nella
cura dei pazienti affetti da emofilia A.
Il medico calcolerà la sua dose di ADYNOVI in base alla sua condizione, al suo peso e alla finalità per
cui viene usato, cioè prevenzione o trattamento del sanguinamento. La frequenza della
somministrazione dipenderà da quanto sarà efficace ADYNOVI nel suo caso. In genere la terapia
sostitutiva con ADYNOVI è un trattamento che dura per tutta la vita.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico.
Prevenzione del sanguinamento
La dose normale di ADYNOVI varia da 40 a 50 UI per kg di peso corporeo, somministrato 2 volte alla
settimana.
Trattamento del sanguinamento
La dose di ADYNOVI è calcolata in base al peso corporeo e ai livelli di fattore VIII che si devono
raggiungere. I livelli del fattore VIII da raggiungere dipendono dalla gravità e dalla sede del
sanguinamento.
Se ritiene che l'effetto di ADYNOVI sia insufficiente, si rivolga al medico.
Il medico eseguirà gli esami di laboratorio necessari per verificare se i suoi livelli di fattore VIII sono
adeguati. Ciò è particolarmente importante se Lei sarà sottoposto a un intervento di chirurgia
maggiore.
Uso nei bambini e negli adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Anche negli
adolescenti la dose viene calcolata in base al peso corporeo ed è la stessa usata per gli adulti.
Come si somministra ADYNOVI
ADYNOVI in genere è iniettato in una vena (via endovenosa) dal medico o dall'infermiere.
ADYNOVI può essere somministrato anche da lei o da un’altra persona per iniezione, ma solo dopo
dettagliate per l'autosomministrazione.
Se usa più ADYNOVI di quanto deve
Usi ADYNOVI seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il suo
medico. Se inietta più ADYNOVI della quantità raccomandata, contatti il medico appena possibile.
Se dimentica di usare ADYNOVI
Non inietti una dose doppia per compensare la dimenticanza della dose. Proceda con l’iniezione
successiva programmata e continui secondo le istruzioni del medico.
Se interrompe il trattamento con ADYNOVI
Non interrompa l’uso di ADYNOVI senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Qualora si verificasse una reazione allergica improvvisa e grave(reazione anafilattica), interrompa
immediatamentel'iniezione. Si rivolga immediatamente al medico, se manifesta uno qualsiasi dei
seguenti sintomi iniziali di reazioni allergiche:
- eruzione cutanea, orticaria, pomfi, prurito generalizzato,
- gonfiore delle labbra e della lingua,
- difficoltà di respirazione, respiro sibilante, costrizione toracica,
- sentirsi poco bene,
- capogiro e perdita di coscienza.
Sintomi gravi, compresi difficoltà respiratoria e svenimento (o la sensazione di svenimento),
richiedono un immediato trattamento di emergenza.
Per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di
trattamento) possono formarsi anticorpi inibitori (vedere paragrafo 2) con frequenza non comune
(meno di 1 paziente su 100). Se ciò accade il medicinale potrebbe smettere di agire correttamente e lei
potrebbe riscontrare un sanguinamento persistente. Se ciò accade, deve contattare il medico
immediatamente.
Effetti indesiderati molto comuni(possono colpire più di 1 persona su 10)
Mal di testa
Effetti indesiderati comuni(possono colpire fino a 1 persona su 10)
Nausea
Diarrea
Eruzione cutanea
Capogiri
Orticaria
Effetti indesiderati non comuni(possono colpire fino a 1 persona su 100)
Rossore, reazione allergica (ipersensibilità)
Inibitori del fattore VIII (per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII
(più di 150 giorni di trattamento))
Aumento di qualche tipo di globuli bianchi
Reazione all’infusione
Occhi rossi
Reazione cutanea avversa da farmaco
Effetti indesiderati con frequenza non nota(la frequenza non può essere definita sulla base dei dati
disponibili)
Reazioni potenzialmente rischiose per la vita (anafilassi)
Effetti indesiderati aggiuntivi nei bambini
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelli
negli adulti.
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico o all'infermiere. Può inoltre
segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato
nell’allegato V. Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare ADYNOVI
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all'ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C)
Non congelare.
Tenere il flaconcino nell'imballaggio esterno per proteggere il medicinale dalla luce.
Durante il periodo di validità il flaconcino di polvere può essere conservato a temperatura ambiente
(fino a un massimo di 30 °C) per un singolo periodo che non deve superare i 3 mesi. In tal caso il
medicinale scadrà al termine di questo periodo di 3 mesi o alla data di scadenza stampata sul
flaconcino del prodotto, qualunque evento si verifichi per primo. Registrare il termine del periodo di 3
mesi a temperatura ambiente sulla scatola del prodotto. Il prodotto non può essere conservato di nuovo
nel frigorifero dopo averlo conservato a temperatura ambiente. Non refrigerare la soluzione dopo la
preparazione.
Utilizzare il prodotto entro 3 ore dalla completa dissoluzione della polvere.
Il prodotto è esclusivamente monouso. Smaltire appropriatamente la soluzione non utilizzata.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene ADYNOVI
- Il principio attivo è rurioctocog alfa pegol (fattore VIII della coagulazione umano peghilato prodotto con la tecnologia del DNA ricombinante). Ogni flaconcino di polvere contiene nominalmente 250, 500 o 1 000 UI di rurioctocog alfa pegol.
- Il flaconcino di solvente contiene 2 mL di acqua per preparazioni iniettabili.
- Gli altri componenti sono mannitolo, trealosio diidrato, istidina, glutatione, cloruro di sodio, cloruro di calcio diidrato, tris(idrossimetil)aminometano e polisorbato 80. Vedere paragrafo 2, “ADYNOVI contiene sodio”.
Descrizione dell'aspetto di ADYNOVI e contenuto della confezione
ADYNOVI viene fornito sotto forma di polvere e solvente per soluzione iniettabile (polvere per
soluzione iniettabile). La polvere è una polvere friabile da bianca a biancastra. Il solvente è una
soluzione limpida e incolore. Dopo la ricostituzione la soluzione appare limpida, incolore e priva di
corpi estranei.
Ogni confezione contiene un flaconcino di polvere, un flaconcino di solvente e un dispositivo per la
ricostituzione (BAXJECT II Hi-Flow).
Titolare dell'autorizzazione all'immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Vienna
Produttore
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Τakeda HELLAS S.A.
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel. +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell'Agenzia europea
per i medicinali: http://www.ema.europa.eu/
Istruzioni per la preparazione e la somministrazione
Per la preparazione della soluzione utilizzare solo il solvente e il dispositivo di ricostituzione forniti
con ogni confezione di ADYNOVI. La polvere non deve essere miscelata con altri medicinali o
solventi o utilizzata con altri dispositivi di ricostituzione.
Ogni volta che viene somministrato ADYNOVI, si raccomanda vivamente di registrare il nome e il
numero di lotto del prodotto. Il flaconcino di polvere è fornito di etichette staccabili.
Istruzioni per la ricostituzione
- Non utilizzare dopo la data di scadenza riportata sull'etichetta e sulla scatola.
- Non utilizzare, se il dispositivo BAXJECT II Hi-Flow, la sua barriera sterile o la sua confezione sono danneggiati o mostrano segni di deterioramento.
- 1. Durante la procedura di ricostituzione utilizzare una tecnica antisettica (condizioni di pulizia e bassissimo contenuto di germi) e una superficie di lavoro piatta.
- 2. Prima dell’uso lasciare che tutti i flaconcini di polvere e di solvente raggiungano la temperatura ambiente (tra 15 °C e 25 °C).
- 3. Togliere la capsula di chiusura di plastica dai flaconcini di polvere e di solvente.
- 4. Pulire i tappi di gomma con un tampone imbevuto d'alcol e lasciarli asciugare prima di utilizzarli.
- 5. Aprire la confezione del dispositivo BAXJECT II Hi-Flow togliendo la parte superiore senza toccare la parte interna (Figura A). Non estrarre il dispositivo dalla confezione.
- 6. Capovolgere la confezione. Premere verticalmente verso il basso per inserire completamente la punta di plastica trasparente attraverso il tappo del flaconcino di solvente (Figura B).
- 7. Afferrare il bordo della confezione del BAXJECT II Hi-Flow e allontanare la confezione dal dispositivo (Figura C). Non togliere la capsula di chiusura blu dal dispositivo BAXJECT II Hi- Flow. Non toccare la punta di plastica viola esposta.
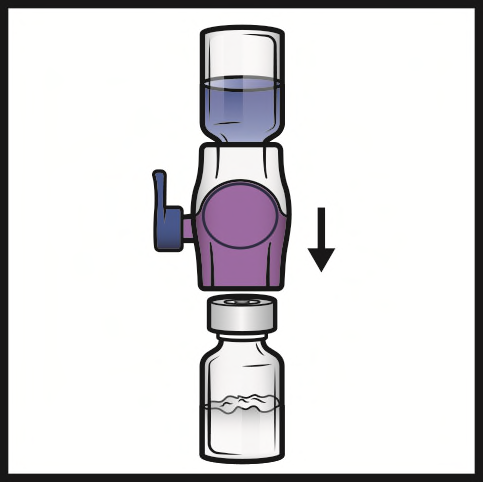
- 8. Capovolgere il sistema in modo che il flaconcino di solvente sia in alto. Inserire rapidamente e completamente la punta di plastica viola nel tappo del flaconcino di polvere premendo verticalmente verso il basso (Figura D). Il vuoto aspirerà il solvente nel flaconcino di polvere.
- 9. Agitare delicatamente fino alla completa dissoluzione della polvere. Non refrigerare dopo la ricostituzione.
Figura AFigura BFigura C
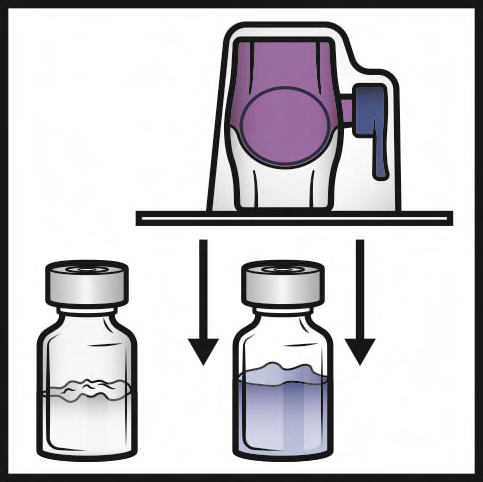
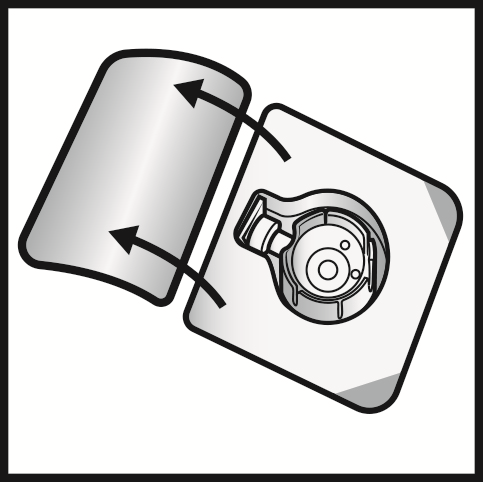
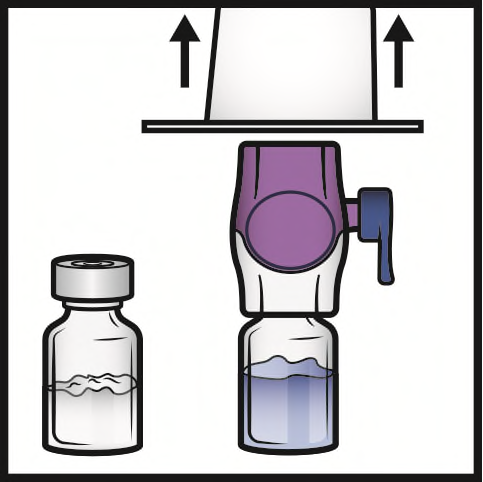
Figura DFigura EFigura F
Istruzioni per l'iniezione
Nota importante:
- Prima della somministrazione ispezionare la soluzione preparata per rilevare l'eventuale presenza di particolato e alterazione del colore (la soluzione deve essere limpida, incolore e priva di particelle).
Non utilizzare ADYNOVI se la soluzione non è completamente limpida o dissolta.
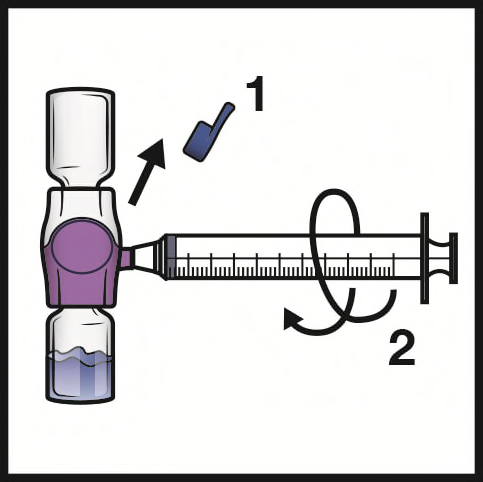
- 1. Togliere la capsula di chiusura blu dal dispositivo BAXJECT II Hi-Flow (Figura E). Nonaspirare aria nella siringa.Collegare la siringa al dispositivo BAXJECT II Hi-Flow. Si consiglia di utilizzare una siringa Luer-lock.
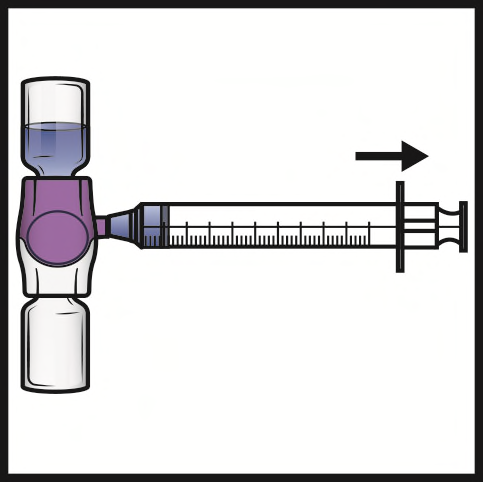
- 2. Capovolgere il sistema (il flaconcino di polvere ora si trova in alto). Aspirare la soluzione ricostituita nella siringa tirando lentamente indietro lo stantuffo (Figura F).
- 3. Scollegare la siringa; attaccare un ago idoneo e iniettare per via endovenosa. Se un paziente deve ricevere più di un flaconcino di ADYNOVI, il contenuto di più flaconcini può essere prelevato nella stessa siringa. Per ricostituire ogni flaconcino di ADYNOVI con il solvente, si deve utilizzare un dispositivo BAXJECT II Hi-Flow separato.
- 4. Somministrare per un periodo di tempo non superiore a 5 minuti (velocità massima di infusione 10 mL/min).
- 5. Smaltire appropriatamente la soluzione non utilizzata.
-------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Trattamento al bisogno
Nell’eventualità dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto
del livello di attività plasmatica determinato (in % del valore normale o in UI/dL) nel periodo
corrispondente. La seguente tabella può essere utilizzata come riferimento per il dosaggio negli
episodi di sanguinamento e negli interventi chirurgici.
Tabella 1:Guida per il dosaggio negli episodi di sanguinamento e negli interventi chirurgici
| Grado di emorragia/Tipo di procedura chirurgica | n Livello di fattore VIII necessario (% o UI/dL) | Frequenza delle dosi (ore)/durata della terapia (giorni) |
| Emorragia Emartrosi precoce, sanguinamento muscolare o del cavo orale. Emartrosi più estesa, sanguinamento muscolare o a ematoma i Emorragie potenzialmente letali. | a i
| Ripetere le iniezioni ogni 12 – 24 ore. Almeno 1 giorno, fino alla risoluzione dell’episodio di sanguinamento, indicato dal dolore, o al raggiungimento della guarigione. Ripetere le iniezioni ogni 12 – 24 ore per 3 – 4 giorni o più fino alla risoluzione del dolore e della disabilità acuta. Ripetere le iniezioni ogni 8 – 24 ore fino alla risoluzione della minaccia. |
| z n Intervento chirurgico Minore e Compresa estrazione dentaria. g Maggiore A |
| Ogni 24 ore almeno 1 giorno, fino alla guarigione. Ripetere le iniezioni ogni 8 – 24 ore fino a un’adeguata guarigione della ferita, quindi proseguire la terapia per almeno altri 7 giorni per mantenere un’attività del fattore VIII tra il 30% e il 60% (UI/dL). |
Profilassi
Per la profilassi a lungo termine, la dose raccomandata è di 40 – 50 UI di ADYNOVI per
chilogrammo di peso corporeo due volte alla settimana con intervalli di 3 – 4 giorni.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
Popolazione pediatrica
Il dosaggio del trattamento al bisogno nei pazienti pediatrici (da 12 a 18 anni) è lo stesso dei pazienti
adulti. Il trattamento profilattico per i pazienti da 12 anni a < 18 anni è lo stesso dei pazienti adulti. La
sicurezza a lungo termine di ADYNOVI nei bambini al di sotto dei 12 anni non è stata ancora stabilita.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in
considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al
sanguinamento.
ADYNOVI 250 UI / 2 mL polvere e solvente per soluzione iniettabile, 500 UI / 2 mL polvere e solvente per soluzione iniettabile, 1 000 UI / 2 mL polvere e solvente per soluzione iniettabile
rurioctocog alfa pegol (fattore VIII della coagulazione umano ricombinante peghilato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia mai ad altri. anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è ADYNOVI e a cosa serve
- 2. Cosa deve sapere prima di usare ADYNOVI
- 3. Come usare ADYNOVI
- 4. Possibili effetti indesiderati
- 5. Come conservare ADYNOVI
- 6. Contenuto della confezione e altre informazioni
1. Cos’è ADYNOVI e a cosa serve
ADYNOVI contiene il principio attivo rurioctocog alfa pegol, il fattore VIII della coagulazione umano
peghilato. Il fattore VIII della coagulazione umano è stato modificato per prolungare la sua durata
d'azione. Il fattore VIII è necessario affinché il sangue coaguli e fermi i sanguinamenti. Nei pazienti
affetti da emofilia A (mancanza congenita del fattore VIII) esso non è presente o non agisce
correttamente.
ADYNOVI viene utilizzato per il trattamento e la prevenzione del sanguinamento nei pazienti dai 12
anni di età affetti da emofilia A (un disturbo ereditario della coagulazione causato da una mancanza di
fattore VIII).
2. Cosa deve sapere prima di usare ADYNOVI
Non usi ADYNOVI
- se è allergico a rurioctocog alfa pegol, a octocog alfa o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se è allergico alle proteine di topo o di criceto
Se ha dei dubbi a riguardo, si rivolga al medico.
Avvertenze e precauzioni
È importante tenere traccia del numero di lotto di ADYNOVI. Quindi, ogni volta che prende una
nuova confezione di ADYNOVI, annoti la data e il numero di lotto (che si trova sulla confezione dopo
“Lotto”) conservi queste informazioni in un luogo sicuro.
Si rivolga al medico prima di usare ADYNOVI.
Esiste un raro rischio che lei possa sviluppare una reazione anafilattica (una reazione allergica
improvvisa e grave) ad ADYNOVI. Deve essere a conoscenza dei segni iniziali delle reazioni
allergiche, come eruzione cutanea, orticaria, pomfi, prurito generalizzato, gonfiore delle labbra e della
lingua, difficoltà di respirazione, respiro sibilante, costrizione toracica, sentirsi poco bene e capogiro.
Questi potrebbero essere sintomi iniziali di shock anafilattico; altre manifestazioni possono includere
capogiro forte, perdita di coscienza ed estrema difficoltà di respirazione.
In presenza di uno qualsiasi di questi sintomi, interrompa immediatamente l'iniezione e si rivolga al
medico. Sintomi gravi, compresi difficoltà a respirare e svenimento (o la sensazione di svenimento)
richiedono un immediato trattamento di emergenza.
Se soffre di una malattia del cuore informi il medico perché vi è un rischio più elevato di
complicazioni della coagulazione del sangue.
Pazienti che sviluppano inibitori del fattore VIII
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento
con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al
trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per
verificare lo sviluppo di questi inibitori. Se ADYNOVI non mantiene sotto controllo l’emorragia sua o
di suo figlio, informi il medico immediatamente.
Complicanze da catetere
Se ha bisogno di un dispositivo di accesso venoso centrale (CVAD, central venous access device), si
deve considerare il rischio di complicanze legate al CVAD, comprese infezioni locali, la presenza di
batteri nel sangue e la trombosi della sede del catetere.
Bambini e adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Le avvertenze e
le precauzioni elencate si applicano anche agli adolescenti.
Altri medicinali e ADYNOVI
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale. L’emofilia A si verifica
solo raramente nelle donne. Non è dunque disponibile alcuna esperienza sull’uso di ADYNOVI
durante la gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
ADYNOVI non altera o altera in modo trascurabile la sua capacità di guidare veicoli o di utilizzare
macchinari.
ADYNOVI contiene sodio
Questo medicinale contiene fino a 12,42 mg di sodio (componente principale del sale da cucina) per
flaconcino. Questo equivale a 0,62% dell’assunzione massima giornaliera raccomandata con la dieta di
un adulto. A seconda del suo peso corporeo e della dose di ADYNOVI, è possibile che le vengano
somministrati più flaconcini. Questo deve essere preso in considerazione se segue una dieta a basso
contenuto di sale.
3. Come usare ADYNOVI
Il trattamento con ADYNOVI deve essere iniziato e supervisionato da un medico con esperienza nella
cura dei pazienti affetti da emofilia A.
Il medico calcolerà la sua dose di ADYNOVI in base alla sua condizione, al suo peso e alla finalità per
cui viene usato, cioè prevenzione o trattamento del sanguinamento. La frequenza della
somministrazione dipenderà da quanto sarà efficace ADYNOVI nel suo caso. In genere la terapia
sostitutiva con ADYNOVI è un trattamento che dura per tutta la vita.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico.
Prevenzione del sanguinamento
La dose normale di ADYNOVI varia da 40 a 50 UI per kg di peso corporeo, somministrato 2 volte alla
settimana.
Trattamento del sanguinamento
La dose di ADYNOVI è calcolata in base al peso corporeo e ai livelli di fattore VIII che si devono
raggiungere. I livelli del fattore VIII da raggiungere dipendono dalla gravità e dalla sede del
sanguinamento.
Se ritiene che l'effetto di ADYNOVI sia insufficiente, si rivolga al medico.
Il medico eseguirà gli esami di laboratorio necessari per verificare se i suoi livelli di fattore VIII sono
adeguati. Ciò è particolarmente importante se Lei sarà sottoposto a un intervento di chirurgia
maggiore.
Uso nei bambini e negli adolescenti
ADYNOVI può essere usato solo negli adolescenti e negli adulti (dai 12 anni in poi). Anche negli
adolescenti la dose viene calcolata in base al peso corporeo ed è la stessa usata per gli adulti.
Come si somministra ADYNOVI
ADYNOVI in genere è iniettato in una vena (via endovenosa) dal medico o dall'infermiere.
ADYNOVI può essere somministrato anche da lei o da un’altra persona per iniezione, ma solo dopo
dettagliate per l'autosomministrazione.
Se usa più ADYNOVI di quanto deve
Usi ADYNOVI seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il suo
medico. Se inietta più ADYNOVI della quantità raccomandata, contatti il medico appena possibile.
Se dimentica di usare ADYNOVI
Non inietti una dose doppia per compensare la dimenticanza della dose. Proceda con l’iniezione
successiva programmata e continui secondo le istruzioni del medico.
Se interrompe il trattamento con ADYNOVI
Non interrompa l’uso di ADYNOVI senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Qualora si verificasse una reazione allergica improvvisa e grave(reazione anafilattica), interrompa
immediatamentel'iniezione. Si rivolga immediatamente al medico, se manifesta uno qualsiasi dei
seguenti sintomi iniziali di reazioni allergiche:
- eruzione cutanea, orticaria, pomfi, prurito generalizzato,
- gonfiore delle labbra e della lingua,
- difficoltà di respirazione, respiro sibilante, costrizione toracica,
- sentirsi poco bene,
- capogiro e perdita di coscienza.
Sintomi gravi, compresi difficoltà respiratoria e svenimento (o la sensazione di svenimento),
richiedono un immediato trattamento di emergenza.
Per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di
trattamento) possono formarsi anticorpi inibitori (vedere paragrafo 2) con frequenza non comune
(meno di 1 paziente su 100). Se ciò accade il medicinale potrebbe smettere di agire correttamente e lei
potrebbe riscontrare un sanguinamento persistente. Se ciò accade, deve contattare il medico
immediatamente.
Effetti indesiderati molto comuni(possono colpire più di 1 persona su 10)
Mal di testa
Effetti indesiderati comuni(possono colpire fino a 1 persona su 10)
Nausea
Diarrea
Eruzione cutanea
Capogiri
Orticaria
Effetti indesiderati non comuni(possono colpire fino a 1 persona su 100)
Rossore, reazione allergica (ipersensibilità)
Inibitori del fattore VIII (per i pazienti che hanno ricevuto un trattamento precedente con il fattore VIII
(più di 150 giorni di trattamento))
Aumento di qualche tipo di globuli bianchi
Reazione all’infusione
Occhi rossi
Reazione cutanea avversa da farmaco
Effetti indesiderati con frequenza non nota(la frequenza non può essere definita sulla base dei dati
disponibili)
Reazioni potenzialmente rischiose per la vita (anafilassi)
Effetti indesiderati aggiuntivi nei bambini
Si prevede che la frequenza, il tipo e la gravità delle reazioni avverse nei bambini siano uguali a quelli
negli adulti.
Segnalazione degli effetti indesiderati
Se si manifesta un qualsiasi effetto indesiderato, si rivolga al medico o all'infermiere. Può inoltre
segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato
nell’allegato V. Segnalando gli effetti indesiderati può contribuire a fornire maggiori informazioni
sulla sicurezza di questo medicinale.
5. Come conservare ADYNOVI
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all'ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C)
Non congelare.
Tenere il blister nell'imballaggio esterno per proteggere il medicinale dalla luce.
Durante il periodo di validità il flaconcino di polvere può essere conservato a temperatura ambiente
(fino a un massimo di 30 °C) per un singolo periodo che non deve superare i 3 mesi. In tal caso il
medicinale scadrà al termine di questo periodo di 3 mesi o alla data di scadenza stampata sul
flaconcino del prodotto, qualunque evento si verifichi per primo. Registrare il termine del periodo di 3
mesi a temperatura ambiente sulla scatola del prodotto. Il prodotto non può essere conservato di nuovo
nel frigorifero dopo averlo conservato a temperatura ambiente. Non refrigerare la soluzione dopo la
preparazione.
Utilizzare il prodotto entro 3 ore dalla completa dissoluzione della polvere.
Il prodotto è esclusivamente monouso. Smaltire appropriatamente la soluzione non utilizzata.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l'ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene ADYNOVI
- Il principio attivo è rurioctocog alfa pegol (fattore VIII della coagulazione umano peghilato prodotto con la tecnologia del DNA ricombinante). Ogni flaconcino di polvere contiene nominalmente 250, 500 o 1 000 UI di rurioctocog alfa pegol.
- Il flaconcino di solvente contiene 2 mL di acqua per preparazioni iniettabili.
- Gli altri componenti sono mannitolo, trealosio diidrato, istidina, glutatione, cloruro di sodio, cloruro di calcio diidrato, tris(idrossimetil)aminometano e polisorbato 80. Vedere paragrafo 2, “ADYNOVI contiene sodio”.
Descrizione dell'aspetto di ADYNOVI e contenuto della confezione
ADYNOVI viene fornito sotto forma di polvere e solvente per soluzione iniettabile (polvere per
soluzione iniettabile). La polvere è una polvere friabile da bianca a biancastra. Il solvente è una
soluzione limpida e incolore. Dopo la ricostituzione la soluzione appare limpida, incolore e priva di
corpi estranei.
Titolare dell'autorizzazione all'immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Vienna
Produttore
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf: +45 46 77 10 10
[email protected]
Malta
Τakeda HELLAS S.A.
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0)800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
Τakeda ΕΛΛΑΣ Α.Ε.
Tηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tél: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Proton Medical (Cyprus) Ltd
Τηλ: +357 22866000
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel: +44 (0) 2830 640 902
[email protected]
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell'Agenzia europea
per i medicinali: http://www.ema.europa.eu/
Istruzioni per la preparazione e la somministrazione
ADYNOVI non deve essere miscelato con altri medicinali o solventi.
Ogni volta che viene somministrato ADYNOVI, si raccomanda vivamente di registrare il nome e il
numero di lotto del prodotto. Il blister è fornito di etichette staccabili.
Istruzioni per la ricostituzione
- Non utilizzare dopo la data di scadenza riportata sull'etichetta e sulla scatola.
- Non utilizzare se la parte superiore non è completamente sigillata sul blister.
- Non refrigerare la soluzione dopo la preparazione.
- 1. Se il prodotto è ancora conservato in frigorifero, estrarre dal frigorifero il blister sigillato (contenente i flaconcini di polvere e solvente preassemblati con il sistema per la ricostituzione) e tenerlo a temperatura ambiente (15 °C – 25 °C).
- 2. Lavarsi accuratamente le mani usando sapone e acqua calda.
- 3. Aprire il blister di ADYNOVI togliendo la parte superiore. Rimuovere il sistema BAXJECT III dal blister.
- 4. Porre il flaconcino di polvere su una superficie piatta con il flaconcino di solvente in alto (Figura 1). Sul flaconcino di solvente è presente una striscia blu. Non rimuovere la capsula di chiusura blu fino a quando indicato in un passaggio successivo.
- 5. Tenendo con una mano il flaconcino di polvere nel sistema BAXJECT III, premere con decisione il flaconcino di solvente con l'altra mano fino a quando il sistema non sia completamente rientrato e il solvente scorra nel flaconcino di polvere (Figura 2). Non inclinare il sistema fino al termine del trasferimento.
- 6. Verificare che il trasferimento del solvente sia stato completato. Agitare delicatamente fino alla dissoluzione completa della sostanza (Figura 3). Assicurarsi che la polvere sia dissolta completamente, altrimenti non tutta la soluzione ricostituita passerà attraverso il filtro del dispositivo. Il prodotto si dissolve rapidamente (in genere in meno di 1 minuto). Dopo la ricostituzione la soluzione appare limpida, incolore e priva di corpi estranei.
Figura 1Figura 2Figura 3
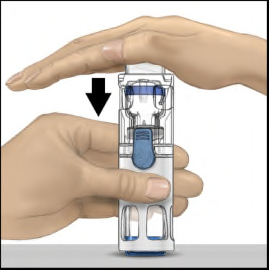
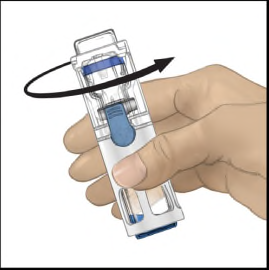
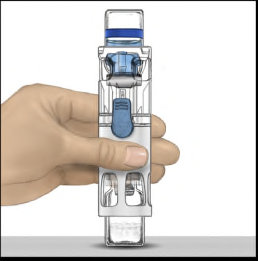
Figura 4Figura 5
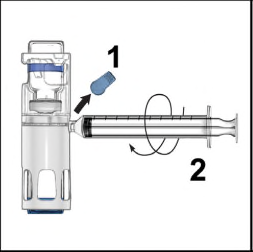
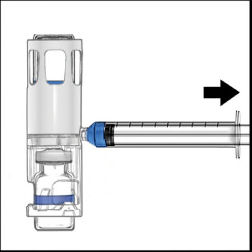
Istruzioni per l'iniezione
Durante la somministrazione si deve utilizzare una tecnica antisettica (condizioni di pulizia e
bassissimo contenuto di germi).
Nota importante:
- Prima della somministrazione ispezionare la soluzione preparata per rilevare l'eventuale presenza di particolato e alterazione del colore (la soluzione deve essere limpida, incolore e priva di particelle). Non utilizzare, se la soluzione non è completamente limpida o dissolta.
- 1. Togliere la capsula di chiusura blu dal dispositivo BAXJECT III (Figura 4). Non aspirare arianella siringa. Collegare la siringa al dispositivo BAXJECT III. Si consiglia di utilizzare una siringa Luer-lock.
- 2. Capovolgere il sistema (il flaconcino di polvere ora si trova in alto). Aspirare la soluzione ricostituita nella siringa tirando lentamente indietro lo stantuffo (Figura 5).
- 3. Scollegare la siringa; attaccare un ago a farfalla alla siringa e iniettare la soluzione ricostituita in una vena. La soluzione deve essere somministrata lentamente, a una velocità determinata dal livello di comfort del paziente, senza superare 10 mL/min. (Vedere il paragrafo 4 “Possibili effetti indesiderati“.)
- 4. Smaltire appropriatamente la soluzione non utilizzata.
-------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Trattamento al bisogno
Nell’eventualità dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto
del livello di attività plasmatica determinato (in % del valore normale o in UI/dL) nel periodo
corrispondente. La seguente tabella può essere utilizzata come riferimento per il dosaggio negli
episodi di sanguinamento e negli interventi chirurgici.
Tabella 1: Guida per il dosaggio negli episodi di sanguinamento e negli interventi chirurgici
| Grado di emorragia/Tipo di procedura chirurgica | d Livello di fattore VIII necessario (% o UI/dL) | Frequenza delle dosi (ore)/durata della terapia (giorni) |
| Emorragia Emartrosi precoce, sanguinamento muscolare o del cavo orale. Emartrosi più estesa, sanguinamento muscolare o ematoma Emorragie potenzialmente letali. | a
| Ripetere le iniezioni ogni 12 – 24 ore. Almeno 1 giorno, fino alla risoluzione dell’episodio di sanguinamento, indicato dal dolore, o al raggiungimento della guarigione. Ripetere le iniezioni ogni 12 – 24 ore per 3 – 4 giorni o più fino alla risoluzione del dolore e della disabilità acuta. Ripetere le iniezioni ogni 8 – 24 ore fino alla risoluzione della minaccia. |
| a Intervento chirurgico Minore i Compresa estrazione dentaria. z Maggiore n e |
| Ogni 24 ore almeno 1 giorno, fino alla guarigione. Ripetere le iniezioni ogni 8 – 24 ore fino a un’adeguata guarigione della ferita, quindi proseguire la terapia per almeno altri 7 giorni per mantenere un’attività del fattore VIII tra il 30% e il 60% (UI/dL). |
Profilassi
Per la profilassi a lungo termine, la dose raccomandata è di 40 – 50 UI di ADYNOVI per
chilogrammo di peso corporeo due volte alla settimana con intervalli di 3 – 4 giorni. Aggiustamenti
delle dosi e degli intervalli tra le somministrazioni possono essere presi in considerazione sulla
base dei livelli di FVIII raggiunti e della predisposizione individuale al sanguinamento.
Popolazione pediatrica
Il dosaggio del trattamento al bisogno nei pazienti pediatrici (da 12 a 18 anni) è lo stesso dei pazienti
adulti. Il trattamento profilattico per i pazienti da 12 anni a < 18 anni è lo stesso dei pazienti adulti. La
sicurezza a lungo termine di ADYNOVI nei bambini al di sotto dei 12 anni non è stata ancora stabilita.
Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in considerazione
sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al sanguinamento.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a ADYNOVIForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 1000 UIPrincipio attivo: coagulation factor VIIIProduttore: CSL BEHRING GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: SWEDISH ORPHAN BIOVITRUM AB (PUBL)Prescrizione richiesta
Medici online per ADYNOVI
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di ADYNOVI — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.