
AFQLIR

Come usare AFQLIR
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Afqlir 40 mg/mL soluzione iniettabile in siringa preriempita
aflibercept
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Afqlir e a cosa serve
- 2. Cosa deve sapere prima di prendere Afqlir
- 3. Come prendere Afqlir
- 4. Possibili effetti indesiderati
- 5. Come conservare Afqlir
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Afqlir e a cosa serve
Afqlir è una soluzione che viene iniettata nell’occhio per trattare negli adulti malattie dell’occhio
chiamate
- degenerazione maculare neovascolare correlata all’età (AMD essudativa),
- compromissione della vista dovuta a edema maculare secondario a occlusione della vena retinica (RVO di branca (BRVO) o RVO centrale (CRVO)),
- compromissione della vista dovuta a edema maculare diabetico ( Diabetic Macular Oedema- DME),
- compromissione della vista dovuta a neovascolarizzazione coroideale miopica (CNV miopica).
Aflibercept, il principio attivo di Afqlir, blocca l’attività di un gruppo di fattori, noti come VEGF-A
(Fattore di crescita endoteliale vascolare A) e PlGF (Fattore di crescita placentare).
Nei pazienti affetti da AMD essudativa e CNV miopica, questi fattori, se in eccesso, sono coinvolti
nella formazione anormale di nuovi vasi sanguigni nell’occhio. I nuovi vasi sanguigni possono causare
la fuoriuscita di componenti del sangue nell’occhio ed eventuali danni ai tessuti oculari responsabili
della vista.
Nei pazienti affetti da CRVO si forma un blocco nel principale vaso sanguigno che trasporta via il
sangue lontano dalla retina. I livelli di VEGF aumentano in risposta a tale evento, causando la
fuoriuscita di liquido nella retina e quindi causando il rigonfiamento della macula (la porzione della
retina responsabile della visione fine), chiamato edema maculare. Quando la macula si gonfia con il
liquido, la visione centrale diventa sfocata.
Nei pazienti con la BRVO, uno o più rami (branche) del vaso sanguigno principale che trasporta via il
sangue dalla retina è bloccato. I livelli di VEGF sono di conseguenza elevati e provocano la fuoriuscita
del liquido nella retina, causando l’edema maculare.
L’edema maculare diabetico è un ringonfiamento della retina che si verifica in pazienti diabetici a
causa della fuoriuscita di liquido dai vasi sanguigni presenti nella macula. La macula è la porzione
della retina responsabile della visione distinta. Quando la macula si riempie di liquido, la visione
centrale diventa offuscata.
È stato dimostrato che Afqlir blocca la crescita di nuovi vasi sanguigni anormali nell’occhio, da cui
spesso fuoriescono liquidi o sangue. Afqlir può aiutare a stabilizzare e, in molti casi, a migliorare la
perdita di vista correlata all'AMD essudativa, alla CRVO, alla BRVO, alla DME e alla CNV miopica.
2. Cosa deve sapere prima di prendere Afqlir
Non prenda Afqlir
- se è allergicoad aflibercept o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione in corso o sospetta all’interno o intorno all’occhio (infezione oculare o perioculare).
- se ha una grave infiammazione dell’occhio (indicata da dolore o arrossamento).
Avvertenze e precauzioni
Si rivolga al medico prima di prendere Afqlir
- se ha un glaucoma.
- se le è mai capitato di vedere lampi di luce o mosche volanti e se il numero e la dimensione delle mosche volanti è aumentato improvvisamente.
- se è stato effettuato o è previsto un intervento chirurgico sull’occhio nelle ultime o nelle prossime quattro settimane.
- se ha una forma grave di CRVO o BRVO (CRVO o BRVO ischemica), il trattamento con Afqlir non è raccomandato.
È inoltre importante che lei sappia che
- la sicurezza e l’efficacia di aflibercept quando viene somministrato a entrambi gli occhi contemporaneamente non sono state studiate e se viene somministrato in questo modo può portare ad un aumento del rischio di sperimentare effetti indesiderati.
- le iniezioni di Afqlir possono scatenare in alcuni pazienti un aumento della pressione dell’occhio (pressione intraoculare) nei 60 minuti successivi all’iniezione. Il medico monitorerà tale effetto dopo ogni iniezione.
- se sviluppa un’infezione o un’infiammazione all’interno dell’occhio (endoftalmite) o altre complicanze, può avere dolore all’occhio o aumento del malessere, peggioramento dell’arrossamento dell’occhio, offuscamento o riduzione della vista e aumento della sensibilità alla luce. È importante che ogni sintomo sia diagnosticato e trattato il prima possibile.
- il medico verificherà se presenta altri fattori di rischio che possono aumentare la possibilità di distacco o rottura di uno degli stati nella parte posteriore dell’occhio (distacco o rottura retinica, e distacco o rottura dell’epitelio pigmentato retinico), in questi casi Afqlir le verrà somministrato con cautela.
- Afqlir non deve essere usato in gravidanza a meno che il beneficio potenziale non superi il rischio potenziale per il nascituro.
- le donne in età fertile devono usare misure contraccettive efficaci durante il trattamento e per almeno ulteriori tre mesi dopo l’ultima iniezione di Afqlir.
L’uso sistemico di inibitori del VEGF, sostanze simili a quelle contenute in Afqlir, è potenzialmente
correlato al rischio che coaguli di sangue blocchino i vasi sanguigni (eventi tromboembolici arteriosi)
determinando un attacco cardiaco o un ictus. Esiste un rischio teorico che si verifichino tali eventi in
seguito all’iniezione di Afqlir nell’occhio. Vi sono dati limitati sulla sicurezza del trattamento di
pazienti affetti da CRVO, BRVO, DME e CNV miopica che hanno avuto un ictus o un mini-ictus
(attacco ischemico transitorio) o un attacco cardiaco negli ultimi 6 mesi. Se una di queste situazioni si
applica al suo caso, Afqlir le verrà somministrato con cautela.
L’esperienza è limitata con il trattamento di
- pazienti affetti da DME dovuta a diabete di tipo I.
- diabetici con valori medi elevati di glicemia (HbA1c superiore al 12%).
- diabetici affetti da una malattia dell’occhio causata dal diabete chiamata retinopatia proliferativa diabetica.
Non vi è alcuna esperienza con il trattamento di
- pazienti con infezioni acute.
- pazienti con altre malattie dell’occhio come distacco della retina o foro maculare.
- diabetici con pressione sanguigna alta non controllata.
- pazienti non asiatici con CNV miopica.
- pazienti precedentemente trattati per la CNV miopica.
- pazienti con lesioni situate al di fuori della parte centrale della macula (lesioni extrafoveali) per la CNV miopica.
Se riscontra in lei uno dei casi sopra descritti, il medico prenderà in considerazione questa assenza di
informazioni quando la tratterà con Afqlir.
Bambini e adolescenti
L’uso di Afqlir nei bambini o adolescenti di età inferiore a 18 anni non è stato studiato perché l’AMD
essudativa, la CRVO, la BRVO, la DME e la CNV miopica si verificano principalmente negli adulti.
Pertanto, il suo uso in questa fascia d’età non è pertinente.
Altri medicinali ed Afqlir
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza e allattamento
- Le donne in età fertile devono usare misure contraccettive efficaci durante il trattamento e per almeno tre mesi dopo l’ultima iniezione di Afqlir.
- Non vi sono esperienze sull’uso di aflibercept in donne in gravidanza. Afqlir non deve essere usato durante la gravidanza a meno che il beneficio potenziale non superi il rischio potenziale per il nascituro. Se è in corso una gravidanza o sta pianificando una gravidanza, ne discuta con il medico prima del trattamento con Afqlir.
- Piccole quantità di Afqlir possono passare nel latte materno. Gli effetti sui neonati/lattanti allattati al seno non sono noti. Afqlir non è raccomandato durante l'allattamento. Se sta allattando al seno, ne discuta con il medico prima del trattamento con Afqlir.
Guida di veicoli e utilizzo di macchinari
Dopo l’iniezione di Afqlir potrebbe presentare alcuni disturbi visivi temporanei. Non guidi veicoli e
non utilizzi macchinati fino alla loro scomparsa.
Informazioni importanti su alcuni componenti di Afqlir
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose unitaria, cioè essenzialmente
‘senza sodio’.
Questo medicinale contiene 0,02 mg di polisorbato 20 in ogni dose somministrata di 0,05 mL
(50 microlitri) di soluzione. I polisorbati possono causare reazioni allergiche. Informi il medico se ha
allergie note.
3. Come prendere Afqlir
Un medico esperto nelle iniezioni oculari inietterà Afqlir nel suo occhio in condizioni asettiche (pulite
e sterili).
La dose raccomandata è 2 mg di aflibercept (0,05 mL).
Afqlir è somministrato come iniezione nell’occhio (iniezione intravitreale).
Prima dell’iniezione il medico userà un lavaggio oculare disinfettante per pulire accuratamente
l’occhio ed impedire le infezioni. Il medico le darà anche un anestetico locale per ridurre o bloccare il
dolore causato dall’iniezione.
AMD essudativa
I pazienti affetti da AMD essudativa saranno trattati con un’iniezione al mese per tre dosi successive,
seguita da un’altra iniezione dopo ulteriori 2 mesi.
Il suo dottore deciderà poi se l’intervallo di trattamento tra le iniezioni può essere mantenuto ogni due
mesi o debba essere gradualmente esteso di intervalli di 2 o 4 settimane se le sue condizioni sono
stabili.
Se le sue condizioni peggiorano, l’intervallo tra le iniezioni può essere accorciato.
A meno che lei non abbia problemi o non venga diversamente consigliato dal medico, non c’è motivo
per farsi visitare dal medico nel periodo compreso fra le iniezioni.
Edema maculare secondario a RVO (RVO di branca e RVO centrale)
Il medico determinerà la frequenza di trattamento più appropriata per lei. Il trattamento inizierà con
una serie di iniezioni mensili di Afqlir.
L’intervallo fra due iniezioni non deve essere inferiore ad un mese.
Se non ha avuto beneficio dopo trattamenti continui, il medico può decidere di interrompere il
trattamento con Afqlir.
Il trattamento verrà continuato con iniezioni mensili fino alla stabilizzazione della sua condizione.
Possono essere necessarie tre o più iniezioni mensili.
Il medico monitorerà la sua risposta al trattamento e potrà continuare il trattamento con un graduale
aumento degli intervalli tra le iniezioni per mantenere una condizione stabile. Se estendendo la durata
dell’intervallo tra i trattamenti le sue condizioni iniziassero a peggiorare, il medico ridurrà gli intervalli
tra i trattamenti di conseguenza.
Sulla base della risposta individuale al trattamento, il medico potrà decidere quando fissare esami di
controllo e trattamenti.
Edema maculare diabetico (DME)
I pazienti affetti da DME saranno trattati con un’iniezione al mese per le prime cinque dosi
consecutive, seguite da un’iniezione ogni 2 mesi.
L’intervallo tra i trattamenti può essere mantenuto ogni 2 mesi o aggiustato per la sua condizione, in
base agli esami eseguiti dal medico. Il medico deciderà la frequenza degli esami di follow-up.
Il medico può decidere di sospendere il trattamento con Afqlir, qualora si determini che lei non sta
traendo beneficio nel continuare il trattamento.
CNV miopica
I pazienti con CNV miopica verranno trattati con una singola iniezione. Lei riceverà altre iniezioni
solo se gli esami effettuati dal medico indicano che la malattia non è migliorata.
L’intervallo tra due iniezioni non deve essere inferiore ad un mese.
Se la malattia sparisce e poi ricompare, il medico potrebbe riprendere il trattamento.
Il medico stabilirà il programma degli esami di controllo.
preparare e somministrare Afqlir agli adulti”.
Se dimentica di prendere Afqlir
Prenda un nuovo appuntamento per eseguire gli esami e l’iniezione.
Se interrompe il trattamento con Afqlir
Consulti il medico prima di interrompere il trattamento.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Si possono potenzialmente verificare reazioni allergiche(ipersensibilità), che possono essere gravi e
necessitare di ricorso immediato al medico.
Con la somministrazione di aflibercept, possono verificarsi alcuni effetti indesiderati a carico degli
occhi, che sono dovuti alla procedura d’iniezione. Alcuni di essi possono essere gravie includono
cecità, una grave infezione o infiammazione all’interno dell’occhio(endoftalmite), distacco,
lacerazione o sanguinamento dello strato sensibile alla luce nella parte posteriore dell’occhio
(distacco o lacerazione retinica), opacizzazione del cristallino(cataratta), sanguinamento all’interno
dell’occhio(emorragia vitreale), distacco dalla retina della sostanza gelatinosa presente all’interno
dell’occhio(distacco vitreale), e aumento della pressione all’interno dell’occhio,vedere
paragrafo 2. Questi gravi effetti indesiderati a carico degli occhi si sono verificati in meno
di 1 iniezione su 1.900 negli studi clinici.
Se riscontra un’improvvisa diminuzione della vista, o un aumento del dolore e arrossamento
dell’occhio dopo l’iniezione, contatti il medico immediatamente.
Elenco degli effetti indesiderati riferiti
Di seguito è riportato un elenco degli effetti indesiderati riferiti come potenzialmente correlati alla
procedura di iniezione o al medicinale. Non si allarmi, potrebbe non presentare nessuno di essi. Parli
sempre con il medico di eventuali effetti indesiderati sospetti.
Effetti indesiderati molto comuni(possono interessare più di 1 persona su 10):
- peggioramento della vista
- sanguinamento nella parte posteriore dell’occhio (emorragia retinica)
- occhio iniettato di sangue causato dal sanguinamento da piccoli vasi sanguigni negli strati esterni dell’occhio
- dolore all’occhio
Effetti indesiderati comuni(possono interessare fino ad 1 persona su 10):
- distacco o rottura di uno degli strati nella parte posteriore dell’occhio, che causano lampi di luce con mosche volanti e a volte portano alla perdita della vista (lacerazione epiteliale dell’epitelio retinico* distacco, distacco retinico/lacerazione) o *Condizioni note per essere associate a degenerazione maculare essudativa correlata all’età (AMD), osservate solo in pazienti affetti da AMD essudativa.
- degenerazione della retina che causa vista disturbata
- sanguinamento nell’occhio (emorragia vitreale)
- alcune forme di opacizzazione del cristallino (cataratta)
- danni allo strato più esterno del globo oculare (la cornea)
- aumento della pressione oculare
- visione di macchie in movimento (mosche volanti)
- distacco dalla retina della sostanza gelatinosa interna all’occhio (distacco vitreale, che causa
lampi di luce con mosche volanti)
- sensazione di avere qualcosa nell’occhio
- aumento della produzione di lacrime
- gonfiore della palpebra
- sanguinamento in sede di iniezione
- arrossamento dell’occhio
Effetti indesiderati non comuni(possono interessare fino a 1 persona su 100):
- reazioni allergiche (ipersensibilità)** o ** Sono state segnalate reazioni allergiche come eruzioni cutanee, prurito, orticaria ed alcuni casi di reazione allergica grave (anafilattica/anafilattoide).
- grave infiammazione o infezione all’interno dell’occhio (endoftalmite)
- infiammazione dell’iride o di altre parti dell’occhio (irite, uveite, iridociclite, bagliore in camera anteriore)
- strana sensazione nell’occhio
- irritazione della palpebra
- gonfiore dello strato più esterno del globo oculare (cornea)
Effetti indesiderati rari(possono interessare fino ad 1 persona su 1.000):
- cecità
- opacizzazione del cristallino a seguito di una lesione (cataratta traumatica)
- infiammazione della sostanza gelatinosa all’interno dell’occhio
- pus nell’occhio
Negli studi clinici è stata rilevata un’aumentata incidenza di sanguinamenti da piccoli vasi sanguigni
nello strato esterno dell’occhio (emorragia della congiuntiva) in pazienti affetti da degenerazione
maculare essudativa correlata all’età (AMD) trattati con i medicinali per fluidificare il sangue. Questa
aumentata incidenza era comparabile fra i pazienti trattati con ranibizumab e quelli trattati con
aflibercept.
L’uso sistemico di inibitori del fattore di crescita endoteliale vascolare (VEGF), che sono sostanze
simili a quelle contenute in Afqlir, è potenzialmente correlato al rischio di coaguli sanguigni che
bloccano i vasi sanguigni (eventi tromboembolici arteriosi) che possono causare un attacco cardiaco o
un ictus. Vi è un rischio potenziale che tali eventi si verifichino in seguito all’iniezione di Afqlir
nell’occhio.
Come con tutte le proteine usate a scopo terapeutico, con Afqlir è possibile che si scateni una reazione
immunitaria (formazione di anticorpi).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il Sistema Nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati lei può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Afqlir
- Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo “Scad.” / “EXP”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Conservare in frigorifero (2 °C - 8 °C). Non congelare.
- Il blister chiuso può essere conservato fuori dal frigorifero ad una temperatura inferiore a 30 °C per un massimo di 14 giorni.
- Conservare nella confezione originale per proteggere il medicinale dalla luce.
- Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Afqlir
- Il principio attivo è aflibercept. Ogni siringa preriempita contiene 6,6 mg di aflibercept in 0,165 mL di soluzione. Si fornisce così una quantità utilizzabile per la somministrazione di una dose singola di 0,05 mL contenenti 2 mg di aflibercept.
- Gli altri componenti sono: polisorbato 20 (E432), istidina, L-istidina monocloridrato monoidrato, trialosio diidrato, sodio idrossido (per la regolazione del pH), acido cloridrico (per la regolazione del pH), acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Afqlir e contenuto della confezione
Afqlir è una soluzione iniettabile (preparazione per iniezione) in siringa preriempita (vetro di tipo I)
marcata con una linea di dosaggio, con un tappo dello stantuffo (gomma elastomerica) e un adattatore
Luer lock con cappuccio per la punta (gomma elastomerica). L’aspetto della soluzione è limpido, da
incolore a leggermente marroncino-giallo.
Confezione da 1 siringa preriempita.
Titolare dell’autorizzazione all’immissione in commercio
Sandoz GmbH
Biochemiestr. 10
6250 Kundl
Austria
Produttore
Alcon-Couvreur N.V.
Rijksweg 14
Puurs-Sint-Amands, 2870
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Sandoz nv/sa
Tél/Tel: +32 2 722 97 97
Lietuva
Sandoz Pharmaceuticals d.d filialas
Tel: +370 5 2636 037
България
Сандоз България КЧТ
Тел.: +359 2 970 47 47
Luxembourg/Luxemburg
Sandoz nv/sa (Belgique/Belgien)
Tél/Tel.: +32 2 722 97 97
Česká republika
Sandoz s.r.o.
Tel: +420 225 775 111
Magyarország
Sandoz Hungária Kft.
Tel.: +36 1 430 2890
Danmark/Norge/Ísland/Sverige
Sandoz A/S
Tlf/Sími/Tel: +45 63 95 10 00
Malta
Sandoz Pharmaceuticals d.d.
Tel: +35699644126
Deutschland
Hexal AG
Tel: +49 8024 908 0
Nederland
Sandoz B.V.
Tel: +31 36 52 41 600
Eesti
Sandoz d.d. Eesti filiaal
Tel: +372 665 2400
Österreich
Sandoz GmbH
Tel: +43 5338 2000
Polska
Sandoz Polska Sp. z o.o.
Tel.: +48 22 209 70 00
España
Sandoz Farmacéutica, S.A.
Tel: +34 900 456 856
Ελλάδα
SANDOZ HELLAS ΜΟΝΟΠΡΟΣΩΠΗ Α.Ε.
Τηλ: +30 216 600 5000
Portugal
Sandoz Farmacêutica Lda.
Tel: +351 21 000 86 00
France
Sandoz SAS
Tél: +33 1 49 64 48 00
România
Sandoz SRL
Tel: +40 21 407 51 60
Hrvatska
Sandoz d.o.o.
Tel: +385 1 23 53 111
Slovenija
Sandoz farmacevtska družba d.d.
Tel: +386 1 580 29 02
Ireland
Rowex Ltd.
Tel: + 353 27 50077
Slovenská republika
Sandoz d.d. - organizačná zložka
Tel: +421 2 48 200 600
Italia
Sandoz S.p.A.
Tel: +39 02 96541
Suomi/Finland
Sandoz A/S
Puh/Tel: +358 10 6133 400
Κύπρος
SANDOZ HELLAS ΜΟΝΟΠΡΟΣΩΠΗ Α.Ε.
(Ελλάδα)
Τηλ: +30 216 600 5000
United Kingdom (Northern Ireland)
Sandoz GmbH (Austria)
Tel: +43 5338 2000
Latvija
Sandoz d.d. Latvia filiāle
Tel: +371 67 892 006
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: https://www.ema.europa.eu .
--------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
La siringa preriempita contiene più della dose raccomandata di 2 mg di aflibercept (equivalente
a 0,05 mL). Il volume in eccesso deve essere eliminato prima della somministrazione.
Istruzioni per l’uso della siringa preriempita:
Conservazione e ispezione
| Conservare Afqlir in frigorifero a 2 °C – 8 °C; non congelare. Tenere la siringa preriempita nell’imballaggio esterno per proteggere il o medicinale dalla luce. | |
 | c Prima dell’uso, il blister chiuso di Afqlir può essere conservato ad una temperatura inferiore a 30 °C per un massimo di 14 giorni. Una volta a aperto il blister, procedere in condizioni asettiche. |
 | m Afqlir è una soluzione limpida da incolore a leggermente marroncina- gialla. |
| r a Prima della somministrazione, la soluzione deve essere ispezionata visivamente, per verificare la presenza di particelle estranee, torbidità F e/o scolorimento o qualsiasi variazione dell’aspetto. Nel caso si verifichi ciò, il prodotto va eliminato. l Non usare se la confezione o la siringa preriempita sono danneggiate o scadute. |
Preparazione e somministrazione
Ogni siringa preriempita deve essere usata esclusivamente per il trattamento di un singolo occhio.
Non aprire il blister sterile della siringa preriempita al di fuori della camera pulita di
somministrazione.
Per l’iniezione intravitreale si deve utilizzare un ago per iniezione da 30 G x ½ pollice
.
Usare una tecnica asettica per eseguire i seguenti passaggi.
Descrizione della siringa preriempita
Impugnatura
Impugnatura
per le dita
per le dita
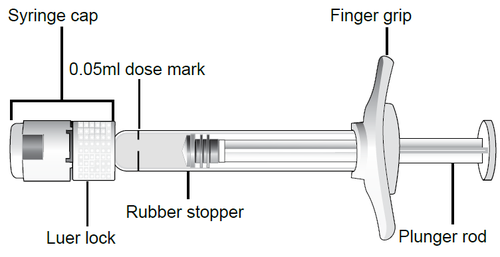
Cappuccio
della siringa
Segno della dose da
0,05 mL
Tappo di gomma
Adattatore Luer lock Asta dello
stantuffo
| 1 | g e | Quando si è pronti per somministrare Afqlir, aprire la scatola ed estrarre il blister sterilizzato. Aprire con cautela il blister sterilizzato garantendo la sterilità del suo contenuto. Tenere la siringa sul vassoio sterile fino a quando non si è pronti per il montaggio. |
| 2 | A | Usando una tecnica asettica, togliere la siringa dal blister sterilizzato. |
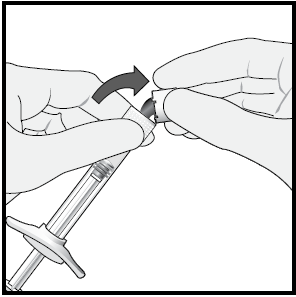
3 Per rimuovere il cappuccio della siringa, tenere la siringa con
una mano e afferrare il cappuccio con il pollice e l’indice
dell’altra mano. Staccare (non ruotare o girare) il cappuccio
della siringa.
Nota:per non compromettere la sterilità del prodotto, non
tirare indietro lo stantuffo.
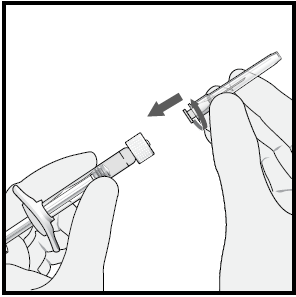
4 Usando una tecnica asettica, inserire l’ago per iniezione
da 30 G x ½ pollice ruotandolo saldamente sulla punta della
siringa con adattatore Luer-lock.
5 Tenendo la siringa con l’ago rivolto verso l’alto, controllare
l’assenza di bolle d’aria al suo interno.
Se vi sono bolle, picchiettare delicatamente la siringa con il
dito per farle salire in superficie.
Rimuovere con attenzione il cappuccio dell’ago tirandolo via.
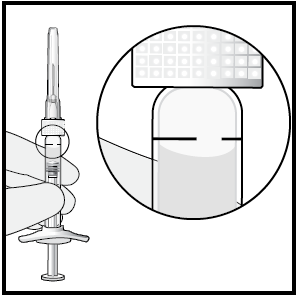
6 Eliminare tutte le bolle ed espellere il medicinale in eccesso,
premendo lentamente lo stantuffo per allineare la base della
punta arrotondata dello stantuffo con la linea di dosaggio
posta sulla siringa (equivalente a 50 microlitri).
Nota:iniettare immediatamentedopo aver preparato la
siringa.
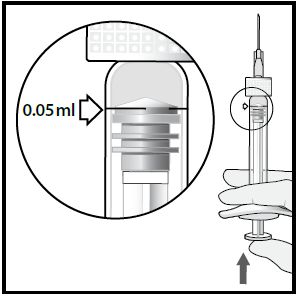
7 Iniettare lentamente fino a quando il tappo di gomma
raggiunge la fine della siringa per somministrare il volume di
0,05 mL. Confermare la somministrazione dell’intera
dosecontrollando che il tappo di gomma abbia raggiunto la
fine del corpo della siringa.
8 La siringa preriempita è esclusivamente monouso.
L’estrazione di dosi multiple da una siringa preriempita può
aumentare il rischio di contaminazione e conseguente
infezione.
Il medicinale inutilizzato e i rifiuti derivati da tale medicinale
devono essere smaltiti in conformità alla normativa locale
vigente.
Afqlir 40 mg/mL soluzione iniettabile in flaconcino
aflibercept
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Afqlir e a cosa serve
- 2. Cosa deve sapere prima di prendere Afqlir
- 3. Come prendere Afqlir
- 4. Possibili effetti indesiderati
- 5. Come conservare Afqlir
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Afqlir e a cosa serve
Afqlir è una soluzione che viene iniettata nell’occhio per trattare negli adulti malattie dell’occhio
chiamate
- degenerazione maculare neovascolare correlata all’età (AMD essudativa),
- compromissione della vista dovuta a edema maculare secondario a occlusione della vena retinica (RVO di branca (BRVO) o RVO centrale (CRVO)),
- compromissione della vista dovuta a edema maculare diabetico ( Diabetic Macular Oedema- DME),
- compromissione della vista dovuta a neovascolarizzazione coroideale miopica (CNV miopica).
Aflibercept, il principio attivo di Afqlir, blocca l’attività di un gruppo di fattori, noti come VEGF-A
(Fattore di crescita endoteliale vascolare A) e PlGF (Fattore di crescita placentare).
Nei pazienti affetti da AMD essudativa e CNV miopica, questi fattori, se in eccesso, sono coinvolti
nella formazione anormale di nuovi vasi sanguigni nell’occhio. I nuovi vasi sanguigni possono causare
la fuoriuscita di componenti del sangue nell’occhio ed eventuali danni ai tessuti oculari responsabili
della vista.
Nei pazienti affetti da CRVO si forma un blocco nel principale vaso sanguigno che trasporta via il
sangue lontano dalla retina. I livelli di VEGF aumentano in risposta a tale evento, causando la
fuoriuscita di liquido nella retina e quindi causando il rigonfiamento della macula (la porzione della
retina responsabile della visione fine), chiamato edema maculare. Quando la macula si gonfia con il
liquido, la visione centrale diventa sfocata.
Nei pazienti con la BRVO, uno o più rami (branche) del vaso sanguigno principale che trasporta via il
sangue dalla retina è bloccato. I livelli di VEGF sono di conseguenza elevati e provocano la fuoriuscita
del liquido nella retina, causando l’edema maculare.
L’edema maculare diabetico è un ringonfiamento della retina che si verifica in pazienti diabetici a
causa della fuoriuscita di liquido dai vasi sanguigni presenti nella macula. La macula è la porzione
della retina responsabile della visione distinta. Quando la macula si riempie di liquido, la visione
centrale diventa offuscata.
È stato dimostrato che Afqlir blocca la crescita di nuovi vasi sanguigni anormali nell’occhio, da cui
spesso fuoriescono liquidi o sangue. Afqlir può aiutare a stabilizzare e, in molti casi, a migliorare la
perdita di vista correlata all'AMD essudativa, alla CRVO, alla BRVO, alla DME e alla CNV miopica.
2. Cosa deve sapere prima di prendere Afqlir
Non prenda Afqlir
- se è allergico ad aflibercept o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione in corso o sospetta all’interno o intorno all’occhio (infezione oculare o perioculare).
- se ha una grave infiammazione dell’occhio (indicata da dolore o arrossamento).
Avvertenze e precauzioni
Si rivolga al medico prima di prendere Afqlir:
- se ha un glaucoma,
- se le è mai capitato di vedere lampi di luce o mosche volanti e se il numero e la dimensione delle mosche volanti è aumentato improvvisamente.
- se è stato effettuato o è previsto un intervento chirurgico sull’occhio nelle ultime o nelle prossime quattro settimane.
- se ha una forma grave di CRVO o BRVO (CRVO o BRVO ischemica), il trattamento con Afqlir non è raccomandato.
È inoltre importante che lei sappia che:
- la sicurezza e l’efficacia di aflibercept quando viene somministrato a entrambi gli occhi contemporaneamente non sono state studiate e se viene somministrato in questo modo può portare ad un aumento del rischio di sperimentare effetti indesiderati.
- le iniezioni di Afqlir possono scatenare in alcuni pazienti un aumento della pressione dell’occhio (pressione intraoculare) nei 60 minuti successivi all’iniezione. Il medico monitorerà tale effetto dopo ogni iniezione.
- se sviluppa un’infezione o un’infiammazione all’interno dell’occhio (endoftalmite) o altre complicanze, può avere dolore all’occhio o aumento del malessere, peggioramento dell’arrossamento dell’occhio, offuscamento o riduzione della vista e aumento della sensibilità alla luce. È importante che ogni sintomo sia diagnosticato e trattato il prima possibile.
- il medico verificherà se presenta altri fattori di rischio che possono aumentare la possibilità di distacco o rottura di uno degli stati nella parte posteriore dell’occhio (distacco o rottura retinica, e distacco o rottura dell’epitelio pigmentato retinico), in questi casi Afqlir le verrà somministrato con cautela.
- Afqlir non deve essere usato in gravidanza a meno che il beneficio potenziale non superi il rischio potenziale per il nascituro.
- le donne in età fertile devono usare misure contraccettive efficaci durante il trattamento e per almeno ulteriori tre mesi dopo l’ultima iniezione di Afqlir.
L’uso sistemico di inibitori del VEGF, sostanze simili a quelle contenute in Afqlir, è potenzialmente
correlato al rischio che coaguli di sangue blocchino i vasi sanguigni (eventi tromboembolici arteriosi)
determinando un attacco cardiaco o un ictus. Esiste un rischio teorico che si verifichino tali eventi in
seguito all’iniezione di Afqlir nell’occhio. Vi sono dati limitati sulla sicurezza del trattamento di
pazienti affetti da CRVO, BRVO, DME e CNV miopica che hanno avuto un ictus o un mini-ictus
(attacco ischemico transitorio) o un attacco cardiaco negli ultimi 6 mesi. Se una di queste situazioni si
applica al suo caso, Afqlir le verrà somministrato con cautela.
L’esperienza è limitata con il trattamento di
- pazienti affetti da DME dovuta a diabete di tipo I.
- diabetici con valori medi elevati di glicemia (HbA1c superiore al 12%).
- diabetici affetti da una malattia dell’occhio causata dal diabete chiamata retinopatia proliferativa diabetica.
Non vi è alcuna esperienza con il trattamento di
- pazienti con infezioni acute.
- pazienti con altre malattie dell’occhio come distacco della retina o foro maculare.
- diabetici con pressione sanguigna alta non controllata.
- pazienti non asiatici con CNV miopica.
- pazienti precedentemente trattati per la CNV miopica.
- pazienti con lesioni situate al di fuori della parte centrale della macula (lesioni extrafoveali) per la CNV miopica.
Se riscontra in lei uno dei casi sopra descritti, il medico prenderà in considerazione questa assenza di
informazioni quando la tratterà con Afqlir.
Bambini e adolescenti
L’uso di Afqlir in bambini o adolescenti di età inferiore a 18 anni non è stato studiato perché l’AMD
essudativa, la CRVO, la BRVO, la DME e la CNV miopica si verificano principalmente negli adulti.
Pertanto, il suo uso in questa fascia d’età non è pertinente.
Altri medicinali ed Afqlir
Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro
medicinale.
Gravidanza e allattamento
- Le donne in età fertile devono usare misure contraccettive efficaci durante il trattamento e per almeno tre mesi dopo l’ultima iniezione di Afqlir.
- Non vi sono esperienze sull’uso di aflibercept in donne in gravidanza. Afqlir non deve essere usato durante la gravidanza a meno che il beneficio potenziale non superi il rischio potenziale per il nascituro. Se è in corso una gravidanza o sta pianificando una gravidanza, ne discuta con il medico prima del trattamento con Afqlir.
- Piccole quantità di Afqlir possono passare nel latte materno. Gli effetti sui neonati/lattanti allattati al seno non sono noti. Afqlir non è raccomandato durante l'allattamento. Se sta allattando al seno, ne discuta con il medico prima del trattamento con Afqlir.
Guida di veicoli e utilizzo di macchinari
Dopo l’iniezione di Afqlir potrebbe presentare alcuni disturbi visivi temporanei. Non guidi veicoli e
non utilizzi macchinati fino alla loro scomparsa.
Informazioni importanti su alcuni eccipienti di Afqlir
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose unitaria, cioè essenzialmente
‘senza sodio’.
Questo medicinale contiene 0,02 mg di polisorbato 20 in ogni dose somministrata di 0,05 mL
(50 microlitri) di soluzione. I polisorbati possono causare reazioni allergiche. Informi il medico se ha
allergie note.
3. Come prendere Afqlir
Un medico esperto nelle iniezioni oculari inietterà Afqlir nel suo occhio in condizioni asettiche (pulite
e sterili).
La dose raccomandata è 2 mg di aflibercept (0,05 mL).
Afqlir è somministrato come iniezione nell’occhio (iniezione intravitreale).
Prima dell’iniezione il medico userà un lavaggio oculare disinfettante per pulire accuratamente
l’occhio ed impedire le infezioni. Il medico le darà anche un anestetico locale per ridurre o bloccare il
dolore causato dall’iniezione.
AMD essudativa
I pazienti affetti da AMD essudativa saranno trattati con un’iniezione al mese per tre dosi successive,
seguita da un’altra iniezione dopo ulteriori 2 mesi.
Il suo dottore deciderà poi se l’intervallo di trattamento tra le iniezioni può essere mantenuto ogni due
mesi o debba essere gradualmente esteso di intervalli di 2 o 4 settimane se le sue condizioni sono
stabili.
Se le sue condizioni peggiorano, l’intervallo tra le iniezioni può essere accorciato.
A meno che lei non abbia problemi o non venga diversamente consigliato dal medico, non c’è motivo
per farsi visitare dal medico nel periodo compreso fra le iniezioni.
Edema maculare secondario a RVO (RVO di branca e RVO centrale)
Il medico determinerà la frequenza di trattamento più appropriata per lei. Il trattamento inizierà con
una serie di iniezioni mensili di Afqlir.
L’intervallo fra due iniezioni non deve essere inferiore ad un mese.
Se non ha avuto beneficio dopo trattamenti continui, il medico può decidere di interrompere il
trattamento con Afqlir.
Il trattamento verrà continuato con iniezioni mensili fino alla stabilizzazione della sua condizione.
Possono essere necessarie tre o più iniezioni mensili.
Il medico monitorerà la sua risposta al trattamento e potrà continuare il trattamento con un graduale
aumento degli intervalli tra le iniezioni per mantenere una condizione stabile. Se estendendo la durata
dell’intervallo tra i trattamenti le sue condizioni iniziassero a peggiorare, il medico ridurrà gli intervalli
tra i trattamenti di conseguenza.
Sulla base della risposta individuale al trattamento, il medico potrà decidere quando fissare esami di
controllo e trattamenti.
Edema maculare diabetico (DME)
I pazienti affetti da DME saranno trattati con un’iniezione al mese per le prime cinque dosi
consecutive, seguite da un’iniezione ogni 2 mesi.
L’intervallo tra i trattamenti può essere mantenuto ogni 2 mesi o aggiustato per la sua condizione, in
base agli esami eseguiti dal medico. Il medico deciderà la frequenza degli esami di follow-up.
Il medico può decidere di sospendere il trattamento con Afqlir, qualora si determini che lei non sta
traendo beneficio nel continuare il trattamento.
CNV miopica
I pazienti con CNV miopica verranno trattati con una singola iniezione. Lei riceverà altre iniezioni
solo se gli esami effettuati dal medico indicano che la malattia non è migliorata.
L’intervallo tra due iniezioni non deve essere inferiore ad un mese.
Se la malattia sparisce e poi ricompare, il medico potrebbe riprendere il trattamento.
Il medico stabilirà il programma degli esami di controllo.
Se dimentica di prendere Afqlir
Prenda un nuovo appuntamento per eseguire gli esami e l’iniezione.
Se interrompe il trattamento con Afqlir
Consulti il medico prima di interrompere il trattamento.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Si possono potenzialmente verificare reazioni allergiche(ipersensibilità), che possono essere gravi e
necessitare di ricorso immediato al medico.
Con la somministrazione di Afqlir, possono verificarsi alcuni effetti indesiderati a carico degli occhi,
che sono dovuti alla procedura d’iniezione. Alcuni di essi possono essere gravie includono cecità,
una grave infezione o infiammazione all’interno dell’occhio(endoftalmite), distacco, lacerazione
o sanguinamento dello strato sensibile alla luce nella parte posteriore dell’occhio(distacco o
lacerazione retinica), opacizzazione del cristallino(cataratta), sanguinamento all’interno
dell’occhio(emorragia vitreale), distacco dalla retina della sostanza gelatinosa presente all’interno
dell’occhio(distacco vitreale), e aumento della pressione all’interno dell’occhio,vedere
paragrafo 2. Questi gravi effetti indesiderati a carico degli occhi si sono verificati in meno
di 1 iniezione su 1.900 negli studi clinici.
Se riscontra un’improvvisa diminuzione della vista, o un aumento del dolore e arrossamento
dell’occhio dopo l’iniezione, contatti il medico immediatamente.
Elenco degli effetti indesiderati riferiti
Di seguito è riportato un elenco degli effetti indesiderati riferiti come potenzialmente correlati alla
procedura di iniezione o al medicinale. Non si allarmi, potrebbe non presentare nessuno di essi. Parli
sempre con il medico di eventuali effetti indesiderati sospetti.
Effetti indesiderati molto comuni(si possono manifestare in più di 1 persona su 10):
- peggioramento della vista
- sanguinamento nella parte posteriore dell’occhio (emorragia retinica)
- occhio iniettato di sangue causato dal sanguinamento da piccoli vasi sanguigni negli strati esterni dell’occhio
- dolore all’occhio
Effetti indesiderati comuni(si possono manifestare fino ad 1 persona su 10):
- distacco o rottura di uno degli strati nella parte posteriore dell’occhio, che causano lampi di luce con mosche volanti e a volte portano alla perdita della vista (lacerazione epiteliale dell’epitelio retinico*/ distacco, distacco retinico/lacerazione)
- degenerazione della retina (che causa vista disturbata)
- sanguinamento nell’occhio (emorragia vitreale)
- alcune forme di opacizzazione del cristallino (cataratta)
- danni allo strato più esterno del globo oculare (la cornea)
- aumento della pressione oculare
- visione di macchie in movimento (mosche volanti)
- distacco dalla retina della sostanza gelatinosa interna all’occhio (distacco vitreale, che causa lampi di luce con mosche volanti)
- sensazione di avere qualcosa nell’occhio
- aumento della produzione di lacrime
- gonfiore della palpebra
- sanguinamento in sede di iniezione
- arrossamento dell’occhio Condizioni note per essere associate a degenerazione maculare essudativa correlata all’età (AMD), osservate solo in pazienti affetti da AMD essudativa.
Effetti indesiderati non comuni(si possono manifestare fino a 1 persona su 100):
- reazioni allergiche (ipersensibilità)**
- grave infiammazione o infezione all’interno dell’occhio (endoftalmite)
- infiammazione dell’iride o di altre parti dell’occhio (irite, uveite, iridociclite, bagliore in camera anteriore)
- strana sensazione nell’occhio
- irritazione della palpebra gonfiore dello strato più esterno del globo oculare (cornea) ** Sono state segnalate reazioni allergiche come eruzioni cutanee, prurito, orticaria ed alcuni casi di reazione allergica grave (anafilattica/anafilattoide).
Effetti indesiderati rari(si possono manifestare fino ad 1 persona su 1.000):
- cecità
- opacizzazione del cristallino a seguito di una lesione (cataratta traumatica)
- infiammazione della sostanza gelatinosa all’interno dell’occhio
- pus nell’occhio
Negli studi clinici è stata rilevata un’aumentata incidenza di sanguinamenti da piccoli vasi sanguigni
nello strato esterno dell’occhio (emorragia della congiuntiva) in pazienti affetti da degenerazione
maculare essudativa correlata all’età (AMD) trattati con i medicinali per fluidificare il sangue. Questa
aumentata incidenza era comparabile fra i pazienti trattati con ranibizumab e quelli trattati con
aflibercept.
L’uso sistemico di inibitori del fattore di crescita endoteliale vascolare (VEGF), che sono sostanze
simili a quelle contenute in Afqlir, è potenzialmente correlato al rischio di coaguli sanguigni che
bloccano i vasi sanguigni (eventi tromboembolici arteriosi) che possono causare un attacco cardiaco o
un ictus. Vi è un rischio potenziale che tali eventi si verifichino in seguito all’iniezione di Afqlir
nell’occhio.
Come con tutte le proteine usate a scopo terapeutico, con Afqlir è possibile che si scateni una reazione
immunitaria (formazione di anticorpi).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il Sistema Nazionale di
segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati lei può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Afqlir
- Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo “Scad.” / “EXP”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Conservare in frigorifero (2 °C - 8 °C). Non congelare.
- Il flaconcino chiuso può essere conservato fuori dal frigorifero ad una temperatura inferiore a 30 °C per un massimo di 14 giorni.
- Conservare nella confezione originale per proteggere il medicinale dalla luce.
- Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Afqlir
- Il principio attivo è aflibercept. Ogni flaconcino contiene 9,6 mg di aflibercept in 0,240 mL di soluzione. Si fornisce così una quantità utilizzabile per la somministrazione di una dose singola di 0,05 mL contenenti 2 mg di aflibercept.
- Gli altri componenti sono: polisorbato 20 (E432), istidina, L-istidina monocloridrato monoidrato, trialosio diidrato, sodio idrossido (per la regolazione del pH), acido cloridrico (per la regolazione del pH), acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Afqlir e contenuto della confezione
Afqlir è una soluzione iniettabile (preparazione per iniezione) in un flaconcino (vetro di tipo I) con un
tappo (gomma elastomerica) e un ago con filtro da 18 G. L’aspetto della soluzione è limpido, da
incolore a leggermente marroncino-giallo.
Confezione da 1 flaconcino + 1 ago con filtro.
Titolare dell’autorizzazione all’immissione in commercio
Sandoz GmbH
Biochemiestr. 10
6250 Kundl
Austria
Produttore
Sandoz GmbH
Biochemiestr. 10
6250 Kundl
Austria
Lek Pharmaceuticals d.d.
Verovškova ulica 57
1000 Lubiana
Slovenia
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Sandoz nv/sa
Tél/Tel: +32 2 722 97 97
Lietuva
Sandoz Pharmaceuticals d.d filialas
Tel: +370 5 2636 037
България
Сандоз България КЧТ
Тел.: +359 2 970 47 47
Luxembourg/Luxemburg
Sandoz nv/sa (Belgique/Belgien)
Tél/Tel.: +32 2 722 97 97
Česká republika
Sandoz s.r.o.
Tel: +420 225 775 111
Magyarország
Sandoz Hungária Kft.
Tel.: +36 1 430 2890
Danmark/Norge/Ísland/Sverige
Sandoz A/S
Tlf/Sími/Tel: +45 63 95 10 00
Malta
Sandoz Pharmaceuticals d.d.
Tel: +35699644126
Deutschland
Hexal AG
Tel: +49 8024 908 0
Nederland
Sandoz B.V.
Tel: +31 36 52 41 600
Eesti
Sandoz d.d. Eesti filiaal
Tel: +372 665 2400
Österreich
Sandoz GmbH
Tel: +43 5338 2000
Polska
Sandoz Polska Sp. z o.o.
Tel.: +48 22 209 70 00
España
Sandoz Farmacéutica, S.A.
Tel: +34 900 456 856
Ελλάδα
SANDOZ HELLAS ΜΟΝΟΠΡΟΣΩΠΗ Α.Ε.
Τηλ: +30 216 600 5000
Portugal
Sandoz Farmacêutica Lda.
Tel: +351 21 000 86 00
France
Sandoz SAS
Tél: +33 1 49 64 48 00
România
Sandoz SRL
Tel: +40 21 407 51 60
Hrvatska
Sandoz d.o.o.
Tel: +385 1 23 53 111
Slovenija
Sandoz farmacevtska družba d.d.
Tel: +386 1 580 29 02
Ireland
Rowex Ltd.
Tel: + 353 27 50077
Slovenská republika
Sandoz d.d. - organizačná zložka
Tel: +421 2 48 200 600
Italia
Sandoz S.p.A.
Tel: +39 02 96541
Suomi/Finland
Sandoz A/S
Puh/Tel: +358 10 6133 400
Κύπρος
SANDOZ HELLAS ΜΟΝΟΠΡΟΣΩΠΗ Α.Ε.
(Ελλάδα)
Τηλ: +30 216 600 5000
United Kingdom (Northern Ireland)
Sandoz GmbH (Austria)
Tel: +43 5338 2000
Latvija
Sandoz d.d. Latvia filiāle
Tel: +371 67 892 006
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: https://www.ema.europa.eu .
--------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Il flaconcino contiene più della dose raccomandata di 2 mg di aflibercept (equivalente a 0,05 mL). Il
volume in eccesso deve essere eliminato prima della somministrazione.
Istruzioni per l’uso del flaconcino:
Conservazione e ispezione
Preparazione e somministrazione
Ogni flaconcino deve essere usato esclusivamente per il trattamento di un singolo occhio.
Per la preparazione e l’iniezione intravitreale sono necessari i seguenti dispositivi medici monouso:
- Un ago smussato con filtro sterile da 5 µm (18 G x 1 / pollice), sterile, fornito con il flaconcino
- Una siringa da 1 mL con un segno di dose da 0,05 mL, sterile
- Un ago per iniezione da 30 G x ½ pollice, sterile.
Usare una tecnica asettica per eseguire i seguenti passaggi.
Procedura d’iniezione
| c Conservare Afqlir in frigorifero a 2 °C – 8 °C; non congelare. Tenere a il flaconcino nell’imballaggio esterno per proteggere il medicinale dalla luce. | |
 | m Prima dell’uso, il flaconcino chiuso di Afqlir può essere conservato ad una temperatura inferiore a 30 °C per un massimo di 14 giorni. Una r volta aperto il flaconcino, procedere in condizioni asettiche. |
 | a F Afqlir è una soluzione limpida da incolore a leggermente marroncina- gialla. |
| l Prima della somministrazione, Afqlir deve essere ispezionato visivamente, per verificare la presenza di particelle estranee, torbidità e e/o scolorimento o qualsiasi variazione dell’aspetto. Nel caso si verifichi ciò, Afqlir va eliminato. d Non usare se la confezione, il flaconcino e/o altri dispositivi medici forniti sono danneggiati o scaduti. |
1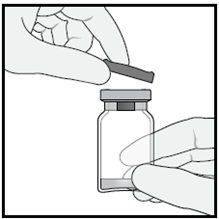 | e n z i a | Togliere il cappuccio in plastica dal flaconcino. |
2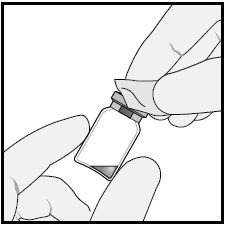 | A g | Pulire la parte superiore del flaconcino con una salvietta imbevuta d’alcol. |
3
Collegare l’ago da 18 G x 1 / pollice con filtro da 5 micron a
una siringa sterile con adattatore Luer-lock.
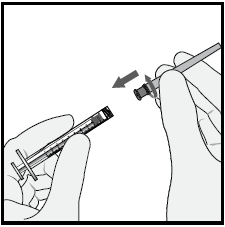
4 Spingere l’ago con filtro nel centro del tappo del flaconcino
finché l’ago sia completamente inserito nel flaconcino e la
punta tocchi il fondo o l’angolo sul fondo del flaconcino.
5 Usando una tecnica asettica, aspirare l'intero contenuto del
flaconcino di Afqlir nella siringa mantenendo il flaconcino in
posizione verticale, leggermente inclinato per facilitare la
completa aspirazione. Per evitare l’introduzione d’aria,
assicurarsi che l’angolo dell’ago con filtro sia completamente
immerso nel liquido. Tenere inclinato il flaconcino durante
l’aspirazione, tenendo l’angolo dell’ago con filtro
completamente immerso nel liquido.
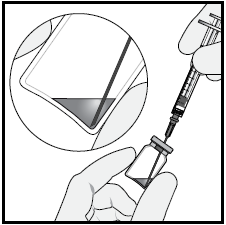
6 Assicurarsi che l’asta dello stantuffo sia tirata
sufficientemente all’indietro quando si svuota il flaconcino in
modo da svuotare completamente l’ago con filtro.
7 Togliere l’ago con filtro dalla siringa e smaltirlo in modo
adeguato.
Nota:l’ago con filtro nondeve essere usato per l’iniezione
intravitreale.
8 Collegare l’ago da iniezione da 30 G x ½ pollice alla siringa
ruotandolo saldamente sulla punta della siringa con adattatore
Luer-lock.
Rimuovere con attenzione il cappuccio dell’ago tirandolo via.
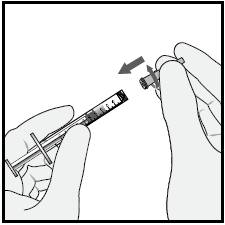
9 Tenendo la siringa con l’ago rivolto verso l’alto, controllare
l’assenza di bolle d’aria al suo interno. Se vi sono bolle,
picchiettare delicatamente la siringa con il dito per farle salire
in superficie.
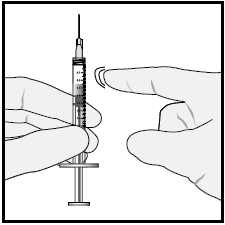
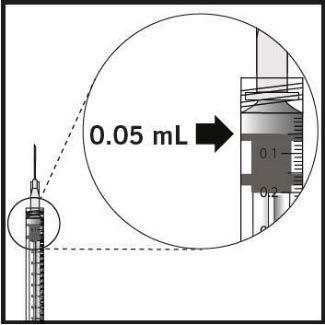
Per eliminare tutte le bolle ed espellere il medicinale in
eccesso, premere lentamentelo stantuffo in modo che la punta
dello stantuffo si allinei alla linea che segna 0,05 mLsulla
siringa .
Nota:iniettare immediatamentedopo la preparazione.
11 Iniettare lentamente fino a quando il tappo di gomma
raggiunge la fine della siringa per somministrare il volume di
0,05 mL. Confermare la somministrazione dell’intera dose
| controllando che il tappo di gomma abbia raggiunto la fine del corpo della siringa. | ||
| 12 | o Il flaconcino è esclusivamente monouso. L’estrazione di dosi multiple da un flaconcino può aumentare il rischio di c contaminazione e conseguente infezione. a Il medicinale inutilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. |
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a AFQLIRForma farmaceutica: Soluzione iniettabile, 40MG/MLPrincipio attivo: afliberceptProduttore: BAYER AGPrescrizione richiestaForma farmaceutica: Soluzione iniettabile in siringa pre-riempita, 120 MG/MLPrincipio attivo: brolucizumabProduttore: NOVARTIS EUROPHARM LIMITEDPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 10 mg/mlPrincipio attivo: ranibizumabProduttore: SAMSUNG BIOEPIS NL B.V.Prescrizione richiesta
Medici online per AFQLIR
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di AFQLIR — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














