
AMGEVITA


Come usare AMGEVITA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- AMGEVITA 20 mg soluzione iniettabile in siringa preriempita, 40 mg soluzione iniettabile in siringa preriempita
- AMGEVITA 40 mg soluzione iniettabile in penna preriempita
- AMGEVITA 20 mg soluzione iniettabile in siringa preriempita, 40 mg soluzione iniettabile in siringa preriempita, 80 mg soluzione iniettabile in siringa preriempita
- AMGEVITA 40 mg soluzione iniettabile in penna preriempita
- AMGEVITA 80 mg soluzione iniettabile in penna preriempita
AMGEVITA 20 mg soluzione iniettabile in siringa preriempita, 40 mg soluzione iniettabile in siringa preriempita
adalimumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Il medico le consegnerà una Scheda Promemoria per il Paziente, che contiene importanti informazioni sulla sicurezza, che ha bisogno di sapere prima della somministrazione di AMGEVITA e durante il trattamento con AMGEVITA. Conservi questa Scheda Promemoriaper il Paziente.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è AMGEVITA e a cosa serve
- 2. Cosa deve sapere prima di usare AMGEVITA
- 3. Come usare AMGEVITA
- 4. Possibili effetti indesiderati
- 5. Come conservare AMGEVITA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è AMGEVITA e a cosa serve
AMGEVITA contiene il principio attivo adalimumab, un medicinale che agisce sul sistema immunitario
(di difesa) dell’organismo.
AMGEVITA è indicato per il trattamento delle malattie infiammatorie di seguito elencate:
- Artrite reumatoide
- Artrite idiopatica giovanile poliarticolare
- Artrite correlata a entesite
- Spondilite anchilosante
- Spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante
- Artrite psoriasica
- Psoriasi a placche
- Idrosadenite suppurativa
- Malattia di Crohn
- Colite ulcerosa
- Uveite non infettiva
Il principio attivo contenuto in AMGEVITA, adalimumab, è un anticorpo monoclonale umano. Gli
anticorpi monoclonali sono proteine che si legano ad un bersaglio specifico.
Il bersaglio di adalimumab è una proteina denominata fattore di necrosi tumorale (TNFα), che è
coinvolto nel sistema immunitario (di difesa) ed è presente a concentrazioni maggiori nelle malattie
infiammatorie elencate sopra. Attraverso il legame al TNFα, AMGEVITA diminuisce il processo
infiammatorio di queste malattie.
Artrite reumatoide
L’artrite reumatoide è una patologia infiammatoria delle articolazioni.
AMGEVITA è usato per trattare l’artrite reumatoide negli adulti. Se soffre di artrite reumatoide di
grado da moderato a grave, inizialmente possono essere assunti altri farmaci modificanti la malattia,
quali il metotressato. Se la risposta a tali farmaci non è soddisfacente, le verrà dato AMGEVITA per
trattare l’artrite reumatoide.
AMGEVITA può essere anche utilizzato per il trattamento dell’artrite reumatoide grave, attiva e
progressiva senza precedente trattamento con metotressato.
AMGEVITA rallenta la progressione del danno alle cartilagini ed alle ossa delle articolazioni causato
dalla malattia e migliora la funzionalità fisica.
Generalmente AMGEVITA è usato con il metotressato. Se il medico decide che il trattamento con
metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Artrite idiopatica giovanile poliarticolare e artrite correlata a entesite
L’artrite idiopatica giovanile poliarticolare e l’artrite correlata a entesite sono malattie infiammatorie
delle articolazioni che di solito si manifestano per la prima volta durante l’infanzia.
AMGEVITA è usato per trattare l’artrite idiopatica giovanile poliarticolare nei pazienti dai 2 anni di età e
l’artrite correlata a entesite nei pazienti dai 6 anni di età. Alla diagnosi possono essere somministrati altri
farmaci modificanti la malattia, come il metotressato. Se la risposta a questi farmaci non dovesse
essere adeguata, le sarà somministrato AMGEVITA per il trattamento dell’artrite idiopatica
giovanile poliarticolare o dell’artrite correlata a entesite.
Spondilite anchilosante e spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante
La spondilite anchilosante e la spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante sono infiammazioni della colonna vertebrale.
AMGEVITA è usato per trattare la spondilite anchilosante e la spondiloartrite assiale senza
evidenza radiografica della spondilite anchilosante negli adulti. Se è affetto da spondilite
anchilosante o da spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante,
assumerà prima altri farmaci. Nel caso in cui non sia in grado di ottenere una risposta adeguata
con questi farmaci, assumerà AMGEVITA per ridurre i segni ed i sintomi della malattia.
Artrite psoriasica
L’artrite psoriasica è un’infiammazione delle articolazioni associata alla psoriasi.
AMGEVITA è usato per trattare l’artrite psoriasica negli adulti. AMGEVITA rallenta il danno alla
cartilagine ed alle ossa delle articolazioni causato dalla malattia e migliora la funzionalità fisica.
Psoriasi a placche in adulti e bambini
La psoriasi a placche è una condizione della cute che causa chiazze rossastre, squamose e indurite di
cute ricoperta da squame argentee. La psoriasi a placche può anche colpire le unghie, provocandone la
rottura, l’ispessimento e il sollevamento dal letto dell’unghia, che può essere doloroso. Si ritiene che la
psoriasi sia causata da un problema del sistema immunitario del corpo che conduce ad un aumento
della produzione di cellule cutanee.
AMGEVITA è usato per trattare la psoriasi a placche di grado da moderato a severo negli adulti.
AMGEVITA è inoltre utilizzato per trattare la psoriasi a placche grave in bambini ed adolescenti da 4
a 17 anni per i quali la terapia topica e le fototerapie non abbiano funzionato in modo ottimale o non
siano indicate.
Idrosadenite suppurativa in adulti e adolescenti
L’idrosadenite suppurativa (chiamata a volte acne inversa) è una malattia infiammatoria cronica della
cute e spesso è dolorosa. I sintomi possono includere noduli dolorosi e ascessi (foruncoli) che
possono drenare pus. Più frequentemente colpisce aree specifiche della cute, come la regione
sottomammaria, le ascelle, l’interno cosce, l’inguine e le natiche. Nelle aree colpite si possono
anche formare delle cicatrici.
AMGEVITA è utilizzato per trattare l’idrosadenite suppurativa negli adulti e negli adolescenti dai
12 anni di età. AMGEVITA può ridurre il numero di noduli e di ascessi che lei ha e il dolore che spesso
è associato a questa malattia. Inizialmente, potrebbe ricevere altri medicinali. Se non risponde
sufficientemente bene a questi medicinali, riceverà AMGEVITA.
Malattia di Crohn negli adulti e nei bambini
La malattia di Crohn è un’infiammazione del tratto digerente.
AMGEVITA è usato per trattare la malattia di Crohn negli adulti e nei bambini di età dai 6 ai
17 anni. Se soffre della malattia di Crohn, le verranno prima somministrati altri farmaci. Nel caso in
cui lei non risponda in maniera sufficientemente adeguata a questi farmaci, le verrà somministrato
AMGEVITA per ridurre segni e sintomi della malattia di Crohn.
Colite ulcerosa negli adulti e nei bambini
La colite ulcerosa è un’infiammazione dell’intestino crasso.
AMGEVITA è usato per trattare la colite ulcerosa da moderata a grave negli adulti e nei bambini di
età dai 6 ai 17 anni. Se è affetto da colite ulcerosa inizialmente potrebbe assumere altri farmaci. Nel
caso in cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà
AMGEVITA per ridurre i segni e i sintomi della malattia.
Uveite non infettiva in adulti e bambini
L’uveite non infettiva è una malattia infiammatoria che colpisce alcune parti dell’occhio.
AMGEVITA è impiegato per il trattamento di
- Adulti affetti da uveite non infettiva con infiammazione che interessa il fondo dell’occhio.
- Bambini dai 2 anni di età con uveite non infettiva cronica con infiammazione che interessa la parte anteriore dell’occhio.
Questa infiammazione può portare a una diminuzione della visione e/o alla presenza di corpi mobili
nell’occhio (punti neri o linee sottili che si muovono attraverso il campo visivo). AMGEVITA
agisce riducendo questa infiammazione.
2. Cosa deve sapere prima di usare AMGEVITA
Non usi AMGEVITA:
- se è allergico ad adalimumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- in presenza di un’infezione grave, incluse tubercolosi attiva, sepsi (infezione del sangue) o altre infezioni opportunistiche (infezioni insolite associate a un sistema immunitario indebolito) (vedere “Avvertenze e precauzioni”). È importante comunicare al medico se ha segni o sintomi di infezione, come per es. febbre, ferite, sensazione di stanchezza, problemi dentali.
- in presenza di insufficienza cardiaca moderata o grave. È importante riferire al medico se c’è stata o è presente una condizione cardiaca grave (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare AMGEVITA:
Reazioni allergiche
- In caso di reazioni allergiche con sintomi quali senso di costrizione toracica, respiro sibilante, capogiro, gonfiore o eruzione cutanea, non si somministri più AMGEVITA e contatti il medico immediatamente considerato che, in rari casi, queste reazioni possono essere rischiose per la vita.
Infezioni
- In caso d’infezione, incluse infezioni a lungo termine o localizzate (per esempio, ulcere alle gambe) consulti il medico prima di iniziare il trattamento con AMGEVITA. Se ha dubbi, contatti il medico.
- È possibile contrarre più facilmente infezioni durante il trattamento con AMGEVITA. Questo rischio può aumentare se la sua funzione polmonare è compromessa. Queste infezioni possono essere gravi ed includere tubercolosi, infezioni causate da virus, funghi, parassiti o batteri, o altre infezioni opportunistiche e sepsi che possono, in rari casi, essere rischiose per la vita del paziente. È importante comunicare al medico la presenza di sintomi quali febbre, ferite, sensazione di stanchezza o problemi dentali. Il medico potrebbe raccomandare la sospensione temporanea di AMGEVITA.
Tubercolosi
- Poiché si sono verificati dei casi di tubercolosi in pazienti sottoposti a trattamento con adalimumab, prima di iniziare la terapia con AMGEVITA il medico dovrà controllare se lei presenta segni o sintomi di tubercolosi. Questo comporterà la raccolta di una valutazione medica dettagliata che includa la sua storia medica e appropriati esami clinici (per es. una radiografia del torace e il test alla tubercolina). L’esecuzione e i risultati di tali esami devono essere registrati nella Scheda Promemoria per il Paziente. È molto importante comunicare al medico se ha mai avuto la tubercolosi, o se ha avuto contatti ravvicinati con malati di tubercolosi.
- La tubercolosi si può manifestare durante la terapia nonostante lei abbia ricevuto un trattamento preventivo per la tubercolosi.
- Contatti immediatamente il medico se durante o dopo la terapia compaiono sintomi di tubercolosi (tosse persistente, perdita di peso, svogliatezza, febbre moderata) o di altre infezioni.
Viaggio/infezione ricorrente
- Avvisi il medico se risiede o viaggia in regioni dove le infezioni fungine, come l’istoplasmosi, la coccidioidomicosi o la blastomicosi, sono endemiche.
- Avvisi il medico se ha avuto infezioni recidivanti o se presenta condizioni che aumentano il rischio di infezione.
Virus dell’epatite B
- Informi il medico se lei è portatore del virus dell’epatite B (HBV), se ha un’infezione in fase attiva da virus dell’epatite B o se pensa di poter essere a rischio di contrarre il virus dell’epatite B. Il medico la deve testare per l’infezione da virus dell’epatite B. L’assunzione di AMGEVITA può causare la riattivazione del virus dell’epatite B nei soggetti che risultano portatori di questo virus. In alcuni rari casi, soprattutto se il paziente è sottoposto a terapia con altri farmaci che sopprimono il sistema immunitario, la riattivazione del virus dell’epatite B può mettere a rischio la vita del paziente.
Età superiore a 65 anni
- Se ha più di 65 anni può essere più suscettibile ad infezioni durante l’assunzione di AMGEVITA. Lei e il medico dovete prestare particolare attenzione a segni di infezione mentre è in trattamento con AMGEVITA. È importante informare il medico se compaiono i sintomi di infezioni quali febbre, ferite, sensazione di stanchezza o problemi dentali.
Interventi chirurgici o procedure dentistiche
- Prima di un intervento chirurgico o procedure dentistiche, informi il medico che sta prendendo AMGEVITA. Il medico potrebbe consigliare la sospensione temporanea di AMGEVITA.
Malattia demielinizzante
- Se è affetto o sviluppa malattia demielinizzante come la sclerosi multipla, il medico deciderà se è il caso di iniziare o continuare a ricevere il trattamento con AMGEVITA. Informi il medico immediatamente nel caso in cui lei manifesti sintomi quali variazioni nella visione, debolezza di braccia o gambe o intorpidimento o formicolio che interessi qualsiasi parte del corpo.
Vaccinazioni
- Certi vaccini contengono forme vive ma indebolite di batteri o virus che causano malattie che possono causare infezioni e non devono essere somministrati durante il trattamento con AMGEVITA. Consulti il medico prima di sottoporsi a vaccinazioni. Nei bambini, prima di iniziare la terapia a base di AMGEVITA, si raccomanda, se possibile, di attuare il programma di vaccinazioni previsto, in ottemperanza alle linee guida in vigore sulle vaccinazioni.
- Se ha assunto AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre tale infezione fino a circa 5 mesi dopo l’ultima somministrazione che lei ha assunto durante la gravidanza. È importante che lei riferisca al pediatra o ad altro operatore sanitario del suo utilizzo di AMGEVITA durante la gravidanza, cosicché possano decidere quando il bambino deve ricevere qualsiasi tipo di vaccinazione.
Insufficienza cardiaca
- In caso di lieve insufficienza cardiaca e di concomitante trattamento con AMGEVITA, il medico dovrà attentamente valutare e seguire lo stato del suo cuore. È importante informare il medico se ha o ha avuto problemi di cuore. Se si manifestano nuovi sintomi di insufficienza cardiaca o se i sintomi già esistenti dovessero peggiorare (per esempio, fiato corto o gonfiore dei piedi), contatti immediatamente il medico. Il medico deciderà se può assumere AMGEVITA.
Febbre, lividi, sanguinamento o aspetto pallido
- In alcuni pazienti l’organismo può non essere in grado di produrre un quantitativo di cellule del sangue sufficiente, tale da aiutarlo a combattere le infezioni o ad arrestare un sanguinamento. Nel caso in cui lei abbia febbre persistente, lividi o facili sanguinamenti o aspetto pallido, si rivolga immediatamente al medico. Il medico potrebbe decidere di interrompere la terapia.
Cancro
- Nei pazienti, sia bambini sia adulti, sottoposti a trattamento con adalimumab o con altri farmaci anti-TNF, molto raramente si sono manifestati alcuni tipi di cancro. I pazienti affetti da artrite reumatoide di grave entità da molto tempo possono presentare un rischio superiore alla media di sviluppare linfoma (un cancro che colpisce il sistema linfatico) e leucemia (un cancro che colpisce il sangue e il midollo osseo).
- Se lei assume AMGEVITA, il rischio di contrarre linfoma, leucemia o altri cancri può aumentare. In rare circostanze, nei pazienti sottoposti a terapia con adalimumab, è stato osservato un tipo specifico e grave di linfoma. Alcuni di questi pazienti erano anche in terapia con azatioprina o 6-mercaptopurina. Avvisi il medico se sta assumendo azatioprina o 6-mercaptopurina con AMGEVITA.
- Inoltre, nei pazienti che assumono adalimumab, sono stati osservati casi di cancro della cute non melanotico. Se nel corso della terapia, o successivamente ad essa, dovessero comparire nuove lesioni cutanee o se l’aspetto delle lesioni già esistenti si dovesse modificare, lo riferisca al medico.
- Ci sono stati casi di cancri, oltre al linfoma, in pazienti con uno specifico tipo di malattia del polmone chiamata Malattia Polmonare Ostruttiva Cronica (COPD) trattati con un altro anti-TNF. Se soffre di COPD, o fuma molto, deve discutere con il medico se è appropriato il trattamento con un anti-TNF.
Malattie autoimmuni
- Raramente, il trattamento con AMGEVITA può portare alla manifestazione di una sindrome simil- lupoide. Informi il medico qualora si manifestino sintomi come eruzione cutanea persistente di natura inspiegabile, febbre, dolore alle articolazioni o stanchezza.
Al fine di migliorare la tracciabilità di questo medicinale, il medico o il farmacista deve registrare il
nome dello stesso ed il numero di lotto del prodotto che le è stato somministrato sulla sua scheda
paziente. Lei può prendere nota di questi dettagli in caso le venissero chiesti in futuro.
Bambini e adolescenti
- Vaccinazioni: se possibile, i bambini dovrebbero aver già fatto tutte le vaccinazioni prima di usare AMGEVITA.
- Non dare AMGEVITA a bambini con artrite idiopatica giovanile poliarticolare di età inferiore ai 2 anni.
- Non dare AMGEVITA a bambini con psoriasi a placche di età inferiore ai 4 anni.
- Non dare AMGEVITA a bambini con malattia di Crohn o colite ulcerosa di età inferiore ai 6 anni.
Altri medicinali e AMGEVITA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
AMGEVITA può essere assunto sia con il metotressato che con altri farmaci antireumatici
modificanti la malattia (sulfasalazina, idrossiclorochina, leflunomide e sali d’oro per via
parenterale), steroidi o analgesici, compresi i farmaci anti-infiammatori non steroidei (FANS).
AMGEVITA non deve essere preso in concomitanza con farmaci contenenti come principio attivo
anakinra o abatacept a causa del rischio aumentato di contrarre infezioni gravi. Se ha dubbi, si rivolga al
medico.
Gravidanza e allattamento
- Deve considerare l’utilizzo di un’adeguata misura contraccettiva per prevenire una gravidanza e continuarne l’utilizzo per almeno 5 mesi dopo l’ultima terapia con AMGEVITA.
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, chieda consiglio al suo medico circa l’assunzione di questo medicinale.
- AMGEVITA deve essere usato durante la gravidanza solo se necessario.
- Secondo uno studio sulla gravidanza, non è stato riscontrato un rischio maggiore di difetti alla nascita quando la madre aveva ricevuto AMGEVITA durante la gravidanza, rispetto a madri che avevano la stessa patologia, ma che non avevano ricevuto AMGEVITA.
- AMGEVITA può essere usato durante l’allattamento con latte materno.
- Se assume AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre un’infezione.
- É importante che lei riferisca al pediatra o ad altro operatore sanitario dell’utilizzo di AMGEVITA durante la gravidanza, prima che il bambino riceva qualsiasi tipo di vaccinazione. Per maggiori informazioni sulle vaccinazioni consulti la sezione “Avvertenze e precauzioni”.
Guida di veicoli e utilizzo di macchinari
AMGEVITA può influenzare, benché solo in maniera modesta, la sua capacità di guidare, andare in
bicicletta o utilizzare macchinari. In seguito all’assunzione di AMGEVITA, si possono avere disturbi
della visione e la sensazione che l’ambiente in cui ci si trova ruoti (vertigini).
AMGEVITA contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per la dose da 0,8 mL, cioè, é
essenzialmente “senza sodio”.
3. Come usare AMGEVITA
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Adulti con artrite reumatoide, artrite psoriasica, spondilite anchilosante o spondiloartrite assiale senza
evidenza radiografica di spondilite anchilosante.
AMGEVITA è iniettato sotto la cute (uso sottocutaneo). In pazienti adulti con artrite reumatoide,
spondilite anchilosante, spondiloartrite assiale senza evidenza radiografica di spondilite anchilosante
e artrite psoriasica, il normale dosaggio è di 40 mg a settimane alterne, somministrato in un’unica
dose.
Nell’artrite reumatoide, il metotressato viene continuato durante il trattamento con AMGEVITA.
Se il medico decide che il metotressato non è appropriato, AMGEVITA può essere somministrato da
solo.
Se è affetto da artrite reumatoide e non riceve metotressato in associazione al trattamento con
AMGEVITA, il medico può decidere di prescriverle 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite idiopatica giovanile poliarticolare
Bambini e adolescenti a partire da 2 anni di età e con peso compreso tra 10 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è 20 mg a settimane alterne.
Bambini, adolescenti e adulti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite correlata a entesite
Bambini e adolescenti a partire da 6 anni di età e con peso compreso tra 15 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è 20 mg a settimane alterne.
Bambini, adolescenti e adulti a partire da 6 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Adulti con psoriasi a placche
La dose abituale per gli adulti affetti da psoriasi a placche è rappresentata da una dose iniziale pari a
80 mg (tramite due iniezioni da 40 mg in un giorno), seguita da una dose pari a 40 mg, somministrata
a settimane alterne, ad iniziare dalla settimana successiva all’assunzione della dose iniziale. Lei deve
continuare il trattamento con AMGEVITA per il tempo indicato dal medico. In base alla risposta
clinica, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti affetti da psoriasi a placche
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso compreso tra 15 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 20 mg, seguita da una dose di 20 mg la
settimana seguente. Successivamente, la dose abituale è di 20 mg a settimane alterne.
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 40 mg, seguita da una dose di 40 mg la
settimana seguente. Successivamente, la dose abituale è di 40 mg a settimane alterne.
Adulti con idrosadenite suppurativa
La dose abituale per l’idrosadenite suppurativa è una dose iniziale di 160 mg (tramite quattro iniezioni
da 40 mg in un giorno o due iniezioni da 40 mg al giorno per due giorni consecutivi), seguita da una
dose di 80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane dopo. Dopo altre due
settimane, continuare con una dose di 40 mg a settimana o 80 mg a settimane alterne, come prescritto
dal medico. Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree
interessate.
Adolescenti con idrosadenite suppurativa di età compresa tra 12 e 17 anni, con peso uguale o superiore
a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 80 mg (tramite due iniezioni da 40 mg in
un giorno), seguita da 40 mg somministrati a settimane alterne a partire da una settimana dopo la dose
iniziale. In caso di risposta inadeguata a 40 mg di AMGEVITA a settimane alterne, il medico può
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adulti con malattia di Crohn
In caso di malattia di Crohn, la dose abituale è inizialmente di 80 mg (tramite due iniezioni da 40 mg in un
giorno) seguita da 40 mg a settimane alterne, dopo due settimane. Se è necessario indurre una risposta più
rapida, il medico potrebbe prescrivere una dose iniziale di 160 mg (tramite quattro iniezioni da
40 mg in un giorno o in due iniezioni da 40 mg al giorno per due giorni consecutivi) seguita da
80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane più tardi, e successivamente
40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe aumentare la dose a
40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con malattia di Crohn
Bambini e adolescenti di età compresa tra 6 e 17 anni e con peso inferiore a 40 kg
All’inizio, il regime di dose abituale è di 40 mg, seguito da 20 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 80 mg (come due iniezioni da
40 mg in un giorno) seguita da 40 mg due settimane più tardi.
Successivamente, la dose abituale è di 20 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la frequenza della dose a 20 mg ogni settimana.
Bambini ed adolescenti di età compresa tra 6 e 17 anni e con peso uguale o superiore a 40 kg
All’inizio, il regime di dose abituale è di 80 mg (tramite due iniezioni da 40 mg in un giorno), seguito
da 40 mg due settimane più tardi. Se è richiesta una risposta più rapida, il medico può prescrivere una
dose iniziale di 160 mg (come quattro iniezioni da 40 mg in un giorno o come due iniezioni da 40 mg
al giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due
settimane più tardi.
Successivamente, la dose abituale è di 40 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con colite ulcerosa
Per gli adulti affetti da colite ulcerosa, la dose iniziale abituale di AMGEVITA è pari a 160 mg (tramite
quattro iniezioni da 40 mg in un giorno o due iniezioni da 40 mg al giorno per due giorni consecutivi)
seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane più tardi, poi 40 mg a
settimane alterne. In funzione della risposta clinica, il medico potrebbe aumentare la dose a 40 mg ogni
settimana o 80 mg a settimane alterne.
Bambini e adolescenti con colite ulcerosa
Bambini e adolescenti a partire dai 6 anni di età e con peso inferiore a 40 kg
La dose abituale di AMGEVITA è di 80 mg (tramite due iniezioni da 40 mg in un giorno) seguita da
40 mg (tramite una sola iniezione da 40 mg) dopo due settimane. Successivamente, la dose abituale è di
40 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 40 mg a settimane alterne devono continuare la dose
prescritta.
Bambini e adolescenti a partire dai 6 anni di età e con peso uguale o superiore a 40 kg
La dose abituale di AMGEVITA è di 160 mg (tramite quattro iniezioni da 40 mg in un giorno o due
iniezioni da 40 mg al giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da
40 mg in un giorno) dopo due settimane. Successivamente la dose abituale è di 80 mg a settimane
alterne.
I pazienti che compiono 18 anni mentre assumono 80 mg a settimane alterne devono continuare la dose
prescritta.
Adulti con uveite non infettiva
Per gli adulti con uveite non infettiva, la dose abituale è una dose iniziale di 80 mg, (tramite due
iniezioni da 40 mg in un giorno), seguita da 40 mg somministrati a settimane alterne a partire da una
settimana dopo la dose iniziale. Deve continuare ad iniettarsi AMGEVITA per tutto il tempo indicato
dal medico.
Nell’uveite non infettiva, i corticosteroidi o gli altri farmaci che influiscono sul sistema immunitario
potranno essere continuati durante il trattamento con AMGEVITA. AMGEVITA può anche essere
somministrato in monoterapia.
Bambini e adolescenti con uveite cronica non infettiva a partire da 2 anni di età
Bambini e adolescenti a partire da 2 anni e con peso inferiore a 30 kg
La dose abituale di AMGEVITA è di 20 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 40 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Bambini e adolescenti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose abituale di AMGEVITA è di 40 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 80 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Modo e via di somministrazione
AMGEVITA è somministrato per iniezione sotto la cute (iniezione sottocutanea).
Istruzioni dettagliate su come iniettare AMGEVITA sono fornite nel paragrafo “Istruzioni per l’uso”.
Se usa più AMGEVITA di quanto deve
Se accidentalmente inietta AMGEVITA più frequentemente di quanto disposto dal medico o dal
farmacista, contatti il medico o il farmacista informandolo di aver assunto più farmaco. Conservi sempre
la scatola di questo medicinale, anche se vuota.
Se dimentica di usare AMGEVITA
Se dimentica di fare un’iniezione, deve iniettarsi la dose successiva di AMGEVITA non appena se
ne ricorda. Dopodiché riprenda la dose regolarmente secondo lo schema posologico stabilito.
Se interrompe il trattamento con AMGEVITA
La decisione di interrompere l’uso di AMGEVITA deve essere discussa con il medico. I sintomi
possono ritornare dopo l’interruzione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino. La maggior parte degli effetti indesiderati si presenta in forma da lieve a moderata.
Tuttavia, alcuni possono essere gravi e richiedere un trattamento. Effetti indesiderati possono
manifestarsi fino a 4 mesi dall’ultima iniezione di AMGEVITA.
Informi immediatamente il medico se nota uno qualsiasi dei seguenti segni di reazione allergica o di
insufficienza cardiaca:
- eruzione cutanea grave, orticaria o altri segni di reazione allergica;
- gonfiore di viso, mani e piedi;
- difficoltà nella respirazione, difficoltà ad inghiottire;
- respiro affannoso sotto sforzo o in posizione sdraiata o gonfiore dei piedi.
Informi appena possibile il medico se nota una qualsiasi delle seguenti reazioni:
- segni di infezione come febbre, sensazione di star male, ferite, problemi dentali, bruciore nell’urinare;
- stanchezza o debolezza;
- tosse;
- formicolio;
- torpore;
- visione doppia;
- debolezza delle braccia o gambe;
- segni di cancro della pelle come una protuberanza o piaga che non guarisce;
- segni e sintomi che suggeriscono la comparsa di disturbi a carico del sistema ematico (sangue), come la presenza di febbre persistente, lividi, sanguinamenti, pallore.
I sintomi sopra descritti possono essere segni dei seguenti effetti indesiderati, che sono stati osservati
con adalimumab.
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- reazioni nella sede di iniezione (tra cui dolore, gonfiore, arrossamento o prurito);
- infezioni delle vie respiratorie (tra cui raffreddore, naso che cola, infezione sinusale e infezione polmonare);
- cefalea;
- dolore addominale;
- nausea e vomito;
- eruzione cutanea;
- dolore muscoloscheletrico.
Comuni (possono manifestarsi fino a 1 persona su 10)
- infezioni gravi (tra cui setticemia ed influenza);
- infezioni intestinali (tra cui gastroenterite);
- infezioni della pelle (tra cui cellulite e infezione da Herpes Zoster);
- infezioni dell’orecchio;
- infezioni orali (tra cui infezioni dentarie ed herpes labiale);
- infezioni dell’apparato riproduttivo;
- infezione delle vie urinarie;
- infezioni micotiche;
- infezioni articolari;
- tumori benigni;
- cancro della pelle;
- reazioni allergiche (tra cui allergia stagionale);
- disidratazione;
- sbalzi diumore (tra cui depressione);
- ansia;
- difficoltà a dormire;
- disturbi della sensibilità come formicolio, sensazione di fitte o intorpidimento;
- emicrania;
- compressione di radice nervosa (tra cui dolore dorso-lombare e dolore alle gambe);
- disturbi della visione;
- infiammazione degli occhi;
- infiammazione delle palpebre e tumefazione degli occhi;
- vertigini (sensazione di capogiro o stanza che ruota);
- sensazione di battito cardiaco accelerato;
- pressione del sangue elevata;
- rossore;
- ematoma;
- tosse;
- asma;
- respiro affannoso;
- sanguinamento gastrointestinale;
- dispepsia (indigestione, stomaco gonfio, bruciore di stomaco);
- disturbo da reflusso acido;
- sindrome sicca (tra cui occhi secchi e bocca secca);
- prurito;
- eruzione cutanea pruriginosa;
- lividi;
- infiammazione della pelle (come eczema);
- rottura delle unghie delle dita della mano e del piede;
- sudorazione aumentata;
- perdita di capelli;
- insorgenza o peggioramento della psoriasi;
- spasmi muscolari;
- sangue nell’urina;
- problemi renali;
- dolore toracico;
- edema;
- febbre;
- riduzione delle piastrine nel sangue che aumenta il rischio di sanguinamento o di lividi;
- difficoltà di cicatrizzazione.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- infezioni opportunistiche (che includono la tubercolosi ed altre infezioni che si manifestano quando si abbassano le difese immunitarie);
- infezioni neurologiche (tra cui la meningite virale);
- infezioni degli occhi;
- infezioni batteriche;
- diverticolite (infiammazione e infezione dell’intestino crasso);
- cancro, tra cui cancro che colpisce il sistema linfatico (linfoma) e melanoma (cancro della cute);
- disturbi del sistema immunitario che potrebbero colpire polmoni, cute e linfonodi (che si presentano più comunemente come sarcoidosi);
- vasculite (infiammazione dei vasi sanguigni);
- tremore;
- neuropatia;
- ictus;
- perdita dell’udito, ronzio;
- sensazione di battito cardiaco irregolare come battiti saltati;
- problemi al cuore che possono causare respiro affannoso o gonfiore alle caviglie;
- attacco cardiaco;
- formazione di una sacca nella parete di un’arteria principale, infiammazione e coagulo in una vena, ostruzione di un vaso sanguigno;
- malattie polmonari che provocano respiro affannoso (inclusa infiammazione);
- embolia polmonare (occlusione di una arteria del polmone);
- versamento della pleura (anomala raccolta di liquido nello spazio pleurico);
- infiammazione del pancreas che causa forti dolori all’addome ed alla schiena;
- difficoltà di deglutizione;
- edema facciale;
- infiammazione della cistifellea, calcoli della cistifellea;
- fegato grasso;
- sudorazioni notturne;
- cicatrice;
- anormale catabolismo muscolare;
- lupus eritematoso sistemico (tra cui infiammazione di cute, cuore, polmone, articolazioni e di altri organi);
- sonno interrotto;
- impotenza;
- infiammazioni.
Rari (possono manifestarsi fino a 1 persona su 1.000)
- leucemia (cancro del sangue del midollo osseo);
- reazione allergica grave con shock;
- sclerosi multipla;
- patologie neurologiche (come infiammazione del nervo ottico e sindrome di Guillain-Barré che può causare debolezza muscolare, sensazioni anomale, formicolio alle braccia ed alla parte superiore del corpo);
- arresto cardiaco;
- fibrosi polmonare (cicatrici del polmone);
- perforazione intestinale (foro nella parete dell’intestino);
- epatite (infiammazione del fegato);
- riattivazione dell’epatite B;
- epatite autoimmune (infiammazione del fegato causata dal proprio sistema immunitario);
- vasculite cutanea (infiammazione dei vasi sanguigni della pelle);
- sindrome di Stevens-Johnson (reazione rischiosa per la vita con sintomi simil-influenzali ed eruzione cutanea con vescicole);
- edema facciale associato a reazioni allergiche;
- eritema multiforme (eruzione cutanea infiammatoria);
- sindrome simil-lupoide;
- angioedema (gonfiore localizzato della pelle);
- reazione cutanea lichenoide (eruzione cutanea rosso-violacea pruriginosa).
Non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- linfoma epato-splenico a cellule T (un raro cancro del sangue che spesso risulta fatale);
- carcinoma a cellule di Merkel (un tipo di cancro della pelle);
- sarcoma di Kaposi, una rara forma di cancro correlato a infezione da Herpes virus umano 8. Il sarcoma di Kaposi si manifesta più comunemente con lesioni viola sulla pelle;
- insufficienza epatica;
- peggioramento di una condizione chiamata dermatomiosite (che si manifesta come eruzione cutanea accompagnata da debolezza muscolare);
- aumento di peso (per la maggior parte dei pazienti l’aumento di peso è stato basso).
Alcuni degli effetti indesiderati osservati con adalimumab possono essere asintomatici e possono
essere individuati solo attraverso gli esami del sangue. Questi includono:
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- conta dei globuli bianchi bassa;
- conta dei globuli rossi bassa;
- lipidi nel sangue aumentati;
- enzimi epatici aumentati.
Comuni (possono manifestarsi fino a 1 persona su 10)
- conta dei globuli bianchi aumentata;
- conta delle piastrine ridotta;
- acido urico nel sangue aumentato;
- sodio nel sangue anormale;
- calcio nel sangue diminuito;
- fosfato nel sangue diminuito;
- zuccheri nel sangue aumentati;
- latticodeidrogenasi nel sangue aumentata;
- autoanticorpi presenti nel sangue;
- potassio nel sangue diminuito.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- bilirubina nel sangue elevata (esame epatico del sangue).
Rari (possono manifestarsi fino a 1 persona su 1.000)
- conta di globuli bianchi, globuli rossi e piastrine bassa.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare AMGEVITA
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta/blister e sulla scatola
dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C – 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Una singola siringa preriempita di AMGEVITA può essere conservata a temperature fino ad un
massimo di 25°C per un periodo massimo di 14 giorni. La siringa preriempita deve essere protetta dalla
luce e deve essere gettata via se non usata entro il periodo di 14 giorni.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene AMGEVITA
- Il principio attivo è adalimumab. Ogni siringa preriempita contiene 20 mg di adalimumab in 0,4 mL di soluzione o 40 mg di adalimumab in 0,8 mL di soluzione.
- Gli altri eccipienti sono acido acetico glaciale, saccarosio, polisorbato 80, sodio idrossido e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di AMGEVITA e contenuto della confezione
AMGEVITA è una soluzione limpida e da incolore a leggermente gialla.
Ogni confezione contiene 1 siringa preriempita monouso da 20 mg (con uno stantuffo giallo).
Ogni confezione contiene 1, 2, 4 o 6 siringhe preriempite monouso da 40 mg (con uno stantuffo blu).
Titolare dell’autorizzazione all’immissione in commercio e produttore
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Titolare dell’autorizzazione all’immissione in commercio
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Produttore
Amgen Technology Ireland UC
Pottery Road
Dun Laoghaire
Co Dublin
Irlanda
Produttore
Amgen NV
Telecomlaan 5-7
1831 Diegem
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
s.a. Amgen n.v.
Tél/Tel: +32 (0)2 7752711
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
България
Амджен България ЕООД
Тел.: +359 (0)2 424 7440
Luxembourg/Luxemburg
s.a. Amgen
Belgique/Belgien
Tél/Tel: +32 (0)2 7752711
Česká republika
Amgen s.r.o.
Tel: +420 221 773 500
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
Danmark
Amgen, filial af Amgen AB, Sverige
Tlf: +45 39617500
Malta
Amgen S.r.l.
Italy
Tel: +39 02 6241121
Deutschland
Amgen GmbH
Tel: +49 89 1490960
Nederland
Amgen B.V.
Tel: +31 (0)76 5732500
Eesti
Amgen Switzerland AG Vilniaus filialas
Tel: +372 586 09553
Norge
Amgen AB
Tlf: +47 23308000
Ελλάδα
Amgen Ελλάς Φαρμακευτικά Ε.Π.Ε.
Τηλ: +30 210 3447000
Österreich
Amgen GmbH
Tel: +43 (0)1 50 217
España
Amgen S.A.
Tel: +34 93 600 18 60
Polska
Amgen Biotechnologia Sp. z o.o.
Tel.: +48 22 581 3000
France
Amgen S.A.S.
Tél: +33 (0)9 69 363 363
Portugal
Amgen Biofarmacêutica, Lda.
Tel: +351 21 4220606
Hrvatska
Amgen d.o.o.
Tel: +385 (0)1 562 57 20
România
Amgen România SRL
Tel: +4021 527 3000
Ireland
Amgen Ireland Limited
Tel: +353 1 8527400
Slovenija
AMGEN zdravila d.o.o.
Tel: +386 (0)1 585 1767
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Amgen Slovakia s.r.o.
Tel: +421 2 321 114 49
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial
i Finland
Puh/Tel: +358 (0)9 54900500
Kύπρος
C.A. Papaellinas Ltd
Τηλ: +357 22741 741
Sverige
Amgen AB
Tel: +46 (0)8 6951100
Latvija
Amgen Switzerland AG Rīgas filiāle
Tel: +371 257 25888
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, http://www.ema.europa.eu .
-----------------------------------------------------------------------------------------------------------------------------
Istruzioni per l’uso:
AMGEVITA, siringa preriempita monouso
Per uso sottocutaneo
| c Guida alle parti | |
Prima dell’uso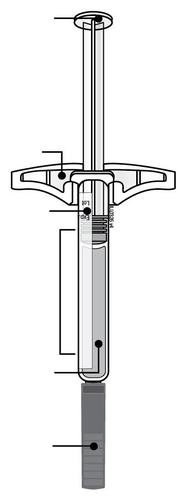 | a Dopo l’uso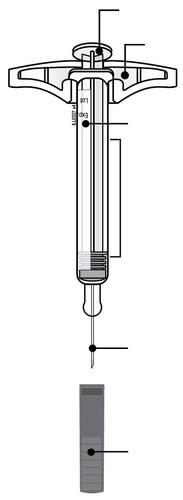 |
| Stantuffo Flangia Etichetta e data di scadenza Corpo della siringa Medicinale n Cappuccio a dell’ago inserito i l a t I a i z | m Stantuffo usato Flangia r a Etichetta e data di scadenza F Corpo della siringa l usato e d Ago usato a Cappuccio dell’ago disinserito |
| n Importante: L’ago è all’interno | |
Importante
Prima di usare una siringa preriempita di AMGEVITA, leggere queste informazioni:
Utilizzo delle siringhe preriempite di AMGEVITA
- È importante non cercare di eseguire autonomamente l’iniezione senza che lei o la persona che la assiste siate stati prima addestrati.
- Non utilizzareuna siringa preriempita di AMGEVITA se è caduta su una superficie rigida. Alcune parti della siringa preriempita di AMGEVITA potrebbero essersi rotte anche se il danno non le è visibile. Usare una siringa preriempita di AMGEVITA nuova.
Passaggio 1: Preparazione
A.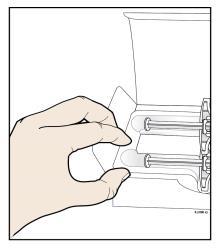 | F Togliere dalla confezione il numero di siringhe preriempite di AMGEVITA di cui necessita.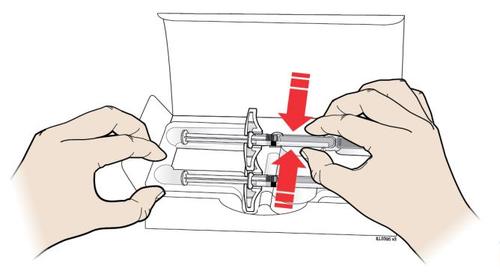 |
Per togliere la l siringa dal vassoio e afferrarla dal corpo. d a n a Mentre si estrae la siringa, tenere Afferrare Qui fermo il bordo del vassoio con i l’indice o il pollice. l Riporre la scatola con le siringhe inutilizzate in frigorifero. a Per motivi di sicurezza: t
| |
B.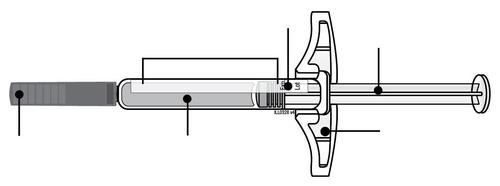 | Ispezionare la siringa preriempita di AMGEVITA. |
Corpo della Data di scadenza o siringa sull’etichetta Stantuffo c a m r a Cappuccio dell’ago Medicinale Flangia F inserito Afferrare sempre la siringa dal corpo della siringa. l Assicurarsi che il medicinale nella siringa sia da limpido ed incolore a leggermente giallo. e
| |
| C. | Radunare tutto il necessario per eseguire l’iniezione/le iniezioni. |
n a Lavarsi accuratamente le mani con acqua e sapone. Su una superficie pulita e ben illuminata, posizionare una siringa preriempita nuova. i Altri articoli necessari, ma non inclusi nella confezione: l
  | |
D.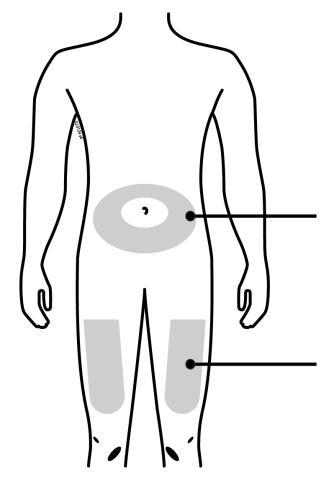 | Preparazione e pulizia del sito o dei siti d’iniezione. |
o c a Addome m Coscia r a F Lei può utilizzare:
| |
Passaggio 2: Preparazione per l’iniezione
E.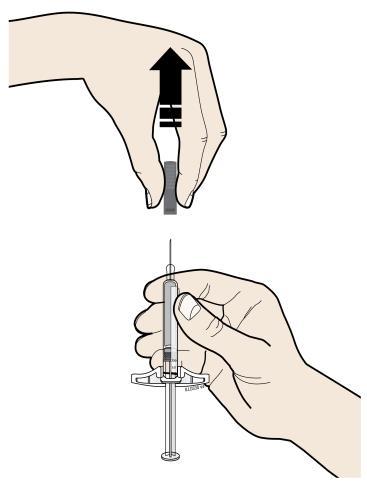 | o Quando si è pronti per praticare l’iniezione, estrarre in modo deciso il cappuccio dell’ago tenendolo lontano dal corpo. |
c a m r a F l e È normale notare la presenza di una goccia di liquido sull’estremità dell’ago.
| |
F.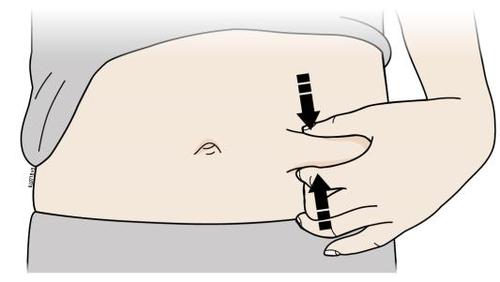 | n Formare una plica cutanea per creare una superficie di iniezione sicura. |
| a i l a t I a Afferrare saldamente una parte di pelle con il pollice e le altre dita formando una plica larga circa 5 centimetri. i Importante: Tenere la plica di pelle saldamente durante l’iniezione. | |
Passaggio 3: Iniezione
| G. | o Tenere la plica. Con il cappuccio dell’ago disinserito, inserire la siringa nella pelle con un’inclinazione da 45 a 90 gradi. |
c a m r Durante l’inserimento dell’ago, non tenere il dito sullo stantuffo.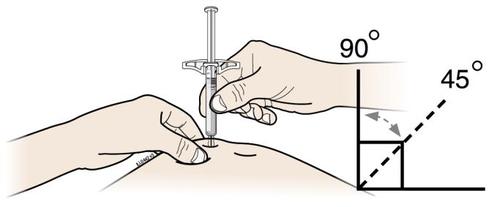 | |
| H. | F Premere lo stantuffo fino in fondo esercitando una pressione lenta e costante finché non si muove più. |
a d e l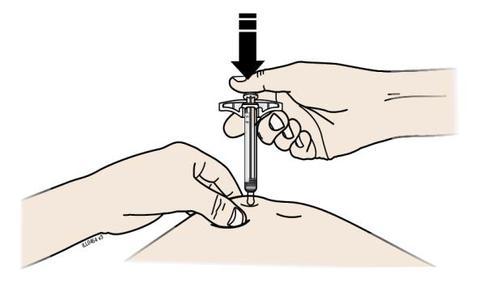 | |
| I. | n a Una volta terminato, rilasciare il pollice dallo stantuffo ed estrarre delicatamente la siringa dalla pelle. |
I t a l i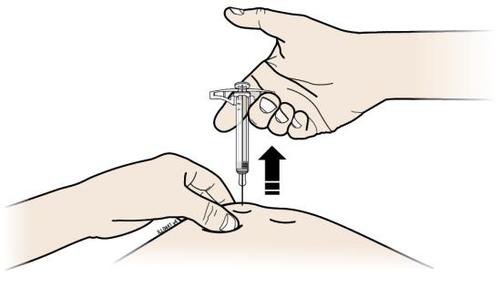 | |
Passaggio 4: Procedure finali
J.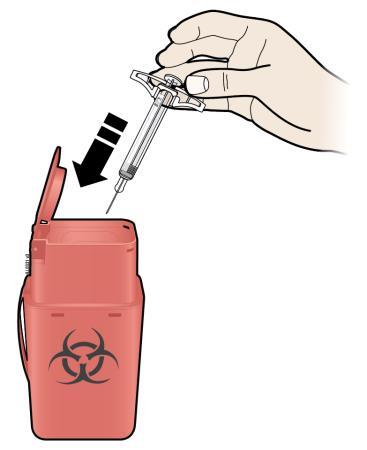 | Gettare la siringa usata ed il cappuccio dell’ago. |
o c a m r a F
| |
| K. | Esaminare il sito d’iniezione. |
| a i Se si nota la presenza di sangue, tenervi premuto sopra un batuffolo di cotone o una garza. Non strofinare il sito d’iniezione. Se necessario, applicare un cerotto. | |
AMGEVITA 40 mg soluzione iniettabile in penna preriempita
adalimumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Il medico le consegnerà una Scheda Promemoria per il Paziente, che contiene importanti informazioni sulla sicurezza, che ha bisogno di sapere prima della somministrazione di AMGEVITA e durante il trattamento con AMGEVITA. Conservi questa Scheda Promemoriaper il Paziente.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è AMGEVITA e a cosa serve
- 2. Cosa deve sapere prima di usare AMGEVITA
- 3. Come usare AMGEVITA
- 4. Possibili effetti indesiderati
- 5. Come conservare AMGEVITA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è AMGEVITA e a cosa serve
AMGEVITA contiene il principio attivo adalimumab, un medicinale che agisce sul sistema immunitario
(di difesa) dell’organismo.
AMGEVITA è indicato per il trattamento delle malattie infiammatorie di seguito elencate:
- Artrite reumatoide
- Artrite idiopatica giovanile poliarticolare
- Artrite correlata a entesite
- Spondilite anchilosante
- Spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante
- Artrite psoriasica
- Psoriasi a placche
- Idrosadenite suppurativa
- Malattia di Crohn
- Colite ulcerosa
- Uveite non infettiva
Il principio attivo contenuto in AMGEVITA, adalimumab, è un anticorpo monoclonale umano. Gli
anticorpi monoclonali sono proteine che si legano ad un bersaglio specifico.
Il bersaglio di adalimumab è una proteina denominata fattore di necrosi tumorale (TNFα), che è
coinvolto nel sistema immunitario (di difesa) ed è presente a concentrazioni maggiori nelle malattie
infiammatorie elencate sopra. Attraverso il legame al TNFα, AMGEVITA diminuisce il processo
infiammatorio di queste malattie.
Artrite reumatoide
L’artrite reumatoide è una patologia infiammatoria delle articolazioni.
AMGEVITA è usato per trattare l’artrite reumatoide negli adulti. Se soffre di artrite reumatoide di
grado da moderato a grave, inizialmente possono essere assunti altri farmaci modificanti la malattia,
quali il metotressato. Se la risposta a tali farmaci non è soddisfacente, le verrà dato AMGEVITA per
trattare l’artrite reumatoide.
AMGEVITA può essere anche utilizzato per il trattamento dell’artrite reumatoide grave, attiva e
progressiva senza precedente trattamento con metotressato.
AMGEVITA rallenta la progressione del danno alle cartilagini ed alle ossa delle articolazioni causato
dalla malattia e migliora la funzionalità fisica.
Generalmente AMGEVITA è usato con il metotressato. Se il medico decide che il trattamento con
metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Artrite idiopatica giovanile poliarticolare e artrite correlata a entesite
L’artrite idiopatica giovanile poliarticolare e l’artrite correlata a entesite sono malattie infiammatorie
delle articolazioni che di solito si manifestano per la prima volta durante l’infanzia.
AMGEVITA è usato per trattare l’artrite idiopatica giovanile poliarticolare in pazienti dai 2 anni di età
e l’artrite correlata a entesite in pazienti dai 6 anni di età. Alla diagnosi possono essere somministrati
altri farmaci modificanti la malattia, come il metotressato. Se la risposta a questi farmaci non
dovesse essere adeguata, le sarà somministrato AMGEVITA per il trattamento dell’artrite
idiopatica giovanile poliarticolare o dell’artrite correlata a entesite.
Spondilite anchilosante e spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante
La spondilite anchilosante e la spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante sono infiammazioni della colonna vertebrale.
AMGEVITA è usato per trattare la spondilite anchilosante e la spondiloartrite assiale senza
evidenza radiografica della spondilite anchilosante negli adulti. Se è affetto da spondilite
anchilosante o da spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante,
assumerà prima altri farmaci. Nel caso in cui non sia in grado di ottenere una risposta adeguata
con questi farmaci, assumerà AMGEVITA per ridurre i segni ed i sintomi della malattia.
Artrite psoriasica
L’artrite psoriasica è un’infiammazione delle articolazioni associata alla psoriasi.
AMGEVITA è usato per trattare l’artrite psoriasica negli adulti. AMGEVITA rallenta il danno alla
cartilagine ed alle ossa delle articolazioni causato dalla malattia e migliora la funzionalità fisica.
Psoriasi a placche in adulti e bambini
La psoriasi a placche è una condizione della cute che causa chiazze rossastre, squamose e indurite di
cute ricoperta da squame argentee. La psoriasi a placche può anche colpire le unghie, provocandone la
rottura, l’ispessimento e il sollevamento dal letto dell’unghia, che può essere doloroso. Si ritiene che la
psoriasi sia causata da un problema del sistema immunitario del corpo che conduce ad un aumento
della produzione di cellule cutanee.
AMGEVITA è usato per trattare la psoriasi a placche di grado da moderato a severo negli adulti.
AMGEVITA è inoltre utilizzato per trattare la psoriasi a placche grave in bambini e adolescenti da 4 a
17 anni per i quali la terapia topica e le fototerapie non abbiano funzionato in modo ottimale o non siano
indicate.
Idrosadenite suppurativa in adulti e adolescenti
L’idrosadenite suppurativa (chiamata a volte acne inversa) è una malattia infiammatoria cronica della
cute e spesso è dolorosa. I sintomi possono includere noduli dolorosi e ascessi (foruncoli) che
possono drenare pus. Più frequentemente colpisce aree specifiche della cute, come la regione
sottomammaria, le ascelle, l’interno cosce, l’inguine e le natiche. Nelle aree colpite si possono
anche formare delle cicatrici.
AMGEVITA è utilizzato per trattare l’idrosadenite suppurativa negli adulti e negli adolescenti dai
12 anni di età. AMGEVITA può ridurre il numero di noduli e di ascessi che lei ha e il dolore che spesso
è associato a questa malattia. Inizialmente, potrebbe ricevere altri medicinali. Se non risponde
sufficientemente bene a questi medicinali, riceverà AMGEVITA.
Malattia di Crohn negli adulti e nei bambini
La malattia di Crohn è un’infiammazione del tratto digerente.
AMGEVITA è usato per trattare la malattia di Crohn negli adulti e nei bambini di età dai 6 ai
17 anni. Se soffre della malattia di Crohn, le verranno prima somministrati altri farmaci. Nel caso in
cui lei non risponda in maniera sufficientemente adeguata a questi farmaci, le verrà somministrato
AMGEVITA per ridurre segni e sintomi della malattia di Crohn.
Colite ulcerosa negli adulti e nei bambini
La colite ulcerosa è un’infiammazione dell’intestino crasso.
AMGEVITA è usato per trattare la colite ulcerosa da moderata a grave negli adulti e nei bambini di
età dai 6 ai 17 anni. Se è affetto da colite ulcerosa inizialmente potrebbe assumere altri farmaci. Nel
caso in cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà
AMGEVITA per ridurre i segni e i sintomi della malattia.
Uveite non infettiva negli adulti e nei bambini
L’uveite non infettiva è una malattia infiammatoria che colpisce alcune parti dell’occhio.
AMGEVITA è impiegato per il trattamento di
- Adulti affetti da uveite non infettiva con infiammazione che interessa il fondo dell’occhio.
- Bambini dai 2 anni di età con uveite non infettiva cronica con infiammazione che interessa la parte anteriore dell’occhio.
Questa infiammazione può portare a una diminuzione della visione e/o alla presenza di corpi mobili
nell’occhio (punti neri o linee sottili che si muovono attraverso il campo visivo). AMGEVITA
agisce riducendo questa infiammazione.
2. Cosa deve sapere prima di usare AMGEVITA
Non usi AMGEVITA:
- se è allergico ad adalimumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- in presenza di un’infezione grave, incluse tubercolosi attiva, sepsi (infezione del sangue) o altre infezioni opportunistiche (infezioni insolite associate a un sistema immunitario indebolito) (vedere “Avvertenze e precauzioni”). È importante comunicare al medico se ha segni o sintomi di infezione, come per es. febbre, ferite, sensazione di stanchezza, problemi dentali.
- in presenza di insufficienza cardiaca moderata o grave. È importante riferire al medico se c’è stata o è presente una condizione cardiaca grave (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare AMGEVITA:
Reazioni allergiche
- In caso di reazioni allergiche con sintomi quali senso di costrizione toracica, respiro sibilante, capogiro, gonfiore o eruzione cutanea, non si somministri più AMGEVITA e contatti il medico immediatamente considerato che, in rari casi, queste reazioni possono essere rischiose per la vita.
Infezioni
- In caso d’infezione, incluse infezioni a lungo termine o localizzate (per esempio, ulcere alle gambe) consulti il medico prima di iniziare il trattamento con AMGEVITA. Se ha dubbi, contatti il medico.
- È possibile contrarre più facilmente infezioni durante il trattamento con AMGEVITA. Questo rischio può aumentare se la sua funzione polmonare è compromessa. Queste infezioni possono essere gravi ed includere tubercolosi, infezioni causate da virus, funghi, parassiti o batteri, o altre infezioni opportunistiche e sepsi che possono, in rari casi, essere rischiose per la vita del paziente. È importante comunicare al medico la presenza di sintomi quali febbre, ferite, sensazione di stanchezza o problemi dentali. Il medico potrebbe raccomandare la sospensione temporanea di AMGEVITA.
Tubercolosi
- Poiché si sono verificati dei casi di tubercolosi in pazienti sottoposti a trattamento con adalimumab, prima di iniziare la terapia con AMGEVITA il medico dovrà controllare se lei presenta segni o sintomi di tubercolosi. Questo comporterà la raccolta di una valutazione medica dettagliata che includa la sua storia medica e appropriati esami clinici (per es. una radiografia del torace e il test della tubercolina). L’esecuzione e i risultati di tali esami devono essere registrati nella Scheda Promemoria per il Paziente. È molto importante comunicare al medico se ha mai avuto la tubercolosi, o se ha avuto contatti ravvicinati con malati di tubercolosi.
- La tubercolosi si può manifestare durante la terapia nonostante lei abbia ricevuto un trattamento preventivo per la tubercolosi.
- Contatti immediatamente il medico se durante o dopo la terapia compaiono sintomi di tubercolosi (tosse persistente, perdita di peso, svogliatezza, febbre moderata) o di altre infezioni.
Viaggio/infezione ricorrente
- Avvisi il medico se risiede o viaggia in regioni dove le infezioni fungine, come l’istoplasmosi, la coccidioidomicosi o la blastomicosi, sono endemiche.
- Avvisi il medico se ha avuto infezioni recidivanti o se presenta condizioni che aumentano il rischio di infezione.
Virus dell’epatite B
- Informi il medico se lei è portatore del virus dell’epatite B (HBV), se ha un’infezione in fase attiva da virus dell’epatite B o se pensa di poter essere a rischio di contrarre il virus dell’epatite B. Il medico la deve testare per l’infezione da virus dell’epatite B. L’assunzione di AMGEVITA può causare la riattivazione del virus dell’epatite B nei soggetti che risultano portatori di questo virus. In alcuni rari casi, soprattutto se il paziente è sottoposto a terapia con altri farmaci che sopprimono il sistema immunitario, la riattivazione del virus dell’epatite B può mettere a rischio la vita del paziente.
Età superiore a 65 anni
- Se ha più di 65 anni può essere più suscettibile ad infezioni durante l’assunzione di AMGEVITA. Lei e il medico dovete prestare particolare attenzione a segni di infezione mentre è in trattamento con AMGEVITA. È importante informare il medico se compaiono i sintomi di infezioni quali febbre, ferite, sensazione di stanchezza o problemi dentali.
Intervento chirurgico o procedure dentistiche
- Prima di un intervento chirurgico o procedure dentistiche, informi il medico che sta prendendo AMGEVITA. Il medico potrebbe consigliare la sospensione temporanea di AMGEVITA.
Malattia demielinizzante
- Se è affetto o sviluppa malattia demielinizzante come la sclerosi multipla, il medico deciderà se è il caso di iniziare o continuare a ricevere il trattamento con AMGEVITA. Informi il medico immediatamente nel caso in cui lei manifesti sintomi quali variazioni nella visione, debolezza di braccia o gambe o intorpidimento o formicolio che interessi qualsiasi parte del corpo.
Vaccinazioni
- Certi vaccini contengono forme vive ma indebolite di batteri o virus che causano malattie che possono causare infezioni e non devono essere somministrati durante il trattamento con AMGEVITA. Consulti il medico prima di sottoporsi a vaccinazioni. Nei bambini, prima di iniziare la terapia a base di AMGEVITA, si raccomanda, se possibile, di attuare il programma di vaccinazioni previsto, in ottemperanza alle linee guida in vigore sulle vaccinazioni.
- Se ha assunto AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre tale infezione fino a circa 5 mesi dopo l’ultima somministrazione che lei ha assunto durante la gravidanza. È importante che lei riferisca al pediatra o ad altro operatore sanitario del suo utilizzo di AMGEVITA durante la gravidanza, cosicché possano decidere quando il bambino deve ricevere qualsiasi tipo di vaccinazione.
Insufficienza cardiaca
- In caso di lieve insufficienza cardiaca e di concomitante trattamento con AMGEVITA, il medico dovrà attentamente valutare e seguire lo stato del suo cuore. È importante informare il medico se ha o ha avuto problemi di cuore. Se si manifestano nuovi sintomi di insufficienza cardiaca o se i sintomi già esistenti dovessero peggiorare (per esempio, fiato corto o gonfiore dei piedi), contatti immediatamente il medico. Il medico deciderà se può assumere AMGEVITA.
Febbre, lividi, sanguinamento oaspetto pallido
- In alcuni pazienti l’organismo può non essere in grado di produrre un quantitativo di cellule del sangue sufficiente, tale da aiutarlo a combattere le infezioni o ad arrestare un sanguinamento. Nel caso in cui lei abbia febbre persistente, lividi o facilisanguinamenti o aspetto pallido, si rivolga immediatamente al medico. Quest’ultimo potrebbe decidere di interrompere la terapia.
Cancro
- Nei pazienti, sia bambini sia adulti, sottoposti a trattamento con adalimumab o con altri farmaci anti-TNF, molto raramente si sono manifestati alcuni tipi di cancro. I pazienti affetti da artrite reumatoide di grave entità da molto tempo possono presentare un rischio superiore alla media di svilupparelinfoma (un cancro che colpisce il sistema linfatico) e leucemia (un cancro che colpisce il sangue e il midollo osseo).
- Se lei assume AMGEVITA, il rischio di contrarre linfoma, leucemia o altri cancri può aumentare. In rare circostanze, nei pazienti sottoposti a terapia con adalimumab, è stato osservato un tipo specifico e grave di linfoma. Alcuni di questi pazienti erano anche in terapia con azatioprina o 6-mercaptopurina. Avvisi il medico se sta assumendo azatioprina o 6-mercaptopurina con AMGEVITA.
- Inoltre, nei pazienti che assumono adalimumab, sono stati osservati casi di cancro della cute non melanotico. Se nel corso della terapia o successivamente ad essa, dovessero comparire nuove lesioni cutanee o se l’aspetto delle lesioni già esistenti si dovesse modificare, lo riferisca al medico.
- Ci sono stati casi di cancri, oltre al linfoma, in pazienti con uno specifico tipo di malattia del polmone chiamata Malattia Polmonare Ostruttiva Cronica (COPD) trattati con un altro anti-TNF. Se soffre di COPD, o fuma molto, deve discutere con il medico se è appropriato il trattamento con un anti-TNF.
Malattie autoimmuni
- Raramente, il trattamento con AMGEVITA può portare alla manifestazione di una sindrome simil- lupoide. Informi il medico qualora si manifestino sintomi come eruzione cutanea persistente di natura inspiegabile, febbre, dolore alle articolazioni o stanchezza.
Al fine di migliorare la tracciabilità di questo medicinale, il medico o il farmacista deve registrare il
nome dello stesso ed il numero di lotto del prodotto che le è stato somministrato sulla sua scheda
paziente. Lei può prendere nota di questi dettagli in caso le venissero chiesti in futuro.
Bambini e adolescenti
- Vaccinazioni: se possibile, i bambini dovrebbero aver già fatto tutte le vaccinazioni prima di usare AMGEVITA.
- Non dare AMGEVITA a bambini con artrite idiopatica giovanile poliarticolare di età inferiore ai 2 anni.
- Non dare AMGEVITA a bambini con psoriasi a placche di età inferiore ai 4 anni.
- Non dare AMGEVITA a bambini con malattia di Crohn o colite ulcerosa di età inferiore ai 6 anni.
Altri medicinali e AMGEVITA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
AMGEVITA può essere assunto sia con il metotressato che con altri farmaci antireumatici
modificanti la malattia (sulfasalazina, idrossiclorochina, leflunomide e sali d’oro per via
parenterale), steroidi o analgesici, compresi i farmaci anti-infiammatori non steroidei (FANS).
AMGEVITA non deve essere preso in concomitanza con farmaci contenenti come principio attivo anakinra
o abatacept a causa del rischio aumentato di contrarre infezioni gravi. Se ha dubbi, si rivolga al medico.
Gravidanza e allattamento
- Deve considerare l’utilizzo di un’adeguata misura contraccettiva per prevenire una gravidanza e continuarne l’utilizzo per almeno 5 mesi dopo l’ultima terapia con AMGEVITA.
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, chieda consiglio al suo medico circa l’assunzione di questo medicinale.
- AMGEVITA deve essere usato durante la gravidanza solo se necessario.
- Secondo uno studio sulla gravidanza, non è stato riscontrato un rischio maggiore di difetti alla nascita quando la madre aveva ricevuto AMGEVITA durante la gravidanza, rispetto a madri che avevano la stessa patologia, ma che non avevano ricevuto AMGEVITA.
- AMGEVITA può essere usato durante l’allattamento con latte materno.
- Se assume AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre un’infezione.
- É importante che lei riferisca al pediatra o ad altro operatore sanitario dell’utilizzo di AMGEVITA durante la gravidanza, prima che il bambino riceva qualsiasi tipo di vaccinazione. Per maggiori informazioni sulle vaccinazioni consulti la sezione “Avvertenze e precauzioni”.
Guida di veicoli e utilizzo di macchinari
AMGEVITA può influenzare, benché solo in maniera modesta, la sua capacità di guidare, andare in
bicicletta o utilizzare macchinari. In seguito all’assunzione di AMGEVITA, si possono avere disturbi
della visione e la sensazione che l’ambiente in cui ci si trova ruoti (vertigini).
AMGEVITA contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per la dose da 0,8 mL, cioè, é
essenzialmente “senza sodio”.
3. Come usare AMGEVITA
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Adulti con artrite reumatoide, artrite psoriasica, spondilite anchilosante o spondiloartrite assiale senza
evidenza radiografica di spondilite anchilosante
AMGEVITA è iniettato sotto la cute (uso sottocutaneo). In pazienti adulti con artrite reumatoide,
spondilite anchilosante, spondiloartrite assiale senza evidenza radiografica di spondilite anchilosante
e artrite psoriasica, il normale dosaggio è di 40 mg a settimane alterne, somministrato in un’unica
dose.
Nell’artrite reumatoide, il metotressato viene continuato durante il trattamento con AMGEVITA.
Se il medico decide che il metotressato non è appropriato, AMGEVITA può essere somministrato da
solo.
Se è affetto da artrite reumatoide e non riceve metotressato in associazione al trattamento con
AMGEVITA, il medico può decidere di prescriverle 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite idiopatica giovanile poliarticolare
Bambini, adolescenti e adulti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite correlata a entesite
Bambini, adolescenti e adulti a partire da 6 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Adulti con psoriasi a placche
La dose abituale per gli adulti affetti da psoriasi a placche è rappresentata da una dose iniziale pari a
80 mg (tramite due iniezioni da 40 mg in un giorno), seguita da una dose pari a 40 mg,
somministrata a settimane alterne, ad iniziare dalla settimana successiva all’assunzione della dose
iniziale. Lei deve continuare il trattamento con AMGEVITA per il tempo indicato dal medico. In base
alla risposta clinica, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane
alterne.
Bambini e adolescenti affetti da psoriasi a placche
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 40 mg, seguita da una dose di 40 mg la
settimana seguente. Successivamente, la dose abituale è di 40 mg a settimane alterne.
Adulti con idrosadenite suppurativa
La dose abituale per l’idrosadenite suppurativa è una dose iniziale di 160 mg (quattro iniezioni da 40 mg
in un giorno o due iniezioni da 40 mg al giorno per due giorni consecutivi), seguita da una dose di
80 mg (due iniezioni da 40 mg in un giorno) due settimane dopo. Dopo altre due settimane, continuare
con una dose di 40 mg a settimana o 80 mg a settimane alterne, come prescritto dal medico. Si
raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adolescenti con idrosadenite suppurativa di età compresa tra 12 e 17 anni, con peso uguale o superiore
a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 80 mg (tramite due iniezioni da 40 mg in
un giorno), seguita da 40 mg somministrati a settimane alterne a partire da una settimana dopo la dose
iniziale. In caso di risposta inadeguata a 40 mg di AMGEVITA a settimane alterne, il medico può
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adulti con malattia di Crohn
In caso di malattia di Crohn, la dose abituale è inizialmente di 80 mg (tramite due iniezioni da 40 mg
in un giorno) seguiti da 40 mg a settimane alterne, due settimane più tardi. Se è necessario indurre
una risposta più rapida, il medico potrebbe prescrivere una dose iniziale di 160 mg (somministrata in
quattro iniezioni da 40 mg in un giorno o in due iniezioni da 40 mg al giorno per due giorni
consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane più tardi, e
successivamente 40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con malattia di Crohn
Bambini e adolescenti di età compresa tra 6 e 17 anni e con peso inferiore a 40 kg
All’inizio, il regime di dose abituale è di 40 mg seguito da 20 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 80 mg (come due iniezioni da
40 mg in un giorno) seguita da 40 mg due settimane più tardi.
Successivamente, la dose abituale è di 20 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la frequenza della dose a 20 mg ogni settimana.
La penna preriempita da 40 mg non può essere usata per dispensare la dose da 20 mg. Una siringa
preriempita da 20 mg di AMGEVITA è tuttavia disponibile per la dose da 20 mg.
Bambini ed adolescenti di età compresa tra 6 e 17 anni e con peso uguale o superiore a 40 kg
All’inizio, il regime di dose abituale è di 80 mg (tramite due iniezioni da 40 mg in un giorno), seguito
da 40 mg due settimane più tardi. Se è richiesta una risposta più rapida, il medico può prescrivere una
dose iniziale di 160 mg (come quattro iniezioni da 40 mg in un giorno o come due iniezioni da 40 mg
al giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due
settimane più tardi.
Successivamente, la dose abituale è di 40 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con colite ulcerosa
Per gli adulti affetti da colite ulcerosa, la dose iniziale abituale di AMGEVITA è pari a 160 mg
(somministrata in quattro iniezioni da 40 mg in un giorno o in due iniezioni da 40 mg al giorno
per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due
settimane più tardi, 40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con colite ulcerosa
Bambini e adolescenti a partire dai 6 anni di età e con peso inferiore a 40 kg
La dose abituale di AMGEVITA è di 80 mg (tramite due iniezioni da 40 mg in un giorno) seguita da
40 mg (tramite una sola iniezione da 40 mg) dopo due settimane. Successivamente, la dose abituale è di
40 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 40 mg a settimane alterne devono continuare la dose
prescritta.
Bambini e adolescenti a partire dai 6 anni di età e con peso uguale o superiore a 40 kg
La dose abituale di AMGEVITA è di 160 mg (tramite quattro iniezioni da 40 mg in un giorno o due
iniezioni da 40 mg al giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da
40 mg in un giorno) dopo due settimane. Successivamente la dose abituale è di 80 mg a settimane
alterne.
I pazienti che compiono 18 anni mentre assumono 80 mg a settimane alterne devono continuare la dose
prescritta.
Adulti con uveite non infettiva
Per gli adulti affetti da uveite non infettiva, la dose abituale è una dose iniziale pari a 80 mg (tramite due
iniezioni da 40 mg in un giorno), seguita da 40 mg somministrati a settimane alterne a partire da una
settimana dopo la dose iniziale. Deve continuare ad iniettarsi AMGEVITA per tutto il tempo indicato
dal medico.
Nell’uveite non infettiva, i corticosteroidi o gli altri farmaci che influiscono sul sistema immunitario
potranno essere continuati durante il trattamento con AMGEVITA. AMGEVITA può anche essere
somministrato in monoterapia.
Bambini e adolescenti con uveite cronica non infettiva a partire da 2 anni di età
Bambini e adolescenti a partire da 2 anni e con peso inferiore a 30 kg
La dose abituale di AMGEVITA è di 20 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 40 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
La penna preriempita da 40 mg non può essere utilizzata per la dose da 20 mg. Una siringapreriempita
di AMGEVITA da 20 mg è tuttavia disponibile per la dose da 20 mg.
Bambini e adolescenti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose abituale di AMGEVITA è di 40 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 80 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Modo e via di somministrazione
AMGEVITA è somministrato per iniezione sotto la cute (iniezione sottocutanea).
Istruzioni dettagliate su come iniettare AMGEVITA sono fornite nel paragrafo “Istruzioni per l’uso”.
Se usa più AMGEVITA di quanto deve
Se accidentalmente inietta AMGEVITA più frequentemente di quanto disposto dal medico o dal
farmacista, contatti il medico o il farmacista informandolo di aver assunto più farmaco. Conservi sempre
la scatola di questo medicinale, anche se vuota.
Se dimentica di usare AMGEVITA
Se dimentica di fare un’iniezione, deve iniettarsi la dose successiva di AMGEVITA non appena se
ne ricorda. Dopodiché riprenda la dose regolarmente secondo lo schema posologico stabilito.
Se interrompe il trattamento con AMGEVITA
La decisione di interrompere l’uso di AMGEVITA deve essere discussa con il medico. I sintomi
possono ritornare dopo l’interruzione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
manifestino. La maggior parte degli effetti indesiderati si presenta in forma da lieve a moderata.
Tuttavia, alcuni possono essere gravi e richiedere un trattamento. Effetti indesiderati possono
manifestarsi fino a 4 mesi dall’ultima iniezione di AMGEVITA.
Informi immediatamente il medico se nota uno qualsiasi dei seguenti segni di reazione allergica o di
insufficienza cardiaca:
- eruzione cutanea grave, orticaria o altri segni di reazione allergica;
- gonfiore di viso, mani e piedi;
- difficoltà nella respirazione, difficoltà ad inghiottire;
- respiro affannoso sotto sforzo o in posizione sdraiata o gonfiore dei piedi.
Informi appena possibile il medico se nota una qualsiasi delle seguenti reazioni:
- segni di infezione come febbre, sensazione di star male, ferite, problemi dentali, bruciore nell’urinare;
- stanchezza o debolezza;
- tosse;
- formicolio;
- torpore;
- visione doppia;
- debolezza di braccia o gambe;
- segni di cancro della cute come una protuberanza o piaga che non guarisce;
- segni e sintomi che suggeriscono la comparsa di disturbi a carico del sistema ematico (sangue), come la presenza di febbre persistente, lividi, sanguinamenti, pallore.
I sintomi sopra descritti possono essere segni dei seguenti effetti indesiderati, che sono stati osservati
con adalimumab.
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- reazioni nella sede di iniezione (tra cui dolore, gonfiore, arrossamento o prurito);
- infezioni delle vie respiratorie (tra cui raffreddore, naso che cola, infezione sinusale e infezione polmonare);
- cefalea;
- dolore addominale;
- nausea e vomito;
- eruzione cutanea;
- dolore muscoloscheletrico.
Comuni (possono manifestarsi fino a 1 persona su 10)
- infezioni gravi (tra cui setticemia ed influenza);
- infezioni intestinali (tra cui gastroenterite);
- infezioni della cute (tra cui cellulite e infezione da Herpes Zoster);
- infezioni dell’orecchio;
- infezioni orali (tra cui infezioni dentarie ed herpes labiale);
- infezioni dell’apparato riproduttivo;
- infezione delle vie urinarie;
- infezione micotica;
- infezioni articolari;
- tumori benigni;
- cancro della cute;
- reazioni allergiche (tra cui allergia stagionale);
- disidratazione;
- sbalzi di umore (tra cui depressione);
- ansia;
- difficoltà a dormire;
- disturbi della sensibilità come formicolio, sensazione di fitte o intorpidimento;
- emicrania;
- compressione di radice nervosa (tra cui dolore dorso-lombare e dolore alle gambe);
- disturbi della visione;
- infiammazione degli occhi;
- infiammazione delle palpebre e tumefazione degli occhi;
- vertigini (sensazione di capogiro o stanza che ruota);
- sensazione di battito cardiaco accelerato;
- pressione del sangue elevata;
- rossore;
- ematoma;
- tosse;
- asma;
- respiro affannoso;
- sanguinamento gastrointestinale;
- dispepsia (indigestione, stomaco gonfio, bruciore di stomaco);
- disturbo da reflusso acido;
- sindrome sicca (tra cui occhi secchi e bocca secca);
- prurito;
- eruzione cutanea pruriginosa;
- lividi;
- infiammazione della cute (come eczema);
- rottura delle unghie delle dita della mano e del piede;
- sudorazione aumentata;
- perdita di capelli;
- insorgenza o peggioramento della psoriasi;
- spasmi muscolari;
- sangue nell’urina;
- problemi renali;
- dolore toracico;
- edema;
- febbre;
- riduzione delle piastrine nel sangue che aumenta il rischio di sanguinamenti o di lividi;
- difficoltà di cicatrizzazione.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- infezioni opportunistiche (che includono la tubercolosi ed altre infezioni che si manifestano quando si abbassano le difese immunitarie);
- infezioni neurologiche (tra cui la meningite virale);
- infezioni degli occhi;
- infezioni batteriche;
- diverticolite (infiammazione e infezione dell’intestino crasso);
- cancro, tra cui cancro che colpisce il sistema linfatico (linfoma) e melanoma (cancro della cute);
- disturbi del sistema immunitario che potrebbero colpire polmoni, cute e linfonodi (che si presentano più comunemente come sarcoidosi);
- vasculite (infiammazione dei vasi sanguigni);
- tremore;
- neuropatia;
- ictus;
- perdita dell’udito, ronzio;
- sensazione di battito cardiaco irregolare come battiti saltati;
- problemi al cuore che possono causare respiro affannoso o gonfiore alle caviglie;
- attacco cardiaco;
- formazione di una sacca nella parete di un’arteria principale, infiammazione e coagulo in una vena, ostruzione di un vaso sanguigno;
- malattie polmonari che provocano respiro affannoso (inclusa infiammazione);
- embolia polmonare (occlusione di una arteria del polmone);
- versamento della pleura (anomala raccolta di liquido nello spazio pleurico);
- infiammazione del pancreas che causa forti dolori all’addome ed alla schiena;
- difficoltà di deglutizione;
- edema facciale;
- infiammazione della cistifellea, calcoli della cistifellea;
- fegato grasso;
- sudorazioni notturne;
- cicatrice;
- anormale catabolismo muscolare;
- lupus eritematoso sistemico (tra cui infiammazione di cute, cuore, polmone, articolazioni e di altri organi);
- sonno interrotto;
- impotenza;
- infiammazioni.
Rari (possono manifestarsi fino a 1 persona su 1.000)
- leucemia (cancro del sangue del midollo osseo);
- reazione allergica grave con shock;
- sclerosi multipla;
- patologie neurologiche (come infiammazione del nervo ottico e sindrome di Guillain-Barré che può causare debolezza muscolare, sensazioni anomale, formicolio alle braccia ed alla parte superiore del corpo);
- arresto cardiaco;
- fibrosi polmonare (cicatrici del polmone);
- perforazione intestinale (foro nella parete dell’intestino);
- epatite (infiammazione del fegato);
- riattivazione dell’epatite B;
- epatite autoimmune (infiammazione del fegato causata dal proprio sistema immunitario);
- vasculite cutanea (infiammazione dei vasi sanguigni della pelle);
- sindrome di Stevens-Johnson (reazione rischiosa per la vita con sintomi simil-influenzali ed eruzione cutanea con vescicole);
- edema facciale associato a reazioni allergiche;
- eritema multiforme (eruzione cutanea infiammatoria);
- sindrome simil-lupoide;
- angioedema (gonfiore localizzato della pelle);
- reazione cutanea lichenoide (eruzione cutanea rosso-violacea pruriginosa).
Non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- linfoma epato-splenico a cellule T (un raro cancro del sangue che spesso risulta fatale);
- carcinoma a cellule di Merkel (un tipo di cancro della pelle);
- sarcoma di Kaposi, una rara forma di cancro correlato a infezione da Herpes virus umano 8. Il sarcoma di Kaposi si manifesta più comunemente con lesioni viola sulla pelle;
- insufficienza epatica;
- peggioramento di una condizione chiamata dermatomiosite (che si manifesta come eruzione cutanea accompagnata da debolezza muscolare);
- aumento di peso (per la maggior parte dei pazienti, l’aumento di peso è stato basso).
Alcuni degli effetti indesiderati osservati con adalimumab possono essere asintomatici e possono
essere individuati solo attraverso gli esami del sangue. Questi includono:
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- conta dei globuli bianchi bassa;
- conta dei globuli rossi bassa;
- lipidi nel sangue aumentati;
- enzimi epatici aumentati.
Comuni (possono manifestarsi fino a 1 persona su 10)
- conta dei globuli bianchi aumentata;
- conta delle piastrine ridotta;
- acido urico nel sangue aumentato;
- sodio nel sangue anormale;
- calcio nel sangue diminuito;
- fosfato nel sangue diminuito;
- zuccheri nel sangue aumentati;
- latticodeidrogenasi nel sangue aumentata;
- autoanticorpi presenti nel sangue;
- potassio nel sangue diminuito.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- bilirubina nel sangue elevata (esame epatico del sangue).
Rari (possono manifestarsi fino a 1 persona su 1.000)
- conta di globuli bianchi, globuli rossi e piastrine bassa.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare AMGEVITA
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C – 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Una singola penna di AMGEVITA può essere conservata a temperature fino ad un massimo di 25°C
per un periodo massimo di 14 giorni. La penna preriempita deve essere protetta dalla luce e deve essere
gettata via se non usata entro il periodo di 14 giorni.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene AMGEVITA
- Il principio attivo è adalimumab. Ogni penna preriempita contiene 40 mg di adalimumab in 0,8 mL di soluzione.
- Gli altri eccipienti sono acido acetico glaciale, saccarosio, polisorbato 80, sodio idrossido e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di AMGEVITA e contenuto della confezione
AMGEVITA è una soluzione limpida e da incolore a leggermente gialla.
Ogni confezione contiene 1, 2, 4 o 6 penne preriempite monouso SureClick.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Titolare dell’autorizzazione all’immissione in commercio
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Produttore
Amgen Technology Ireland UC
Pottery Road
Dun Laoghaire
Co Dublin
Irlanda
Produttore
Amgen NV
Telecomlaan 5-7
1831 Diegem
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
s.a. Amgen n.v.
Tél/Tel: +32 (0)2 7752711
Lietuva
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
България
Амджен България ЕООД
Тел.: +359 (0)2 424 7440
Luxembourg/Luxemburg
s.a. Amgen
Belgique/Belgien
Tél/Tel: +32 (0)2 7752711
Česká republika
Amgen s.r.o.
Tel: +420 221 773 500
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
Danmark
Amgen, filial af Amgen AB, Sverige
Tlf: +45 39617500
Malta
Amgen S.r.l.
Italy
Tel: +39 02 6241121
Deutschland
Amgen GmbH
Tel: +49 89 1490960
Nederland
Amgen B.V.
Tel: +31 (0)76 5732500
Eesti
Amgen Switzerland AG Vilniaus filialas
Tel: +372 586 09553
Norge
Amgen AB
Tlf: +47 23308000
Ελλάδα
Amgen Ελλάς Φαρμακευτικά Ε.Π.Ε.
Τηλ: +30 210 3447000
Österreich
Amgen GmbH
Tel: +43 (0)1 50 217
España
Amgen S.A.
Tel: +34 93 600 18 60
Polska
Amgen Biotechnologia Sp. z o.o.
Tel.: +48 22 581 3000
France
Amgen S.A.S.
Tél: +33 (0)9 69 363 363
Portugal
Amgen Biofarmacêutica, Lda.
Tel: +351 21 4220606
Hrvatska
Amgen d.o.o.
Tel: +385 (0)1 562 57 20
România
Amgen România SRL
Tel: +4021 527 3000
Ireland
Amgen Ireland Limited
Tel: +353 1 8527400
Slovenija
AMGEN zdravila d.o.o.
Tel: +386 (0)1 585 1767
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Amgen Slovakia s.r.o.
Tel: +421 2 321 114 49
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial
i Finland
Puh/Tel: +358 (0)9 54900500
Kύπρος
C.A. Papaellinas Ltd
Τηλ: +357 22741 741
Sverige
Amgen AB
Tel: +46 (0)8 6951100
Latvija
Amgen Switzerland AG Rīgas filiāle
Tel: +371 257 25888
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, http://www.ema.europa.eu .
-----------------------------------------------------------------------------------------------------------------------------
Istruzioni per l’uso:
AMGEVITA, penna preriempita monouso SureClick
Per uso sottocutaneo
| c Guida alle parti | |
Prima dell’uso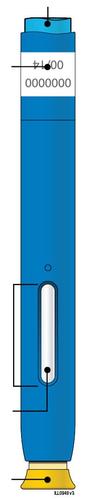 | a Dopo l’uso |
| Pulsante blu di avvio Data di scadenza Finestra n a Medicinale i l Tappo giallo a inserito t I a i z | m r a Data di scadenza F l e d a Finestra gialla (iniezione completa) Dispositivo di sicurezza giallo Tappo giallo disinserito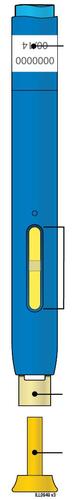 |
| n Importante: L’ago è all’interno | |
Importante
Prima di usare una penna preriempita di AMGEVITA, leggere queste informazioni:
Utilizzo della penna preriempita di AMGEVITA
- È importante non cercare di eseguire autonomamente l’iniezione senza che lei o la persona che la assiste siate stati prima addestrati.
- Nonutilizzare una penna preriempita di AMGEVITA se è caduta su una superficie rigida. Alcune parti della penna preriempita di AMGEVITA potrebbero essersi rotte anche se il danno non le è visibile. Usare una penna preriempita di AMGEVITA nuova.
Passaggio 1: Preparazione
| A. | Estrarre una penna preriempita di AMGEVITA dalla confezione. |
F Estrarre la penna preriempita dalla scatola in posizione verticale e con cautela. l Se la scatola contiene altre penne preriempite ancora inutilizzate, riporla in frigorifero. e Per un’iniezione più confortevole, lasciare la penna preriempita a temperatura ambiente per 15-30 d minuti prima di praticare l’iniezione.
| |
B. | i Ispezionare la penna preriempita di AMGEVITA. |
l a t I Tappo giallo Finestra Medicinale a inserito Osservandolo dall’apposita finestra, assicurarsi che il medicinale sia trasparente, da incolore a i leggermente giallo. z n
| |
| C. | Radunare tutto il necessario per eseguire l’iniezione. |
Lavarsi accuratamente le mani con acqua e sapone. o Su una superficie pulita e ben illuminata, posizionare una penna preriempita nuova. c Altri articoli necessari, ma non inclusi nella confezione:
  | |
D.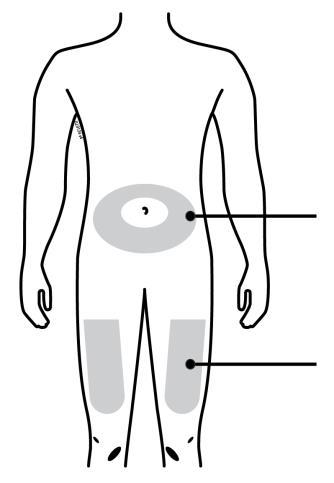 | l Preparazione e pulizia del sito d’iniezione. |
e d a Addome n a Coscia i l a Lei può utilizzare: t
| |
Passaggio 2: Preparazione per l’iniezione
E.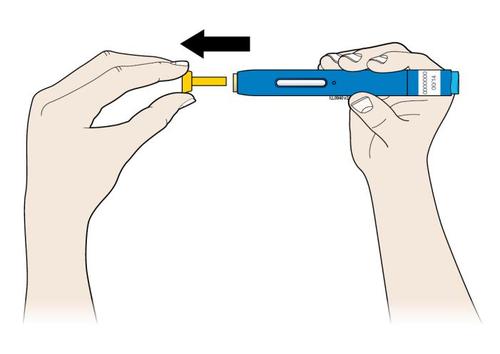 | o Non appena si è pronti ad eseguire l’iniezione, togliere il cappuccio giallo tirandolo in modo deciso. |
c a m r a F l È normale notare la presenza di una goccia di liquido sull’estremità dell’ago o sul dispositivo di e sicurezza giallo. d
| |
F.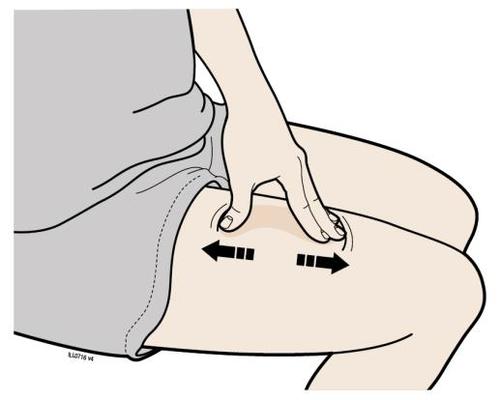 | Distendere la pelle o formare una plica per creare una superficie d’iniezione sicura. |
| Metodo della distensione o c a m r a F Stendere bene la pelle muovendo il pollice e le altre dita in direzioni opposte, in modo da creare un’area larga circa 5 centimetri. OPPURE Metodo della plica l e d a n Afferrare saldamente una parte di pelle con il pollice e le altre dita formando una plica larga circa 5 centimetri. | |
a Importante: Tenere la pelle tesa o afferrare saldamente la plica durante l’iniezione.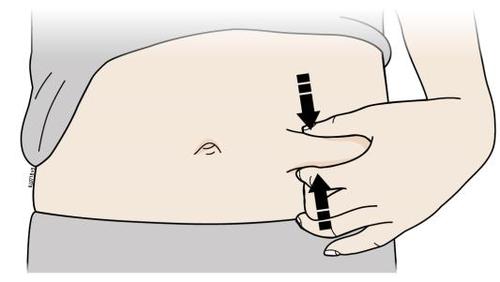 | |
Passaggio 3: Praticare l’iniezione
| G. | a Tenere la pelle distesa o la plica. Dopo aver tolto il cappuccio giallo, posizionare la penna t preriempita sulla pelle con un’inclinazione di 90 gradi. |
I a i z n Importante: Per il momento non toccare il pulsante di avvio blu.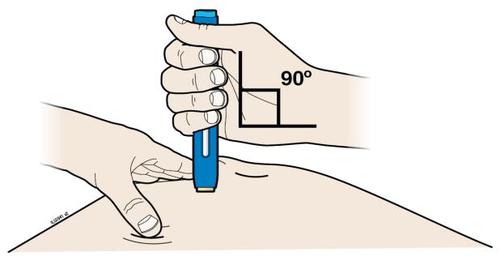 | |
H.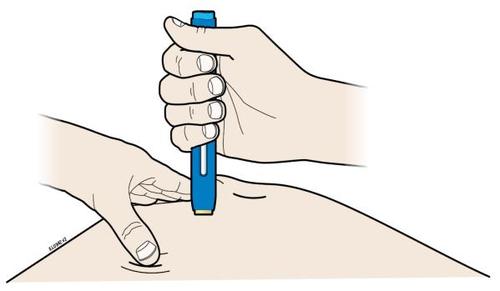 | Premere con decisione la penna preriempita sulla pelle finché non smette di muoversi.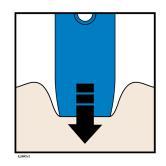 |
| o Premere verso il basso c a m r Importante: Premere verso il basso il più possibile, ma non toccare il pulsante di avvio blu fino a che non si è pronti a praticare l’iniezione. | |
| I. | a Non appena si è pronti a praticare l’iniezione, premere il pulsante di avvio blu. Sentirà un click. |
F “Click” l e d a n a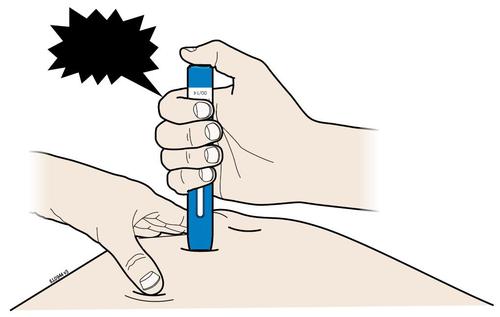 | |
J.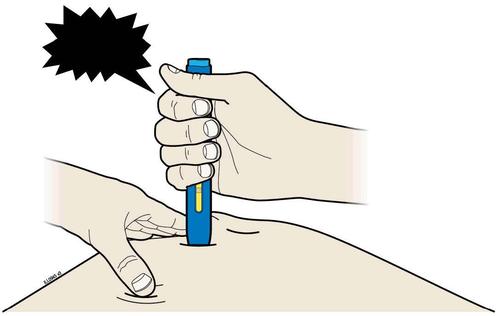 | Continuare a premere verso il basso sulla pelle. L’iniezione potrebbe richiedere circa 10 secondi. 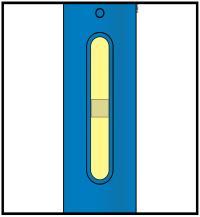 |
o Circa 10 secondi c “Click” a m La finestra diventerà gialla una r volta completata l’iniezione. Potrebbe sentire un secondo a click. F Nota: Dopo aver rimosso la penna preriempita dalla l pelle, l’ago verrà automaticamente ricoperto. e d a Importante: Quando si rimuove la penna preriempita, se la finestra non è diventata gialla, o se si ha l’impressione che il farmaco sia ancora in fase di iniezione, significa che non si è ricevuta una dose intera. Contattare immediatamente il medico.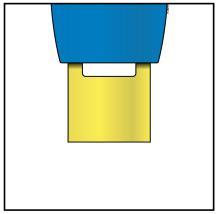 | |
Passaggio 4: Procedure finali
K.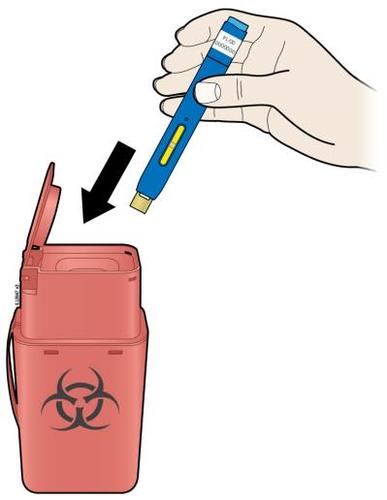 | Gettare la penna preriempita e il cappuccio giallo. |
o c a m r a F l
| |
| L. | a Esaminare il sito d’iniezione. |
| i Se si nota la presenza di sangue, tenervi premuto sopra un batuffolo di cotone o una garza. Non strofinare il sito d’iniezione. Se necessario, applicare un cerotto. | |
AMGEVITA 20 mg soluzione iniettabile in siringa preriempita, 40 mg soluzione iniettabile in siringa preriempita, 80 mg soluzione iniettabile in siringa preriempita
adalimumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Il medico le consegnerà una Scheda Promemoria per il Paziente, che contiene importanti informazioni sulla sicurezza, che ha bisogno di sapere prima della somministrazione di AMGEVITA e durante il trattamento con AMGEVITA. Conservi questa Scheda Promemoriaper il Paziente.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è AMGEVITA e a cosa serve
- 2. Cosa deve sapere prima di usare AMGEVITA
- 3. Come usare AMGEVITA
- 4. Possibili effetti indesiderati
- 5. Come conservare AMGEVITA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è AMGEVITA e a cosa serve
AMGEVITA contiene il principio attivo adalimumab, un medicinale che agisce sul sistema immunitario
(di difesa) dell’organismo.
AMGEVITA è indicato per il trattamento delle malattie infiammatorie di seguito elencate:
- Artrite reumatoide
- Artrite idiopatica giovanile poliarticolare
- Artrite correlata a entesite
- Spondilite anchilosante
- Spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante
- Artrite psoriasica
- Psoriasi a placche
- Idrosadenite suppurativa
- Malattia di Crohn
- Colite ulcerosa
- Uveite non infettiva
Il principio attivo contenuto in AMGEVITA, adalimumab, è un anticorpo monoclonale umano. Gli
anticorpi monoclonali sono proteine che si legano ad un bersaglio specifico.
Il bersaglio di adalimumab è una proteina denominata fattore di necrosi tumorale (TNFα), che è
coinvolto nel sistema immunitario (di difesa) ed è presente a concentrazioni maggiori nelle malattie
infiammatorie elencate sopra. Attraverso il legame al TNFα, AMGEVITA diminuisce il processo
infiammatorio di queste malattie.
Artrite reumatoide
L’artrite reumatoide è una patologia infiammatoria delle articolazioni.
AMGEVITA è usato per trattare l’artrite reumatoide negli adulti. Se soffre di artrite reumatoide di
grado da moderato a grave, inizialmente possono essere assunti altri farmaci modificanti la malattia,
quali il metotressato. Se la risposta a tali farmaci non è soddisfacente, le verrà dato AMGEVITA per
trattare l’artrite reumatoide.
AMGEVITA può essere anche utilizzato per il trattamento dell’artrite reumatoide grave, attiva e
progressiva senza precedente trattamento con metotressato.
AMGEVITA rallenta la progressione del danno alle cartilagini ed alle ossa delle articolazioni causato
dalla malattia e migliora la funzionalità fisica.
Generalmente AMGEVITA è usato con il metotressato. Se il medico decide che il trattamento con
metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Artrite idiopatica giovanile poliarticolare e artrite correlata a entesite
L’artrite idiopatica giovanile poliarticolare e l’artrite correlata a entesite sono malattie infiammatorie
delle articolazioni che di solito si manifestano per la prima volta durante l’infanzia.
AMGEVITA è usato per trattare l’artrite idiopatica giovanile poliarticolare nei pazienti dai 2 anni di età
e l’artrite correlata a entesite nei pazienti dai 6 anni di età. Alla diagnosi possono essere somministrati
altri farmaci modificanti la malattia, come il metotressato. Se la risposta a questi farmaci non dovesse
essere adeguata, le sarà somministrato AMGEVITA per il trattamento dell’artrite idiopatica giovanile
poliarticolare o dell’artrite correlata a entesite.
Spondilite anchilosante e spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante
La spondilite anchilosante e la spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante sono infiammazioni della colonna vertebrale.
AMGEVITA è usato per trattare la spondilite anchilosante e la spondiloartrite assiale senza evidenza
radiografica della spondilite anchilosante negli adulti. Se è affetto da spondilite anchilosante o da
spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante, assumerà prima altri
farmaci. Nel caso in cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà
AMGEVITA per ridurre i segni ed i sintomi della malattia.
Artrite psoriasica
L’artrite psoriasica è un’infiammazione delle articolazioni associata alla psoriasi.
AMGEVITA è usato per trattare l’artrite psoriasica negli adulti. AMGEVITA rallenta il danno alla
cartilagine ed alle ossa delle articolazioni causato dalla malattia e migliora la funzionalità fisica.
Psoriasi a placche in adulti e bambini
La psoriasi a placche è una condizione della pelle che causa chiazze rossastre, squamose e indurite di
pelle ricoperta da squame argentee. La psoriasi a placche può anche colpire le unghie, provocandone la
rottura, l’ispessimento e il sollevamento dal letto dell’unghia, che può essere doloroso. Si ritiene che la
psoriasi sia causata da un problema del sistema immunitario del corpo che conduce ad un aumento della
produzione di cellule cutanee.
AMGEVITA è usato per trattare la psoriasi a placche di grado da moderato a severo negli adulti.
AMGEVITA è inoltre utilizzato per trattare la psoriasi a placche grave in bambini ed adolescenti da 4 a
17 anni per i quali la terapia topica e le fototerapie non abbiano funzionato in modo ottimale o non
siano indicate.
Idrosadenite suppurativa in adulti e adolescenti
L’idrosadenite suppurativa (chiamata a volte acne inversa) è una malattia infiammatoria cronica della
cute e spesso è dolorosa. I sintomi possono includere noduli dolorosi e ascessi (foruncoli) che possono
drenare pus. Più frequentemente colpisce aree specifiche della cute, come la regione sottomammaria, le
ascelle, l’interno cosce, l’inguine e le natiche. Nelle aree colpite si possono anche formare delle
cicatrici.
AMGEVITA è utilizzato per trattare l’idrosadenite suppurativa negli adulti e negli adolescenti dai
12 anni di età. AMGEVITA può ridurre il numero di noduli e di ascessi che lei ha e il dolore che spesso
è associato a questa malattia. Inizialmente, potrebbe ricevere altri medicinali. Se non risponde
sufficientemente bene a questi medicinali, riceverà AMGEVITA.
Malattia di Crohn negli adulti e nei bambini
La malattia di Crohn è un’infiammazione del tratto digerente.
AMGEVITA è usato per trattare la malattia di Crohn negli adulti e nei bambini di età dai 6 ai 17 anni.
Se soffre della malattia di Crohn, le verranno prima somministrati altri farmaci. Nel caso in cui lei non
risponda in maniera sufficientemente adeguata a questi farmaci, le verrà somministrato AMGEVITA
per ridurre segni e sintomi della malattia di Crohn.
Colite ulcerosa negli adulti e nei bambini
La colite ulcerosa è un’infiammazione dell’intestino crasso.
AMGEVITA è usato per trattare la colite ulcerosa da moderata a grave negli adulti e nei bambini di età
dai 6 ai 17 anni. Se è affetto da colite ulcerosa inizialmente potrebbe assumere altri farmaci. Nel caso in
cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà AMGEVITA per
ridurre i segni e i sintomi della malattia.
Uveite non infettiva in adulti e bambini
L’uveite non infettiva è una malattia infiammatoria che colpisce alcune parti dell’occhio.
AMGEVITA è impiegato per il trattamento di
- Adulti affetti da uveite non infettiva con infiammazione che interessa il fondo dell’occhio.
- Bambini dai 2 anni di età con uveite non infettiva cronica con infiammazione che interessa la parte anteriore dell’occhio.
Questa infiammazione può portare a una diminuzione della visione e/o alla presenza di corpi mobili
nell’occhio (punti neri o linee sottili che si muovono attraverso il campo visivo). AMGEVITA agisce
riducendo questa infiammazione.
2. Cosa deve sapere prima di usare AMGEVITA
Non usi AMGEVITA:
- se è allergico ad adalimumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- in presenza di un’infezione grave, incluse tubercolosi attiva, sepsi (infezione del sangue) o altre infezioni opportunistiche (infezioni insolite associate a un sistema immunitario indebolito) (vedere “Avvertenze e precauzioni”). È importante comunicare al medico se ha segni o sintomi di infezione, come per es. febbre, ferite, sensazione di stanchezza, problemi dentali.
- in presenza di insufficienza cardiaca moderata o grave. È importante riferire al medico se c’è stata o è presente una condizione cardiaca grave (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare AMGEVITA:
Reazioni allergiche
- In caso di reazioni allergiche con sintomi quali senso di costrizione toracica, respiro sibilante, capogiro, gonfiore o eruzione cutanea, non si somministri più AMGEVITA e contatti il medico immediatamente considerato che, in rari casi, queste reazioni possono essere rischiose per la vita.
Infezioni
- In caso d’infezione, incluse infezioni a lungo termine o localizzate (per esempio, ulcere alle gambe) consulti il medico prima di iniziare il trattamento con AMGEVITA. Se ha dubbi, contatti il medico.
- È possibile contrarre più facilmente infezioni durante il trattamento con AMGEVITA. Questo rischio può aumentare se la sua funzione polmonare è compromessa. Queste infezioni possono essere gravi ed includere tubercolosi, infezioni causate da virus, funghi, parassiti o batteri, o altre infezioni opportunistiche e sepsi che possono, in rari casi, essere rischiose per la vita del paziente. È importante comunicare al medico la presenza di sintomi quali febbre, ferite, sensazione di stanchezza o problemi dentali. Il medico potrebbe raccomandare la sospensione temporanea di AMGEVITA.
Tubercolosi
- Poiché si sono verificati dei casi di tubercolosi in pazienti sottoposti a trattamento con adalimumab, prima di iniziare la terapia con AMGEVITA il medico dovrà controllare se lei presenta segni o sintomi di tubercolosi. Questo comporterà la raccolta di una valutazione medica dettagliata che includa la sua storia medica e appropriati esami clinici (per es. una radiografia del torace e il test della tubercolina). L’esecuzione e i risultati di tali esami devono essere registrati nella Scheda Promemoria per il Paziente. È molto importante comunicare al medico se ha mai avuto la tubercolosi, o se ha avuto contatti ravvicinati con malati di tubercolosi.
- La tubercolosi si può manifestare durante la terapia nonostante lei abbia ricevuto un trattamento preventivo per la tubercolosi.
- Contatti immediatamente il medico se durante o dopo la terapia compaiono sintomi di tubercolosi (tosse persistente, perdita di peso, svogliatezza, febbre moderata) o di altre infezioni.
Viaggio/infezione ricorrente
- Avvisi il medico se risiede o viaggia in regioni dove le infezioni fungine, come l’istoplasmosi, la coccidioidomicosi o la blastomicosi, sono endemiche.
- Avvisi il medico se ha avuto infezioni recidivanti o se presenta condizioni che aumentano il rischio di infezione.
Virus dell’epatite B
- Informi il medico se lei è portatore del virus dell’epatite B (HBV), se ha un’infezione in fase attiva da virus dell’epatite B o se pensa di poter essere a rischio di contrarre il virus dell’epatite B. Il medico la deve testare per l’infezione da virus dell’epatite B. L’assunzione di AMGEVITA può causare la riattivazione del virus dell’epatite B nei soggetti che risultano portatori di questo virus. In alcuni rari casi, soprattutto se il paziente è sottoposto a terapia con altri farmaci che sopprimono il sistema immunitario, la riattivazione del virus dell’epatite B può mettere a rischio la vita del paziente.
Età superiore a 65 anni
- Se ha più di 65 anni può essere più suscettibile ad infezioni durante l’assunzione di AMGEVITA. Lei e il medico dovete prestare particolare attenzione a segni di infezione mentre è in trattamento con AMGEVITA. È importante informare il medico se compaiono i sintomi di infezioni quali febbre, ferite, sensazione di stanchezza o problemi dentali.
Interventi chirurgici o procedure dentistiche
- Prima di un intervento chirurgico o procedure dentistiche, informi il medico che sta prendendo AMGEVITA. Il medico potrebbe consigliare la sospensione temporanea di AMGEVITA.
Malattia demielinizzante
- Se è affetto o sviluppa malattia demielinizzante come la sclerosi multipla, il medico deciderà se è il caso di iniziare o continuare a ricevere il trattamento con AMGEVITA. Informi il medico immediatamente nel caso in cui lei manifesti sintomi quali variazioni nella visione, debolezza di braccia o gambe o intorpidimento o formicolio che interessi qualsiasi parte del corpo.
Vaccinazioni
- Certi vaccini contengono forme vive ma indebolite di batteri o virus che causano malattie che possono causare infezioni e non devono essere somministrati durante il trattamento con AMGEVITA. Consulti il medico prima di sottoporsi a vaccinazioni. Nei bambini, prima di iniziare la terapia a base di AMGEVITA, si raccomanda, se possibile, di attuare il programma di vaccinazioni previsto, in ottemperanza alle linee guida in vigore sulle vaccinazioni.
- Se ha assunto AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre tale infezione fino a circa 5 mesi dopo l’ultima somministrazione che lei ha assunto durante la gravidanza. È importante che lei riferisca al pediatra o ad altro operatore sanitario del suo utilizzo di AMGEVITA durante la gravidanza, cosicché possano decidere quando il bambino deve ricevere qualsiasi tipo di vaccinazione.
Insufficienza cardiaca
- In caso di lieve insufficienza cardiaca e di concomitante trattamento con AMGEVITA, il medico dovrà attentamente valutare e seguire lo stato del suo cuore. È importante informare il medico se ha o ha avuto problemi di cuore. Se si manifestano nuovi sintomi di insufficienza cardiaca o se i sintomi già esistenti dovessero peggiorare (per esempio, fiato corto o gonfiore dei piedi), contatti immediatamente il medico. Il medico deciderà se può assumere AMGEVITA.
Febbre, lividi, sanguinamento o aspetto pallido
- In alcuni pazienti l’organismo può non essere in grado di produrre un quantitativo di cellule del sangue sufficiente, tale da aiutarlo a combattere le infezioni o ad arrestare un sanguinamento. Nel caso in cui lei abbia febbre persistente, lividi o facili sanguinamenti o aspetto pallido, si rivolga immediatamente al medico. Il medico potrebbe decidere di interrompere la terapia.
Cancro
- Nei pazienti, sia bambini sia adulti, sottoposti a trattamento con adalimumab o con altri farmaci anti-TNF, molto raramente si sono manifestati alcuni tipi di cancro. I pazienti affetti da artrite reumatoide di grave entità da molto tempo possono presentare un rischio superiore alla media di svilupparelinfoma (un cancro che colpisce il sistema linfatico) e leucemia (un cancro che colpisce il sangue e il midollo osseo).
- Se lei assume AMGEVITA, il rischio di contrarre linfoma, leucemia o altri cancri può aumentare. In rare circostanze, nei pazienti sottoposti a terapia con adalimumab, è stato osservato un tipo specifico e grave di linfoma. Alcuni di questi pazienti erano anche in terapia con azatioprina o 6-mercaptopurina. Avvisi il medico se sta assumendo azatioprina o 6-mercaptopurina con AMGEVITA.
- Inoltre, nei pazienti che assumono adalimumab, sono stati osservati casi di cancro della cute non melanotico. Se nel corso della terapia, o successivamente ad essa, dovessero comparire nuove lesioni cutanee o se l’aspetto delle lesioni già esistenti si dovesse modificare, lo riferisca al medico.
- Ci sono stati casi di cancri, oltre al linfoma, in pazienti con uno specifico tipo di malattia del polmone chiamata Malattia Polmonare Ostruttiva Cronica (COPD) trattati con un altro anti-TNF. Se soffre di COPD, o fuma molto, deve discutere con il medico se è appropriato il trattamento con un anti-TNF.
Malattie autoimmuni
- Raramente, il trattamento con AMGEVITA può portare alla manifestazione di una sindrome simil- lupoide. Informi il medico qualora si manifestino sintomi come eruzione cutanea persistente di natura inspiegabile, febbre, dolore alle articolazioni o stanchezza.
Al fine di migliorare la tracciabilità di questo medicinale, il medico o il farmacista deve registrare il
nome dello stesso ed il numero di lotto del prodotto che le è stato somministrato sulla sua scheda
paziente. Lei può prendere nota di questi dettagli in caso le venissero chiesti in futuro.
Bambini e adolescenti
- Vaccinazioni: se possibile, i bambini dovrebbero aver già fatto tutte le vaccinazioni prima di usare AMGEVITA.
- Non dare AMGEVITA a bambini con artrite idiopatica giovanile poliarticolare di età inferiore ai 2 anni.
- Non dare AMGEVITA a bambini con psoriasi a placche di età inferiore ai 4 anni.
- Non dare AMGEVITA a bambini con malattia di Crohn o colite ulcerosa di età inferiore ai 6 anni.
Altri medicinali e AMGEVITA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
AMGEVITA può essere assunto sia con il metotressato che con altri farmaci antireumatici modificanti
la malattia (sulfasalazina, idrossiclorochina, leflunomide e sali d’oro per via parenterale), steroidi o
analgesici, compresi i farmaci anti-infiammatori non steroidei (FANS).
AMGEVITA non deve essere preso in concomitanza con farmaci contenenti come principio attivo
anakinra o abatacept a causa del rischio aumentato di contrarre infezioni gravi. Se ha dubbi, si rivolga al
medico.
Gravidanza e allattamento
- Deve considerare l’utilizzo di un’adeguata misura contraccettiva per prevenire una gravidanza e continuarne l’utilizzo per almeno 5 mesi dopo l’ultima terapia con AMGEVITA.
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, chieda consiglio al suo medico circa l’assunzione di questo medicinale.
- AMGEVITA deve essere usato durante la gravidanza solo se necessario.
- Secondo uno studio sulla gravidanza, non è stato riscontrato un rischio maggiore di difetti alla nascita quando la madre aveva ricevuto AMGEVITA durante la gravidanza, rispetto a madri che avevano la stessa patologia, ma che non avevano ricevuto AMGEVITA.
- AMGEVITA può essere usato durante l’allattamento con latte materno.
- Se assume AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre un’infezione.
- É importante che lei riferisca al pediatra o ad altro operatore sanitario dell’utilizzo di AMGEVITA durante la gravidanza, prima che il bambino riceva qualsiasi tipo di vaccinazione. Per maggiori informazioni sulle vaccinazioni consulti la sezione “Avvertenze e precauzioni”.
Guida di veicoli e utilizzo di macchinari
AMGEVITA può influenzare, benché solo in maniera modesta, la sua capacità di guidare, andare in
bicicletta o utilizzare macchinari. In seguito all’assunzione di AMGEVITA, si possono avere disturbi
della visione e la sensazione che l’ambiente in cui ci si trova ruoti (vertigini).
AMGEVITA contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per la dose da 0,8 mL, cioè, é
essenzialmente “senza sodio”.
3. Come usare AMGEVITA
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Adulti con artrite reumatoide, artrite psoriasica, spondilite anchilosante o spondiloartrite assiale senza
evidenza radiografica di spondilite anchilosante.
AMGEVITA è iniettato sotto la cute (uso sottocutaneo). In pazienti adulti con artrite reumatoide,
spondilite anchilosante, spondiloartrite assiale senza evidenza radiografica di spondilite anchilosante e
artrite psoriasica, il normale dosaggio è di 40 mg a settimane alterne, somministrato in un’unica dose.
Nell’artrite reumatoide, il metotressato viene continuato durante il trattamento con AMGEVITA. Se il
medico decide che il metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Se è affetto da artrite reumatoide e non riceve metotressato in associazione al trattamento con
AMGEVITA, il medico può decidere di prescriverle 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite idiopatica giovanile poliarticolare
Bambini e adolescenti a partire da 2 anni di età e con peso compreso tra 10 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è 20 mg a settimane alterne.
Bambini, adolescenti e adulti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite correlata a entesite
Bambini e adolescenti a partire da 6 anni di età e con peso compreso tra 15 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è 20 mg a settimane alterne.
Bambini, adolescenti e adulti a partire da 6 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Adulti con psoriasi a placche
La dose abituale per gli adulti affetti da psoriasi a placche è rappresentata da una dose iniziale pari a
80 mg, seguita da una dose pari a 40 mg, somministrata a settimane alterne, ad iniziare dalla settimana
successiva all’assunzione della dose iniziale. Lei deve continuare il trattamento con AMGEVITA per il
tempo indicato dal medico. In base alla risposta clinica, il medico può aumentare la dose a 40 mg ogni
settimana o 80 mg a settimane alterne.
Bambini e adolescenti affetti da psoriasi a placche
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso compreso tra 15 kg e meno di 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 20 mg, seguita da una dose di 20 mg la
settimana seguente. Successivamente, la dose abituale è di 20 mg a settimane alterne.
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 40 mg, seguita da una dose di 40 mg la
settimana seguente. Successivamente, la dose abituale è di 40 mg a settimane alterne.
Adulti con idrosadenite suppurativa
La dose abituale per l’idrosadenite suppurativa è una dose iniziale di 160 mg (due iniezioni da 80 mg in
un giorno o una iniezione da 80 mg al giorno per due giorni consecutivi), seguita da una dose di 80 mg
due settimane dopo. Dopo altre due settimane, continuare con una dose di 40 mg a settimana o 80 mg a
settimane alterne, come prescritto dal medico. Si raccomanda di utilizzare tutti i giorni una soluzione di
lavaggio antisettica sulle aree interessate.
Adolescenti con idrosadenite suppurativa di età compresa tra 12 e 17 anni, con peso uguale o superiore
a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 80 mg, seguita da 40 mg somministrati a
settimane alterne a partire da una settimana dopo la dose iniziale. In caso di risposta inadeguata a 40 mg
di AMGEVITA a settimane alterne, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a
settimane alterne.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adulti con malattia di Crohn
In caso di malattia di Crohn, la dose abituale è inizialmente di 80 mg seguita da 40 mg a settimane
alterne, dopo due settimane. Se è necessario indurre una risposta più rapida, il medico potrebbe
prescrivere una dose iniziale di 160 mg (due iniezioni da 80 mg in un giorno o una iniezione da 80 mg
al giorno per due giorni consecutivi) seguita da 80 mg due settimane più tardi, e successivamente 40 mg
a settimane alterne. In funzione della risposta clinica, il medico potrebbe aumentare la dose a 40 mg
ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con malattia di Crohn
Bambini e adolescenti di età compresa tra 6 e 17 anni e con peso inferiore a 40 kg
All’inizio, il regime di dose abituale è di 40 mg, seguito da 20 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 80 mg seguita da 40 mg due
settimane più tardi.
Successivamente, la dose abituale è di 20 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la frequenza della dose a 20 mg ogni settimana.
Bambini ed adolescenti di età compresa tra 6 e 17 anni e con peso uguale o superiore a 40 kg
All’inizio, il regime di dose abituale è di 80 mg, seguito da 40 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 160 mg (due iniezioni da 80 mg
in un giorno o una iniezione da 80 mg al giorno per due giorni consecutivi) seguita da 80 mg due
settimane più tardi.
Successivamente, la dose abituale è di 40 mg a settimane alterne. A seconda della risposta del
bambino, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con colite ulcerosa
Per gli adulti affetti da colite ulcerosa, la dose abituale di AMGEVITA è pari a 160 mg (due iniezioni
da 80 mg in un giorno o una iniezione da 80 mg al giorno per due giorni consecutivi) seguita da 80 mg
due settimane più tardi, poi 40 mg a settimane alterne. In funzione della risposta clinica, il medico
potrebbe aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con colite ulcerosa
Bambini e adolescenti a partire dai 6 anni di età e con peso inferiore a 40 kg
La dose abituale di AMGEVITA è di 80 mg seguita da 40 mg (tramite una sola iniezione da 40 mg)
dopo due settimane. Successivamente, la dose abituale è di 40 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 40 mg a settimane alterne devono continuare la dose
prescritta.
Bambini e adolescenti a partire dai 6 anni di età e con peso uguale o superiore a 40 kg
La dose abituale di AMGEVITA è di 160 mg (due iniezioni da 80 mg in un giorno o una iniezione da
80 mg al giorno per due giorni consecutivi) seguita da 80 mg dopo due settimane. Successivamente la
dose abituale è di 80 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 80 mg a settimane alterne devono continuare la dose
prescritta.
Adulti con uveite non infettiva
Per gli adulti con uveite non infettiva, la dose abituale è una dose iniziale di 80 mg, seguita da 40 mg
somministrati a settimane alterne a partire da una settimana dopo la dose iniziale. Deve continuare ad
iniettarsi AMGEVITA per tutto il tempo indicato dal medico.
Nell’uveite non infettiva, i corticosteroidi o gli altri farmaci che influiscono sul sistema immunitario
potranno essere continuati durante il trattamento con AMGEVITA. AMGEVITA può anche essere
somministrato in monoterapia.
Bambini e adolescenti con uveite cronica non infettiva a partire da 2 anni di età
Bambini e adolescenti a partire da 2 anni e con peso inferiore a 30 kg
La dose abituale di AMGEVITA è di 20 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 40 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Bambini e adolescenti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose abituale di AMGEVITA è di 40 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 80 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Modo e via di somministrazione
AMGEVITA è somministrato per iniezione sotto la cute (iniezione sottocutanea).
Istruzioni dettagliate su come iniettare AMGEVITA sono fornite nel paragrafo “Istruzioni per l’uso”.
Se usa più AMGEVITA di quanto deve
Se accidentalmente inietta AMGEVITA più frequentemente di quanto disposto dal medico o dal
farmacista, contatti il medico o il farmacista informandolo di aver assunto più farmaco. Conservi
sempre la scatola di questo medicinale, anche se vuota.
Se dimentica di usare AMGEVITA
Se dimentica di fare un’iniezione, deve iniettarsi la dose successiva di AMGEVITA non appena se ne
ricorda. Dopodiché riprenda la dose regolarmente secondo lo schema posologico stabilito.
Se interrompe il trattamento con AMGEVITA
La decisione di interrompere l’uso di AMGEVITA deve essere discussa con il medico. I sintomi
possono ritornare dopo l’interruzione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino. La maggior parte degli effetti indesiderati si presenta in forma da lieve a moderata.
Tuttavia, alcuni possono essere gravi e richiedere un trattamento. Effetti indesiderati possono
manifestarsi fino a 4 mesi dall’ultima iniezione di AMGEVITA.
Informi immediatamente il medico se nota uno qualsiasi dei seguenti segni di reazione allergica o di
insufficienza cardiaca:
- eruzione cutanea grave, orticaria o altri segni di reazione allergica;
- gonfiore di viso, mani e piedi;
- difficoltà nella respirazione, difficoltà ad inghiottire;
- respiro affannoso sotto sforzo o in posizione sdraiata o gonfiore dei piedi.
Informi appena possibile il medico se nota una qualsiasi delle seguenti reazioni:
- segni di infezione come febbre, sensazione di star male, ferite, problemi dentali, bruciore nell’urinare;
- stanchezza o debolezza;
- tosse;
- formicolio;
- torpore;
- visione doppia;
- debolezza di braccia o gambe;
- segni di cancro della pelle come protuberanza o piaga che non guarisce;
- segni e sintomi che suggeriscono la comparsa di disturbi a carico del sistema ematico (sangue), come la presenza di febbre persistente, lividi, sanguinamenti, pallore.
I sintomi sopra descritti possono essere segni dei seguenti effetti indesiderati, che sono stati osservati
con adalimumab.
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- reazioni nella sede di iniezione (tra cui dolore, gonfiore, arrossamento o prurito);
- infezioni delle vie respiratorie (tra cui raffreddore, naso che cola, infezione sinusale e infezione polmonare);
- cefalea;
- dolore addominale;
- nausea e vomito;
- eruzione cutanea;
- dolore muscoloscheletrico.
Comuni (possono manifestarsi fino a 1 persona su 10)
- infezioni gravi (tra cui setticemia ed influenza);
- infezioni intestinali (tra cui gastroenterite);
- infezioni della pelle (tra cui cellulite e infezione da Herpes Zoster);
- infezioni dell’orecchio;
- infezioni orali (tra cui infezioni dentarie ed herpes labiale);
- infezioni dell’apparato riproduttivo;
- infezione delle vie urinarie;
- infezione micotica;
- infezioni articolari;
- tumori benigni;
- cancro della pelle;
- reazioni allergiche (tra cui allergia stagionale);
- disidratazione;
- sbalzi di umore (tra cui depressione);
- ansia;
- difficoltà a dormire;
- disturbi della sensibilità come formicolii, sensazione di fitte o intorpidimento;
- emicrania;
- compressione di radice nervosa (tra cui dolore dorso-lombare e dolore alle gambe);
- disturbi della visione;
- infiammazione degli occhi;
- infiammazione delle palpebre e tumefazione degli occhi;
- vertigini (sensazione di capogiro o stanza che ruota);
- sensazione di battito cardiaco accelerato;
- pressione del sangue elevata;
- rossore;
- ematoma;
- tosse;
- asma;
- respiro affannoso;
- sanguinamento gastrointestinale;
- dispepsia (indigestione, stomaco gonfio, bruciore di stomaco);
- disturbo da reflusso acido;
- sindrome sicca (tra cui occhi secchi e bocca secca);
- prurito;
- eruzione cutanea pruriginosa;
- lividi;
- infiammazione della pelle (come eczema);
- rottura delle unghie delle dita della mano e del piede;
- sudorazione aumentata;
- perdita di capelli;
- insorgenza o peggioramento della psoriasi;
- spasmi muscolari;
- sangue nell’urina;
- problemi renali;
- dolore toracico;
- edema;
- febbre;
- riduzione delle piastrine nel sangue che aumenta il rischio di sanguinamento o di lividi;
- difficoltà di cicatrizzazione.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- infezioni opportunistiche (che includono la tubercolosi ed altre infezioni che si manifestano quando si abbassano le difese immunitarie);
- infezioni neurologiche (tra cui la meningite virale);
- infezioni degli occhi;
- infezioni batteriche;
- diverticolite (infiammazione e infezione dell’intestino crasso);
- cancro, tra cui cancro che colpisce il sistema linfatico (linfoma) e melanoma (cancro della cute);
- disturbi del sistema immunitario che potrebbero colpire polmoni, cute e linfonodi (che si presentano più comunemente come sarcoidosi);
- vasculite (infiammazione dei vasi sanguigni);
- tremore;
- neuropatia;
- ictus;
- perdita dell’udito, ronzio;
- sensazione di battito cardiaco irregolare come battiti saltati;
- problemi al cuore che possono causare respiro affannoso o gonfiore alle caviglie;
- attacco cardiaco;
- formazione di una sacca nella parete di un’arteria principale, infiammazione e coagulo in una vena, ostruzione di un vaso sanguigno;
- malattie polmonari che provocano respiro affannoso (inclusa infiammazione);
- embolia polmonare (occlusione di una arteria del polmone);
- versamento della pleura (anomala raccolta di liquido nello spazio pleurico);
- infiammazione del pancreas che causa forti dolori all’addome ed alla schiena;
- difficoltà di deglutizione;
- edema facciale;
- infiammazione della cistifellea, calcoli della cistifellea;
- fegato grasso;
- sudorazioni notturne;
- cicatrice;
- anormale catabolismo muscolare;
- lupus eritematoso sistemico (tra cui infiammazione di cute, cuore, polmone, articolazioni e di altri organi);
- sonno interrotto;
- impotenza;
- infiammazioni.
Rari (possono manifestarsi fino a 1 persona su 1 000)
- leucemia (cancro del sangue del midollo osseo);
- reazione allergica grave con shock;
- sclerosi multipla;
- patologie neurologiche (come infiammazione del nervo ottico e sindrome di Guillain-Barré che può causare debolezza muscolare, sensazioni anomale, formicolio alle braccia ed alla parte superiore del corpo);
- arresto cardiaco;
- fibrosi polmonare (cicatrici del polmone);
- perforazione intestinale (foro nella parete dell’intestino);
- epatite (infiammazione del fegato);
- riattivazione dell’epatite B;
- epatite autoimmune (infiammazione del fegato causata dal proprio sistema immunitario);
- vasculite cutanea (infiammazione dei vasi sanguigni della pelle);
- sindrome di Stevens-Johnson (reazione rischiosa per la vita con sintomi simil-influenzali ed eruzione cutanea con vescicole);
- edema facciale associato a reazioni allergiche;
- eritema multiforme (eruzione cutanea infiammatoria);
- sindrome simil-lupoide;
- angioedema (gonfiore localizzato della pelle);
- reazione cutanea lichenoide (eruzione cutanea rosso-violacea pruriginosa).
Non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- linfoma epato-splenico a cellule T (un raro cancro del sangue che spesso risulta fatale);
- carcinoma a cellule di Merkel (un tipo di cancro della pelle);
- sarcoma di Kaposi, una rara forma di cancro correlato a infezione da Herpes virus umano 8. Il sarcoma di Kaposi si manifesta più comunemente con lesioni viola sulla pelle;
- insufficienza epatica;
- peggioramento di una condizione chiamata dermatomiosite (che si manifesta come eruzione cutanea accompagnata da debolezza muscolare);
- aumento di peso (per la maggior parte dei pazienti l’aumento di peso è stato basso).
Alcuni degli effetti indesiderati osservati con adalimumab possono essere asintomatici e possono essere
individuati solo attraverso gli esami del sangue. Questi includono:
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- conta dei globuli bianchi bassa;
- conta dei globuli rossi bassa;
- lipidi nel sangue aumentati;
- enzimi epatici aumentati.
Comuni (possono manifestarsi fino a 1 persona su 10)
- conta dei globuli bianchi aumentata;
- conta delle piastrine ridotta;
- acido urico nel sangue aumentato;
- sodio nel sangue anormale;
- calcio nel sangue diminuito;
- fosfato nel sangue diminuito;
- zuccheri nel sangue aumentati;
- latticodeidrogenasi nel sangue aumentata;
- autoanticorpi presenti nel sangue;
- potassio nel sangue diminuito.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- bilirubina nel sangue elevata (esame epatico del sangue).
Rari (possono manifestarsi fino a 1 persona su 1 000)
- conta di globuli bianchi, globuli rossi e piastrine bassa.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a
fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare AMGEVITA
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta/blister e sulla scatola
dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C – 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Una singola siringa preriempita di AMGEVITA può essere conservata a temperature fino ad un
massimo di 25°C per un periodo massimo di 14 giorni. La siringa preriempita deve essere protetta dalla
luce e deve essere gettata via se non usata entro il periodo di 14 giorni.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene AMGEVITA
- Il principio attivo è adalimumab. Ogni siringa preriempita contiene 20 mg di adalimumab in 0,2 mL di soluzione, 40 mg di adalimumab in 0,4 mL di soluzione o 80 mg di adalimumab in 0,8 mL di soluzione.
- Gli altri eccipienti sono acido L-lattico, saccarosio, polisorbato 80, sodio idrossido e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di AMGEVITA e contenuto della confezione
AMGEVITA è una soluzione limpida e da incolore a leggermente gialla.
Ogni confezione contiene 1 siringa preriempita monouso da 20 mg (con uno stantuffo giallo).
Ogni confezione contiene 1, 2 o 6 siringhe preriempite monouso da 40 mg (con uno stantuffo blu).
Ogni confezione contiene 1, 2 o 3 siringhe preriempite monouso da 80 mg (con uno stantuffo
arancione).
Titolare dell’autorizzazione all’immissione in commercio e produttore
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Titolare dell’autorizzazione all’immissione in commercio
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Produttore
Amgen Technology Ireland UC
Pottery Road
Dun Laoghaire
Co Dublin
Irlanda
Produttore
Amgen NV
Telecomlaan 5-7
1831 Diegem
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
s.a. Amgen n.v.
Tél/Tel: +32 (0)2 7752711
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
България
Амджен България ЕООД
Тел.: +359 (0)2 424 7440
Luxembourg/Luxemburg
s.a. Amgen
Belgique/Belgien
Tél/Tel: +32 (0)2 7752711
Česká republika
Amgen s.r.o.
Tel: +420 221 773 500
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
Danmark
Amgen, filial af Amgen AB, Sverige
Tlf: +45 39617500
Malta
Amgen S.r.l.
Italy
Tel: +39 02 6241121
Deutschland
Amgen GmbH
Tel: +49 89 1490960
Nederland
Amgen B.V.
Tel: +31 (0)76 5732500
Eesti
Amgen Switzerland AG Vilniaus filialas
Tel: +372 586 09553
Norge
Amgen AB
Tlf: +47 23308000
Ελλάδα
Amgen Ελλάς Φαρμακευτικά Ε.Π.Ε.
Τηλ: +30 210 3447000
Österreich
Amgen GmbH
Tel: +43 (0)1 50 217
España
Amgen S.A.
Tel: +34 93 600 18 60
Polska
Amgen Biotechnologia Sp. z o.o.
Tel.: +48 22 581 3000
France
Amgen S.A.S.
Tél: +33 (0)9 69 363 363
Portugal
Amgen Biofarmacêutica, Lda.
Tel: +351 21 4220606
Hrvatska
Amgen d.o.o.
Tel: +385 (0)1 562 57 20
România
Amgen România SRL
Tel: +4021 527 3000
Ireland
Amgen Ireland Limited
Tel: +353 1 8527400
Slovenija
AMGEN zdravila d.o.o.
Tel: +386 (0)1 585 1767
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Amgen Slovakia s.r.o.
Tel: +421 2 321 114 49
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial
i Finland
Puh/Tel: +358 (0)9 54900500
Kύπρος
C.A. Papaellinas Ltd
Τηλ: +357 22741 741
Sverige
Amgen AB
Tel: +46 (0)8 6951100
Latvija
Amgen Switzerland AG Rīgas filiāle
Tel: +371 257 25888
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, http://www.ema.europa.eu .
ISTRUZIONI PER L’USO
Guida alle parti della siringa preriempita
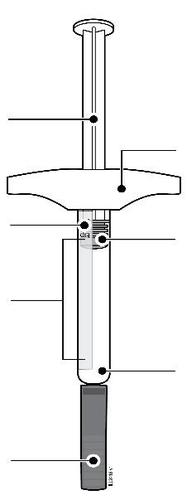
Stantuffo
Flangia
Data di scadenza
Estremità stantuffo
(la posizione può
variare)
Corpo della
siringa
Medicinale
Cappuccio
dell’ago
(ago all’interno)
1Informazioni importanti da conoscere prima di eseguire l’iniezione di AMGEVITA
Dosaggio:
- AMGEVITA è disponibile in tre diversi dosaggi: 20 mg/0,2 mL, 40 mg/0,4 mL, 80 mg/0,8 mL. Controllare la prescrizione medica per accertarsi di avere il dosaggio corretto.
- Il colore e l’aspetto della siringa preriempita variano a seconda del dosaggio. Anche la quantità di medicinale contenuto nella siringa preriempita varia a seconda del dosaggio.
- Ad esempio, è corretto che il dosaggio di 20 mg/0,2 mL contenga una piccola quantità di medicinale e che il dosaggio di 80 mg/0,8 mL contenga una grande quantità di medicinale. Fare riferimento alle illustrazioni sottostanti per conoscere quale sia l’aspetto del dosaggio prescritto nella siringa preriempita.
20 mg/0,2 mL 40 mg/0,4 mL 80 mg/0,8 mL
Utilizzo della siringa preriempita di AMGEVITA:
- È importante non procedere autonomamente all’iniezione prima di avere letto e compreso interamente le presenti istruzioni per l’uso e senza aver ricevuto un’apposita formazione da parte del medico o dell’operatore sanitario.
- Nonutilizzare la siringa preriempita se la confezione risulta danneggiata o il sigillo di chiusura non è integro.
- Nonutilizzare la siringa preriempita dopo la data di scadenza indicata sull’etichetta.
- Nonagitare mai la siringa preriempita.
- Nonrimuovere il cappuccio dell’ago dalla siringa preriempita finché non si è pronti per l’iniezione.
- Nonutilizzare la siringa preriempita se è stata congelata.
- Nonutilizzare la siringa preriempita se è caduta su una superficie dura. Alcune parti della siringa preriempita potrebbero essersi rotte, anche se il danno potrebbe non essere visibile. Utilizzare una nuova siringa preriempita e rivolgersi al medico o all’operatore sanitario.
- La siringa preriempita non contiene lattice di gomma naturale.
Importante:tenere la siringa preriempita e il contenitore per lo smaltimento di oggetti taglienti
fuori dalla vista e dalla portata dei bambini.
| 2 | Preparazione per l’iniezione di AMGEVITA |
2a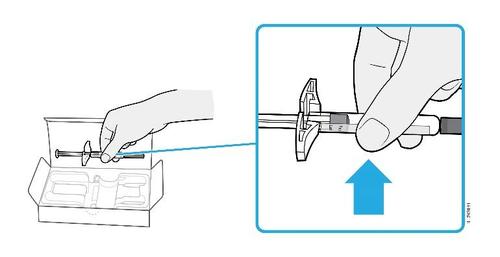 | Afferrare il corpo della siringa ed estrarre la siringa preriempita dalla confezione. |
| r m a c o | |
a
| |
| 2b | l Attendere 30 minuti affinché la siringa preriempita raggiunga la temperatura ambiente. |
| e d ATTENDERE 30 a minuti | |
n
| |
2c | Raccogliere e porre il materiale per l’iniezione su una superficie pulita e ben illuminata. a i Salvietta imbevuta di alcol z n Cerotto Contenitore per lo e smaltimento di oggetti Batuffolo di cotone o taglienti g tampone di garza |
A
| |
3Preparazione per l’iniezione
3aIspezionare il medicinale.
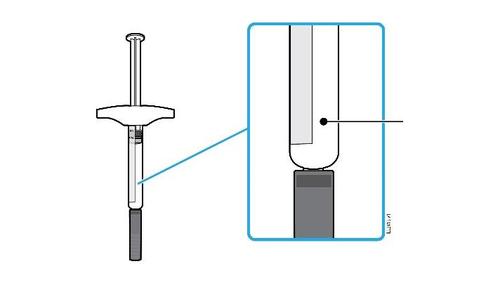
Medicinale
- Deve essere limpido, da incolore a leggermente giallo.
- È corretto osservare la presenza di bolle d’aria nella siringa preriempita.
- Nonusare se il medicinale è torbido, di colore alterato o contiene frammenti o particelle.
Importante: se il medicinale è torbido, di colore alterato o contiene frammenti o particelle,
rivolgersi al medico o all’operatore sanitario.
| 3b | a Controllare la data di scadenza (EXP) e ispezionare la siringa preriempita per accertarsi dell’assenza di danni. |
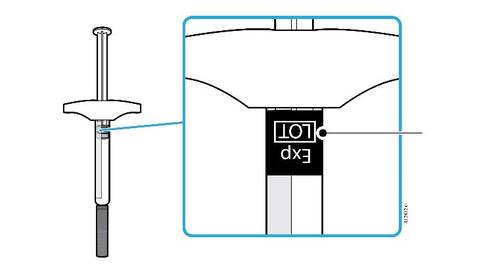
Data di scadenza
- Nonutilizzare se la data di scadenza è stata superata.
- Nonutilizzare la siringa preriempita se:
- Il cappuccio dell’ago è mancante o non è fissato saldamente.
- Una qualsiasi parte è incrinata o rotta.
- La siringa è caduta su una superficie dura. Importante:se la siringa preriempita è danneggiata o il medicinale è scaduto, rivolgersi al medico o all’operatore sanitario.
3cEseguire l’iniezione in una di queste sedi.
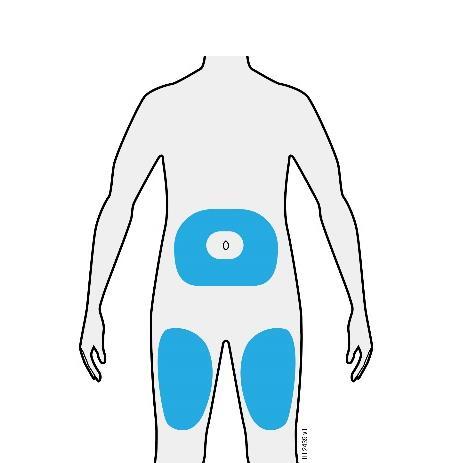
- Eseguire l’iniezione nella coscia o nell’addome (ad eccezione dell’area di 5 cm attorno all’ombelico).
- Scegliere una sede diversa per ogni iniezione.
- Lavare le mani accuratamente con acqua e sapone.
- Pulire la sede di iniezione con una salvietta imbevuta di alcol.
- Lasciare asciugare la pelle.
- Nontoccare più l’area disinfettata prima dell’iniezione.
Importante:evitare aree con cicatrici, smagliature o aree in cui la pelle presenti dolorabilità,
lividi, arrossamento o indurimento.
4Esecuzione dell’iniezione di AMGEVITA
Importante:rimuovere il cappuccio dell’ago solo quando è possibile eseguire immediatamente
l’iniezione (entro 5 minuti), poiché il medicinale può essiccarsi.
4aTenendo fermo il corpo della siringa preriempita, estrarre in modo deciso il cappuccio
dell’ago.
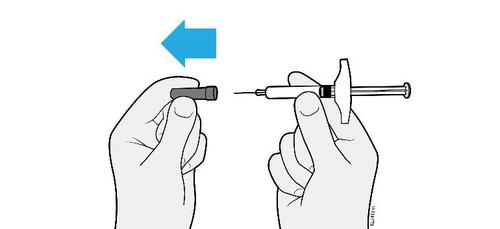
- Nonruotare o piegare il cappuccio dell’ago.
- Nonrimettere mai il cappuccio dell’ago sulla siringa. Potrebbe danneggiare l’ago.
- Nonlasciare che l’ago entri in contatto con qualsiasi materiale una volta rimosso il cappuccio dell’ago.
- Nonappoggiare la siringa preriempita su qualsiasi superficie una volta rimosso il cappuccio dell’ago.
- Noncercare di spingere le bolle d’aria fuori dalla siringa preriempita. È corretto osservare la presenza di bolle d’aria.
- È normare notare la presenza di una goccia di medicinale.
| 4b | Afferrare la pelle attorno alla sede di iniezione prima di eseguire l’iniezione. |
AFFERRARE LA PELLE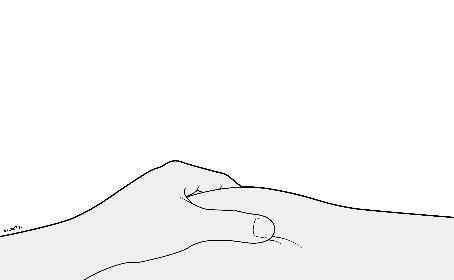 | |
| a c o | |
m
| |
| 4c | Inserire l’ago nella plica cutanea. |
a INSERIRE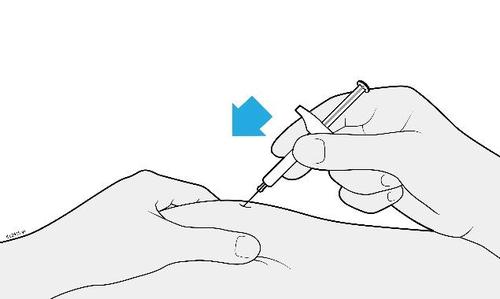 | |
| d e l F | |
a
| |
4dPremere lentamente lo stantuffo fino in fondo per iniettare il medicinale.
INIETTARE
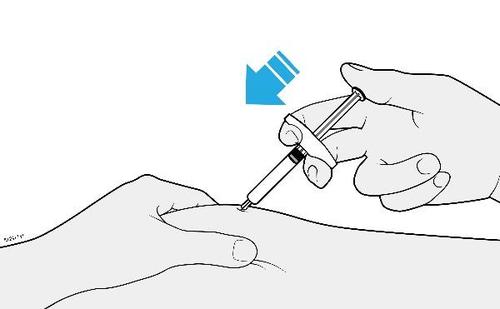
- Nonretrarre mai lo stantuffo.
- Nonrimuovere l’ago fino a quando tutto il medicinale non sia stato rilasciato. Importante:continuare a tenere la plica cutanea fino al completamento dell’iniezione.
5Procedure finali e smaltimento di AMGEVITA
Importante:non rimettere mai il cappuccio dell’ago sulla siringa.
5aGettare la siringa preriempita usata e il cappuccio dell’ago nel contenitore per lo
smaltimento di oggetti taglienti.
Nonriciclare la siringa preriempita né gettarla nei rifiuti domestici.
- Nonriutilizzare la siringa preriempita.
- Nonutilizzare eventuali residui di medicinale presenti nella siringa preriempita.
- Riporre la siringa di AMGEVITA usata in un contenitore per lo smaltimento di oggetti taglienti subito dopo l’uso. Nongettare (smaltire) la siringa nei rifiuti domestici.
- Discutere con il medico o il farmacista dei metodi adeguati di smaltimento. Potrebbero esistere linee guida locali apposite.
- Nonriciclare la siringa o il contenitore per lo smaltimento di oggetti taglienti, né gettarli nei rifiuti domestici. Importante: tenere sempre il contenitore per lo smaltimento di oggetti taglienti fuori dalla vista e dalla portata dei bambini.
| 5b | a Esaminare la sede di iniezione. |
i
| |
AMGEVITA 40 mg soluzione iniettabile in penna preriempita
adalimumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Il medico le consegnerà una Scheda Promemoria per il Paziente, che contiene importanti informazioni sulla sicurezza, che ha bisogno di sapere prima della somministrazione di AMGEVITA e durante il trattamento con AMGEVITA. Conservi questa Scheda Promemoriaper il Paziente.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è AMGEVITA e a cosa serve
- 2. Cosa deve sapere prima di usare AMGEVITA
- 3. Come usare AMGEVITA
- 4. Possibili effetti indesiderati
- 5. Come conservare AMGEVITA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è AMGEVITA e a cosa serve
AMGEVITA contiene il principio attivo adalimumab, un medicinale che agisce sul sistema immunitario
(di difesa) dell’organismo.
AMGEVITA è indicato per il trattamento delle malattie infiammatorie di seguito elencate:
- Artrite reumatoide
- Artrite idiopatica giovanile poliarticolare
- Artrite correlata a entesite
- Spondilite anchilosante
- Spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante
- Artrite psoriasica
- Psoriasi a placche
- Idrosadenite suppurativa
- Malattia di Crohn
- Colite ulcerosa
- Uveite non infettiva
Il principio attivo contenuto in AMGEVITA, adalimumab, è un anticorpo monoclonale umano. Gli
anticorpi monoclonali sono proteine che si legano ad un bersaglio specifico.
Il bersaglio di adalimumab è una proteina denominata fattore di necrosi tumorale (TNFα), che è
coinvolto nel sistema immunitario (di difesa) ed è presente a concentrazioni maggiori nelle malattie
infiammatorie elencate sopra. Attraverso il legame al TNFα, AMGEVITA diminuisce il processo
infiammatorio di queste malattie.
Artrite reumatoide
L’artrite reumatoide è una patologia infiammatoria delle articolazioni.
AMGEVITA è usato per trattare l’artrite reumatoide negli adulti. Se soffre di artrite reumatoide di
grado da moderato a grave, inizialmente possono essere assunti altri farmaci modificanti la malattia,
quali il metotressato. Se la risposta a tali farmaci non è soddisfacente, le verrà dato AMGEVITA per
trattare l’artrite reumatoide.
AMGEVITA può essere anche utilizzato per il trattamento dell’artrite reumatoide grave, attiva e
progressiva senza precedente trattamento con metotressato.
AMGEVITA rallenta la progressione del danno alle cartilagini ed alle ossa delle articolazioni causato
dalla malattia e migliora la funzionalità fisica.
Generalmente AMGEVITA è usato con il metotressato. Se il medico decide che il trattamento con
metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Artrite idiopatica giovanile poliarticolare e artrite correlata a entesite
L’artrite idiopatica giovanile poliarticolare e l’artrite correlata a entesite sono malattie infiammatorie
delle articolazioni che di solito si manifestano per la prima volta durante l’infanzia.
AMGEVITA è usato per trattare l’artrite idiopatica giovanile poliarticolare in pazienti dai 2 anni di età e
l’artrite correlata a entesite in pazienti dai 6 anni di età. Alla diagnosi possono essere somministrati altri
farmaci modificanti la malattia, come il metotressato. Se la risposta a questi farmaci non dovesse essere
adeguata, le sarà somministrato AMGEVITA per il trattamento dell’artrite idiopatica giovanile
poliarticolare o dell’artrite correlata a entesite.
Spondilite anchilosante e spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante
La spondilite anchilosante e la spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante sono infiammazioni della colonna vertebrale.
AMGEVITA è usato per trattare la spondilite anchilosante e la spondiloartrite assiale senza evidenza
radiografica della spondilite anchilosante negli adulti. Se è affetto da spondilite anchilosante o da
spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante, assumerà prima altri
farmaci. Nel caso in cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà
AMGEVITA per ridurre i segni ed i sintomi della malattia.
Artrite psoriasica
L’artrite psoriasica è un’infiammazione delle articolazioni associata alla psoriasi.
AMGEVITA è usato per trattare l’artrite psoriasica negli adulti. AMGEVITA rallenta il danno alla
cartilagine ed alle ossa delle articolazioni causato dalla malattia e migliora la funzionalità fisica.
Psoriasi a placche in adulti e bambini
La psoriasi a placche è una condizione della pelle che causa chiazze rossastre, squamose e indurite di
pelle ricoperta da squame argentee. La psoriasi a placche può anche colpire le unghie, provocandone la
rottura, l’ispessimento e il sollevamento dal letto dell’unghia, che può essere doloroso. Si ritiene che la
psoriasi sia causata da un problema del sistema immunitario del corpo che conduce ad un aumento della
produzione di cellule cutanee.
AMGEVITA è usato per trattare la psoriasi a placche di grado da moderato a severo negli adulti.
AMGEVITA è inoltre utilizzato per trattare la psoriasi a placche grave in bambini e adolescenti da 4 a
17 anni per i quali la terapia topica e le fototerapie non abbiano funzionato in modo ottimale o non
siano indicate.
Idrosadenite suppurativa in adulti e adolescenti
L’idrosadenite suppurativa (chiamata a volte acne inversa) è una malattia infiammatoria cronica della
cute e spesso è dolorosa. I sintomi possono includere noduli dolorosi e ascessi (foruncoli) che possono
drenare pus. Più frequentemente colpisce aree specifiche della cute, come la regione sottomammaria, le
ascelle, l’interno cosce, l’inguine e le natiche. Nelle aree colpite si possono anche formare delle
cicatrici.
AMGEVITA è utilizzato per trattare l’idrosadenite suppurativa negli adulti e negli adolescenti dai
12 anni di età. AMGEVITA può ridurre il numero di noduli e di ascessi che lei ha e il dolore che spesso
è associato a questa malattia. Inizialmente, potrebbe ricevere altri medicinali. Se non risponde
sufficientemente bene a questi medicinali, riceverà AMGEVITA.
Malattia di Crohn negli adulti e nei bambini
La malattia di Crohn è un’infiammazione del tratto digerente.
AMGEVITA è usato per trattare la malattia di Crohn negli adulti e nei bambini di età dai 6 ai 17 anni.
Se soffre della malattia di Crohn, le verranno prima somministrati altri farmaci. Nel caso in cui lei non
risponda in maniera sufficientemente adeguata a questi farmaci, le verrà somministrato AMGEVITA
per ridurre segni e sintomi della malattia di Crohn.
Colite ulcerosa negli adulti e nei bambini
La colite ulcerosa è un’infiammazione dell’intestino crasso.
AMGEVITA è usato per trattare la colite ulcerosa da moderata a grave negli adulti e nei bambini di età
dai 6 ai 17 anni. Se è affetto da colite ulcerosa inizialmente potrebbe assumere altri farmaci. Nel caso in
cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà AMGEVITA per
ridurre i segni e i sintomi della malattia.
Uveite non infettiva negli adulti e nei bambini
L’uveite non infettiva è una malattia infiammatoria che colpisce alcune parti dell’occhio.
AMGEVITA è impiegato per il trattamento di
- Adulti affetti da uveite non infettiva con infiammazione che interessa il fondo dell’occhio.
- Bambini dai 2 anni di età con uveite non infettiva cronica con infiammazione che interessa la parte anteriore dell’occhio.
Questa infiammazione può portare a una diminuzione della visione e/o alla presenza di corpi mobili
nell’occhio (punti neri o linee sottili che si muovono attraverso il campo visivo). AMGEVITA agisce
riducendo questa infiammazione.
2. Cosa deve sapere prima di usare AMGEVITA
Non usi AMGEVITA:
- se è allergico ad adalimumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- in presenza di un’infezione grave, inclusa tubercolosi attiva, sepsi (infezione del sangue) o altre infezioni opportunistiche (infezioni insolite associate a un sistema immunitario indebolito) (vedere “Avvertenze e precauzioni”). È importante comunicare al medico se ha segni o sintomi di infezione, come per es. febbre, ferite, sensazione di stanchezza, problemi dentali.
- in presenza di insufficienza cardiaca moderata o grave. È importante riferire al medico se c’è stata o è presente una condizione cardiaca grave (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare AMGEVITA:
Reazioni allergiche
- In caso di reazioni allergiche con sintomi quali senso di costrizione toracica, respiro sibilante, capogiro, gonfiore o eruzione cutanea, non si somministri più AMGEVITA e contatti il medico immediatamente considerato che, in rari casi, queste reazioni possono essere rischiose per la vita.
Infezioni
- In caso d’infezione, incluse infezioni a lungo termine o localizzate (per esempio, ulcere alle gambe) consulti il medico prima di iniziare il trattamento con AMGEVITA. Se ha dubbi, contatti il medico.
- È possibile contrarre più facilmente infezioni durante il trattamento con AMGEVITA. Questo rischio può aumentare se la sua funzione polmonare è compromessa. Queste infezioni possono essere gravi ed includere tubercolosi, infezioni causate da virus, funghi, parassiti o batteri, o altre infezioni opportunistiche e sepsi che possono, in rari casi, essere rischiose per la vita del paziente. È importante comunicare al medico la presenza di sintomi quali febbre, ferite, sensazione di stanchezza o problemi dentali. Il medico potrebbe raccomandare la sospensione temporanea di AMGEVITA.
Tubercolosi
- Poiché si sono verificati dei casi di tubercolosi in pazienti sottoposti a trattamento con adalimumab, prima di iniziare la terapia con AMGEVITA il medico dovrà controllare se lei presenta segni o sintomi di tubercolosi. Questo comporterà la raccolta di una valutazione medica dettagliata che includa la sua storia medica e appropriati esami clinici (per es. una radiografia del torace e il test della tubercolina). L’esecuzione e i risultati di tali esami devono essere registrati nella Scheda Promemoria per il Paziente. È molto importante comunicare al medico se ha mai avuto la tubercolosi, o se ha avuto contatti ravvicinati con malati di tubercolosi.
- La tubercolosi si può manifestare durante la terapia nonostante lei abbia ricevuto un trattamento preventivo per la tubercolosi.
- Contatti immediatamente il medico se durante o dopo la terapia compaiono sintomi di tubercolosi (tosse persistente, perdita di peso, svogliatezza, febbre moderata) o di altre infezioni.
Viaggio/infezione ricorrente
- Avvisi il medico se risiede o viaggia in regioni dove le infezioni fungine, come l’istoplasmosi, la coccidioidomicosi o la blastomicosi, sono endemiche.
- Avvisi il medico se ha avuto infezioni recidivanti o se presenta condizioni che aumentano il rischio di infezione.
Virus dell’epatite B
- Informi il medico se lei è portatore del virus dell’epatite B (HBV), se ha un’infezione in fase attiva da virus dell’epatite B o se pensa di poter essere a rischio di contrarre il virus dell’epatite B. Il medico la deve testare per l’infezione da virus dell’epatite B. L’assunzione di AMGEVITA può causare la riattivazione del virus dell’epatite B nei soggetti che risultano portatori di questo virus. In alcuni rari casi, soprattutto se il paziente è sottoposto a terapia con altri farmaci che sopprimono il sistema immunitario, la riattivazione del virus dell’epatite B può mettere a rischio la vita del paziente.
Età superiore a 65 anni
- Se ha più di 65 anni può essere più suscettibile ad infezioni durante l’assunzione di AMGEVITA. Lei e il medico dovete prestare particolare attenzione a segni di infezione mentre è in trattamento con AMGEVITA. È importante informare il medico se compaiono i sintomi di infezioni quali febbre, ferite, sensazione di stanchezza o problemi dentali.
Intervento chirurgico o procedure dentistiche
- Prima di un intervento chirurgico o procedure dentistiche, informi il medico che sta prendendo AMGEVITA. Il medico potrebbe consigliare la sospensione temporanea di AMGEVITA.
Malattia demielinizzante
- Se è affetto o sviluppa malattia demielinizzante come la sclerosi multipla, il medico deciderà se è il caso di iniziare o continuare a ricevere il trattamento con AMGEVITA. Informi il medico immediatamente nel caso in cui lei manifesti sintomi quali variazioni nella visione, debolezza di braccia o gambe o intorpidimento o formicolio che interessi qualsiasi parte del corpo.
Vaccinazioni
- Certi vaccini contengono forme vive ma indebolite di batteri o virus che causano malattie che possono causare infezioni e non devono essere somministrati durante il trattamento con AMGEVITA. Consulti il medico prima di sottoporsi a vaccinazioni. Nei bambini, prima di iniziare la terapia a base di AMGEVITA, si raccomanda, se possibile, di attuare il programma di vaccinazioni previsto, in ottemperanza alle linee guida in vigore sulle vaccinazioni.
- Se ha assunto AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre tale infezione fino a circa 5 mesi dopo l’ultima somministrazione che lei ha assunto durante la gravidanza. È importante che lei riferisca al pediatra o ad altro operatore sanitario del suo utilizzo di AMGEVITA durante la gravidanza, cosicché possano decidere quando il bambino deve ricevere qualsiasi tipo di vaccinazione.
Insufficienza cardiaca
- In caso di lieve insufficienza cardiaca e di concomitante trattamento con AMGEVITA, il medico dovrà attentamente valutare e seguire lo stato del suo cuore. È importante informare il medico se ha o ha avuto problemi di cuore. Se si manifestano nuovi sintomi di insufficienza cardiaca o se i sintomi già esistenti dovessero peggiorare (per esempio, fiato corto o gonfiore dei piedi), contatti immediatamente il medico. Il medico deciderà se può assumere AMGEVITA.
Febbre, lividi, sanguinamento o aspetto pallido
- In alcuni pazienti l’organismo può non essere in grado di produrre un quantitativo di cellule del sangue sufficiente, tale da aiutarlo a combattere le infezioni o ad arrestare un sanguinamento. Nel caso in cui lei abbia febbre persistente, lividi o facili sanguinamenti o aspetto pallido, si rivolga immediatamente al medico. Quest’ultimo potrebbe decidere di interrompere la terapia.
Cancro
- Nei pazienti, sia bambini sia adulti, sottoposti a trattamento con adalimumab o con altri farmaci anti-TNF, molto raramente si sono manifestati alcuni tipi di cancro. I pazienti affetti da artrite reumatoide di grave entità da molto tempo possono presentare un rischio superiore alla media di sviluppare linfoma (un cancroche colpisce il sistema linfatico) e leucemia (un cancro che colpisce il sangue e il midollo osseo).
- Se lei assume AMGEVITA, il rischio di contrarre linfomi, leucemia o altri cancri può aumentare. In rare circostanze, nei pazienti sottoposti a terapia con adalimumab, è stato osservato un tipo specifico e grave di linfoma. Alcuni di questi pazienti erano anche in terapia con azatioprina o 6-mercaptopurina. Avvisi il medico se sta assumendo azatioprina o 6-mercaptopurina con AMGEVITA.
- Inoltre, nei pazienti che assumono adalimumab, sono stati osservati casi di cancro della cute non melanotico. Se nel corso della terapia, o successivamente ad essa, dovessero comparire nuove lesioni cutanee o se l’aspetto delle lesioni già esistenti si dovesse modificare, lo riferisca al medico.
- Ci sono stati casi di cancri, oltre al linfoma, in pazienti con uno specifico tipo di malattia del polmone chiamata Malattia Polmonare Ostruttiva Cronica (COPD) trattati con un altro anti-TNF. Se soffre di COPD, o fuma molto, deve discutere con il medico se è appropriato il trattamento con un anti-TNF.
Malattie autoimmuni
- Raramente, il trattamento con AMGEVITA può portare alla manifestazione di una sindrome simil- lupoide. Informi il medico qualora si manifestino sintomi come eruzione cutanea persistente di natura inspiegabile, febbre, dolore alle articolazioni o stanchezza.
Al fine di migliorare la tracciabilità di questo medicinale, il medico o il farmacista deve registrare il
nome dello stesso ed il numero di lotto del prodotto che le è stato somministrato sulla sua scheda
paziente. Lei può prendere nota di questi dettagli in caso le venissero chiesti in futuro.
Bambini e adolescenti
- Vaccinazioni: se possibile, i bambini dovrebbero aver già fatto tutte le vaccinazioni prima di usare AMGEVITA.
- Non dare AMGEVITA a bambini con artrite idiopatica giovanile poliarticolare di età inferiore ai 2 anni.
- Non dare AMGEVITA a bambini con psoriasi a placche di età inferiore ai 4 anni.
- Non dare AMGEVITA a bambini con malattia di Crohn o colite ulcerosa di età inferiore ai 6 anni.
Altri medicinali e AMGEVITA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
AMGEVITA può essere assunto sia con il metotressato che con altri farmaci antireumatici modificanti
la malattia (sulfasalazina, idrossiclorochina, leflunomide e sali d’oro per via parenterale), steroidi o
analgesici, compresi i farmaci anti-infiammatori non steroidei (FANS).
AMGEVITA non deve essere preso in concomitanza con farmaci contenenti come principio attivo
anakinra o abatacept a causa del rischio aumentato di contrarre infezioni gravi. Se ha dubbi, si rivolga al
medico.
Gravidanza e allattamento
- Deve considerare l’utilizzo di un’adeguata misura contraccettiva per prevenire una gravidanza e continuarne l’utilizzo per almeno 5 mesi dopo l’ultima terapia con AMGEVITA.
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, chieda consiglio al suo medico circa l’assunzione di questo medicinale.
- AMGEVITA deve essere usato durante la gravidanza solo se necessario.
- Secondo uno studio sulla gravidanza, non è stato riscontrato un rischio maggiore di difetti alla nascita quando la madre aveva ricevuto AMGEVITA durante la gravidanza, rispetto a madri che avevano la stessa patologia, ma che non avevano ricevuto AMGEVITA.
- AMGEVITA può essere usato durante l’allattamento con latte materno.
- Se assume AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre un’infezione.
- É importante che lei riferisca al pediatra o ad altro operatore sanitario dell’utilizzo di AMGEVITA durante la gravidanza, prima che il bambino riceva qualsiasi tipo di vaccinazione. Per maggiori informazioni sulle vaccinazioni consulti la sezione “Avvertenze e precauzioni”.
Guida di veicoli e utilizzo di macchinari
AMGEVITA può influenzare, benché solo in maniera modesta, la sua capacità di guidare, andare in
bicicletta o utilizzare macchinari. In seguito all’assunzione di AMGEVITA, si possono avere disturbi
della visione e la sensazione che l’ambiente in cui ci si trova ruoti (vertigini).
AMGEVITA contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per la dose da 0,8 mL, cioè, é
essenzialmente “senza sodio”.
3. Come usare AMGEVITA
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Adulti con artrite reumatoide, artrite psoriasica, spondilite anchilosante o spondiloartrite assiale senza
evidenza radiografica di spondilite anchilosante
AMGEVITA è iniettato sotto la cute (uso sottocutaneo). In pazienti adulti con artrite reumatoide,
spondilite anchilosante, spondiloartrite assiale senza evidenza radiografica di spondilite anchilosante e
artrite psoriasica, il normale dosaggio è di 40 mg a settimane alterne, somministrato in un’unica dose.
Nell’artrite reumatoide, il metotressato viene continuato durante il trattamento con AMGEVITA. Se il
medico decide che il metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Se è affetto da artrite reumatoide e non riceve metotressato in associazione al trattamento con
AMGEVITA, il medico può decidere di prescriverle 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite idiopatica giovanile poliarticolare
Bambini, adolescenti e adulti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Bambini, adolescenti e adulti con artrite correlata a entesite
Bambini, adolescenti e adulti a partire da 6 anni di età e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è 40 mg a settimane alterne.
Adulti con psoriasi a placche
La dose abituale per gli adulti affetti da psoriasi a placche è rappresentata da una dose iniziale pari a
80 mg (tramite due iniezioni da 40 mg in un giorno), seguita da una dose pari a 40 mg, somministrata a
settimane alterne, ad iniziare dalla settimana successiva all’assunzione della dose iniziale. Lei deve
continuare il trattamento con AMGEVITA per il tempo indicato dal medico. In base alla risposta
clinica, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti affetti da psoriasi a placche
Bambini e adolescenti di età compresa tra 4 e 17 anni e con peso uguale o superiore a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 40 mg, seguita da una dose di 40 mg la
settimana seguente. Successivamente, la dose abituale è di 40 mg a settimane alterne.
Adulti con idrosadenite suppurativa
La dose abituale per l’idrosadenite suppurativa è una dose iniziale di 160 mg (quattro iniezioni da
40 mg in un giorno o due iniezioni da 40 mg al giorno per due giorni consecutivi), seguita da una dose
di 80 mg (due iniezioni da 40 mg in un giorno) due settimane dopo. Dopo altre due settimane,
continuare con una dose di 40 mg a settimana o 80 mg a settimane alterne, come prescritto dal medico.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adolescenti con idrosadenite suppurativa di età compresa tra 12 e 17 anni, con peso uguale o superiore
a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 80 mg (tramite due iniezioni da 40 mg in
un giorno), seguita da 40 mg somministrati a settimane alterne a partire da una settimana dopo la dose
iniziale. In caso di risposta inadeguata a 40 mg di AMGEVITA a settimane alterne, il medico può
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adulti con malattia di Crohn
In caso di malattia di Crohn, la dose abituale è inizialmente di 80 mg (tramite due iniezioni da 40 mg in
un giorno) seguiti da 40 mg a settimane alterne, due settimane più tardi. Se è necessario indurre una
risposta più rapida, il medico potrebbe prescrivere una dose iniziale di 160 mg (somministrata in quattro
iniezioni da 40 mg in un giorno o in due iniezioni da 40 mg al giorno per due giorni consecutivi) seguita
da 80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane più tardi, e successivamente
40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe aumentare la dose a
40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con malattia di Crohn
Bambini e adolescenti di età compresa tra 6 e 17 anni e con peso inferiore a 40 kg
All’inizio, il regime di dose abituale è di 40 mg, seguito da 20 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 80 mg (come due iniezioni da
40 mg in un giorno) seguita da 40 mg due settimane più tardi.
Successivamente, la dose abituale è di 20 mg a settimane alterne. A seconda della risposta del bambino,
il medico può aumentare la frequenza della dose a 20 mg ogni settimana.
La penna preriempita da 40 mg non può essere usata per dispensare la dose da 20 mg. Una siringa
preriempita da 20 mg di AMGEVITA è tuttavia disponibile per la dose da 20 mg.
Bambini ed adolescenti di età compresa tra 6 e 17 anni e con peso uguale o superiore a 40 kg
All’inizio, il regime di dose abituale è di 80 mg (tramite due iniezioni da 40 mg in un giorno), seguito
da 40 mg due settimane più tardi. Se è richiesta una risposta più rapida, il medico può prescrivere una
dose iniziale di 160 mg (come quattro iniezioni da 40 mg in un giorno o come due iniezioni da 40 mg al
giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due
settimane più tardi.
Successivamente, la dose abituale è di 40 mg a settimane alterne. A seconda della risposta del bambino,
il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con colite ulcerosa
Per gli adulti affetti da colite ulcerosa, la dose iniziale abituale di AMGEVITA è pari a 160 mg
(somministrata in quattro iniezioni da 40 mg in un giorno o in due iniezioni da 40 mg al giorno per due
giorni consecutivi) seguita da 80 mg (tramite due iniezioni da 40 mg in un giorno) due settimane più
tardi, 40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe aumentare la dose
a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con colite ulcerosa
Bambini e adolescenti a partire dai 6 anni di età e con peso inferiore a 40 kg
La dose abituale di AMGEVITA è di 80 mg (tramite due iniezioni da 40 mg in un giorno) seguita da
40 mg (tramite una sola iniezione da 40 mg) dopo due settimane. Successivamente, la dose abituale è di
40 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 40 mg a settimane alterne devono continuare la dose
prescritta.
Bambini e adolescenti a partire dai 6 anni di età e con peso uguale o superiore a 40 kg
La dose abituale di AMGEVITA è di 160 mg (tramite quattro iniezioni da 40 mg in un giorno o due
iniezioni da 40 mg al giorno per due giorni consecutivi) seguita da 80 mg (tramite due iniezioni da
40 mg in un giorno) dopo due settimane. Successivamente la dose abituale è di 80 mg a settimane
alterne.
I pazienti che compiono 18 anni mentre assumono 80 mg a settimane alterne devono continuare la dose
prescritta.
Adulti con uveite non infettiva
Per gli adulti affetti da uveite non infettiva, la dose abituale è una dose iniziale pari a 80 mg (tramite
due iniezioni da 40 mg in un giorno), seguita da 40 mg somministrati a settimane alterne a partire da
una settimana dopo la dose iniziale. Deve continuare ad iniettarsi AMGEVITA per tutto il tempo
indicato dal medico.
Nell’uveite non infettiva, i corticosteroidi o gli altri farmaci che influiscono sul sistema immunitario
potranno essere continuati durante il trattamento con AMGEVITA. AMGEVITA può anche essere
somministrato in monoterapia.
Bambini e adolescenti con uveite cronica non infettiva a partire da 2 anni di età
Bambini e adolescenti a partire da 2 anni e con peso inferiore a 30 kg
La dose abituale di AMGEVITA è di 20 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 40 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
La penna preriempita da 40 mg non può essere utilizzata per la dose da 20 mg. Una siringa preriempita
di AMGEVITA da 20 mg è tuttavia disponibile per la dose da 20 mg.
Bambini e adolescenti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose abituale di AMGEVITA è di 40 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 80 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Modo e via di somministrazione
AMGEVITA è somministrato per iniezione sotto la cute (iniezione sottocutanea).
Istruzioni dettagliate su come iniettare AMGEVITA sono fornite nel paragrafo “Istruzioni per l’uso”.
Se usa più AMGEVITA di quanto deve
Se accidentalmente inietta AMGEVITA più frequentemente di quanto disposto dal medico o dal
farmacista, contatti il medico o il farmacista informandolo di aver assunto più farmaco. Conservi
sempre la scatola di questo medicinale, anche se vuota.
Se dimentica di usare AMGEVITA
Se dimentica di fare un’iniezione, deve iniettarsi la dose successiva di AMGEVITA non appena se ne
ricorda. Dopodiché riprenda la dose regolarmente secondo lo schema posologico stabilito.
Se interrompe il trattamento con AMGEVITA
La decisione di interrompere l’uso di AMGEVITA deve essere discussa con il medico. I sintomi
possono ritornare dopo l’interruzione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino. La maggior parte degli effetti indesiderati si presenta in forma da lieve a moderata.
Tuttavia, alcuni possono essere gravi e richiedere un trattamento. Effetti indesiderati possono
manifestarsi fino a 4 mesi dall’ultima iniezione di AMGEVITA.
Informi immediatamente il medico se nota uno qualsiasi dei seguenti segni di reazione allergica o di
insufficienza cardiaca:
- eruzione cutanea grave, orticaria o altri segni di reazione allergica;
- gonfiore di viso, mani e piedi;
- difficoltà nella respirazione, difficoltà ad inghiottire;
- respiro affannoso sotto sforzo o in posizione sdraiata o gonfiore ai piedi.
Informi appena possibile il medico se nota una qualsiasi delle seguenti reazioni:
- segni di infezione come febbre, sensazione di star male, ferite, problemi dentali, bruciore nell’urinare;
- stanchezza o debolezza;
- tosse;
- formicolio;
- torpore;
- visione doppia;
- debolezza di braccia o gambe;
- segni di cancro della pelle come una protuberanza o piaga che non guarisce;
- segni e sintomi che suggeriscono la comparsa di disturbi a carico del sistema ematico (sangue), come la presenza di febbre persistente, lividi, sanguinamenti, pallore.
I sintomi sopra descritti possono essere segni dei seguenti effetti indesiderati, che sono stati osservati
con adalimumab.
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- reazioni in sede di iniezione (tra cui dolore, gonfiore, arrossamento o prurito);
- infezioni delle vie respiratorie (tra cui raffreddore, naso che cola, infezione sinusale e infezione polmonare);
- cefalea;
- dolore addominale;
- nausea e vomito;
- eruzione cutanea;
- dolore muscoloscheletrico.
Comuni (possono manifestarsi fino a 1 persona su 10)
- infezioni gravi (tra cui setticemia ed influenza);
- infezioni intestinali (tra cui gastroenterite);
- infezioni della pelle (tra cui cellulite e infezione da Herpes Zoster);
- infezioni dell’orecchio;
- infezioni orali (tra cui infezioni dentali ed herpes labiale);
- infezioni dell’apparato riproduttivo;
- infezione delle vie urinarie;
- infezione micotica;
- infezioni articolari;
- tumori benigni;
- cancro della pelle;
- reazioni allergiche (tra cui allergia stagionale);
- disidratazione;
- sbalzi di umore (tra cui depressione);
- ansia;
- difficoltà a dormire;
- disturbi della sensibilità come formicolii, sensazione di fitte o intorpidimento;
- emicrania;
- compressione di radice nervosa (tra cui dolore dorso-lombare e dolore alle gambe);
- disturbi della visione;
- infiammazione degli occhi;
- infiammazione delle palpebre e tumefazione degli occhi;
- vertigini (sensazione di capogiro o stanza che ruota);
- sensazione di battito cardiaco accelerato;
- pressione del sangue elevata;
- rossore;
- ematoma;
- tosse;
- asma;
- respiro affannoso;
- sanguinamento gastrointestinale;
- dispepsia (indigestione, stomaco gonfio, bruciore di stomaco);
- disturbo da reflusso acido;
- sindrome sicca (tra cui occhi secchi e bocca secca);
- prurito;
- eruzione cutanea pruriginosa;
- lividi;
- infiammazione della pelle (come eczema);
- rottura delle unghie delle dita della mano e del piede;
- sudorazione aumentata;
- perdita di capelli;
- insorgenza o peggioramento della psoriasi;
- spasmi muscolari;
- sangue nell’urina;
- problemi renali;
- dolore toracico;
- edema;
- febbre;
- riduzione delle piastrine nel sangue che aumenta il rischio di sanguinamenti o di lividi;
- difficoltà di cicatrizzazione.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- infezioni opportunistiche (che includono la tubercolosi ed altre infezioni che si manifestano quando si abbassano le difese immunitarie);
- infezioni neurologiche (tra cui la meningite virale);
- infezioni degli occhi;
- infezioni batteriche;
- diverticolite (infiammazione e infezione dell’intestino crasso);
- cancro, tra cui cancro che colpisce il sistema linfatico (linfoma) e melanoma (cancro della cute);
- disturbi del sistema immunitario che potrebbero colpire polmoni, cute e linfonodi (che si presentano più comunemente come sarcoidosi);
- vasculite (infiammazione dei vasi sanguigni);
- tremore;
- neuropatia;
- ictus;
- perdita dell’udito, ronzio;
- sensazione di battito cardiaco irregolare come battiti saltati;
- problemi al cuore che possono causare respiro affannoso o gonfiore alle caviglie;
- attacco cardiaco;
- formazione di una sacca nella parete di un’arteria principale, infiammazione e coagulo in una vena, ostruzione di un vaso sanguigno;
- malattie polmonari che provocano respiro affannoso (inclusa infiammazione);
- embolia polmonare (occlusione di una arteria del polmone);
- versamento della pleura (anomala raccolta di liquido nello spazio pleurico);
- infiammazione del pancreas che causa forti dolori all’addome ed alla schiena;
- difficoltà di deglutizione;
- edema facciale;
- infiammazione della cistifellea, calcoli della cistifellea;
- fegato grasso;
- sudorazioni notturne;
- cicatrice;
- anormale catabolismo muscolare;
- lupus eritematoso sistemico (tra cui infiammazione di cute, cuore, polmone, articolazioni e di altri organi);
- sonno interrotto;
- impotenza;
- infiammazioni.
Rari (possono manifestarsi fino a 1 persona su 1 000)
- leucemia (cancro del sangue del midollo osseo);
- reazione allergica grave con shock;
- sclerosi multipla;
- patologie neurologiche (come infiammazione del nervo ottico e sindrome di Guillain-Barré che può causare debolezza muscolare, sensazioni anomale, formicolio alle braccia ed alla parte superiore del corpo);
- arresto cardiaco;
- fibrosi polmonare (cicatrici del polmone);
- perforazione intestinale (foro nella parete dell’intestino);
- epatite (infiammazione del fegato);
- riattivazione dell’epatite B;
- epatite autoimmune (infiammazione del fegato causata dal proprio sistema immunitario);
- vasculite cutanea (infiammazione dei vasi sanguigni della pelle);
- sindrome di Stevens-Johnson (reazione rischiosa per la vita con sintomi simil-influenzali ed eruzione cutanea con vescicole);
- edema facciale associato a reazioni allergiche;
- eritema multiforme (eruzione cutanea infiammatoria);
- sindrome simil-lupoide;
- angioedema (gonfiore localizzato della pelle);
- reazione cutanea lichenoide (eruzione cutanea rosso-violacea pruriginosa).
Non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- linfoma epato-splenico a cellule T (un raro cancro del sangue che spesso risulta fatale);
- carcinoma a cellule di Merkel (un tipo di cancro della pelle);
- sarcoma di Kaposi, una rara forma di cancro correlato a infezione da Herpes virus umano 8. Il sarcoma di Kaposi si manifesta più comunemente con lesioni viola sulla pelle;
- insufficienza epatica;
- peggioramento di una condizione chiamata dermatomiosite (che si manifesta come eruzione cutanea accompagnata da debolezza muscolare);
- aumento di peso (per la maggior parte dei pazienti, l’aumento di peso è stato basso).
Alcuni degli effetti indesiderati osservati con adalimumab possono essere asintomatici e possono essere
individuati solo attraverso gli esami del sangue. Questi includono:
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- conta dei globuli bianchi bassa;
- conta dei globuli rossi bassa;
- ipidi nel sangue aumentati;
- enzimi epatici aumentati.
Comuni (possono manifestarsi fino a 1 persona su 10)
- conta dei globuli bianchi aumentata;
- conta delle piastrine ridotta;
- acido urico nel sangue aumentato;
- sodio nel sangue anormale;
- calcio nel sangue diminuito;
- fosfato nel sangue diminuito;
- zuccheri nel sangue aumentati;
- latticodeidrogenasi nel sangue aumentata;
- autoanticorpi presenti nel sangue;
- potassio nel sangue diminuito.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- bilirubina nel sangue elevata (esame epatico del sangue).
Rari (possono manifestarsi fino a 1 persona su 1 000)
- conta di globuli bianchi, globuli rossi e piastrine bassa.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a
fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare AMGEVITA
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C – 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Una singola penna di AMGEVITA può essere conservata a temperature fino ad un massimo di 25°C per
un periodo massimo di 14 giorni. La penna preriempita deve essere protetta dalla luce e deve essere
gettata via se non usata entro il periodo di 14 giorni.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene AMGEVITA
- Il principio attivo è adalimumab. Ogni penna preriempita contiene 40 mg di adalimumab in 0,4 mL di soluzione.
- Gli altri eccipienti sono acido L-lattico, saccarosio, polisorbato 80, sodio idrossido e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di AMGEVITA e contenuto della confezione
AMGEVITA è una soluzione limpida e da incolore a leggermente gialla.
Ogni confezione contiene 1, 2 o 6 penne preriempite monouso SureClick da 40 mg.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Titolare dell’autorizzazione all’immissione in commercio
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Produttore
Amgen Technology Ireland UC
Pottery Road
Dun Laoghaire
Co Dublin
Irlanda
Produttore
Amgen NV
Telecomlaan 5-7
1831 Diegem
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
s.a. Amgen n.v.
Tél/Tel: +32 (0)2 7752711
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
България
Амджен България ЕООД
Тел.: +359 (0)2 424 7440
Luxembourg/Luxemburg
s.a. Amgen
Belgique/Belgien
Tél/Tel: +32 (0)2 7752711
Česká republika
Amgen s.r.o.
Tel: +420 221 773 500
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
Danmark
Amgen, filial af Amgen AB, Sverige
Tlf: +45 39617500
Malta
Amgen S.r.l.
Italy
Tel: +39 02 6241121
Deutschland
Amgen GmbH
Tel: +49 89 1490960
Nederland
Amgen B.V.
Tel: +31 (0)76 5732500
Eesti
Amgen Switzerland AG Vilniaus filialas
Tel: +372 586 09553
Norge
Amgen AB
Tlf: +47 23308000
Ελλάδα
Amgen Ελλάς Φαρμακευτικά Ε.Π.Ε.
Τηλ: +30 210 3447000
Österreich
Amgen GmbH
Tel: +43 (0)1 50 217
España
Amgen S.A.
Tel: +34 93 600 18 60
Polska
Amgen Biotechnologia Sp. z o.o.
Tel.: +48 22 581 3000
France
Amgen S.A.S.
Tél: +33 (0)9 69 363 363
Portugal
Amgen Biofarmacêutica, Lda.
Tel: +351 21 4220606
Hrvatska
Amgen d.o.o.
Tel: +385 (0)1 562 57 20
România
Amgen România SRL
Tel: +4021 527 3000
Ireland
Amgen Ireland Limited
Tel: +353 1 8527400
Slovenija
AMGEN zdravila d.o.o.
Tel: +386 (0)1 585 1767
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Amgen Slovakia s.r.o.
Tel: +421 2 321 114 49
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial
i Finland
Puh/Tel: +358 (0)9 54900500
Kύπρος
C.A. Papaellinas Ltd
Τηλ: +357 22741 741
Sverige
Amgen AB
Tel: +46 (0)8 6951100
Latvija
Amgen Switzerland AG Rīgas filiāle
Tel: +371 257 25888
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, http://www.ema.europa.eu .
-----------------------------------------------------------------------------------------------------------------------------
ISTRUZIONI PER L’USO 40 mg/0,4 mL
Guida alle parti della penna preriempita SureClick
Pulsante azzurro di
avvio
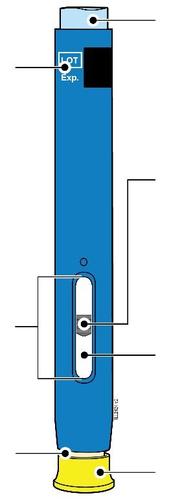
Data di scadenza
Estremità stantuffo
(può essere visibile
nella finestra; la
posizione può
variare)
Finestra
Medicinale
Dispositivo di
sicurezza color
crema Tappo giallo
(ago all’interno)
40 mg/0,4 mL
1Informazioni importanti da conoscere prima di eseguire l’iniezione di AMGEVITA
Utilizzo della penna SureClick preriempita di AMGEVITA:
- È importante non procedere autonomamente all’iniezione prima di avere letto e compreso interamente le presenti istruzioni per l’uso e senza aver ricevuto un’apposita formazione da parte del medico o dell’operatore sanitario.
- Nonutilizzare la penna preriempita se la confezione risulta danneggiata o il sigillo di chiusura non è integro.
- Nonutilizzare la penna preriempita dopo la data di scadenza indicata sull’etichetta.
- Nonagitare mai la penna preriempita.
- Nonrimuovere il tappo giallo dalla penna preriempita finché non si è pronti per l’iniezione.
- Nonutilizzare la penna preriempita se è stata congelata.
- Nonutilizzare la penna preriempita se è caduta su una superficie dura. Alcune parti della penna preriempita potrebbero essersi rotte, anche se il danno potrebbe non essere visibile. Utilizzare una nuova penna preriempita e rivolgersi al medico o all’operatore sanitario.
Importante:tenere la penna preriempita e il contenitore per lo smaltimento di oggetti taglienti
fuori dalla vista e dalla portata dei bambini.
| 2 | Preparazione per l’iniezione di AMGEVITA |
| 2a | Attendere 30 minuti affinché la penna preriempita raggiunga la temperatura ambiente. |
| o c ATTENDERE a 30 m minuti | |
r
| |
2b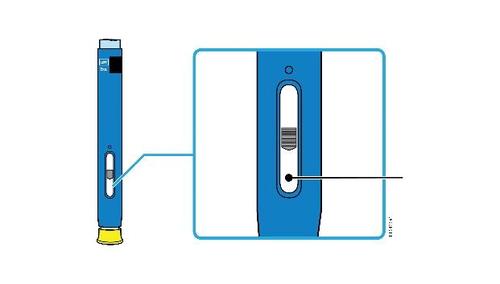 | d Ispezionare il medicinale. Deve essere limpido, da incolore a leggermente giallo. |
a n a Medicinale i l a
| |
2cControllare la data di scadenza (EXP) e ispezionare la penna preriempita per
accertarsi dell’assenza di danni.
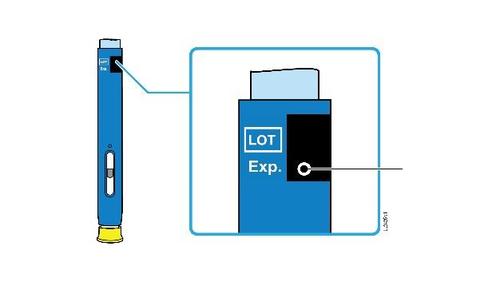
Data di scadenza
- Nonutilizzare se la data di scadenza è stata superata.
- Nonutilizzare la penna preriempita se: o Il tappo giallo è mancante o non è fissato saldamente. o Una qualsiasi parte è incrinata o rotta o La penna è caduta su una superficie dura.
- Accertarsi di avere il medicinale e il dosaggio corretti.
Importante: se il medicinale è torbido, di colore alterato o contiene frammenti, rivolgersi al
medico o all’operatore sanitario.
| 3 | a Preparazione per l’iniezione |
3a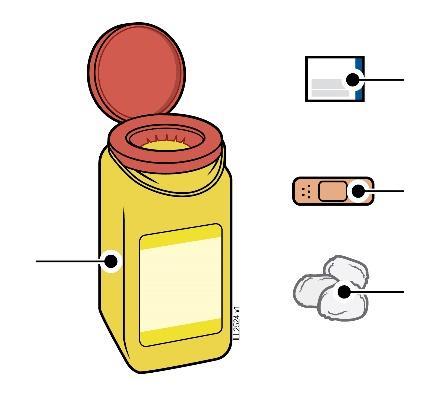 | Raccogliere e porre il materiale per l’iniezione su una superficie pulita e ben illuminata. |
| n a Salvietta imbevuta di alcol i l Cerotto a Contenitore per lo smaltimento di t Batuffolo di cotone o tampone di garza oggetti taglienti I | |
a
| |
3bEseguire l’iniezione in una di queste sedi.
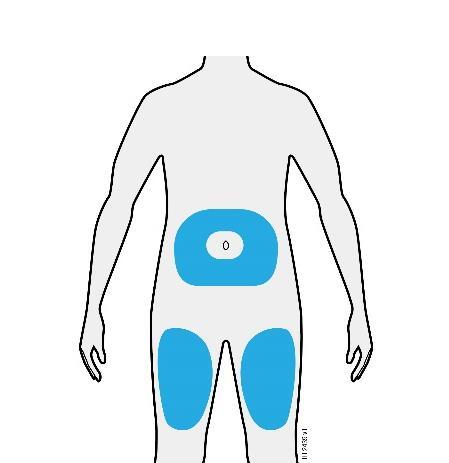
- Eseguire l’iniezione nella coscia o nell’addome (ad eccezione dell’area di 5 cm attorno all’ombelico).
- Scegliere una sede diversa per ogni iniezione.
- Lavare le mani accuratamente con acqua e sapone.
- Pulire la sede di iniezione con una salvietta imbevuta di alcol.
- Lasciare asciugare la pelle.
- Nontoccare più l’area disinfettata prima dell’iniezione. Importante:evitare aree con cicatrici, smagliature o aree in cui la pelle presenti dolorabilità, lividi, arrossamento o indurimento.
4Esecuzione dell’iniezione di AMGEVITA
Importante:rimuovere il tappo giallo solo quando è possibile eseguire immediatamente
l’iniezione (entro 5 minuti), poiché il medicinale può essiccarsi.
4aTenere la penna preriempita in modo che la finestra sia visibile. Estrarre in modo deciso
il tappo giallo.
Potrebbe essere necessario esercitare una certa forza.
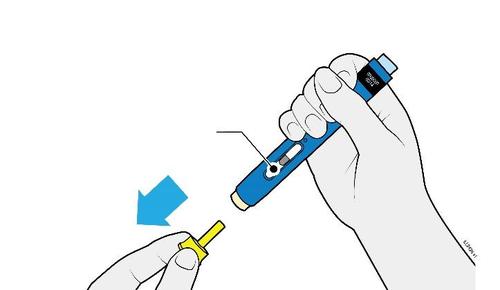
La finestra deve essere
visibile
- Nonruotare, piegare o muovere avanti e indietro il tappo giallo durante la sua estrazione.
- Nonrimettere mai il cappuccio dell’ago sulla penna. Potrebbe danneggiare l’ago.
- Noninserire le dita nel dispositivo di sicurezza color crema.
- È normale osservare la presenza di una goccia di medicinale all’estremità dell’ago o del dispositivo di sicurezza color crema.
| 4b | Afferrare la pelle in modo da creare una plica cutanea con superficie tesa a livello della sede di iniezione. Applicare il dispositivo di sicurezza color crema direttamente contro la pelle. |
| o AFFERRARE LA PELLE | |
F a r m a c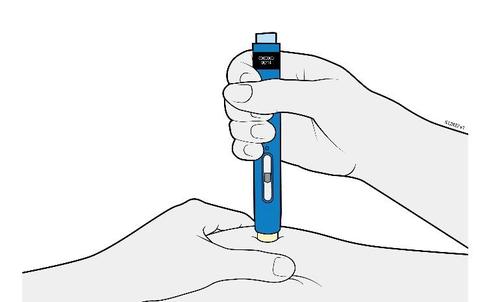 | |
| |
l e
| |
| PREMERE o e tenere contro la pelle c a m r a | |
4c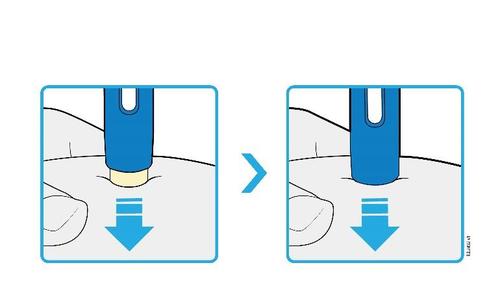 | F Premere con decisione fino a quando il dispositivo di sicurezza color crema cessa di muoversi. Tenere premuto; non sollevare. |
| Il dispositivo di sicurezza color crema spinge e sblocca il pulsante azzurro di avvio. | |
| e PREMERE d il pulsante azzurro di avvio a n a i l a t I | |
4d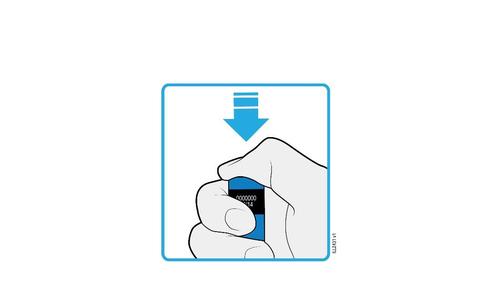 | a Continuando a premere saldamente verso il basso, premere il pulsante azzurro di avvio per iniziare l’iniezione. |
i z
| |
OSSERVARE PER VERIFICARE
che la finestra diventi completamente gialla
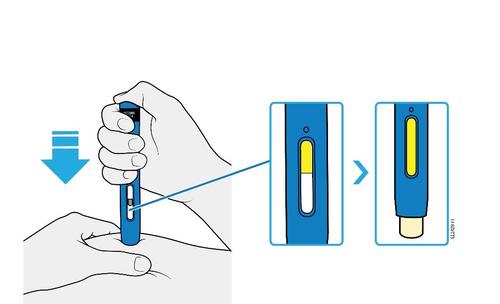
4eContinuare a premere verso il basso. Quando la finestra è completamente gialla,
l’iniezione è completa.
- Il completamento dell’iniezione può richiedere fino a 10secondi.
- Si potrebbe udire o avvertire uno scatto.
- Sollevare la penna preriempita e allontanarla dalla pelle.
- Il dispositivo di sicurezza color crema si blocca attorno all’ago. Importante:se la finestra non è diventata gialla o se si ha l’impressione che l’erogazione del medicinale sia ancora in corso, ciò indica che non si è ricevuta una dose completa. Rivolgersi immediatamente al medico o all’operatore sanitario.
5Procedure finali e smaltimento di AMGEVITA
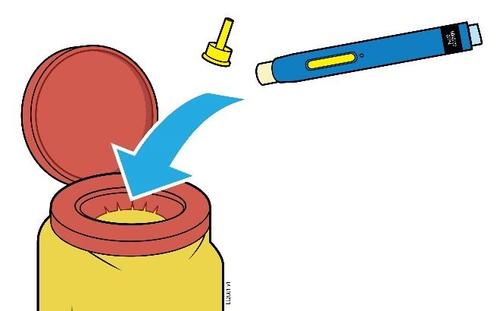
Importante:non gettare la penna preriempita nei rifiuti domestici.
5aRiporre la penna preriempita usata e il tappo giallo nel contenitore per lo smaltimento di
oggetti taglienti
- Nonriutilizzare la penna preriempita
- Nontoccare il dispositivo di sicurezza color crema 5bEsaminare la sede di iniezione.
- Nonsfregare la sede di iniezione.
- Se si nota la presenza di sangue, tenere premuto un batuffolo di cotone o un tampone di garza sulla sede di iniezione. Se necessario, applicare un cerotto.
AMGEVITA 80 mg soluzione iniettabile in penna preriempita
adalimumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe avere bisogno di leggerlo di nuovo.
- Il medico le consegnerà una Scheda Promemoria per il Paziente, che contiene importanti informazioni sulla sicurezza, che ha bisogno di sapere prima della somministrazione di AMGEVITA e durante il trattamento con AMGEVITA. Conservi questa Scheda Promemoriaper il Paziente.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è AMGEVITA e a cosa serve
- 2. Cosa deve sapere prima di usare AMGEVITA
- 3. Come usare AMGEVITA
- 4. Possibili effetti indesiderati
- 5. Come conservare AMGEVITA
- 6. Contenuto della confezione e altre informazioni
1. Cos’è AMGEVITA e a cosa serve
AMGEVITA contiene il principio attivo adalimumab, un medicinale che agisce sul sistema immunitario
(di difesa) dell’organismo.
AMGEVITA è indicato per il trattamento delle malattie infiammatorie di seguito elencate:
- Artrite reumatoide
- Artrite idiopatica giovanile poliarticolare
- Artrite correlata a entesite
- Spondilite anchilosante
- Spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante
- Artrite psoriasica
- Psoriasi a placche
- Idrosadenite suppurativa
- Malattia di Crohn
- Colite ulcerosa
- Uveite non infettiva
Il principio attivo contenuto in AMGEVITA, adalimumab, è un anticorpo monoclonale umano. Gli
anticorpi monoclonali sono proteine che si legano ad un bersaglio specifico.
Il bersaglio di adalimumab è una proteina denominata fattore di necrosi tumorale (TNFα), che è
coinvolto nel sistema immunitario (di difesa) ed è presente a concentrazioni maggiori nelle malattie
infiammatorie elencate sopra. Attraverso il legame al TNFα, AMGEVITA diminuisce il processo
infiammatorio di queste malattie.
Artrite reumatoide
L’artrite reumatoide è una patologia infiammatoria delle articolazioni.
AMGEVITA è usato per trattare l’artrite reumatoide negli adulti. Se soffre di artrite reumatoide di
grado da moderato a grave, inizialmente possono essere assunti altri farmaci modificanti la malattia,
quali il metotressato. Se la risposta a tali farmaci non è soddisfacente, le verrà dato AMGEVITA per
trattare l’artrite reumatoide.
AMGEVITA può essere anche utilizzato per il trattamento dell’artrite reumatoide grave, attiva e
progressiva senza precedente trattamento con metotressato.
AMGEVITA rallenta la progressione del danno alle cartilagini ed alle ossa delle articolazioni causato
dalla malattia e migliora la funzionalità fisica.
Generalmente AMGEVITA è usato con il metotressato. Se il medico decide che il trattamento con
metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Artrite idiopatica giovanile poliarticolare e artrite correlata a entesite
L’artrite idiopatica giovanile poliarticolare e l’artrite correlata a entesite sono malattie infiammatorie
delle articolazioni che di solito si manifestano per la prima volta durante l’infanzia.
AMGEVITA è usato per trattare l’artrite idiopatica giovanile poliarticolare in pazienti dai 2 anni di età e
l’artrite correlata a entesite in pazienti dai 6 anni di età. Alla diagnosi possono essere somministrati altri
farmaci modificanti la malattia, come il metotressato. Se la risposta a questi farmaci non dovesse essere
adeguata, le sarà somministrato AMGEVITA per il trattamento dell’artrite idiopatica giovanile
poliarticolare o dell’artrite correlata a entesite.
Spondilite anchilosante e spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante
La spondilite anchilosante e la spondiloartrite assiale senza evidenza radiografica della spondilite
anchilosante sono infiammazioni della colonna vertebrale.
AMGEVITA è usato per trattare la spondilite anchilosante e la spondiloartrite assiale senza evidenza
radiografica della spondilite anchilosante negli adulti. Se è affetto da spondilite anchilosante o da
spondiloartrite assiale senza evidenza radiografica della spondilite anchilosante, assumerà prima altri
farmaci. Nel caso in cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà
AMGEVITA per ridurre i segni ed i sintomi della malattia.
Artrite psoriasica
L’artrite psoriasica è un’infiammazione delle articolazioni associata alla psoriasi.
AMGEVITA è usato per trattare l’artrite psoriasica negli adulti. AMGEVITA rallenta il danno alla
cartilagine ed alle ossa delle articolazioni causato dalla malattia e migliora la funzionalità fisica.
Psoriasi a placche in adulti e bambini
La psoriasi a placche è una condizione della pelle che causa chiazze rossastre, squamose e indurite di
pelle ricoperta da squame argentee. La psoriasi a placche può anche colpire le unghie, provocandone la
rottura, l’ispessimento e il sollevamento dal letto dell’unghia, che può essere doloroso. Si ritiene che la
psoriasi sia causata da un problema del sistema immunitario del corpo che conduce ad un aumento della
produzione di cellule cutanee.
AMGEVITA è usato per trattare la psoriasi a placche di grado da moderato a severo negli adulti.
AMGEVITA è inoltre utilizzato per trattare la psoriasi a placche grave in bambini e adolescenti da 4 a
17 anni per i quali la terapia topica e le fototerapie non abbiano funzionato in modo ottimale o non
siano indicate.
Idrosadenite suppurativa in adulti e adolescenti
L’idrosadenite suppurativa (chiamata a volte acne inversa) è una malattia infiammatoria cronica della
cute e spesso è dolorosa. I sintomi possono includere noduli dolorosi e ascessi (foruncoli) che possono
drenare pus. Più frequentemente colpisce aree specifiche della cute, come la regione sottomammaria, le
ascelle, l’interno cosce, l’inguine e le natiche. Nelle aree colpite si possono anche formare delle
cicatrici.
AMGEVITA è utilizzato per trattare l’idrosadenite suppurativa negli adulti e negli adolescenti dai
12 anni di età. AMGEVITA può ridurre il numero di noduli e di ascessi che lei ha e il dolore che spesso
è associato a questa malattia. Inizialmente, potrebbe ricevere altri medicinali. Se non risponde
sufficientemente bene a questi medicinali, riceverà AMGEVITA.
Malattia di Crohn negli adulti e nei bambini
La malattia di Crohn è un’infiammazione del tratto digerente.
AMGEVITA è usato per trattare la malattia di Crohn negli adulti e nei bambini di età dai 6 ai 17 anni.
Se soffre della malattia di Crohn, le verranno prima somministrati altri farmaci. Nel caso in cui lei non
risponda in maniera sufficientemente adeguata a questi farmaci, le verrà somministrato AMGEVITA
per ridurre segni e sintomi della malattia di Crohn.
Colite ulcerosa negli adulti e nei bambini
La colite ulcerosa è un’infiammazione dell’intestino crasso.
AMGEVITA è usato per trattare la colite ulcerosa da moderata a grave negli adulti e nei bambini di età
dai 6 ai 17 anni. Se è affetto da colite ulcerosa inizialmente potrebbe assumere altri farmaci. Nel caso in
cui non sia in grado di ottenere una risposta adeguata con questi farmaci, assumerà AMGEVITA per
ridurre i segni e i sintomi della malattia.
Uveite non infettiva negli adulti e nei bambini
L’uveite non infettiva è una malattia infiammatoria che colpisce alcune parti dell’occhio.
AMGEVITA è impiegato per il trattamento di
- Adulti affetti da uveite non infettiva con infiammazione che interessa il fondo dell’occhio.
- Bambini dai 2 anni di età con uveite non infettiva cronica con infiammazione che interessa la parte anteriore dell’occhio.
Questa infiammazione può portare a una diminuzione della visione e/o alla presenza di corpi mobili
nell’occhio (punti neri o linee sottili che si muovono attraverso il campo visivo). AMGEVITA agisce
riducendo questa infiammazione.
2. Cosa deve sapere prima di usare AMGEVITA
Non usi AMGEVITA:
- se è allergico ad adalimumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- in presenza di un’infezione grave, incluse tubercolosi attiva, sepsi (infezione del sangue) o altre infezioni opportunistiche (infezioni insolite associate a un sistema immunitario indebolito) (vedere “Avvertenze e precauzioni”). È importante comunicare al medico se ha segni o sintomi di infezione, come per es. febbre, ferite, sensazione di stanchezza, problemi dentali.
- in presenza di insufficienza cardiaca moderata o grave. È importante riferire al medico se c’è stata o è presente una condizione cardiaca grave (vedere “Avvertenze e precauzioni”).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di usare AMGEVITA:
Reazioni allergiche
- In caso di reazioni allergiche con sintomi quali senso di costrizione toracica, respiro sibilante, capogiro, gonfiore o eruzione cutanea, non si somministri più AMGEVITA e contatti il medico immediatamente considerato che, in rari casi, queste reazioni possono essere rischiose per la vita.
Infezioni
- In caso d’infezione, incluse infezioni a lungo termine o localizzate (per esempio, ulcere alle gambe) consulti il medico prima di iniziare il trattamento con AMGEVITA. Se ha dubbi, contatti il medico.
- È possibile contrarre più facilmente infezioni durante il trattamento con AMGEVITA. Questo rischio può aumentare se la sua funzione polmonare è compromessa. Queste infezioni possono essere gravi ed includere tubercolosi, infezioni causate da virus, funghi, parassiti o batteri, o altre infezioni opportunistiche e sepsi che possono, in rari casi, essere rischiose per la vita del paziente. È importante comunicare al medico la presenza di sintomi quali febbre, ferite, sensazione di stanchezza o problemi dentali. Il medico potrebbe raccomandare la sospensione temporanea di AMGEVITA.
Tubercolosi
- Poiché si sono verificati dei casi di tubercolosi in pazienti sottoposti a trattamento con adalimumab, prima di iniziare la terapia con AMGEVITA il medico dovrà controllare se lei presenta segni o sintomi di tubercolosi. Questo comporterà la raccolta di una valutazione medica dettagliata che includa la sua storia medica e appropriati esami clinici (per es., una radiografia del torace e il test della tubercolina). L’esecuzione e i risultati di tali esami devono essere registrati nella Scheda Promemoria per il Paziente. È molto importante comunicare al medico se ha mai avuto la tubercolosi, o se ha avuto contatti ravvicinati con malati di tubercolosi.
- La tubercolosi si può manifestare durante la terapia nonostante lei abbia ricevuto un trattamento preventivo per la tubercolosi.
- Contatti immediatamente il medico se durante o dopo la terapia compaiono sintomi di tubercolosi (tosse persistente, perdita di peso, svogliatezza, febbre moderata) o di altre infezioni.
Viaggio/infezione ricorrente
- Avvisi il medico se risiede o viaggia in regioni dove le infezioni fungine, come l’istoplasmosi, la coccidioidomicosi o la blastomicosi, sono endemiche.
- Avvisi il medico se ha avuto infezioni recidivanti o se presenta condizioni che aumentano il rischio di infezione.
Virus dell’epatite B
- Informi il medico se lei è portatore del virus dell’epatite B (HBV), se ha un’infezione in fase attiva da virus dell’epatite B o se pensa di poter essere a rischio di contrarre il virus dell’epatite
- B. Il medico la deve testare per l’infezione da virus dell’epatite B. L’assunzione di AMGEVITA può causare la riattivazione del virus dell’epatite B nei soggetti che risultano portatori di questo virus. In alcuni rari casi, soprattutto se il paziente è sottoposto a terapia con altri farmaci che sopprimono il sistema immunitario, la riattivazione del virus dell’epatite B può mettere a rischio la vita del paziente.
Età superiore a 65 anni
- Se ha più di 65 anni può essere più suscettibile ad infezioni durante l’assunzione di AMGEVITA. Lei e il medico dovete prestare particolare attenzione a segni di infezione mentre è in trattamento con AMGEVITA. È importante informare il medico se compaiono i sintomi di infezioni quali febbre, ferite, sensazione di stanchezza o problemi dentali.
Intervento chirurgico o procedure dentistiche
- Prima di un intervento chirurgico o procedure dentistiche, informi il medico che sta prendendo AMGEVITA. Il medico potrebbe consigliare la sospensione temporanea di AMGEVITA.
Malattia demielinizzante
- Se è affetto o sviluppa malattia demielinizzante come la sclerosi multipla, il medico deciderà se è il caso di iniziare o continuare a ricevere il trattamento con AMGEVITA. Informi il medico immediatamente nel caso in cui lei manifesti sintomi quali variazioni nella visione, debolezza di braccia o gambe o intorpidimento o formicolio che interessi qualsiasi parte del corpo.
Vaccinazioni
- Certi vaccini contengono forme vive ma indebolite di batteri o virus che causano malattie che possono causare infezioni e non devono essere somministrati durante il trattamento con AMGEVITA. Consulti il medico prima di sottoporsi a vaccinazioni. Nei bambini, prima di iniziare la terapia a base di AMGEVITA, si raccomanda, se possibile, di attuare il programma di vaccinazioni previsto, in ottemperanza alle linee guida in vigore sulle vaccinazioni.
- Se ha assunto AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre tale infezione fino a circa 5 mesi dopo l’ultima somministrazione che lei ha assunto durante la gravidanza. È importante che lei riferisca al pediatra o ad altro operatore sanitario del suo utilizzo di AMGEVITA durante la gravidanza, cosicché possano decidere quando il bambino deve ricevere qualsiasi tipo di vaccinazione.
Insufficienza cardiaca
- In caso di lieve insufficienza cardiaca e di concomitante trattamento con AMGEVITA, il medico dovrà attentamente valutare e seguire lo stato del suo cuore. È importante informare il medico se ha o ha avuto problemi di cuore. Se si manifestano nuovi sintomi di insufficienza cardiaca o se i sintomi già esistenti dovessero peggiorare (per esempio, fiato corto o gonfiore dei piedi), contatti immediatamente il medico. Il medico deciderà se può assumere AMGEVITA.
Febbre, lividi, sanguinamento o aspetto pallido
- In alcuni pazienti l’organismo può non essere in grado di produrre un quantitativo di cellule del sangue sufficiente, tale da aiutarlo a combattere le infezioni o ad arrestare un sanguinamento. Nel caso in cui lei abbia febbre persistente, lividi o facili sanguinamenti o aspetto pallido, si rivolga immediatamente al medico. Quest’ultimo potrebbe decidere di interrompere la terapia.
Cancro
- Nei pazienti, sia bambini sia adulti, sottoposti a trattamento con adalimumab o con altri farmaci anti-TNF, molto raramente si sono manifestati alcuni tipi di cancro. I pazienti affetti da artrite reumatoide di grave entità da molto tempo possono presentare un rischio superiore alla media di sviluppare linfoma (un cancro che colpisce il sistema linfatico) e leucemia (un cancro che colpisce il sangue e il midollo osseo).
- Se lei assume AMGEVITA, il rischio di contrarre linfomi, leucemia o altri cancri può aumentare. In rare circostanze, nei pazienti sottoposti a terapia con adalimumab, è stato osservato un tipo specifico e grave di linfoma. Alcuni di questi pazienti erano anche in terapia con azatioprina o 6-mercaptopurina. Avvisi il medico se sta assumendo azatioprina o 6-mercaptopurina con AMGEVITA.
- Inoltre, nei pazienti che assumono adalimumab, sono stati osservati casi di cancro della cute non melanotico. Se nel corso della terapia, o successivamente ad essa, dovessero comparire nuove lesioni cutanee o se l’aspetto delle lesioni già esistenti si dovesse modificare, lo riferisca al medico.
- Ci sono stati casi di cancri, oltre al linfoma, in pazienti con uno specifico tipo di malattia del polmone chiamata Malattia Polmonare Ostruttiva Cronica (COPD) trattati con un altro anti-TNF. Se soffre di COPD, o fuma molto, deve discutere con il medico se è appropriato il trattamento con un anti-TNF.
Malattie autoimmuni
- Raramente, il trattamento con AMGEVITA può portare alla manifestazione di una sindrome simil-lupoide. Informi il medico qualora si manifestino sintomi come eruzione cutanea persistente di natura inspiegabile, febbre, dolore alle articolazioni o stanchezza.
Al fine di migliorare la tracciabilità di questo medicinale, il medico o il farmacista deve registrare il
nome dello stesso ed il numero di lotto del prodotto che le è stato somministrato sulla sua scheda
paziente. Lei può prendere nota di questi dettagli in caso le venissero chiesti in futuro.
Bambini e adolescenti
- Vaccinazioni: se possibile, i bambini dovrebbero aver già fatto tutte le vaccinazioni prima di usare AMGEVITA.
- Non dare AMGEVITA a bambini con artrite idiopatica giovanile poliarticolare di età inferiore ai 2 anni.
- Non dare AMGEVITA a bambini con psoriasi a placche di età inferiore ai 4 anni.
- Non dare AMGEVITA a bambini con malattia di Crohn o colite ulcerosa di età inferiore ai 6 anni.
Altri medicinali e AMGEVITA
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
AMGEVITA può essere assunto sia con il metotressato che con altri farmaci antireumatici modificanti
la malattia (sulfasalazina, idrossiclorochina, leflunomide e sali d’oro per via parenterale), steroidi o
analgesici, compresi i farmaci anti-infiammatori non steroidei (FANS).
AMGEVITA non deve essere preso in concomitanza con farmaci contenenti come principio attivo
anakinra o abatacept a causa del rischio aumentato di contrarre infezioni gravi. Se ha dubbi, si rivolga al
medico.
Gravidanza e allattamento
- Deve considerare l’utilizzo di un’adeguata misura contraccettiva per prevenire una gravidanza e continuarne l’utilizzo per almeno 5 mesi dopo l’ultima terapia con AMGEVITA.
- Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, chieda consiglio al suo medico circa l’assunzione di questo medicinale.
- AMGEVITA deve essere usato durante la gravidanza solo se necessario.
- Secondo uno studio sulla gravidanza, non è stato riscontrato un rischio maggiore di difetti alla nascita quando la madre aveva ricevuto AMGEVITA durante la gravidanza, rispetto a madri che avevano la stessa patologia, ma che non avevano ricevuto AMGEVITA.
- AMGEVITA può essere usato durante l’allattamento con latte materno.
- Se assume AMGEVITA durante la gravidanza, il bambino potrebbe avere un maggior rischio di contrarre un’infezione.
- É importante che lei riferisca al pediatra o ad altro operatore sanitario dell’utilizzo di AMGEVITA durante la gravidanza, prima che il bambino riceva qualsiasi tipo di vaccinazione. Per maggiori informazioni sulle vaccinazioni consulti la sezione “Avvertenze e precauzioni”.
Guida di veicoli e utilizzo di macchinari
AMGEVITA può influenzare, benché solo in maniera modesta, la sua capacità di guidare, andare in
bicicletta o utilizzare macchinari. In seguito all’assunzione di AMGEVITA, si possono avere disturbi
della visione e la sensazione che l’ambiente in cui ci si trova ruoti (vertigini).
AMGEVITA contiene sodio
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per la dose da 0,8 mL, cioè, é
essenzialmente “senza sodio”.
3. Come usare AMGEVITA
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Adulti con artrite reumatoide, artrite psoriasica, spondilite anchilosante o spondiloartrite assiale senza
evidenza radiografica di spondilite anchilosante
AMGEVITA è iniettato sotto la cute (uso sottocutaneo). In pazienti adulti con artrite reumatoide,
spondilite anchilosante, spondiloartrite assiale senza evidenza radiografica di spondilite anchilosante e
artrite psoriasica, il normale dosaggio è di 40 mg a settimane alterne, somministrato in un’unica dose.
Nell’artrite reumatoide, il metotressato viene continuato durante il trattamento con AMGEVITA. Se il
medico decide che il metotressato non è appropriato, AMGEVITA può essere somministrato da solo.
Se è affetto da artrite reumatoide e non riceve metotressato in associazione al trattamento con
AMGEVITA, il medico può decidere di prescriverle 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con psoriasi a placche
La dose abituale per gli adulti affetti da psoriasi a placche è rappresentata da una dose iniziale pari a
80 mg, seguita da una dose pari a 40 mg, somministrata a settimane alterne, ad iniziare dalla settimana
successiva all’assunzione della dose iniziale. Lei deve continuare il trattamento con AMGEVITA per il
tempo indicato dal medico. In base alla risposta clinica, il medico può aumentare la dose a 40 mg ogni
settimana o 80 mg a settimane alterne.
Adulti con idrosadenite suppurativa
La dose abituale per l’idrosadenite suppurativa è una dose iniziale di 160 mg (due iniezioni da 80 mg in
un giorno o una iniezione da 80 mg al giorno per due giorni consecutivi), seguita da una dose di 80 mg
(una iniezione da 80 mg) due settimane dopo. Dopo altre due settimane, continuare con una dose di
40 mg a settimana o 80 mg a settimane alterne, come prescritto dal medico. Si raccomanda di utilizzare
tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adolescenti con idrosadenite suppurativa di età compresa tra 12 e 17 anni, con peso uguale o superiore
a 30 kg
La dose raccomandata di AMGEVITA è una dose iniziale di 80 mg, seguita da 40 mg somministrati a
settimane alterne a partire da una settimana dopo la dose iniziale. In caso di risposta inadeguata a 40 mg
di AMGEVITA a settimane alterne, il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a
settimane alterne.
Si raccomanda di utilizzare tutti i giorni una soluzione di lavaggio antisettica sulle aree interessate.
Adulti con malattia di Crohn
In caso di malattia di Crohn, la dose abituale è inizialmente di 80 mg seguiti da 40 mg a settimane
alterne, due settimane più tardi. Se è necessario indurre una risposta più rapida, il medico potrebbe
prescrivere una dose iniziale di 160 mg (somministrata in due iniezioni da 80 mg in un giorno o in una
iniezione da 80 mg al giorno per due giorni consecutivi) seguita da 80 mg due settimane più tardi, e
successivamente 40 mg a settimane alterne. In funzione della risposta clinica, il medico potrebbe
aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Bambini e adolescenti con malattia di Crohn
Bambini e adolescenti di età compresa tra 6 e 17 anni e con peso inferiore a 40 kg
All’inizio, il regime di dose abituale è di 40 mg, seguito da 20 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 80 mg seguita da 40 mg due
settimane più tardi.
Successivamente, la dose abituale è di 20 mg a settimane alterne. A seconda della risposta del bambino,
il medico può aumentare la frequenza della dose a 20 mg ogni settimana.
La penna preriempita da 40 mg non può essere usata per dispensare la dose da 20 mg. Una siringa
preriempita da 20 mg di AMGEVITA è tuttavia disponibile per la dose da 20 mg.
Bambini ed adolescenti di età compresa tra 6 e 17 anni e con peso uguale o superiore a 40 kg
All’inizio, il regime di dose abituale è di 80 mg, seguito da 40 mg due settimane più tardi. Se è richiesta
una risposta più rapida, il medico può prescrivere una dose iniziale di 160 mg (due iniezioni da 80 mg
in un giorno o una iniezione da 80 mg al giorno per due giorni consecutivi) seguita da 80 mg due
settimane più tardi.
Successivamente, la dose abituale è di 40 mg a settimane alterne. A seconda della risposta del bambino,
il medico può aumentare la dose a 40 mg ogni settimana o 80 mg a settimane alterne.
Adulti con colite ulcerosa
Per gli adulti affetti da colite ulcerosa, la dose iniziale abituale di AMGEVITA è pari a 160 mg
(somministrata in due iniezioni da 80 mg in un giorno o in una iniezione da 80 mg al giorno per due
giorni consecutivi) seguita da 80 mg due settimane più tardi, 40 mg a settimane alterne. In funzione
della risposta clinica, il medico potrebbe aumentare la dose a 40 mg ogni settimana o 80 mg a settimane
alterne.
Bambini e adolescenti con colite ulcerosa
Bambini e adolescenti a partire dai 6 anni di età e con peso inferiore a 40 kg
La dose abituale di AMGEVITA è di 80 mg seguita da 40 mg (tramite una sola iniezione da 40 mg)
dopo due settimane. Successivamente, la dose abituale è di 40 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 40 mg a settimane alterne devono continuare la dose
prescritta.
Bambini e adolescenti a partire dai 6 anni di età e con peso uguale o superiore a 40 kg
La dose abituale di AMGEVITA è di 160 mg (due iniezioni da 80 mg in un giorno o una iniezione da
80 mg al giorno per due giorni consecutivi) seguita da 80 mg dopo due settimane. Successivamente la
dose abituale è di 80 mg a settimane alterne.
I pazienti che compiono 18 anni mentre assumono 80 mg a settimane alterne devono continuare la dose
prescritta.
Adulti con uveite non infettiva
Per gli adulti affetti da uveite non infettiva, la dose abituale è una dose iniziale pari a 80 mg, seguita da
40 mg somministrati a settimane alterne a partire da una settimana dopo la dose iniziale. Deve
continuare ad iniettarsi AMGEVITA per tutto il tempo indicato dal medico.
Nell’uveite non infettiva, i corticosteroidi o gli altri farmaci che influiscono sul sistema immunitario
potranno essere continuati durante il trattamento con AMGEVITA. AMGEVITA può anche essere
somministrato in monoterapia.
Bambini e adolescenti con uveite cronica non infettiva a partire da 2 anni di età
Bambini e adolescenti a partire da 2 anni e con peso inferiore a 30 kg
La dose abituale di AMGEVITA è di 20 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 40 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
La penna preriempita da 40 mg non può essere utilizzata per la dose da 20 mg. Una siringapreriempita
di AMGEVITA da 20 mg è tuttavia disponibile per la dose da 20 mg.
Bambini e adolescenti a partire da 2 anni di età e con peso uguale o superiore a 30 kg
La dose abituale di AMGEVITA è di 40 mg somministrati a settimane alterne con metotressato.
Il medico potrebbe prescrivere anche una dose iniziale da 80 mg che può essere somministrata una
settimana prima dell’inizio della dose abituale.
Modo e via di somministrazione
AMGEVITA è somministrato per iniezione sotto la cute (iniezione sottocutanea).
Istruzioni dettagliate su come iniettare AMGEVITA sono fornite nel paragrafo “Istruzioni per l’uso”.
Se usa più AMGEVITA di quanto deve
Se accidentalmente inietta AMGEVITA più frequentemente di quanto disposto dal medico o dal
farmacista, contatti il medico o il farmacista informandolo di aver assunto più farmaco. Conservi
sempre la scatola di questo medicinale, anche se vuota.
Se dimentica di usare AMGEVITA
Se dimentica di fare un’iniezione, deve iniettarsi la dose successiva di AMGEVITA non appena se ne
ricorda. Dopodiché riprenda la dose regolarmente secondo lo schema posologico stabilito.
Se interrompe il trattamento con AMGEVITA
La decisione di interrompere l’uso di AMGEVITA deve essere discussa con il medico. I sintomi
possono ritornare dopo l’interruzione.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino. La maggior parte degli effetti indesiderati si presenta in forma da lieve a moderata.
Tuttavia, alcuni possono essere gravi e richiedere un trattamento. Effetti indesiderati possono
manifestarsi fino a 4 mesi dall’ultima iniezione di AMGEVITA.
Informi immediatamente il medico se nota uno qualsiasi dei seguenti segni di reazione allergica o di
insufficienza cardiaca:
- eruzione cutanea grave, orticaria o altri segni di reazione allergica;
- gonfiore di viso, mani e piedi;
- difficoltà nella respirazione, difficoltà ad inghiottire;
- respiro affannoso sotto sforzo o in posizione sdraiata o gonfiore dei piedi.
Informi appena possibile il medico se nota una qualsiasi delle seguenti reazioni:
- segni di infezione come febbre, sensazione di star male, ferite, problemi dentali, bruciore nell’urinare;
- stanchezza o debolezza;
- tosse;
- formicolio;
- torpore;
- visione doppia;
- debolezza delle braccia o gambe;
- segni di cancro della pelle come una protuberanza o piaga che non guarisce;
- segni e sintomi che suggeriscono la comparsa di disturbi a carico del sistema ematico (sangue), come la presenza di febbre persistente, lividi, sanguinamenti, pallore.
I sintomi sopra descritti possono essere segni dei seguenti effetti indesiderati, che sono stati osservati
con adalimumab.
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- reazioni in sede di iniezione (tra cui dolore, gonfiore, arrossamento o prurito);
- infezioni delle vie respiratorie (tra cui raffreddore, naso che cola, infezione sinusale e infezione polmonare);
- cefalea;
- dolore addominale;
- nausea e vomito;
- eruzione cutanea;
- dolore muscoloscheletrico.
Comuni (possono manifestarsi fino a 1 persona su 10)
- infezioni gravi (tra cui setticemia ed influenza);
- infezioni intestinali (tra cui gastroenterite);
- infezioni della pelle (tra cui cellulite e infezione da Herpes Zoster);
- infezioni dell’orecchio;
- infezioni orali (tra cui infezioni dentarie ed herpes labiale);
- infezioni dell’apparato riproduttivo;
- infezione delle vie urinarie;
- infezione micotica;
- infezioni articolari;
- tumori benigni;
- cancro della pelle;
- reazioni allergiche (tra cui allergia stagionale);
- disidratazione;
- sbalzi di umore (tra cui depressione);
- ansia;
- difficoltà a dormire;
- disturbi della sensibilità come formicolii, sensazione di fitte o intorpidimento;
- emicrania;
- compressione di radice nervosa (tra cui dolore dorso-lombare e dolore alle gambe);
- disturbi della visione;
- infiammazione degli occhi;
- infiammazione delle palpebre e tumefazione degli occhi;
- vertigini (sensazione di capogiro o stanza che ruota);
- sensazione di battito cardiaco accelerato;
- pressione del sangue elevata;
- rossore;
- ematoma;
- tosse;
- asma;
- respiro affannoso;
- sanguinamento gastrointestinale;
- dispepsia (indigestione, stomaco gonfio, bruciore di stomaco);
- disturbo da reflusso acido;
- sindrome sicca (tra cui occhi secchi e bocca secca);
- prurito;
- eruzione cutanea pruriginosa;
- lividi;
- infiammazione della pelle (come eczema);
- rottura delle unghie delle dita della mano e del piede;
- sudorazione aumentata;
- perdita di capelli;
- insorgenza o peggioramento della psoriasi;
- spasmi muscolari;
- sangue nell’ urina;
- problemi renali;
- dolore toracico;
- edema;
- febbre;
- riduzione delle piastrine nel sangue che aumenta il rischio di sanguinamenti o di lividi;
- difficoltà di cicatrizzazione.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- infezioni opportunistiche (che includono la tubercolosi ed altre infezioni che si manifestano quando si abbassano le difese immunitarie);
- infezioni neurologiche (tra cui la meningite virale);
- infezioni degli occhi;
- infezioni batteriche;
- diverticolite (infiammazione e infezione dell’intestino crasso);
- cancro, tra cui cancro che colpisce il sistema linfatico (linfoma) e melanoma (cancro della cute);
- disturbi del sistema immunitario che potrebbero colpire polmoni, cute e linfonodi (che si presentano più comunemente come sarcoidosi);
- vasculite (infiammazione dei vasi sanguigni);
- tremore;
- neuropatia;
- ictus;
- perdita dell’udito, ronzio;
- sensazione di battito cardiaco irregolare come battiti saltati;
- problemi al cuore che possono causare respiro affannoso o gonfiore alle caviglie;
- attacco cardiaco;
- formazione di una sacca nella parete di un’arteria principale, infiammazione e coagulo in una vena, ostruzione di un vaso sanguigno;
- malattie polmonari che provocano respiro affannoso (inclusa infiammazione);
- embolia polmonare (occlusione di una arteria del polmone);
- versamento della pleura (anomala raccolta di liquido nello spazio pleurico);
- infiammazione del pancreas che causa forti dolori all’addome ed alla schiena;
- difficoltà di deglutizione;
- edema facciale;
- infiammazione della cistifellea, calcoli della cistifellea;
- fegato grasso;
- sudorazioni notturne;
- cicatrice;
- anormale catabolismo muscolare;
- lupus eritematoso sistemico (tra cui infiammazione di cute, cuore, polmone, articolazioni e di altri organi);
- sonno interrotto;
- impotenza;
- infiammazioni.
Rari (possono manifestarsi fino a 1 persona su 1 000)
- leucemia (cancro del sangue del midollo osseo);
- reazione allergica grave con shock;
- sclerosi multipla;
- patologie neurologiche (come infiammazione del nervo ottico e sindrome di Guillain-Barré che può causare debolezza muscolare, sensazioni anomale, formicolio alle braccia ed alla parte superiore del corpo);
- arresto cardiaco;
- fibrosi polmonare (cicatrici del polmone);
- perforazione intestinale (foro nella parete dell’intestino);
- epatite (infiammazione del fegato);
- riattivazione dell’epatite B;
- epatite autoimmune (infiammazione del fegato causata dal proprio sistema immunitario);
- vasculite cutanea (infiammazione dei vasi sanguigni della pelle);
- sindrome di Stevens-Johnson (reazione rischiosa per la vita con sintomi simil-influenzali ed eruzione cutanea con vescicole);
- edema facciale associato a reazioni allergiche;
- eritema multiforme (eruzione cutanea infiammatoria);
- sindrome simil-lupoide;
- angioedema (gonfiore localizzato della pelle);
- reazione cutanea lichenoide (eruzione cutanea rosso-violacea pruriginosa).
Non nota (la frequenza non può essere definita sulla base dei dati disponibili)
- linfoma epato-splenico a cellule T (un raro cancro del sangue che spesso risulta fatale);
- carcinoma a cellule di Merkel (un tipo di cancro della pelle);
- sarcoma di Kaposi, una rara forma di cancro correlato a infezione da Herpes virus umano 8. Il sarcoma di Kaposi si manifesta più comunemente con lesioni viola sulla pelle;
- insufficienza epatica;
- peggioramento di una condizione chiamata dermatomiosite (che si manifesta come eruzione cutanea accompagnata da debolezza muscolare);
- aumento di peso (per la maggior parte dei pazienti, l’aumento di peso è stato basso).
Alcuni degli effetti indesiderati osservati con adalimumab possono essere asintomatici e possono essere
individuati solo attraverso gli esami del sangue. Questi includono:
Molto comuni (possono manifestarsi in più di 1 persona su 10)
- conta dei globuli bianchi bassa;
- conta dei globuli rossi bassa;
- lipidi nel sangue aumentati;
- enzimi epatici aumentati.
Comuni (possono manifestarsi fino a 1 persona su 10)
- conta dei globuli bianchi aumentata;
- conta delle piastrine ridotta;
- acido urico nel sangue aumentato;
- sodio nel sangue anormale;
- calcio nel sangue diminuito;
- fosfato nel sangue diminuito;
- zuccheri nel sangue aumentati;
- latticodeidrogenasi nel sangue aumentata;
- autoanticorpi presenti nel sangue;
- potassio nel sangue diminuito.
Non comuni (possono manifestarsi fino a 1 persona su 100)
- bilirubina nel sangue elevata (esame epatico del sangue).
Rari (possono manifestarsi fino a 1 persona su 1 000)
- conta di globuli bianchi, globuli rossi e piastrine bassa.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o al farmacista. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire a
fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare AMGEVITA
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola dopo
Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2°C – 8°C). Non congelare.
Conservare nella confezione originale per proteggere il medicinale dalla luce.
Una singola penna di AMGEVITA può essere conservata a temperature fino ad un massimo di 25°C per
un periodo massimo di 14 giorni. La penna preriempita deve essere protetta dalla luce e deve essere
gettata via se non usata entro il periodo di 14 giorni.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene AMGEVITA
- Il principio attivo è adalimumab. Ogni penna preriempita contiene 80 mg di adalimumab in 0,8 mL di soluzione.
- Gli altri eccipienti sono acido L-lattico, saccarosio, polisorbato 80, sodio idrossido e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di AMGEVITA e contenuto della confezione
AMGEVITA è una soluzione limpida e da incolore a leggermente gialla.
Ogni confezione contiene 1, 2 o 3 penne preriempite monouso SureClick da 80 mg.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Titolare dell’autorizzazione all’immissione in commercio
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Paesi Bassi
Produttore
Amgen Technology Ireland UC
Pottery Road
Dun Laoghaire
Co Dublin
Irlanda
Produttore
Amgen NV
Telecomlaan 5-7
1831 Diegem
Belgio
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
s.a. Amgen n.v.
Tél/Tel: +32 (0)2 7752711
Lietuva
Amgen Switzerland AG Vilniaus filialas
Tel: +370 5 219 7474
България
Амджен България ЕООД
Тел.: +359 (0)2 424 7440
Luxembourg/Luxemburg
s.a. Amgen
Belgique/Belgien
Tél/Tel: +32 (0)2 7752711
Česká republika
Amgen s.r.o.
Tel: +420 221 773 500
Magyarország
Amgen Kft.
Tel.: +36 1 35 44 700
Danmark
Amgen, filial af Amgen AB, Sverige
Tlf: +45 39617500
Malta
Amgen S.r.l.
Italy
Tel: +39 02 6241121
Deutschland
Amgen GmbH
Tel: +49 89 1490960
Nederland
Amgen B.V.
Tel: +31 (0)76 5732500
Eesti
Amgen Switzerland AG Vilniaus filialas
Tel: +372 586 09553
Norge
Amgen AB
Tlf: +47 23308000
Ελλάδα
Amgen Ελλάς Φαρμακευτικά Ε.Π.Ε.
Τηλ: +30 210 3447000
Österreich
Amgen GmbH
Tel: +43 (0)1 50 217
España
Amgen S.A.
Tel: +34 93 600 18 60
Polska
Amgen Biotechnologia Sp. z o.o.
Tel.: +48 22 581 3000
France
Amgen S.A.S.
Tél: +33 (0)9 69 363 363
Portugal
Amgen Biofarmacêutica, Lda.
Tel: +351 21 4220606
Hrvatska
Amgen d.o.o.
Tel: +385 (0)1 562 57 20
România
Amgen România SRL
Tel: +4021 527 3000
Ireland
Amgen Ireland Limited
Tel: +353 1 8527400
Slovenija
AMGEN zdravila d.o.o.
Tel: +386 (0)1 585 1767
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika
Amgen Slovakia s.r.o.
Tel: +421 2 321 114 49
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial
i Finland
Puh/Tel: +358 (0)9 54900500
Kύπρος
C.A. Papaellinas Ltd
Τηλ: +357 22741 741
Sverige
Amgen AB
Tel: +46 (0)8 6951100
Latvija
Amgen Switzerland AG Rīgas filiāle
Tel: +371 257 25888
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali, http://www.ema.europa.eu .
-----------------------------------------------------------------------------------------------------------------------------
ISTRUZIONI PER L’USO 80 mg/0,8 mL
Guida alle parti della penna preriempita SureClick
80 mg/0,8 mL
Pulsante azzurro di
avvio
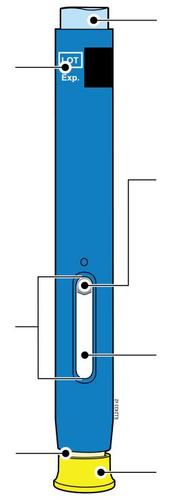
Data di scadenza
Estremità stantuffo
(può essere visibile
nella finestra; la
posizione può
variare)
Finestra
Medicinale
Dispositivo di
sicurezza color
crema
(ago all’interno)
Tappo giallo
1Informazioni importanti da conoscere prima di eseguire l’iniezione di AMGEVITA
Utilizzo della penna SureClick preriempita di AMGEVITA:
- È importante non procedere autonomamente all’iniezione prima di avere letto e compreso interamente le presenti istruzioni per l’uso e senza aver ricevuto un’apposita formazione da parte del medico o dell’operatore sanitario.
- Nonutilizzare la penna preriempita se la confezione risulta danneggiata o il sigillo di chiusura non è integro.
- Nonutilizzare la penna preriempita dopo la data di scadenza indicata sull’etichetta.
- Nonagitare mai la penna preriempita.
- Nonrimuovere il tappo giallo dalla penna preriempita finché non si è pronti per l’iniezione.
- Nonutilizzare la penna preriempita se è stata congelata.
- Nonutilizzare la penna preriempita se è caduta su una superficie dura. Alcune parti della penna preriempita potrebbero essersi rotte, anche se il danno potrebbe non essere visibile. Utilizzare una nuova penna preriempita e rivolgersi al medico o all’operatore sanitario.
Importante:tenere la penna preriempita e il contenitore per lo smaltimento di oggetti taglienti
fuori dalla vista e dalla portata dei bambini.
| 2 | Preparazione per l’iniezione di AMGEVITA |
| 2a | Attendere 30 minuti affinché la penna preriempita raggiunga la temperatura ambiente. |
| o c ATTENDERE a 30 m minuti | |
r
| |
2b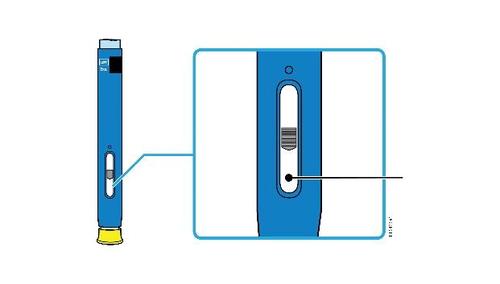 | d Ispezionare il medicinale. Deve essere limpido, da incolore a leggermente giallo. |
a n a Medicinale i l a
| |
2cControllare la data di scadenza (EXP) e ispezionare la penna preriempita per
accertarsi dell’assenza di danni.
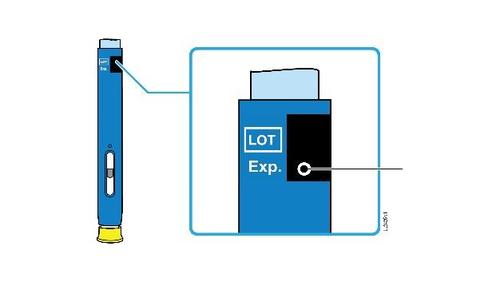
Data di scadenza
- Nonutilizzare se la data di scadenza è stata superata.
- Nonutilizzare la penna preriempita se: o Il tappo giallo è mancante o non è fissato saldamente. o Una qualsiasi parte è incrinata o rotta o La penna è caduta su una superficie dura.
- Accertarsi di avere il medicinale e il dosaggio corretti.
Importante: se il medicinale è torbido, di colore alterato o contiene frammenti, rivolgersi al
medico o all’operatore sanitario.
| 3 | Preparazione per l’iniezione |
3a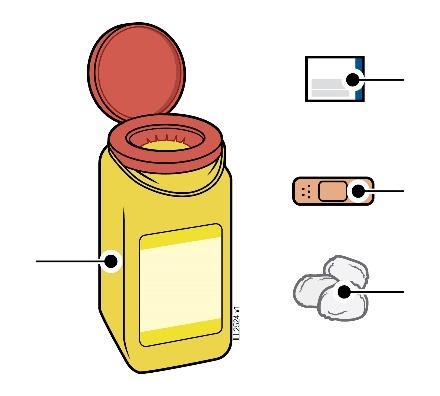 | a Raccogliere e porre il materiale per l’iniezione su una superficie pulita e ben illuminata. |
| n a Salvietta imbevuta di alcol i Cerotto l Contenitore per lo a smaltimento di Batuffolo di cotone o tampone di garza oggetti taglienti t I | |
a
| |
3bEseguire l’iniezione in una di queste sedi.
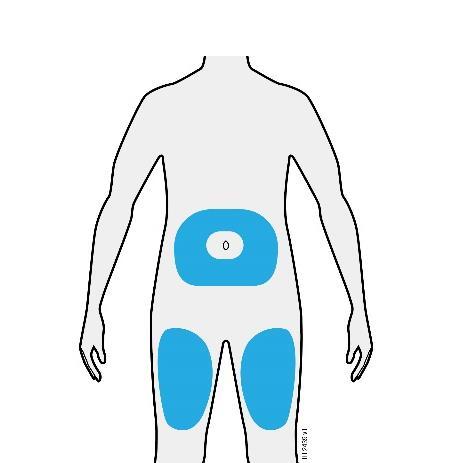
- Eseguire l’iniezione nella coscia o nell’addome (ad eccezione dell’area di 5 cm attorno all’ombelico).
- Scegliere una sede diversa per ogni iniezione.
- Lavare le mani accuratamente con acqua e sapone.
- Pulire la sede di iniezione con una salvietta imbevuta di alcol.
- Lasciare asciugare la pelle.
- Nontoccare più l’area disinfettata prima dell’iniezione. Importante:evitare aree con cicatrici, smagliature o aree in cui la pelle presenti dolorabilità, lividi, arrossamento o indurimento.
4Esecuzione dell’iniezione di AMGEVITA
Importante:rimuovere il tappo giallo solo quando è possibile eseguire immediatamente
l’iniezione (entro 5 minuti), poiché il medicinale può essiccarsi.
4aTenere la penna preriempita in modo che la finestra sia visibile. Estrarre in modo deciso
il tappo giallo.
Potrebbe essere necessario esercitare una certa forza.
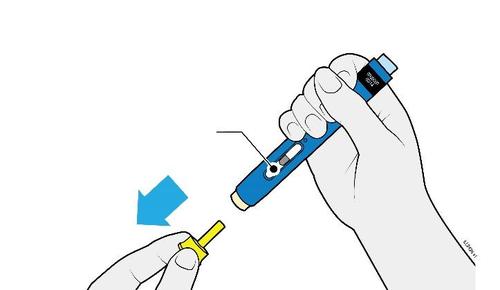
La finestra deve essere
visibile
- Nonruotare, piegare o muovere avanti e indietro il tappo giallo durante la sua estrazione.
- Nonrimettere mai il cappuccio dell’ago sulla penna. Potrebbe danneggiare l’ago.
- Noninserire le dita nel dispositivo di sicurezza color crema.
- È normale osservare la presenza di una goccia di medicinale all’estremità dell’ago o del dispositivo di sicurezza color crema.
| 4b | Afferrare la pelle in modo da creare una plica cutanea con superficie tesa a livello della sede di iniezione. Applicare il dispositivo di sicurezza color crema direttamente contro la pelle. |
| o AFFERRARE LA PELLE | |
F a r m a c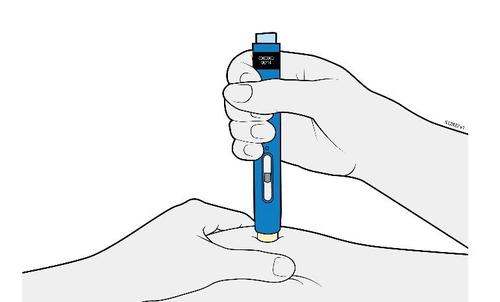 | |
| |
l e
| |
| PREMERE o e tenere contro la pelle c a m r a | |
4c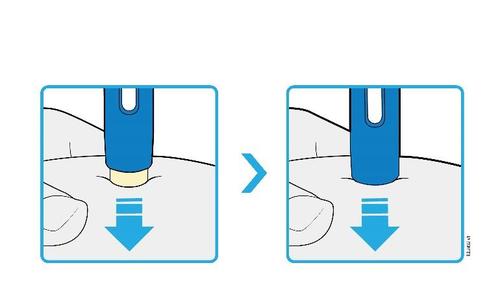 | F Premere con decisione fino a quando il dispositivo di sicurezza color crema cessa di muoversi. Tenere premuto; non sollevare. |
| Il dispositivo di sicurezza color crema spinge e sblocca il pulsante azzurro di avvio. | |
| e PREMERE d il pulsante azzurro di avvio a n a i l a t I | |
4d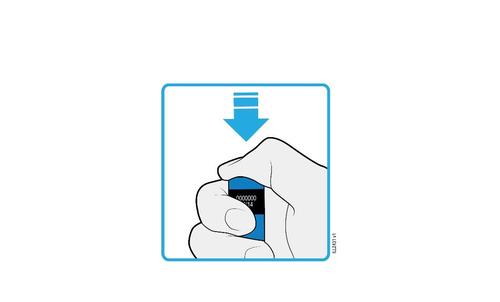 | a Continuando a premere saldamente verso il basso, premere il pulsante azzurro di avvio per iniziare l’iniezione. |
i z
| |
OSSERVARE PER VERIFICARE
che la finestra diventi completamente gialla
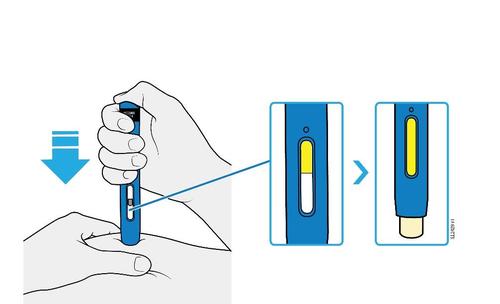
4eContinuare a premere verso il basso. Quando la finestra è completamente gialla,
l’iniezione è completa.
- Il completamento dell’iniezione può richiedere fino a 15secondi.
- Si potrebbe udire o avvertire uno scatto.
- Sollevare la penna preriempita e allontanarla dalla pelle.
- Il dispositivo di sicurezza color crema si blocca attorno all’ago. Importante:se la finestra non è diventata gialla o se si ha l’impressione che l’erogazione del medicinale sia ancora in corso, ciò indica che non si è ricevuta una dose completa. Rivolgersi immediatamente al medico o all’operatore sanitario.
5Procedure finali e smaltimento di AMGEVITA
Importante:non gettare la penna preriempita nei rifiuti domestici.
5aRiporre la penna preriempita usata e il tappo giallo nel contenitore per lo smaltimento di
oggetti taglienti
- Nonriutilizzare la penna preriempita
- Nontoccare il dispositivo di sicurezza color crema 5bEsaminare la sede di iniezione.
- Nonsfregare la sede di iniezione.
- Se si nota la presenza di sangue, tenere premuto un batuffolo di cotone o un tampone di garza sulla sede di iniezione. Se necessario, applicare un cerotto.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a AMGEVITAForma farmaceutica: Soluzione iniettabile, 40 MGPrincipio attivo: adalimumabProduttore: SANDOZ GMBHPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 40 mgPrincipio attivo: adalimumabProduttore: STADA ARZNEIMITTEL AGPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 40 MGPrincipio attivo: adalimumabProduttore: BIOSIMILAR COLLABORATIONS IRELAND LIMITEDPrescrizione richiesta
Medici online per AMGEVITA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di AMGEVITA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





