
ENTYVIO

Come usare ENTYVIO
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra traduzioneContenuto del foglietto illustrativo
Entyvio 300 mg polvere per concentrato per soluzione per infusione
vedolizumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o all’infermiere.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Entyvio e a cosa serve
- 2. Cosa deve sapere prima che le venga somministrato Entyvio
- 3. Come verrà somministrato Entyvio
- 4. Possibili effetti indesiderati
- 5. Come conservare Entyvio
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Entyvio e a cosa serve
Cos’è Entyvio
Entyvio contiene il principio attivo ‘vedolizumab’. Vedolizumab appartiene a un gruppo di medicinali
biologici chiamati anticorpi monoclonali (MAb, dall’inglese Monoclonal Antibodies).
Come agisce Entyvio
Entyvio agisce bloccando una proteina presente sulla superficie dei globuli bianchi che provoca
l’infiammazione nella colite ulcerosa, nel morbo di Crohn e nella pouchite. Questo riduce l’entità
dell’infiammazione.
A cosa serve Entyvio
Entyvio è usato per trattare segni e sintomi in adulti affetti da:
- colite ulcerosa attiva da moderata a grave
- morbo di Crohn attivo da moderato a grave
- pouchite cronica attiva da moderata a grave.
Colite ulcerosa
La colite ulcerosa è una malattia che provoca infiammazione dell’intestino crasso. Se ha la colite
ulcerosa, le saranno prima prescritti altri medicinali. Se non risponderà adeguatamente o non riuscirà a
tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e sintomi della
malattia.
Morbo di Crohn
Il morbo di Crohn è una malattia che provoca infiammazione dell’apparato digerente. Se ha il morbo
di Crohn, le saranno prima somministrati altri medicinali. Se non risponderà adeguatamente o non
riuscirà a tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e
sintomi della malattia.
Pouchite
La pouchite è una malattia che provoca infiammazione del rivestimento interno della tasca (pouch)
creata durante un intervento chirurgico per il trattamento della colite ulcerosa. Se ha la pouchite, forse
le saranno prima prescritti degli antibiotici. Se non risponderà adeguatamente agli antibiotici, il
medico potrebbe prescriverle Entyvio per ridurre segni e sintomi della malattia.
2. Cosa deve sapere prima che le venga somministrato Entyvio
Non usi Entyvio
- se è allergico a vedolizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione grave attiva, come TB (tubercolosi), infezione del sangue (sepsi), diarrea e vomito gravi (gastroenterite), infezione del sistema nervoso.
Avvertenze e precauzioni
Si rivolga al medico o all’infermiere prima che le venga somministrato Entyvio.
Informi immediatamenteil medico o l’infermierequando riceve questo medicinale per la prima
volta, durante la terapia e tra una dose e l’altra:
- se manifesta visione offuscata, perdita della vista o visione doppia, difficoltà a parlare, debolezza ad un braccio o ad una gamba, alterazione del modo di camminare o problemi di equilibrio, intorpidimento persistente, riduzione o perdita della sensibilità, perdita di memoria o stato confusionale. Questi potrebbero essere tutti sintomi di una malattia del cervello grave e che puòprovocare la mortechiamata leucoencefalopatia multifocale progressiva ( PML, dall’inglese Progressive Multifocal Leukoencephalopathy).
- se ha, o pensa di avere, un’ infezione: sono segni di infezione brividi, tremori, tosse persistente o febbre alta. Alcune infezioni possono divenire gravi e possono provocare la morte se non trattate.
- se manifesta segni di una reazione allergica o di un’altra reazione all’infusione, come respiro ansimante, difficoltà di respirazione, orticaria, sensazione di prurito, gonfiore o capogiri. Questi sintomi potrebbero manifestarsi durante o dopo l’infusione. Per informazioni più dettagliate, vedere infusione e reazioni allergiche al paragrafo 4.
- se sta per sottoporsi a una vaccinazioneo si è recentemente sottoposto a una vaccinazione. Entyvio può influire sulla sua risposta alla vaccinazione.
- se ha un tumore, informi il medico. Il medico stabilirà se può comunque ricevere Entyvio.
- se non si sente meglio, poiché in pazienti che presentano un morbo di Crohn molto attivo, l’azione di vedolizumab potrebbe richiedere fino a 14 settimane per manifestarsi.
Bambini e adolescenti
L’uso di Entyvio non è raccomandato in bambini o adolescenti (sotto i 18 anni di età), in
considerazione della mancanza di dati sull’uso di questo medicinale in questa fascia d’età.
Altri medicinali ed Entyvio
Informi il medico o l’infermiere se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
- Entyvio non deve essere somministrato insieme ad altri medicinali biologici che sopprimono il sistema immunitario, poiché gli effetti di questa associazione non sono noti.
Informi il medico se ha già assunto in precedenza:
- natalizumab (un medicinale per la sclerosi multipla) o
- rituximab (un medicinale per alcuni tipi di tumore e l’artrite reumatoide). Il medico stabilirà se lei può comunque ricevere Entyvio.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
Gravidanza
Gli effetti di Entyvio sulle donne in stato di gravidanza non sono noti. Questo medicinale non è
pertanto raccomandato durante la gravidanza. Lei e il medico dovete stabilire se il beneficio per lei
superi chiaramente il potenziale rischio per lei e per il bambino.
Se è una donna in età fertile, è consigliato evitare una gravidanza durante l’uso di Entyvio. Dovrà
utilizzare un adeguato metodo di contraccezione durante il trattamento e per almeno 4,5 mesi dopo
l’ultimo trattamento.
Allattamento
Informi il medico se sta allattando al seno o se intende farlo. Entyvio passa nel latte materno. Le
informazioni in merito ai possibili effetti sul bambino e sulla produzione di latte non sono sufficienti.
È necessario decidere se interrompere l’allattamento al seno o interrompere la terapia con Entyvio
tenendo in considerazione il beneficio dell’allattamento al seno per il suo bambino e il beneficio della
terapia per lei.
Guida di veicoli e utilizzo di macchinari
Questo medicinale altera lievemente la capacità di guidare o di usare strumenti o macchinari. Un
piccolo numero di pazienti ha avuto capogiri dopo la somministrazione di Entyvio. Se ciò accadesse,
non guidi né utilizzi strumenti o macchinari.
3. Come verrà somministrato Entyvio
Quanto Entyvio riceverà
Il trattamento con Entyvio è lo stesso per la colite ulcerosa, per il morbo di Crohn e per la pouchite.
La dose raccomandata è 300 mg di Entyvio somministrati nel modo seguente (vedere la tabella che
segue):
Numero del trattamento (infusione) Momento del trattamento (infusione)
Trattamento 1 0 settimane
Trattamento 2 2 settimane dopo il trattamento 1
Trattamento 3 6 settimane dopo il trattamento 1
Ulteriori trattamenti Ogni 8 settimane
Il medico potrebbe decidere di modificare questo schema di trattamento in funzione dell’efficacia che
avrà Entyvio su di lei.
- L’infusione le sarà somministrata da un medico o un infermiere, mediante fleboclisi in 1 vena di un braccio (infusione endovenosa) nell’arco di 30 minuti.
- Per le prime 2 infusioni il medico o l’infermiere la monitoreranno attentamente durante l’infusione e per circa 2 ore dopo averla completata. Per tutte le infusioni successive (dopo le prime 2), sarà monitorato durante l’infusione e per circa 1 ora dopo averla completata.
Se dimentica o salta l’infusione di Entyvio
Se dimentica o salta un appuntamento per la somministrazione dell’infusione, fissi un altro
appuntamento il prima possibile.
Se interrompe il trattamento con Entyvio
Non interrompa il trattamento con Entyvio senza prima consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Effetti indesiderati gravi
Informi il medico immediatamentese nota uno dei seguenti sintomi:
- reazioni allergiche (possono interessare fino a 1 persona su 100). Sono segni di reazione allergica: respiro ansimante o difficoltà di respirazione, orticaria, prurito della pelle, gonfiore, malessere, dolore nel punto di infusione, arrossamento della pelle;
- infezioni (possono interessare fino a 1 persona su 10). Sono segni di infezione: brividi o tremori, febbre alta o eruzione cutanea.
Altri effetti indesiderati
Informi il medico il prima possibilese nota uno dei seguenti sintomi:
Effetti indesiderati molto comuni(possono interessare più di 1 persona su 10):
- raffreddore
- dolore articolare
- mal di testa
Effetti indesiderati comuni(possono interessare fino a 1 persona su 10):
- infezione polmonare
- infezione dell’intestino crasso dovuta al batterio Clostridium difficile
- febbre
- infezione del torace
- alterazioni della funzionalità del fegato, aumento degli enzimi del fegato (indicato da esami del sangue)
- stanchezza
- tosse
- influenza
- mal di schiena
- mal di gola
- sinusite
- prurito
- eruzione cutanea e arrossamento
- dolore a gambe e/o braccia
- crampi muscolari
- debolezza muscolare
- infezione alla gola
- influenza gastrointestinale
- infezione anale
- ragadi anali
- feci dure
- stomaco gonfio
- gas intestinali
- pressione sanguigna elevata
- pizzicore o formicolio
- bruciore di stomaco
- emorroidi
- naso chiuso
- eczema
- sudorazioni notturne
- acne (brufoli)
- sanguinamento del retto
- fastidio al torace
- fuoco di S. Antonio (herpes zoster)
Effetti indesiderati non comuni(possono interessare fino a 1 persona su 100):
- arrossamento e dolorabilità dei follicoli piliferi
- infezione da lieviti alla gola e alla bocca
- infezione vaginale
- visione offuscata (perdita di nitidezza della vista)
Effetti indesiderati molto rari(possono interessare fino a 1 persona su 10.000):
- improvvisa reazione allergica grave che può causare difficoltà di respirazione, gonfiore, accelerazione del battito cardiaco, sudorazione, calo della pressione sanguigna, sensazione di stordimento, perdita di coscienza e collasso (reazione anafilattica e shock anafilattico)
- infiammazione del fegato (epatite). Segni e sintomi di epatite possono includere esami della funzionalità del fegato anormali, ingiallimento della pelle o della parte bianca degli occhi (ittero), dolore al lato destro dell’area corrispondente allo stomaco, lividi.
Non nota(la frequenza non può essere definita sulla base dei dati disponibili):
- malattia polmonare che causa respiro corto (malattia polmonare interstiziale)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti indesiderati può contribuire
a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Entyvio
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo
“Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Entyvio generalmente viene somministrato da un medico o da un infermiere e i pazienti non devono
conservare o manipolare Entyvio.
Entyvio è esclusivamente monouso.
Flaconcino non aperto:Conservare in frigorifero (2 °C – 8 °C). Conservare il flaconcino nella
confezione originale per proteggere il medicinale dalla luce.
Soluzioni ricostituite e diluite:Usare immediatamente. Qualora ciò non fosse possibile, la soluzione
ricostituita nel flaconcino può essere conservata fino a 8 ore a 2 °C-8 °C. La soluzione diluita in
soluzione per iniezione di cloruro di sodio 9 mg/mL (0,9%) può essere conservata fino a 12 ore a
temperatura ambiente non superiore ai 25 °C o fino a 24 ore in frigorifero (2 °C-8 °C), o fino a 12 ore
a temperatura ambiente e in frigorifero (2 °C-8 °C) per un periodo complessivo di 24 ore. Il periodo di
24 ore può includere fino a 8 ore a 2 °C-8 °C per la soluzione ricostituita nel flaconcino e fino a 12 ore
a 20 °C-25 °C per la soluzione diluita nella sacca per infusione, a condizione che la sacca per
infusione sia conservata in frigorifero (2 °C-8 °C) per la restante parte del periodo di 24 ore. Il tempo
di permanenza della soluzione ricostituita all’interno del flaconcino deve essere sottratto dal tempo di
permanenza ammesso per la soluzione all’interno della sacca per infusione.
Non congelare.
Non usi questo medicinale se nota la presenza di particelle nel liquido o alterazione del colore (la
soluzione dev’essere trasparente oppure opalescente, da incolore a giallina) prima della
somministrazione.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente
6. Contenuto della confezione e altre informazioni
Cosa contiene Entyvio
- Il principio attivoè vedolizumab. Ogni flaconcino contiene 300 mg di vedolizumab.
- Gli altri componentisono L-istidina, L-istidina monocloridrato, L-arginina cloridrato, saccarosio e polisorbato 80.
Descrizione dell’aspetto di Entyvio e contenuto della confezione
- Entyvio è una polvere per concentrato per soluzione per infusione di colore da bianco a biancastro, contenuta in flaconcini di vetro con tappo in gomma e cappuccio in plastica.
- Ogni confezione di Entyvio contiene un singolo flaconcino.
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharma A/S
Delta Park 45
2665 Vallensbaek Strand
Danimarca
Produttore
Takeda Austria GmbH
St. Peter-Straβe 25
4020 Linz
Austria
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: + 32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: + 359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: + 32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: + 361 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd.
Tel.: + 356 2141 9070
[email protected]
Deutschland
Takeda GmbH
Tel.: + 49 (0) 800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel.: + 31 20 203 5492
[email protected]
Eesti
Takeda Pharma OÜ
Tel.: + 372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
TAKEDA ΕΛΛΑΣ Α.Ε.
Τηλ.: + 30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel.: + 43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel.: + 34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tel.: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel.: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: + 385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel.: +40 21 335 03 91
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba
d.o.o.
Tel.: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: + 354 535 7000
[email protected]
Ireland
Takeda Products Ireland Ltd.
Tel.: 1800 937 970
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: + 421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel.: + 39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
A.POTAMITIS MEDICARE LTD
Tηλ: +357 22583333
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel.: +44 (0) 3333 000 181
[email protected]
Altre fonti d’informazioni
Questo foglio informativo è disponibile in formati adatti ai pazienti non vedenti o ipovedenti, che
possono essere richiesti al rappresentante locale del titolare dell’autorizzazione all’immissione in
commercio.
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Istruzioni per la ricostituzione e l’infusione
- 1. Utilizzare una tecnica asettica per preparare Entyvio soluzione per infusione endovenosa.
- 2. Togliere il cappuccio a strappo (flip-off) dal flaconcino e pulire con un tamponcino imbevuto di alcol. Ricostituire vedolizumab con 4,8 mL di acqua per preparazioni iniettabili sterile, a temperatura ambiente (20 °C-25 °C), utilizzando una siringa con un ago calibro 21-25 G.
- 3. Inserire l’ago nel flaconcino attraverso il centro del tappo e dirigere il flusso del liquido verso la parete del flaconcino per evitare un’eccessiva formazione di schiuma.
- 4. Far ruotare delicatamente il flaconcino per almeno 15 secondi. Non agitare in modo vigoroso, né capovolgere.
- 5. Lasciare riposare il flaconcino per 20 minuti a temperatura ambiente (20 °C-25 °C), per consentire la ricostituzione e lo smaltimento dell’eventuale schiuma; in questo intervallo di tempo il flaconcino può essere fatto roteare e ispezionato per verificare la dissoluzione. Se, dopo 20 minuti, la dissoluzione non risultasse completa proseguire per altri 10 minuti.
- 6. Ispezionare visivamente la soluzione ricostituita prima della diluizione per escludere la presenza di sostanza particellata e segni di alterazione del colore. La soluzione deve apparire trasparente o opalescente, da incolore a giallina e priva di particolato visibile. Se la soluzione ricostituita ha un colore inusuale o contiene del particolato, non deve essere somministrata.
- 7. A dissoluzione avvenuta, capovolgere delicatamente il flaconcino 3 volte.
- 8. Prelevare immediatamente 5 mL (300 mg) di Entyvio ricostituito, utilizzando una siringa con ago di calibro 21-25 G.
- 9. Aggiungere i 5 mL (300 mg) di Entyvio ricostituito a 250 mL di soluzione per iniezione sterile di cloruro di sodio 9 mg/mL (0,9%) e miscelare delicatamente la sacca per infusione (non devono essere prelevati 5 mL di soluzione per iniezione di cloruro di sodio 9 mg/mL (0,9%) dalla sacca per infusione prima dell’aggiunta di Entyvio). Non aggiungere altri medicinali alla soluzione per infusione preparata o al set per infusione endovenosa. Somministrare la soluzione per infusione nell’arco di 30 minuti.
Una volta ricostituita, la soluzione per infusione deve essere utilizzata il prima possibile.
Condizioni di conservazione
Frigorifero (2 °C-8 °C) 20 °C-25 °C
Soluzione ricostituita nel flaconcino 8 ore Non conservare
Soluzione diluita in soluzione per iniezione di
cloruro di sodio 9 mg/mL (0,9%)
24 ore 12 ore
Non congelare. Non conservare parti non utilizzate della soluzione ricostituita o della soluzione per
infusione per un successivo riutilizzo.
Ogni flaconcino è esclusivamente monouso.
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
Entyvio 108 mg soluzione iniettabile in siringa preriempita
vedolizumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Entyvio e a cosa serve
- 2. Cosa deve sapere prima di usare Entyvio
- 3. Come usare Entyvio
- 4. Possibili effetti indesiderati
- 5. Come conservare Entyvio
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Entyvio e a cosa serve
Cos’è Entyvio
Entyvio contiene il principio attivo ‘vedolizumab’. Vedolizumab appartiene a un gruppo di medicinali
biologici chiamati anticorpi monoclonali (MAb, dall’inglese Monoclonal Antibodies).
Come agisce Entyvio
Entyvio agisce bloccando una proteina presente sulla superficie dei globuli bianchi che provoca
l’infiammazione nella colite ulcerosa e nel morbo di Crohn. Questo riduce l’entità dell’infiammazione.
A cosa serve Entyvio
Entyvio è usato per trattare segni e sintomi in adulti affetti da:
- colite ulcerosa attiva da moderata a grave
- morbo di Crohn attivo da moderato a grave.
Colite ulcerosa
La colite ulcerosa è una malattia che provoca infiammazione dell’intestino crasso. Se ha la colite
ulcerosa, le saranno prima prescritti altri medicinali. Se non risponderà adeguatamente o non riuscirà a
tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e sintomi della
malattia.
Morbo di Crohn
Il morbo di Crohn è una malattia che provoca infiammazione dell’apparato digerente. Se ha il morbo
di Crohn, le saranno prima somministrati altri medicinali. Se non risponderà adeguatamente o non
riuscirà a tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e
sintomi della malattia.
2. Cosa deve sapere prima di usare Entyvio
Non usi Entyvio
- se è allergico a vedolizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione grave attiva, come TB (tubercolosi), infezione del sangue (sepsi), diarrea e vomito gravi (gastroenterite), infezione del sistema nervoso.
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima di usare Entyvio.
Informi immediatamenteil medico, il farmacista o l’infermierequando usa questo medicinale per
la prima volta, durante la terapia e tra una dose e l’altra:
- se manifesta visione offuscata, perdita della vista o visione doppia, difficoltà a parlare, debolezza ad un braccio o ad una gamba, alterazione del modo di camminare o problemi di equilibrio, intorpidimento persistente, riduzione o perdita della sensibilità, perdita di memoria o stato confusionale. Questi potrebbero essere tutti sintomi di una malattia del cervello grave e che puòprovocare la mortechiamata leucoencefalopatia multifocale progressiva ( PML, dall’inglese Progressive Multifocal Leukoencephalopathy).
- se ha, o pensa di avere, un’ infezione: sono segni di infezione brividi, tremori, tosse persistente o febbre alta. Alcune infezioni possono divenire gravi e possono provocare la morte se non trattate.
- se manifesta segni di una reazione allergica, come respiro ansimante, difficoltà di respirazione, orticaria, sensazione di prurito, gonfiore o capogiri. Per informazioni più dettagliate, vedere reazioni allergiche al paragrafo 4.
- se sta per sottoporsi a una vaccinazioneo si è recentemente sottoposto a una vaccinazione. Entyvio può influire sulla sua risposta alla vaccinazione.
- se ha un tumore, informi il medico. Il medico stabilirà se può comunque ricevere Entyvio.
- se non si sente meglio, poiché in pazienti che presentano morbo di Crohn molto attivo, l’azione di vedolizumab potrebbe richiedere fino a 14 settimane per manifestarsi.
Bambini e adolescenti
L’uso di Entyvio non è raccomandato in bambini o adolescenti (sotto i 18 anni di età), in
considerazione della mancanza di dati sull’uso di questo medicinale in questa fascia d’età.
Altri medicinali ed Entyvio
Informi il medico, il farmacista o l’infermiere se sta assumendo, ha recentemente assunto o potrebbe
assumere qualsiasi altro medicinale.
- Entyvio non deve essere somministrato insieme ad altri medicinali biologici che sopprimono il sistema immunitario, poiché gli effetti di questa associazione non sono noti.
Informi il medico se ha già assunto in precedenza:
- natalizumab (un medicinale per la sclerosi multipla) o
- rituximab (un medicinale per alcuni tipi di tumore e l’artrite reumatoide). Il medico stabilirà se lei può comunque ricevere Entyvio.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
Gravidanza
Gli effetti di Entyvio sulle donne in stato di gravidanza non sono noti. Questo medicinale non è
pertanto raccomandato durante la gravidanza. Lei e il medico dovete stabilire se il beneficio per lei
superi chiaramente il potenziale rischio per lei e per il bambino.
Se è una donna in età fertile, è consigliato evitare una gravidanza durante l’uso di Entyvio. Dovrà
utilizzare un adeguato metodo di contraccezione durante il trattamento e per almeno 4,5 mesi dopo
l’ultimo trattamento.
Allattamento
Informi il medico se sta allattando al seno o se intende farlo. Entyvio passa nel latte materno. Le
informazioni in merito ai possibili effetti sul bambino e sulla produzione di latte non sono sufficienti.
È necessario decidere se interrompere l’allattamento al seno o interrompere la terapia con Entyvio
tenendo in considerazione il beneficio dell’allattamento al seno per il suo bambino e il beneficio della
terapia per lei.
Guida di veicoli e utilizzo di macchinari
Questo medicinale altera lievemente la capacità di guidare o di usare strumenti o macchinari. Un
piccolo numero di pazienti ha avuto capogiri dopo la somministrazione di Entyvio. Se ciò accadesse,
non guidi né utilizzi strumenti o macchinari.
Entyvio 108 mg soluzione iniettabile contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè è essenzialmente ‘senza
sodio’.
3. Come usare Entyvio
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Lei o chi si occupa di lei riceverà un’adeguata formazione su come effettuare le iniezioni sotto la pelle
di Entyvio (iniezioni sottocutanee).
Quanto Entyvio riceverà
Il trattamento con Entyvio è lo stesso per la colite ulcerosa e per il morbo di Crohn.
La dose raccomandata è 108 mg di Entyvio somministrati mediante iniezione sottocutanea una volta
ogni 2 settimane.
- All’inizio del trattamento, il medico le somministrerà le dosi iniziali di Entyvio mediante fleboclisi in una vena del braccio (infusione endovenosa) nell’arco di 30 minuti circa.
- Dopo almeno 2 infusioni endovenose, potrà iniziare a ricevere Entyvio mediante un’iniezione sottocutanea. La prima iniezione sottocutanea verrà somministrata nel giorno in cui è stata fissata l’infusione endovenosa successiva e, successivamente, ogni 2 settimane.
Come iniettare Entyvio
Le iniezioni sottocutanee possono essere eseguite da lei stesso/a o da chi si occupa di lei, previa
formazione su come fare. Le istruzioni sono disponibili alla fine di questo foglio.
Se dimentica o salta l’iniezione di Entyvio
Se dimentica o salta una dose, proceda all’iniezione della dose successiva il prima possibile e,
successivamente, ogni 2 settimane.
Se interrompe il trattamento con Entyvio
Non interrompa il trattamento con Entyvio senza prima consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Effetti indesiderati gravi
Informi il medico immediatamentese nota uno dei seguenti sintomi:
- reazioni allergiche (possono interessare fino a 1 persona su 100). Sono segni di reazione allergica: respiro ansimante o difficoltà di respirazione, orticaria, prurito della pelle, gonfiore, malessere, arrossamento della pelle;
- infezioni (possono interessare fino a 1 persona su 10). Sono segni di infezione: brividi o tremori, febbre alta o eruzione cutanea.
Altri effetti indesiderati
Informi il medico il prima possibilese nota uno dei seguenti sintomi:
Effetti indesiderati molto comuni(possono interessare più di 1 persona su 10)
- raffreddore
- dolore articolare
- mal di testa
Effetti indesiderati comuni(possono interessare fino a 1 persona su 10)
- infezione polmonare
- infezione dell’intestino crasso dovuta al batterio Clostridium difficile
- febbre
- infezione del torace
- alterazioni della funzionalità del fegato, aumento degli enzimi del fegato (indicato da esami del sangue)
- stanchezza
- tosse
- influenza
- mal di schiena
- mal di gola
- sinusite
- prurito
- eruzione cutanea e arrossamento
- dolore a gambe e/o braccia
- crampi muscolari
- debolezza muscolare
- infezione alla gola
- influenza gastrointestinale
- infezione anale
- ragadi anali
- feci dure
- stomaco gonfio
- gas intestinali
- pressione sanguigna elevata
- pizzicore o formicolio
- bruciore di stomaco
- emorroidi
- naso chiuso
- eczema
- sudorazioni notturne
- acne (brufoli)
- reazioni nel punto di iniezione (inclusi dolore, gonfiore, arrossamento o prurito)
- fuoco di S. Antonio (herpes zoster)
Effetti indesiderati non comuni(possono interessare fino a 1 persona su 100):
- arrossamento e dolorabilità dei follicoli piliferi
- infezione da lieviti alla gola e alla bocca
- infezione vaginale
- visione offuscata (perdita di nitidezza della vista)
Effetti indesiderati molto rari(possono interessare fino a 1 persona su 10.000):
- improvvisa reazione allergica grave che può causare difficoltà di respirazione, gonfiore, accelerazione del battito cardiaco, sudorazione, calo della pressione sanguigna, sensazione di stordimento, perdita di coscienza e collasso (reazione anafilattica e shock anafilattico)
- infiammazione del fegato (epatite). Segni e sintomi di epatite possono includere esami della funzionalità del fegato anormali, ingiallimento della pelle o della parte bianca degli occhi (ittero), dolore al lato destro dell’area corrispondente allo stomaco, lividi.
Non nota(la frequenza non può essere definita sulla base dei dati disponibili):
- malattia polmonare che causa respiro corto (malattia polmonare interstiziale)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Entyvio
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo “Scad”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Entyvio è esclusivamente monouso.
- Conservare in frigorifero (2 °C - 8 °C). Conservare la/le siringa preriempita/siringhe preriempite nella confezione originale per proteggere il medicinale dalla luce. Se necessario, una siringa preriempita può essere tenuta fuori dal frigorifero al riparo dalla luce a temperatura ambiente (fino a 25 °C) per un massimo di 7 giorni. Non utilizzare la siringa preriempita se è rimasta fuori dal frigorifero per oltre 7 giorni.
- Non congelare. Non esporre alla luce solare diretta.
- Non usi questo medicinale se nota la presenza di particelle nel liquido o alterazione del colore (il medicinale dev’essere da incolore a giallo) prima della somministrazione.
- Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Entyvio
- Il principio attivoè vedolizumab. Ogni siringa preriempita contiene 108 mg di vedolizumab.
- Gli altri componentisono acido citrico monoidrato, citrato di sodio diidrato, L-istidina, L-istidina monocloridrato, L-arginina cloridrato, polisorbato 80 e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Entyvio e contenuto della confezione
- Entyvio è una soluzione iniettabile da incolore a gialla, contenuta in una siringa preriempita di vetro con un dispositivo di sicurezza che si attiva per estensione e blocca l’ago all’interno della protezione una volta completata l’iniezione. La siringa è provvista di un cappuccio copriago in gomma racchiuso in un involucro in plastica e di tappo in gomma.
- Entyvio è disponibile in scatole contenenti 1 o 2 siringhe preriempite e in confezioni multiple da 6 (6x1) siringhe preriempite. È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharma A/S
Delta Park 45
2665 Vallensbaek Strand
Danimarca
Produttore
Takeda Austria GmbH
St. Peter-Straβe 25
4020 Linz
Austria
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
Lietuva
Takeda, UAB
Tel.: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: + 359 2 958 27 36
[email protected]
België/Belgique/Belgien
Takeda Belgium NV
Tél./Tel.: + 32 2 464 06 11
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: + 32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: + 361 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel.: + 356 21419070
[email protected]
Deutschland
Takeda GmbH
Tel.: + 49 (0) 800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel.: + 31 20 203 5492
[email protected]
Eesti
Takeda Pharma OÜ
Tel.: + 372 6177 669
[email protected]
Norge
Takeda AS
Tlf.: +47 800 800 30
[email protected]
Ελλάδα
TAKEDA ΕΛΛΑΣ Α.Ε.
Τηλ.: + 30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: + 43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: + 34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.: +48223062447
[email protected]
France
Takeda France SAS
Tel: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel.: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: + 385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel.: + 40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd.
Tel.: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba
d.o.o.
Tel: +386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel.: + 421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel.: + 39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh./Tel.: 0800 774 051
[email protected]
Κύπρος
A.POTAMITIS MEDICARE LTD
Tηλ: +357 22583333
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel.: + 371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel.: +44 (0) 3333 000 181
[email protected]
Altre fonti d’informazioni
Questo foglio informativo è disponibile in formati adatti ai pazienti non vedenti o ipovedenti, che
possono essere richiesti al rappresentante locale del titolare dell’autorizzazione all’immissione in
commercio.
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Istruzioni per l’uso:
Legga e segua queste istruzioni prima di procedere all’iniezione. Il medico, il farmacista o l’infermiere
le mostrerà come usare la siringa preriempita di Entyvio prima che lei la utilizzi per la prima volta.
La sua siringa preriempita monodose di Entyvio
Prima dell’uso
Protezione per l’ago Medicinale Ago
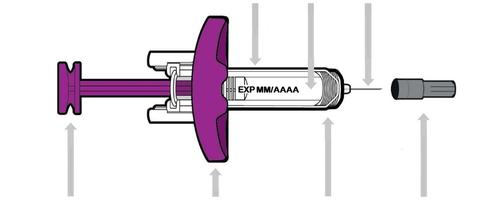
Stantuffo viola Base di appoggio
per le dita
Molla Cappuccio dell’ago
Dopo l’uso
Protezione per l’ago
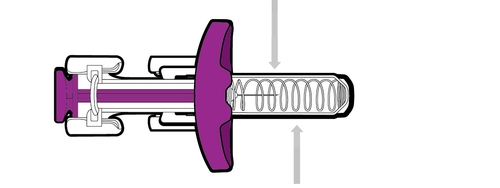
Ago coperto
Ogni siringa preriempita è provvista di una protezione per l’ago, la quale copre automaticamente l’ago
dopo che lo stantuffo viene spinto fino in fondo e poi rilasciato.
- 1)Posizioni tutto il necessario per l’iniezione su una superficiepiana e pulita
- Prenda la scatola della siringa preriempita dal frigorifero.
- Se sta aprendo la scatola per la prima volta, la controlli per assicurarsi che sia sigillata. Nonusi la/le siringa preriempita/siringhe preriempite se uno qualsiasi dei sigilli sulla scatola è rotto o mancante.
- Controlli la data di scadenza (Scad.) sulla scatola. Nonusare dopo la data di scadenza indicata sulla scatola.
- Prenda una siringa preriempita dalla scatola. Tenga le siringhe preriempite eventualmente rimanenti nella scatola in frigorifero.
- Attenda 30 minutiaffinché la siringa preriempita raggiunga la temperatura ambiente.
- Nonriscaldi la siringa preriempita in altri modi.
- Nonesponga il medicinale alla luce solare diretta.
- Nonestragga la siringa preriempita dal vassoietto prima di essere pronto/a a procedere con l’iniezione.
- Le serviranno anche:
- Tampone imbevuto di alcol
- Ovatta o garza
- Contenitore per oggetti appuntiti Attendere 30 minuti

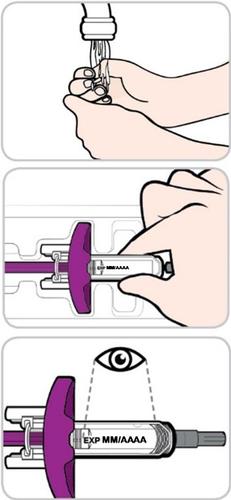
- 2)Apra e controlli la siringa preriempita
- Si lavi le mani.
- Rimuova la pellicola di carta dal vassoietto ed estragga la siringa preriempita afferrandola dalla parte centrale.
- Nontocchi né estragga la siringa afferrandola dallo stantuffo viola.
- Nonrimuova il cappuccio dell’ago fino a quando non sarà pronto/a a procedere con l’iniezione.
- Ispezioni la siringa preriempita per escludere eventuali danni.
- Nonusi la siringa preriempita se qualche componente risulta danneggiato.
- Controlli la data di scadenza sulla siringa preriempita.
- Nonusi la siringa preriempita dopo la data di scadenza riportata su di essa.
- Controlli il medicinale. Dovrà essere da incolore a giallo.
- Nonusi la siringa preriempita se il medicinale appare torbido o vi sono delle particelle in sospensione.
- Potrebbe vedere delle bolle d’aria nella siringa. Questo è normale.
- Nontenti di rimuovere le bolle d’aria dalla siringa preriempita.
- Nonagiti la siringa preriempita.
- 3)Prepari la sede di iniezione
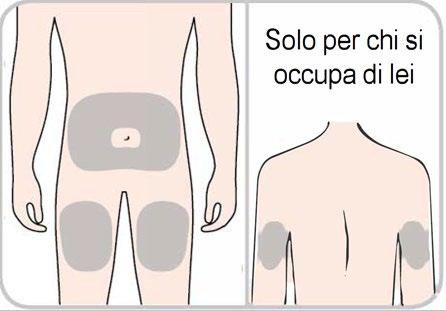
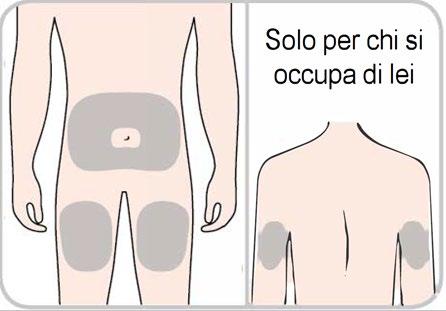
- Scelga una sede di iniezionesulla pelle nuda tra 1 delle opzioni seguenti:
- Parte anteriore della coscia, o
- Area dello stomaco (addome), fatta eccezione per l’area che si estende per 5 cm intorno all’ombelico, o
- Parte posteriore del braccio (solo se l’iniezione sarà somministrata da chi si occupa di lei).
- Per ogni iniezione usi una nuova sede d’iniezione o un’area diversa nella stessa sede d’iniezione.
- Nonesegua l’iniezione su nei, cicatrici, lividi o aree in cui la pelle è dolorante, dura, arrossata o lesionata.
- Pulisca la sede scelta con un tampone imbevuto di alcol. Lasci asciugare la pelle.
- Nontocchi nuovamente quest’area prima di procedere all’iniezione.
- 4) Inietti Entyvio
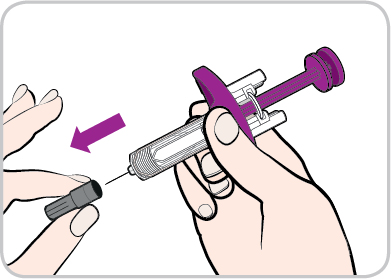
- Rimuova il cappuccio dell’ago con un movimento in linea retta.
- Nontocchi né tiri indietro lo stantuffo viola.
- Potrebbe vedere una goccia di liquido sulla punta dell’ago. Questo è normale.
- Nontocchi l’ago e non rimetta il cappuccio sull’ago.
- Nonusi la siringa preriempita se è caduta.
- Nonusi una siringa preriempita il cui ago sia piegato o rotto.
- Getti via il cappuccio.
- Tenga la siringa preriempita con 1 mano e prenda una plica di pelle nella sede di iniezione con l’altra mano.
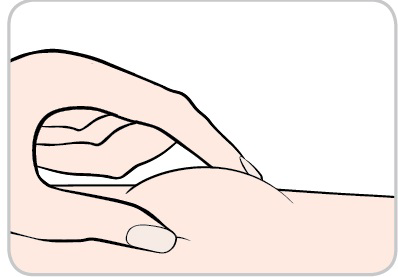
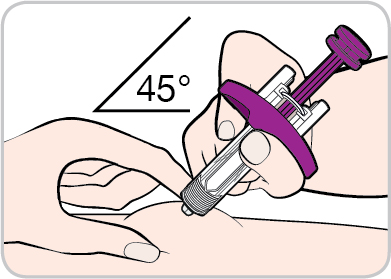
- Mantenga la plica di pelle fino al termine dell’iniezione.
- Inserisca l’ago con un angolo di circa 45 gradispingendolo fino in fondo nella pelle.
- Spinga lo stantuffo fino in fondoper iniettare tutto il medicinale.
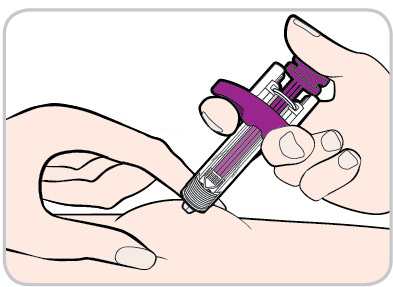
- Estragga l’ago dalla pelle mantenendo premuto lo stantuffo.
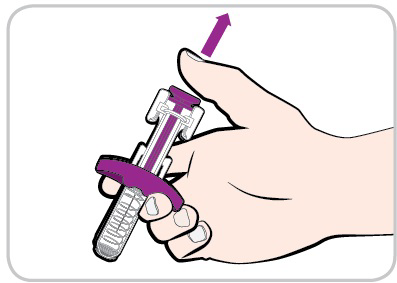
- Stacchi il pollice dallo stantuffoper consentire al dispositivo di protezione di coprire l’ago.
- Potrebbe vedere una piccola quantità di sangue nella sede di iniezione. In tal caso, prema dell’ovatta o della garza sulla cute.
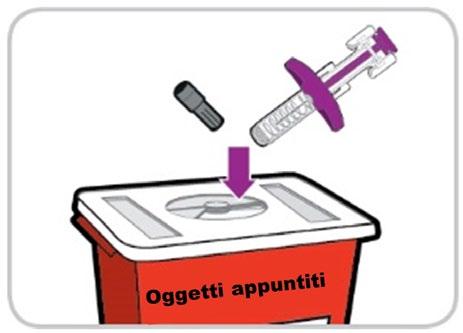
- 5) Getti via il materiale utilizzato
- Riponga la siringa preriempita usata in un contenitore resistente alla perforazione, come un contenitore per oggetti appuntiti, immediatamente dopo l’uso.
- Getti via il contenitore per oggetti appuntiti secondo la normativa locale.
- Il resto del materiale può essere gettato nei rifiuti domestici.
Entyvio 108 mg soluzione iniettabile in penna preriempita
vedolizumab
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Entyvio e a cosa serve
- 2. Cosa deve sapere prima di usare Entyvio
- 3. Come usare Entyvio
- 4. Possibili effetti indesiderati
- 5. Come conservare Entyvio
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Entyvio e a cosa serve
Cos’è Entyvio
Entyvio contiene il principio attivo ‘vedolizumab’. Vedolizumab appartiene a un gruppo di medicinali
biologici chiamati anticorpi monoclonali (MAb, dall’inglese Monoclonal Antibodies).
Come agisce Entyvio
Entyvio agisce bloccando una proteina presente sulla superficie dei globuli bianchi che provoca
l’infiammazione nella colite ulcerosa e nel morbo di Crohn. Questo riduce l’entità dell’infiammazione.
A cosa serve Entyvio
Entyvio è usato per trattare segni e sintomi in adulti affetti da:
- colite ulcerosa attiva da moderata a grave
- morbo di Crohn attivo da moderato a grave.
Colite ulcerosa
La colite ulcerosa è una malattia che provoca infiammazione dell’intestino crasso. Se ha la colite
ulcerosa, le saranno prima prescritti altri medicinali. Se non risponderà adeguatamente o non riuscirà a
tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e sintomi della
malattia.
Morbo di Crohn
Il morbo di Crohn è una malattia che provoca infiammazione dell’apparato digerente. Se ha il morbo
di Crohn, le saranno prima somministrati altri medicinali. Se non risponderà adeguatamente o non
riuscirà a tollerare questi medicinali, il medico potrebbe prescriverle Entyvio per ridurre segni e
sintomi della malattia.
2. Cosa deve sapere prima di usare Entyvio
Non usi Entyvio
- se è allergico a vedolizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
- se ha un’infezione grave attiva, come TB (tubercolosi), infezione del sangue (sepsi), diarrea e vomito gravi (gastroenterite), infezione del sistema nervoso.
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima di usare Entyvio.
Informi immediatamenteil medico, il farmacista o l’infermierequando usa questo medicinale per
la prima volta, durante la terapia e tra una dose e l’altra:
- se manifesta visione offuscata, perdita della vista o visione doppia, difficoltà a parlare, debolezza ad un braccio o ad una gamba, alterazione del modo di camminare o problemi di equilibrio, intorpidimento persistente, riduzione o perdita della sensibilità, perdita di memoria o stato confusionale. Questi potrebbero essere tutti sintomi di una malattia del cervello grave e che puòprovocare la mortechiamata leucoencefalopatia multifocale progressiva ( PML, dall’inglese Progressive Multifocal Leukoencephalopathy).
- se ha, o pensa di avere, un’ infezione: sono segni di infezione brividi, tremori, tosse persistente o febbre alta. Alcune infezioni possono divenire gravi e possono provocare la morte se non trattate.
- se manifesta segni di una reazione allergica, come respiro ansimante, difficoltà di respirazione, orticaria, sensazione di prurito, gonfiore o capogiri. Per informazioni più dettagliate, vedere reazioni allergiche al paragrafo 4.
- se sta per sottoporsi a una vaccinazioneo si è recentemente sottoposto a una vaccinazione. Entyvio può influire sulla sua risposta alla vaccinazione.
- se ha un tumore, informi il medico. Il medico stabilirà se può comunque ricevere Entyvio.
- se non si sente meglio, poiché in pazienti che presentano morbo di Crohn molto attivo, l’azione di vedolizumab potrebbe richiedere fino a 14 settimane per manifestarsi.
Bambini e adolescenti
L’uso di Entyvio non è raccomandato in bambini o adolescenti (sotto i 18 anni di età), in
considerazione della mancanza di dati sull’uso di questo medicinale in questa fascia d’età.
Altri medicinali ed Entyvio
Informi il medico, il farmacista o l’infermiere se sta assumendo, ha recentemente assunto o potrebbe
assumere qualsiasi altro medicinale.
- Entyvio non deve essere somministrato insieme ad altri medicinali biologici che sopprimono il sistema immunitario, poiché gli effetti di questa associazione non sono noti.
Informi il medico se ha già assunto in precedenza:
- natalizumab (un medicinale per la sclerosi multipla) o
- rituximab (un medicinale per alcuni tipi di tumore e l’artrite reumatoide). Il medico stabilirà se lei può comunque ricevere Entyvio.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
Gravidanza
Gli effetti di Entyvio sulle donne in stato di gravidanza non sono noti. Questo medicinale non è
pertanto raccomandato durante la gravidanza. Lei e il medico dovete stabilire se il beneficio per lei
superi chiaramente il potenziale rischio per lei e per il bambino.
Se è una donna in età fertile, è consigliato evitare una gravidanza durante l’uso di Entyvio. Dovrà
utilizzare un adeguato metodo di contraccezione durante il trattamento e per almeno 4,5 mesi dopo
l’ultimo trattamento.
Allattamento
Informi il medico se sta allattando al seno o se intende farlo. Entyvio passa nel latte materno. Le
informazioni in merito ai possibili effetti sul bambino e sulla produzione di latte non sono sufficienti.
È necessario decidere se interrompere l’allattamento al seno o interrompere la terapia con Entyvio
tenendo in considerazione il beneficio dell’allattamento al seno per il suo bambino e il beneficio della
terapia per lei.
Guida di veicoli e utilizzo di macchinari
Questo medicinale altera lievemente la capacità di guidare o di usare strumenti o macchinari. Un
piccolo numero di pazienti ha avuto capogiri dopo la somministrazione di Entyvio. Se ciò accadesse,
non guidi né utilizzi strumenti o macchinari.
Entyvio 108 mg soluzione iniettabile contiene sodio
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè è essenzialmente ‘senza
sodio’.
3. Come usare Entyvio
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha
dubbi consulti il medico o il farmacista.
Lei o chi si occupa di lei riceverà un’adeguata formazione su come effettuare le iniezioni sotto la pelle
di Entyvio (iniezioni sottocutanee).
Quanto Entyvio riceverà
Il trattamento con Entyvio è lo stesso per la colite ulcerosa e per il morbo di Crohn.
La dose raccomandata è 108 mg di Entyvio somministrati mediante iniezione sottocutanea una volta
ogni 2 settimane.
- All’inizio del trattamento, il medico le somministrerà le dosi iniziali di Entyvio mediante fleboclisi in una vena del braccio (infusione endovenosa) nell’arco di 30 minuti circa.
- Dopo almeno 2 infusioni endovenose, potrà iniziare a ricevere Entyvio mediante iniezione sottocutanea. La prima iniezione sottocutanea verrà somministrata nel giorno in cui è stata fissata l’infusione endovenosa successiva e, successivamente, ogni 2 settimane.
Come iniettare Entyvio
Le iniezioni sottocutanee possono essere eseguite da lei stesso/a o da chi si occupa di lei, previa
formazione su come fare. Le istruzioni sono disponibili alla fine di questo foglio.
Se dimentica o salta l’iniezione di Entyvio
Se dimentica o salta una dose, proceda all’iniezione della dose successiva il prima possibile e,
successivamente, ogni 2 settimane.
Se interrompe il trattamento con Entyvio
Non interrompa il trattamento con Entyvio senza prima consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico, al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Effetti indesiderati gravi
Informi il medico immediatamentese nota uno dei seguenti sintomi:
- reazioni allergiche (possono interessare fino a 1 persona su 100). Sono segni di reazione allergica: respiro ansimante o difficoltà di respirazione, orticaria, prurito della pelle, gonfiore, malessere, arrossamento della pelle;
- infezioni (possono interessare fino a 1 persona su 10). Sono segni di infezione: brividi o tremori, febbre alta o eruzione cutanea.
Altri effetti indesiderati
Informi il medico il prima possibilese nota uno dei seguenti sintomi:
Effetti indesiderati molto comuni(possono interessare più di 1 persona su 10):
- raffreddore
- dolore articolare
- mal di testa
Effetti indesiderati comuni(possono interessare fino a 1 persona su 10):
- infezione polmonare
- infezione dell’intestino crasso dovuta al batterio Clostridium difficile
- febbre
- infezione del torace
- alterazioni della funzionalità del fegato, aumento degli enzimi del fegato (indicato da esami del sangue)
- stanchezza
- tosse
- influenza
- mal di schiena
- mal di gola
- sinusite
- prurito
- eruzione cutanea e arrossamento
- dolore a gambe e/o braccia
- crampi muscolari
- debolezza muscolare
- infezione alla gola
- influenza gastrointestinale
- infezione anale
- ragadi anali
- feci dure
- stomaco gonfio
- gas intestinali
- pressione sanguigna elevata
- pizzicore o formicolio
- bruciore di stomaco
- emorroidi
- naso chiuso
- eczema
- sudorazioni notturne
- acne (brufoli)
- reazioni nel punto di iniezione (inclusi dolore, gonfiore, arrossamento o prurito)
- fuoco di S. Antonio (herpes zoster)
Effetti indesiderati non comuni(possono interessare fino a 1 persona su 100):
- arrossamento e dolorabilità dei follicoli piliferi
- infezione da lieviti alla gola e alla bocca
- infezione vaginale
- visione offuscata (perdita di nitidezza della vista)
Effetti indesiderati molto rari(possono interessare fino a 1 persona su 10.000):
- improvvisa reazione allergica grave che può causare difficoltà di respirazione, gonfiore, accelerazione del battito cardiaco, sudorazione, calo della pressione sanguigna, sensazione di stordimento, perdita di coscienza e collasso (reazione anafilattica e shock anafilattico)
- infiammazione del fegato (epatite). Segni e sintomi di epatite possono includere esami della funzionalità del fegato anormali, ingiallimento della pelle o della parte bianca degli occhi (ittero), dolore al lato destro dell’area corrispondente allo stomaco, lividi.
Non nota(la frequenza non può essere definita sulla base dei dati disponibili):
- malattia polmonare che causa respiro corto (malattia polmonare interstiziale)
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Entyvio
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola e sull’etichetta dopo “Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
- Entyvio è esclusivamente monouso.
- Conservare in frigorifero (2 °C - 8 °C). Conservare la/le penna preriempita/penne preriempite nella confezione originale per proteggere il medicinale dalla luce. Se necessario, una penna preriempita può essere tenuta fuori dal frigorifero al riparo dalla luce a temperatura ambiente (fino a 25 °C) per un massimo di 7 giorni. Non utilizzare la penna preriempita se è rimasta fuori dal frigorifero per oltre 7 giorni.
- Non congelare. Non esporre alla luce solare diretta.
- Non usi questo medicinale se nota la presenza di particelle nel liquido o alterazione del colore (il medicinale dev’essere da incolore a giallo) prima della somministrazione.
- Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Entyvio
- Il principio attivoè vedolizumab. Ogni penna preriempita contiene 108 mg di vedolizumab.
- Gli altri componentisono acido citrico monoidrato, citrato di sodio diidrato, L-istidina, L-istidina monocloridrato, L-arginina cloridrato, polisorbato 80 e acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Entyvio e contenuto della confezione
- Entyvio è una soluzione iniettabile da incolore a gialla, contenuta in una penna preriempita di vetro con una protezione per l’ago automatica che si estende e copre l’ago una volta rimosso il dispositivo dalla sede di iniezione.
- Entyvio è disponibile in scatole contenenti 1 o 2 penne preriempite e in confezioni multiple da 6 (6x1) penne preriempite. È possibile che non tutte le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio
Takeda Pharma A/S
Delta Park 45
2665 Vallensbaek Strand
Danimarca
Produttore
Takeda Austria GmbH
St. Peter-Straβe 25
4020 Linz
Austria
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
Lietuva
Takeda, UAB
Tel.: +370 521 09 070
[email protected]
България
Такеда България ЕООД
Тел.: + 359 2 958 27 36
[email protected]
België/Belgique/Belgien
Takeda Belgium NV
Tél./Tel.: + 32 2 464 06 11
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: + 32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel.: + 361 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
[email protected]
Malta
Drugsales Ltd
Tel.: + 356 21 419070
[email protected]
Deutschland
Takeda GmbH
Tel.: + 49 (0) 800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel.: + 31 20 203 5492
[email protected]
Eesti
Takeda Pharma OÜ
Tel.: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: +47 800 800 30
[email protected]
Ελλάδα
TAKEDA ΕΛΛΑΣ Α.Ε.
Τηλ.: + 30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel.: + 43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel.: + 34 917 90 42 22
[email protected]
Polska
Takeda Pharma Sp. z o.o.
Tel.:+48223062447
[email protected]
France
Takeda France SAS
Tel.: + 33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel.: + 351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: + 385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel.: + 40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd.
Tel.: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba
d.o.o.
Tel.: + 386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel.: + 421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel.: + 39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh./Tel.: 0800 774 051
[email protected]
Κύπρος
A.POTAMITIS MEDICARE LTD
Tηλ: +357 22583333
[email protected]
Sverige
Takeda Pharma AB
Tel.: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel.: +371 67840082
[email protected]
United Kingdom (Northern Ireland)
Takeda UK Ltd
Tel.: +44 (0) 3333 000 181
[email protected]
Altre fonti d’informazioni
Questo foglio informativo è disponibile in formati adatti ai pazienti non vedenti o ipovedenti, che
possono essere richiesti al rappresentante locale del titolare dell’autorizzazione all’immissione in
commercio.
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Istruzioni per l’uso:
Legga e segua queste istruzioni prima di procedere all’iniezione. Il medico, il farmacista o l’infermiere
le mostrerà come usare la penna preriempita di Entyvio prima che lei la utilizzi per la prima volta.
La sua penna preriempita monodose di Entyvio
Prima dell’uso
Tappo viola Finestra di osservazione
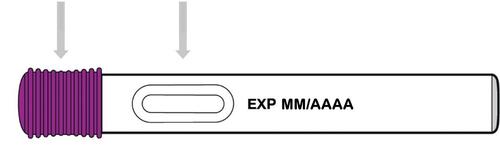
Dopo l’uso
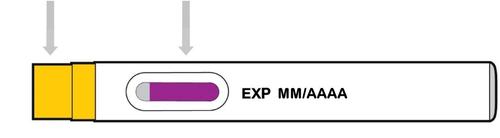
Protezione per l’ago
gialla
Finestra di osservazione
(iniezione completata)
- 1)Posizioni tutto il necessario per l’iniezione su una superficiepiana e pulita
- Prenda la scatola della penna preriempita dal frigorifero.
- Se sta aprendo la scatola per la prima volta, la controlli per assicurarsi che sia sigillata. Nonusi la/le penna preriempita/penne preriempite se uno qualsiasi dei sigilli sulla scatola è rotto o mancante.
- Controlli la data di scadenza (Scad.) sulla scatola. Nonusare dopo la data di scadenza indicata sulla scatola.
- Prenda una penna preriempita dalla scatola. Tenga le penne preriempite eventualmente rimanenti nella scatola in frigorifero.
- Attenda 30 minutiaffinché la penna preriempita raggiunga la temperatura ambiente.
- Nonriscaldi la penna preriempita in altri modi.
- Nonesponga il medicinale alla luce solare diretta.
- Nonestragga la penna preriempita dal vassoietto prima di essere pronto/a a procedere all’iniezione.
- Le serviranno anche:
- Tampone imbevuto di alcol
- Ovatta o garza
- Contenitore per oggetti appuntiti Attendere 30 minuti

- 2)Apra e controlli la penna preriempita
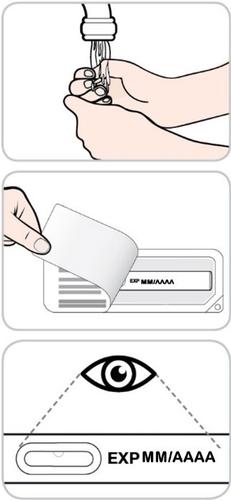
- Si lavi le mani.
- Rimuova la pellicola di carta dal vassoietto ed estragga la penna preriempita.
- Ispezioni la penna preriempita per escludere eventuali danni.
- Nonusi la penna preriempita se qualche componente risulta danneggiato.
- Controlli la data di scadenza sulla penna preriempita.
- Nonusi la penna preriempita dopo la data di scadenza riportata su di essa.
- Controlli il medicinale. Dovrà essere da incolore a giallo.
- Nonusi la penna preriempita se il medicinale appare torbido o vi sono delle particelle in sospensione.
- Potrebbe vedere delle bolle d’aria nella penna preriempita. Questo è normale.
- Nonagiti la penna preriempita.
- 3)Prepari la sede di iniezione
- Scelga una sede di iniezionesulla pelle nuda tra 1 delle opzioni seguenti:
- Parte anteriore della coscia, o
- Area dello stomaco (addome), fatta eccezione per l’area che si estende per 5 cm intorno all’ombelico, o
- Parte posteriore del braccio (solo se l’iniezione sarà somministrata da chi si occupa di lei).
- Per ogni iniezione usi una nuova sede d’iniezione o un’area diversa nella stessa sede d’iniezione.
- Nonesegua l’iniezione su nei, cicatrici, lividi o aree in cui la pelle è dolorante, dura, arrossata o lesionata.
- Pulisca la sede scelta con un tampone imbevuto di alcol. Lasci asciugare la pelle.
- Nontocchi nuovamente quest’area prima di procedere all’iniezione.
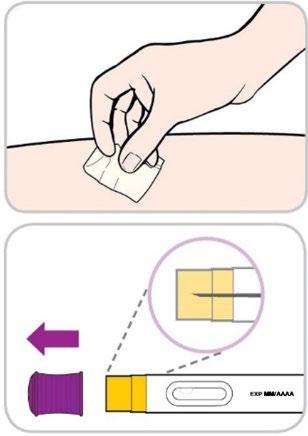
- Rimuova il tappo viola e lo getti via.
- Nontocchi né prema con il pollice, le altre dita o la mano sulla protezione gialla per l’ago.
- Nonrimetta il tappo sulla penna preriempita.
- Nonusi la penna preriempita se è caduta.
- 4) Inietti Entyvio
- Tenga la penna preriempita in modo da vedere la finestra di osservazione.
- Posizioni la penna preriempita a 90 gradisulla sede di iniezione. PREMERE
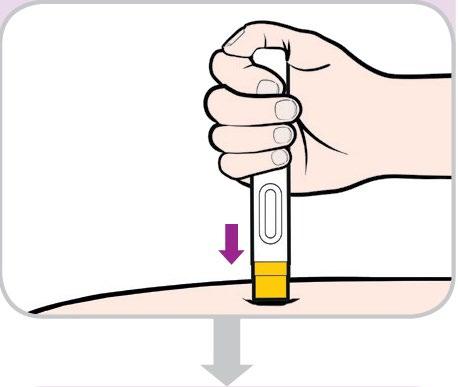
- Si accerti che l’estremità gialla sia rivolta verso la sede diiniezione.
- Nonprema fino a quando non sarà pronto/a a procedere con l’iniezione.
- Spinga la penna preriempita fino in fondoper iniziare l’iniezione.
- Tenga premuto e conti fino a 10continuando a spingere con pressione costante. In questo modo tutto il medicinale sarà iniettato. TENERE PREMUTO(contare fino a 10)
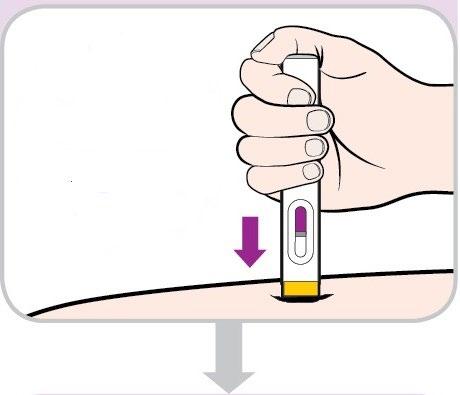
- Potrebbe sentire 2 clic, uno all’inizio e uno alla fine dell’iniezione.
- Verifichi che la finestra di osservazione si sia riempita dicolore violaprima di smettere di premere.
- Vedrà una piccola porzione grigia nella finestra di osservazione. Questo è normale.
- Stacchi la penna preriempita dalla sede di iniezione. CONFERMARE
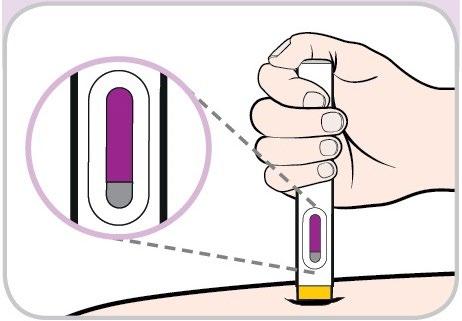
- La protezione gialla per l’ago scenderà a coprire l’ago.
- Se la finestra di osservazione non si è riempita completamente di viola, chiami il medico, il farmacista o l’infermiere. Potrebbe non aver ricevuto l’intera dose del medicinale.
- Potrebbe vedere una piccola quantità di sangue nella sede di iniezione. In tal caso, prema dell’ovatta o della garza sulla cute.
- 5) Getti via il materiale utilizzato
- Riponga la penna preriempita usata in un contenitore resistente alla perforazione, come un contenitore per oggetti appuntiti, immediatamente dopo l’uso.
- Getti via il contenitore per oggetti appuntiti secondo la normativa locale.
- Il resto del materiale può essere gettato nei rifiuti domestici.
ALLEGATO IV
CONCLUSIONI SCIENTIFICHE E MOTIVAZIONI PER LA VARIAZIONE DEI TERMINI
DELLE AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) del Rapporto periodico di
aggiornamento sulla sicurezza ( Periodic Safety Update Report, PSUR) per vedolizumab, le
conclusioni scientifiche del PRAC sono le seguenti:
Alla luce dei dati disponibili sul danno epatico emersi da studi clinici, dalla letteratura, da segnalazioni
spontanee che includono casi di stretta relazione temporale, un dechallengee/o un rechallenge
positivo, il PRAC ritiene che una relazione causale tra vedolizumab e aumento degli enzimi epatici ed
epatite sia da considerarsi almeno una possibilità ragionevole.
Reazioni di ipersensibilità si sono verificate dopo il passaggio dalla somministrazione s.c. alla
somministrazione e.v. in 8 casi spontanei segnalati durante il periodo di questo PSUR e sono state
identificate 4 pubblicazioni pertinenti nell’ambito di un’indagine nazionale su vedolizumab condotta
in Francia da un centro regionale di farmacovigilanza. Questi casi hanno segnalato la comparsa di
eventi avversi correlati a reazioni immediate di ipersensibilità quando vedolizumab e.v. è stato
reintrodotto dopo un trattamento s.c.. Sei di questi casi sono risultati gravi, con un caso di reazione
anafilattica, e 2 non gravi. Il PRAC ritiene che nell’avvertenza esistente sull’ipersensibilità nel
paragrafo 4.4 dell’RCP per la formulazione e.v. si debba fare menzione dei casi verificatisi durante
tale passaggio, al fine di ribadire l’avvertenza esistente sulla necessità di tenere i pazienti sotto
osservazione per eventuali segni di reazioni di ipersensibilità.
Il PRAC ha concluso che le informazioni dei prodotti contenenti vedolizumab debbano essere
modificate di conseguenza.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
( Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione.
Motivazioni per la variazione dei termini delle autorizzazioni all’immissione in commercio
Sulla base delle conclusioni scientifiche su vedolizumab il CHMP ritiene che il rapporto
beneficio/rischio dei medicinali contenenti vedolizumab sia invariato fatte salve le modifiche proposte
alle informazioni del prodotto.
Il CHMP raccomanda la variazione dei termini delle autorizzazioni all’immissione in commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a ENTYVIOForma farmaceutica: Polvere per soluzione per infusione endovenosa, 120 MGPrincipio attivo: belimumabProduttore: GLAXOSMITHKLINE (IRELAND) LIMITEDPrescrizione richiestaForma farmaceutica: Concentrato per soluzione per infusione, 150 mgPrincipio attivo: ublituximabProduttore: NEURAXPHARM PHARMACEUTICALS, S.LPrescrizione richiestaForma farmaceutica: Soluzione iniettabile, 20 MGPrincipio attivo: ofatumumabProduttore: NOVARTIS EUROPHARM LIMITEDPrescrizione richiesta
Medici online per ENTYVIO
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di ENTYVIO — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.





