
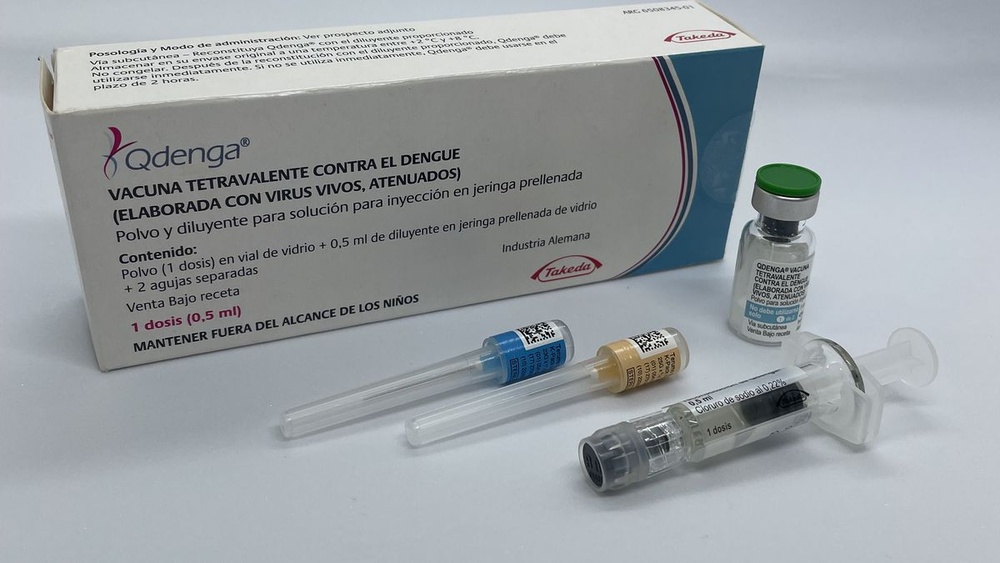
QDENGA

Come usare QDENGA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
Qdenga polvere e solvente per soluzione iniettabile
Vaccino tetravalente per la dengue (vivo, attenuato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che lei o suo figlio siate vaccinati perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei o per suo figlio. Non lo dia ad altre persone.
- Se lei o suo figlio manifestate un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Qdenga e a cosa serve
- 2. Cosa deve sapere prima che lei o suo figlio riceviate Qdenga
- 3. Come viene somministrato Qdenga
- 4. Possibili effetti indesiderati
- 5. Come conservare Qdenga
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Qdenga e a cosa serve
Qdenga è un vaccino. È usato per proteggere lei o suo figlio dalla dengue. La dengue è una malattia
causata dai sierotipi 1, 2, 3 e 4 del virus dengue. Qdenga contiene versioni attenuate di questi 4
sierotipi del virus dengue in maniera tale da non poter causare la malattia.
Qdenga è somministrato ad adulti, giovani e bambini (a partire dai 4 anni di età).
Qdenga deve essere usato conformemente alle raccomandazioni ufficiali.
Come funziona il vaccino
Qdenga stimola le naturali difese dell’organismo (sistema immunitario). Questo aiuterà a proteggerlo
dai virus che causano la dengue se l’organismo vi venisse esposto in futuro.
Cos’è la dengue
La dengue è causata da un virus.
- Il virus si diffonde tramite le zanzare (zanzare Aedes).
- Se una zanzara punge qualcuno con la dengue, può trasmettere il virus alle successive persone che pungerà. La dengue non viene trasmessa direttamente da persona a persona.
I segni della dengue includono febbre, mal di testa, dolore dietro agli occhi, dolore muscolare e
articolare, nausea e vomito, gonfiore delle ghiandole o eruzione cutanea. I segni della dengue di solito
si protraggono per 2-7 giorni. Si può anche essere infettati con il virus della dengue ma non mostrare
alcun segno della malattia.
Occasionalmente, la dengue può essere abbastanza grave da costringere lei o suo figlio a recarsi in
ospedale e, raramente, può causare la morte. La dengue grave può causare febbre alta e uno qualsiasi
dei seguenti sintomi: grave dolore addominale (alla pancia), vomito persistente, respiro accelerato,
grave sanguinamento, sanguinamento nello stomaco, sanguinamento delle gengive, stanchezza,
irrequietezza, coma, crisi convulsive e insufficienza organica.
2. Cosa deve sapere prima che lei o suo figlio riceviate Qdenga
Per assicurarsi che Qdenga sia adatto a lei o a suo figlio, è importante che si rivolga al medico, al
farmacista o all’infermiere se uno qualunque dei punti che seguono si applicano a lei o a suo figlio. Se
non dovesse capire qualcosa, non esiti a chiedere spiegazioni al medico, al farmacista o all’infermiere.
Non usi Qdengase lei o suo figlio
- siete allergici ai principi attivi o ad uno qualsiasi degli altri componenti di Qdenga (elencati al paragrafo 6).
- avete avuto una reazione allergica dopo la somministrazione di Qdenga in passato. Tra i segni di una reazione allergica vi sono eruzione cutanea pruriginosa, respiro affannoso e gonfiore di viso e lingua.
- avete un sistema immunitario (le difese naturali del corpo) debole. Ciò può essere dovuto a un difetto genetico oppure a infezione da HIV.
- state assumendo un medicinale che influisce sul sistema immunitario (come corticosteroidi ad alto dosaggio o chemioterapia). Il medico non utilizzerà Qdenga fino a quando non saranno trascorse 4 settimane dall’interruzione del trattamento con questo medicinale.
- siete in stato di gravidanza o allattamento. Non usi Qdenga se una qualsiasi delle condizioni sopra descritte la riguarda.
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima della somministrazione di Qdenga se lei o
suo figlio:
- avete un’infezione con febbre. Potrebbe essere necessario rimandare la vaccinazione fino alla guarigione.
- avete già avuto un qualsiasi problema di salute dopo la somministrazione di un vaccino. Il medico valuterà attentamente i rischi e i benefici della vaccinazione.
- siete mai svenuti a seguito di un’iniezione. A seguito o addirittura prima di una qualsiasi iniezione con ago possono verificarsi (soprattutto nei giovani) capogiri, mancamento e a volte caduta.
Informazioni importanti sulla protezione fornita
Come qualsiasi vaccino, Qdenga potrebbe non riuscire a proteggere tutte le persone a cui viene
somministrato e la protezione potrebbe diminuire nel tempo. Lei potrebbe ancora contrarre la febbre
dengue in seguito alle punture di zanzara, compresa la malattia dengue grave. Deve continuare a
proteggere se stesso o suo figlio dalle punture di zanzara anche dopo la vaccinazione con Qdenga.
Dopo la vaccinazione, deve rivolgersi a un medico se pensa che lei o suo figlio abbiate contratto
un’infezione da dengue e manifestate uno qualsiasi dei seguenti sintomi: febbre alta, dolore
addominale grave, vomito persistente, respiro accelerato, sanguinamento delle gengive, stanchezza,
irrequietezza e sangue nel vomito.
Precauzioni supplementari di protezione
Deve prendere delle precauzioni contro le punture di zanzara. Ciò include utilizzare repellenti contro
gli insetti, indossare abiti protettivi e utilizzare zanzariere.
Bambini più piccoli
Qdenga non deve essere somministrato ai bambini al di sotto dei 4 anni di età.
Altri medicinali e Qdenga
Qdenga può essere somministrato con il vaccino contro l’epatite A, il vaccino contro la febbre gialla o
il vaccino contro il papillomavirus umano, in una sede di iniezione separata (in un’altra parte del
corpo, di solito l’altro braccio), durante la stessa visita.
Informi il medico o il farmacista se lei o suo figlio state usando, avete recentemente usato o potreste
usare qualsiasi altro vaccino o medicinale.
In particolare, informi il medico o il farmacista se lei o suo figlio state assumendo uno dei seguenti:
- medicinali che influiscono sulle naturali difese dell’organismo (sistema immunitario) come corticosteroidi ad alto dosaggio o chemioterapia. In questo caso, il medico non utilizzerà Qdenga fino a quando non saranno trascorse 4 settimane dall’interruzione del trattamento. Questo perché Qdenga potrebbe non funzionare come dovrebbe.
- medicinali noti come “immunoglobuline” o prodotti ematici contenenti immunoglobuline, come sangue o plasma. In questo caso, il medico non utilizzerà Qdenga fino a quando non saranno trascorse 6 settimane, e preferibilmente 3 mesi, dall’interruzione del trattamento. Questo perché Qdenga potrebbe non funzionare come dovrebbe.
Gravidanza e allattamento
Non usi Qdenga se lei o sua figlia siete in gravidanza o state allattando con latte materno. Se lei o sua
figlia:
- siete in età fertile, dovete prendere delle precauzioni necessarie ad evitare una gravidanza per almeno un mese dopo la vaccinazione con Qdenga.
- pensate di essere in gravidanza o state pianificando una gravidanza, chiedete consiglio al medico, al farmacista o all’infermiere prima di usare Qdenga .
Guida di veicoli e utilizzo di macchinari
Qdenga altera lievemente la capacità di guidare veicoli e usare macchinari nei primi giorni successivi
alla vaccinazione.
Qdenga contiene sodio e potassio
Qdenga contiene meno di 1 mmol (23 mg) di sodio per dose da 0,5 mL, cioè essenzialmente “senza
sodio”.
Qdenga contiene potassio, meno di 1 mmol (39 mg) per dose da 0,5 mL, cioè essenzialmente “senza
potassio”.
3. Come viene somministrato Qdenga
Qdenga viene somministrato dal medico o dall’infermiere attraverso un’iniezione sotto la pelle
(iniezione sottocutanea) nella parte superiore del braccio. Non deve essere iniettato in un vaso
sanguigno.
A lei o suo figlio saranno somministrate 2 iniezioni.
La seconda iniezione viene somministrata 3 mesi dopo la prima iniezione.
Non ci sono dati negli adulti di età superiore ai 60 anni. Si rivolga al medico per consigli sugli
eventuali benefici per lei del trattamento con Qdenga.
Qdenga deve essere usato conformemente alle raccomandazioni ufficiali.
Le istruzioni per preparare il vaccino, destinate esclusivamente ai medici e agli operatori
Se lei o suo figlio saltate una iniezione di Qdenga
- Se lei o suo figlio saltate una iniezione programmata, il medico deciderà quando somministrare l’iniezione saltata. È importante che lei o suo figlio seguiate le istruzioni del medico, del farmacista o dell’infermiere riguardo all’iniezione successiva.
- Se dimentica o non è in grado di tornare nel giorno programmato, chieda consiglio al medico, al farmacista o all’infermiere. Se ha qualsiasi dubbio sull’uso di questo vaccino, si rivolga al medico, al farmacista o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, Qdenga può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Grave reazione allergica (anafilattica)
Contatti immediatamente un medicose uno qualsiasi di questi sintomi si verifica dopo aver lasciato
il luogo in cui a lei o a suo figlio è stata fatta l’iniezione:
- difficoltà a respirare
- colore bluastro della lingua o delle labbra
- eruzione cutanea
- gonfiore del viso o della gola
- pressione sanguigna bassa che causa capogiri o svenimenti
- sensazione di malessere o disagio improvvisi e gravi con calo della pressione sanguigna che provoca capogiri e perdita di coscienza, battito cardiaco accelerato associato a difficoltà respiratorie
Questi segni o sintomi (reazioni anafilattiche) si sviluppano solitamente subito dopo l’iniezione e
mentre lei o suo figlio siete ancora presso la struttura sanitaria o lo studio medico. Possono verificarsi
molto raramente anche dopo aver ricevuto qualsiasi vaccino.
I seguenti effetti indesiderati si sono verificati durante gli studi su bambini, giovani e adulti.
Molto comuni(possono manifestarsi in più di 1 persona su 10):
- dolore in sede di iniezione
- mal di testa
- dolore muscolare
- arrossamento in sede di iniezione
- sensazione generale di star poco bene
- debolezza
- infezioni di naso o gola
- febbre
Comuni(possono manifestarsi fino a 1 persona su 10):
- gonfiore in sede di iniezione
- dolore o infiammazione di naso o gola
- lividi in sede di iniezione
- prurito in sede di iniezione
- infiammazione di gola e tonsille
- dolore articolare
- malattia simil-influenzale
Non comuni(possono manifestarsi fino a 1 persona su 100):
- diarrea
- nausea
- dolore di stomaco
- vomito
- sanguinamento in sede di iniezione
- sensazione di stordimento mentale
- cute pruriginosa
- eruzione cutanea, incluse eruzioni cutanee a chiazze o pruriginose
- orticaria
- stanchezza
- alterazioni del colore della pelle in sede di iniezione
- infiammazione delle vie respiratorie
- naso che cola
Raro(può manifestarsi fino a 1 persona su 1 000):
- piccole macchie rosse o viola sotto la pelle (petecchie)
Molto rari(possono manifestarsi fino a 1 persona su 10 000):
- gonfiore rapido sotto la pelle in aree quali viso, gola, braccia e gambe
- bassi livelli di piastrine nel sangue (trombocitopenia)
Non nota(la frequenza non può essere definita sulla base dei dati disponibili):
- reazione allergica (anafilattica) improvvisa e grave, con difficoltà respiratoria, gonfiore, stordimento, battito cardiaco accelerato, sudorazione e perdita di coscienza
Effetti indesiderati aggiuntivi nei bambini di età compresa tra 4 e 5 anni:
Molto comuni(possono manifestarsi in più di 1 persona su 10):
- appetito ridotto
- sentirsi assonnato
- irritabilità
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Qdenga
Conservi Qdenga fuori dalla vista e dalla portata dei bambini.
Non usi Qdenga dopo la data di scadenza che è riportata sulla scatola dopo Scad. La data di scadenza
si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C).
Non congelare.
Conservare il vaccino nel cartone esterno.
Dopo la miscelazione (ricostituzione) con il solvente in dotazione, Qdenga deve essere utilizzato
immediatamente. Se non utilizzato immediatamente, Qdenga deve essere utilizzato entro 2 ore.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Qdenga
- Dopo la ricostituzione, una dose (0,5 mL) contiene: Virus dengue sierotipo 1 (vivo, attenuato)*: ≥3,3 log10 PFU**/dose Virus dengue sierotipo 2 (vivo, attenuato)#: ≥2,7 log10 PFU**/dose Virus dengue sierotipo 3 (vivo, attenuato)*: ≥4,0 log10 PFU**/dose Virus dengue sierotipo 4 (vivo, attenuato)*: ≥4,5 log10 PFU**/dose
*Prodotto in cellule Vero mediante tecnologia del DNA ricombinante. Geni di proteine di
superficie sierotipo-specifiche ingegnerizzati nella struttura della dengue di tipo 2. Questo
prodotto contiene organismi geneticamente modificati (OGM).
#Prodotto in cellule Vero mediante tecnologia del DNA ricombinante.
**PFU = Unità formanti placca
- Gli altri componenti sono: α,α-trealosio diidrato, polossamero 407, albumina sierica umana, potassio fosfato monobasico, sodio fosfato dibasico, potassio cloruro, sodio cloruro, acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Qdengae contenuto della confezione
Qdenga è una polvere e solvente per soluzione iniettabile. Qdenga è fornito sotto forma di polvere in
un flaconcino monodose e un solvente in un flaconcino monodose.
La polvere e il solvente devono essere miscelati prima dell’uso.
Qdenga polvere e solvente per soluzione iniettabile è disponibile in confezioni da 1 o 10.
È possibile che non tutte le confezioni siano commercializzate.
La polvere è una massa compatta da bianca a biancastra.
Il solvente (soluzione di sodio cloruro allo 0,22%) è un liquido limpido e incolore.
Dopo la ricostituzione, Qdenga è una soluzione limpida, da incolore a giallo pallido e praticamente
priva di particelle estranee.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Takeda GmbH
Byk-Gulden-Str. 2
78467 Konstanz
Germania
Produttore
Takeda GmbH
Production site Singen
Robert-Bosch-Str. 8
78224 Singen
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България
Тел: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tél/Tel: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
[email protected]
Malta
Takeda HELLAS S.A.
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0) 800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: 800 800 30
[email protected]
Ελλάδα
Takeda ΕΛΛΑΣ Α.Ε.
Τηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma sp. z o.o.
Tel: +48 22 306 24 47
[email protected]
France
Takeda France SAS
Tél: +33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: +351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd.
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: +386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Takeda ΕΛΛΑΣ Α.Ε.
Τηλ: +30 210 6387800
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
Regno Unito (Irlanda del nord)
Takeda UK Ltd
Tel: +44 (0) 3333 000 181
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: https://www.ema.europa.eu .
------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Come per ogni altro vaccino iniettabile, devono essere sempre prontamente disponibili un trattamento e un controllo medico adeguati nel caso di un evento di reazione anafilattica conseguente alla somministrazione di Qdenga.
- Qdenga non deve essere miscelato ad altri prodotti medicinali o vaccini nella stessa siringa.
- Qdenga non deve essere somministrato per iniezione endovascolare in nessun caso.
- L’immunizzazione deve essere effettuata mediante iniezione sottocutanea preferibilmente nella parte superiore del braccio, nella zona del deltoide. Qdenga non deve essere somministrato mediante iniezione intramuscolare.
- Dopo qualsiasi vaccinazione, o perfino prima di essa, potrebbe manifestarsi una sincope (mancamento) come risposta psicogena all’iniezione con un ago. Devono essere adottate procedure per evitare lesioni da cadute e per gestire le reazioni da sincope.
Istruzioni per la ricostituzione del vaccino con il solvente contenuto nel flaconcino:
Qdenga è un vaccino a 2 componenti che consiste in un flaconcino contenente il vaccino liofilizzato e
un flaconcino contenente il solvente. Il vaccino liofilizzato deve essere ricostituito con il solvente
prima della somministrazione.
Utilizzare esclusivamente siringhe sterili per la ricostituzione e l’iniezione di Qdenga. Qdenga non
deve essere miscelato ad altri vaccini nella stessa siringa.
Per ricostituire Qdenga, usare solo il solvente (soluzione di sodio cloruro allo 0,22%) in dotazione con
il vaccino, poiché è privo di conservanti o di altre sostanze antivirali. Evitare il contatto con
conservanti, antisettici, detergenti e altre sostanze antivirali poiché potrebbero inattivare il vaccino.
Rimuovere i flaconcini del vaccino e del solvente dal frigorifero e tenerli a temperatura ambiente per
circa 15 minuti.
- Rimuovere le capsule di chiusura da entrambi i flaconcini e pulire la superficie dei tappi sulla parte superiore dei flaconcini usando un batuffolo imbevuto di alcol.
- Attaccare un ago sterile a una siringa sterile da 1 mL e inserire l’ago nel flaconcino del solvente. L’ago consigliato è quello da 23 gauge.
- Premere lentamente lo stantuffo fino in fondo.
- Capovolgere il flaconcino, aspirare l’intero contenuto del flaconcino e continuare a tirare lo stantuffo fino a 0,75 mL. Una bolla deve essere visibile all’interno della siringa.
- Capovolgere la siringa per riportare la bolla nello stantuffo.
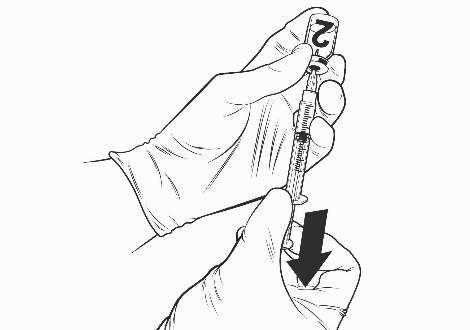
Flaconcino del solvente
- Inserire l’ago della siringa nel flaconcino del vaccino liofilizzato.
- Dirigere il flusso del solvente verso il lato del flaconcino spingendo lentamente lo stantuffo per ridurre la possibilità che si formino bolle.
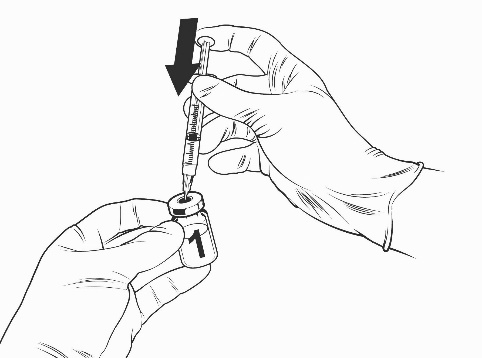
Flaconcino del vaccino liofilizzato
- Rilasciare il dito dallo stantuffo e, posizionando il tutto su una superficie piana, ruotare delicatamente il flaconcino in entrambe le direzioni con l’ago della siringa attaccato.
- NON AGITARE. Potrebbero formarsi schiuma e bolle nel prodotto ricostituito.
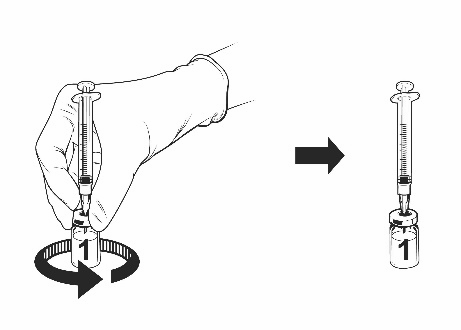
Lasciare che il flaconcino e la siringa attaccata riposino
per un po’ fino a quando la soluzione diventa limpida.
Vaccino ricostituitoQuesto richiede circa 30-60 secondi.
Dopo la ricostituzione, la soluzione risultante deve essere limpida, da incolore a giallo pallido e
praticamente priva di particelle estranee. Gettare via il vaccino in presenza di particolato e/o se
presenta alterazioni della colorazione.
- Aspirare l’intero volume della soluzione ricostituita di Qdenga con la stessa siringa fino a quando una bolla d’aria appare nella siringa.
- Rimuovere l’ago della siringa dal flaconcino.
- Tenere la siringa con l’ago rivolto verso l’alto, picchiettare il lato della siringa per far salire in alto le bolle d’aria, gettare via l’ago attaccato e sostituirlo con un nuovo ago sterile, espellere le bolle d’aria fino a quando una piccola goccia di liquido si forma sulla punta dell’ago. L’ago consigliato è quello da 25 gauge di 16 mm.
- Qdenga è pronto per essere somministrato mediante iniezione sottocutanea.
Qdenga deve essere somministrato immediatamente dopo la ricostituzione. La stabilità chimica e
fisica in uso è stata dimostrata per 2 ore a temperatura ambiente (fino a 32,5 °C) dal momento della
ricostituzione del flaconcino del vaccino. Dopo questo periodo di tempo, il vaccino deve essere
smaltito. Non riporlo in frigorifero. Dal punto di vista microbiologico, Qdenga deve essere utilizzato
immediatamente. Se non viene utilizzato immediatamente, i tempi e le condizioni di conservazione
durate l’uso sono responsabilità dell’utilizzatore.
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
Vaccino ricostituito
Qdenga polvere e solvente per soluzione iniettabile in siringa preriempita
Vaccino tetravalente per la dengue (vivo, attenuato)
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima che lei o suo figlio siate vaccinati perché contiene
importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico, al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei o per suo figlio. Non lo dia ad altre persone.
- Se lei o suo figlio manifestate un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all’infermiere. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Qdenga e a cosa serve
- 2. Cosa deve sapere prima che lei o suo figlio riceviate Qdenga
- 3. Come viene somministrato Qdenga
- 4. Possibili effetti indesiderati
- 5. Come conservare Qdenga
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Qdenga e a cosa serve
Qdenga è un vaccino. È usato per proteggere lei o suo figlio dalla dengue. La dengue è una malattia
causata dai sierotipi 1, 2, 3 e 4 del virus dengue. Qdenga contiene versioni attenuate di questi 4
sierotipi del virus dengue in maniera tale da non poter causare la malattia.
Qdenga è somministrato ad adulti, giovani e bambini (a partire dai 4 anni di età).
Qdenga deve essere usato conformemente alle raccomandazioni ufficiali.
Come funziona il vaccino
Qdenga stimola le naturali difese dell’organismo (sistema immunitario). Questo aiuterà a proteggerlo
dai virus che causano la dengue se l’organismo vi venisse esposto in futuro.
Cosa’è la dengue
La dengue è causata da un virus.
- Il virus si diffonde tramite le zanzare (zanzare Aedes).
- Se una zanzara punge qualcuno con la dengue, può trasmettere il virus alle successive persone che pungerà. La dengue non viene trasmessa direttamente da persona a persona.
I segni della dengue includono febbre, mal di testa, dolore dietro agli occhi, dolore muscolare e
articolare, nausea e vomito, gonfiore delle ghiandole o eruzione cutanea. I segni della dengue di solito
si protraggono per 2-7 giorni. Si può anche essere infettati con il virus della dengue ma non mostrare
alcun segno della malattia.
Occasionalmente, la dengue può essere abbastanza grave da costringere lei o suo figlio a recarsi in
ospedale e, raramente, può causare la morte. La dengue grave può causare febbre alta e uno qualsiasi
dei seguenti sintomi: grave dolore addominale (alla pancia), vomito persistente, respiro accelerato,
grave sanguinamento, sanguinamento nello stomaco, sanguinamento delle gengive, stanchezza,
irrequietezza, coma, crisi convulsive e insufficienza organica.
2. Cosa deve sapere prima che lei o suo figlio riceviate Qdenga
Per assicurarsi che Qdenga sia adatto a lei o a suo figlio, è importante che si rivolga al medico, al
farmacista o all’infermiere se uno qualunque dei punti che seguono si applicano a lei o a suo figlio. Se
non dovesse capire qualcosa, non esiti a chiedere spiegazioni al medico, al farmacista o all’infermiere.
Non usi Qdengase lei o suo figlio
- siete allergici ai principi attivi o ad uno qualsiasi degli altri componenti di Qdenga (elencati al paragrafo 6).
- avete avuto una reazione allergica dopo la somministrazione di Qdenga in passato. Tra i segni di una reazione allergica vi sono eruzione cutanea pruriginosa, respiro affannoso e gonfiore di viso e lingua.
- avete un sistema immunitario (le difese naturali del corpo) debole. Ciò può essere dovuto a un difetto genetico oppure a infezione da HIV.
- state assumendo un medicinale che influisce sul sistema immunitario (come corticosteroidi ad alto dosaggio o chemioterapia). Il medico non utilizzerà Qdenga fino a quando non saranno trascorse 4 settimane dall’interruzione del trattamento con questo medicinale.
- siete in stato di gravidanza o allattamento. Non usi Qdenga se una qualsiasi delle condizioni sopra descritte la riguarda.
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima della somministrazione di Qdenga se lei o
suo figlio:
- avete un’infezione con febbre. Potrebbe essere necessario rimandare la vaccinazione fino alla guarigione.
- avete già avuto un qualsiasi problema di salute dopo la somministrazione di un vaccino. Il medico valuterà attentamente i rischi e i benefici della vaccinazione.
- siete mai svenuti a seguito di un’iniezione. A seguito o addirittura prima di una qualsiasi iniezione con ago possono verificarsi (soprattutto nei giovani) capogiri, mancamento e a volte caduta.
Informazioni importanti sulla protezione fornita
Come qualsiasi vaccino, Qdenga potrebbe non riuscire a proteggere tutte le persone a cui viene
somministrato e la protezione potrebbe diminuire nel tempo. Lei potrebbe ancora contrarre la febbre
dengue in seguito alle punture di zanzara, compresa la malattia dengue grave. Deve continuare a
proteggere se stesso o suo figlio dalle punture di zanzara anche dopo la vaccinazione con Qdenga.
Dopo la vaccinazione, deve rivolgersi a un medico se pensa che lei o suo figlio abbiate contratto
un’infezione da dengue e manifestate uno qualsiasi dei seguenti sintomi: febbre alta, dolore
addominale grave, vomito persistente, respiro accelerato, sanguinamento delle gengive, stanchezza,
irrequietezza e sangue nel vomito.
Precauzioni supplementari di protezione
Deve prendere delle precauzioni contro le punture di zanzara. Ciò include utilizzare repellenti contro
gli insetti, indossare abiti protettivi e utilizzare zanzariere.
Bambini più piccoli
Qdenga non deve essere somministrato ai bambini al di sotto dei 4 anni di età.
Altri medicinali e Qdenga
Qdenga può essere somministrato con il vaccino contro l’epatite A, il vaccino contro la febbre gialla o
il vaccino contro il papillomavirus umano in un sito di iniezione separato (in un’altra parte del corpo,
di solito l’altro braccio) durante la stessa visita.
Informi il medico o il farmacista se lei o suo figlio state usando, avete recentemente usato o potreste
usare qualsiasi altro vaccino o medicinale.
In particolare, informi il medico o il farmacista se lei o suo figlio state assumendo uno dei seguenti:
- medicinali che influiscono sulle naturali difese dell’organismo (sistema immunitario) come corticosteroidi ad alto dosaggio o chemioterapia. In questo caso, il medico non utilizzerà Qdenga fino a quando non saranno trascorse 4 settimane dall’interruzione del trattamento. Questo perché Qdenga potrebbe non funzionare come dovrebbe.
- medicinali noti come “immunoglobuline” o prodotti ematici contenenti immunoglobuline, come sangue o plasma. In questo caso, il medico non utilizzerà Qdenga fino a quando non saranno trascorse 6 settimane, e preferibilmente 3 mesi, dall’interruzione del trattamento. Questo perché Qdenga potrebbe non funzionare come dovrebbe.
Gravidanza e allattamento
Non usi Qdenga se lei o sua figlia siete in gravidanza o state allattando con latte materno. Se lei o sua
figlia:
- siete in età fertile, dovete prendere delle precauzioni necessarie ad evitare una gravidanza per almeno un mese dopo la vaccinazione con Qdenga.
- pensate di essere in gravidanza o state pianificando una gravidanza, chiedete consiglio al medico, al farmacista o all’infermiere prima di usare Qdenga .
Guida di veicoli e utilizzo di macchinari
Qdenga altera lievemente la capacità di guidare veicoli e usare macchinari nei primi giorni successivi
alla vaccinazione.
Qdenga contiene sodio e potassio
Qdenga contiene meno di 1 mmol (23 mg) di sodio per dose da 0,5 mL, cioè essenzialmente “senza
sodio”.
Qdenga contiene potassio, meno di 1 mmol (39 mg) per dose da 0,5 mL, cioè essenzialmente “senza
potassio”.
3. Come viene somministrato Qdenga
Qdenga viene somministrato dal medico o dall’infermiere attraverso un’iniezione sotto la pelle
(iniezione sottocutanea) nella parte superiore del braccio. Non deve essere iniettato in un vaso
sanguigno.
A lei o suo figlio saranno somministrate 2 iniezioni.
La seconda iniezione viene somministrata 3 mesi dopo la prima iniezione.
Non ci sono dati negli adulti di età superiore ai 60 anni. Si rivolga al medico per consigli sugli
eventuali benefici per lei del trattamento con Qdenga.
Qdenga deve essere usato conformemente alle raccomandazioni ufficiali.
Le istruzioni per preparare il vaccino, destinate esclusivamente ai medici e agli operatori
Se lei o suo figlio saltate un’iniezione di Qdenga
- Se lei o suo figlio saltate un’iniezione programmata, il medico deciderà quando somministrare l’iniezione saltata. È importante che lei o suo figlio seguiate le istruzioni del medico, del farmacista o dell’infermiere riguardo all’iniezione successiva.
- Se dimentica o non è in grado di tornare nel giorno programmato, chieda consiglio al medico, al farmacista o all’infermiere. Se ha qualsiasi dubbio sull’uso di questo vaccino, si rivolga al medico, al farmacista o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, Qdenga può causare effetti indesiderati sebbene non tutte le persone li
manifestino.
Grave reazione allergica (anafilattica)
Contatti immediatamente un medicose uno qualsiasi di questi sintomi si verifica dopo aver lasciato
il luogo in cui a lei o a suo figlio è stata fatta l’iniezione:
- difficoltà a respirare
- colore bluastro della lingua o delle labbra
- eruzione cutanea
- gonfiore del viso o della gola
- pressione sanguigna bassa che causa capogiri o svenimenti
- sensazione di malessere o disagio improvvisi e gravi con calo della pressione sanguigna che provoca capogiri e perdita di coscienza, battito cardiaco accelerato associato a difficoltà respiratorie
Questi segni o sintomi (reazioni anafilattiche) si sviluppano solitamente subito dopo l’iniezione e
mentre lei o suo figlio siete ancora presso la struttura sanitaria o lo studio medico. Possono verificarsi
molto raramente anche dopo aver ricevuto qualsiasi vaccino.
I seguenti effetti indesiderati si sono verificati durante gli studi su bambini, giovani e adulti.
Molto comuni(possono manifestarsi in più di 1 persona su 10):
- dolore in sede di iniezione
- mal di testa
- dolore muscolare
- arrossamento in sede di iniezione
- sensazione generale di star poco bene
- debolezza
- infezioni di naso o gola
- febbre
Comuni(possono manifestarsi fino a 1 persona su 10):
- gonfiore in sede di iniezione
- dolore o infiammazione di naso o gola
- lividi in sede di iniezione
- prurito in sede di iniezione
- infiammazione di gola e tonsille
- dolore articolare
- malattia simil-influenzale
Non comuni(possono manifestarsi fino a 1 persona su 100):
- diarrea
- nausea
- dolore di stomaco
- vomito
- sanguinamento in sede di iniezione
- sensazione di stordimento mentale
- cute pruriginosa
- eruzione cutanea, incluse eruzioni cutanee a chiazze o pruriginose
- orticaria
- stanchezza
- alterazioni del colore della pelle in sede di iniezione
- infiammazione delle vie respiratorie
- naso che cola
Raro(può manifestarsi fino a 1 persona su 1 000):
- piccole macchie rosse o viola sotto la pelle (petecchie) Molto rari(possono manifestarsi fino a 1 paziente su 10 000):
- gonfiore rapido sotto la pelle in aree quali viso, gola, braccia e gambe
- bassi livelli di piastrine nel sangue (trombocitopenia)
Non nota(la frequenza non può essere definita sulla base dei dati disponibili):
- reazione allergica (anafilattica) improvvisa e grave, con difficoltà respiratoria, gonfiore, stordimento, battito cardiaco accelerato, sudorazione e perdita di coscienza
Effetti indesiderati aggiuntivi nei bambini di età compresa tra 4 e 5 anni:
Molto comuni(possono manifestarsi più di 1 persona su 10):
- appetito ridotto
- sentirsi assonnato
- irritabilità
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ allegato V . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Qdenga
Conservi Qdenga fuori dalla vista e dalla portata dei bambini.
Non usi Qdenga dopo la data di scadenza che è riportata sulla scatola dopo Scad. La data di scadenza
si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C).
Non congelare.
Conservare il vaccino nel cartone esterno.
Dopo la miscelazione (ricostituzione) con il solvente in dotazione, Qdenga deve essere utilizzato
immediatamente. Se non utilizzato immediatamente, Qdenga deve essere utilizzato entro 2 ore.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Qdenga
- Dopo la ricostituzione, una dose (0,5 mL) contiene: Virus dengue sierotipo 1 (vivo, attenuato)*: ≥3,3 log10 PFU**/dose Virus dengue sierotipo 2 (vivo, attenuato)#: ≥2,7 log10 PFU**/dose Virus dengue sierotipo 3 (vivo, attenuato)*: ≥4,0 log10 PFU**/dose Virus dengue sierotipo 4 (vivo, attenuato)*: ≥4,5 log10 PFU**/dose
*Prodotto in cellule Vero mediante tecnologia del DNA ricombinante. Geni di proteine di
superficie sierotipo-specifiche ingegnerizzati nella struttura della dengue di tipo 2. Questo
prodotto contiene organismi geneticamente modificati (OGM).
#Prodotto in cellule Vero mediante tecnologia del DNA ricombinante.
**PFU = Unità formanti placca
- Gli altri componenti sono: α,α-trealosio diidrato, polossamero 407, albumina sierica umana, potassio fosfato monobasico, sodio fosfato dibasico, potassio cloruro, sodio cloruro, acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Qdengae contenuto della confezione
Qdenga è una polvere e solvente per soluzione iniettabile. Qdenga è fornito sotto forma di polvere in
un flaconcino monodose e un solvente in siringa preriempita con 2 aghi separati o senza ago.
La polvere e il solvente devono essere miscelati prima dell’uso.
Qdenga polvere e solvente per soluzione iniettabile in siringa preriempita è disponibile in confezioni
da 1 o 5.
È possibile che non tutte le confezioni siano commercializzate.
La polvere è una massa compatta da bianca a biancastra.
Il solvente (soluzione di sodio cloruro allo 0,22%) è un liquido limpido e incolore.
Dopo la ricostituzione, Qdenga è una soluzione limpida, da incolore a giallo pallido e praticamente
priva di particelle estranee.
Titolare dell’autorizzazione all’immissione in commercio e produttore
Titolare dell’autorizzazione all’immissione in commercio
Takeda GmbH
Byk-Gulden-Str. 2
78467 Konstanz
Germania
Produttore
Takeda GmbH
Production site Singen
Robert-Bosch-Str. 8
78224 Singen
Germania
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Takeda Belgium NV
Tel/Tél: +32 2 464 06 11
[email protected]
Lietuva
Takeda, UAB
Tel: +370 521 09 070
[email protected]
България
Такеда България
Тел: +359 2 958 27 36
[email protected]
Luxembourg/Luxemburg
Takeda Belgium NV
Tel/Tél: +32 2 464 06 11
[email protected]
Česká republika
Takeda Pharmaceuticals Czech Republic s.r.o.
Tel: +420 234 722 722
[email protected]
Magyarország
Takeda Pharma Kft.
Tel: +36 1 270 7030
[email protected]
Danmark
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
[email protected]
Malta
Takeda HELLAS S.A
Tel: +30 210 6387800
[email protected]
Deutschland
Takeda GmbH
Tel: +49 (0) 800 825 3325
[email protected]
Nederland
Takeda Nederland B.V.
Tel: +31 20 203 5492
[email protected]
Eesti
Takeda Pharma AS
Tel: +372 6177 669
[email protected]
Norge
Takeda AS
Tlf: 800 800 30
[email protected]
Ελλάδα
Takeda ΕΛΛΑΣ Α.Ε.
Τηλ: +30 210 6387800
[email protected]
Österreich
Takeda Pharma Ges.m.b.H.
Tel: +43 (0) 800-20 80 50
[email protected]
España
Takeda Farmacéutica España, S.A.
Tel: +34 917 90 42 22
[email protected]
Polska
Takeda Pharma sp. z o.o.
Tel: +48 22 306 24 47
[email protected]
France
Takeda France SAS
Tél: +33 1 40 67 33 00
[email protected]
Portugal
Takeda Farmacêuticos Portugal, Lda.
Tel: +351 21 120 1457
[email protected]
Hrvatska
Takeda Pharmaceuticals Croatia d.o.o.
Tel: +385 1 377 88 96
[email protected]
România
Takeda Pharmaceuticals SRL
Tel: +40 21 335 03 91
[email protected]
Ireland
Takeda Products Ireland Ltd.
Tel: 1800 937 970
[email protected]
Slovenija
Takeda Pharmaceuticals farmacevtska družba d.o.o.
Tel: +386 (0) 59 082 480
[email protected]
Ísland
Vistor hf.
Sími: +354 535 7000
[email protected]
Slovenská republika
Takeda Pharmaceuticals Slovakia s.r.o.
Tel: +421 (2) 20 602 600
[email protected]
Italia
Takeda Italia S.p.A.
Tel: +39 06 502601
[email protected]
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
[email protected]
Κύπρος
Takeda ΕΛΛΑΣ Α.Ε.
Τηλ: +30 2106387800
[email protected]
Sverige
Takeda Pharma AB
Tel: 020 795 079
[email protected]
Latvija
Takeda Latvia SIA
Tel: +371 67840082
[email protected]
Regno Unito (Irlanda del nord)
Takeda UK Ltd
Tel: +44 (0) 3333 000 181
[email protected]
Altre fonti d’informazioni
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali: https://www.ema.europa.eu .
------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
- Come per ogni altro vaccino iniettabile, devono essere sempre prontamente disponibili un trattamento e un controllo medico adeguati nel caso di un evento di reazione anafilattica conseguente alla somministrazione di Qdenga.
- Qdenga non deve essere miscelato ad altri prodotti medicinali o vaccini nella stessa siringa.
- Qdenga non deve essere somministrato per iniezione endovascolare in nessun caso.
- L’immunizzazione deve essere effettuata mediante iniezione sottocutanea preferibilmente nella parte superiore del braccio, nella zona del deltoide. Qdenga non deve essere somministrato mediante iniezione intramuscolare.
- Dopo qualsiasi vaccinazione, o perfino prima di essa, potrebbe manifestarsi una sincope (mancamento) come risposta psicogena all’iniezione con un ago. Devono essere adottate procedure per evitare lesioni da cadute e per gestire le reazioni da sincope.
Istruzioni per la ricostituzione del vaccino con solvente contenuto nella siringa preriempita:
Qdenga è un vaccino a 2 componenti che consiste in un flaconcino contenente il vaccino liofilizzato e
del solvente fornito nella siringa preriempita. Il vaccino liofilizzato deve essere ricostituito con il
solvente prima della somministrazione.
Qdenga non deve essere miscelato ad altri vaccini nella stessa siringa.
Per ricostituire Qdenga, usare solo il solvente (soluzione di sodio cloruro allo 0,22%) nella siringa
preriempita in dotazione con il vaccino, poiché è privo di conservanti o di altre sostanze antivirali.
Evitare il contatto con conservanti, antisettici, detergenti e altre sostanze antivirali poiché potrebbero
inattivare il vaccino.
Rimuovere il flaconcino del vaccino e la siringa preriempita con solvente dal frigorifero e tenerli a
temperatura ambiente per circa 15 minuti.
- Rimuovere la capsula di chiusura dal flaconcino del vaccino e pulire la superficie del tappo sulla parte superiore del flaconcino usando un batuffolo imbevuto di alcol.
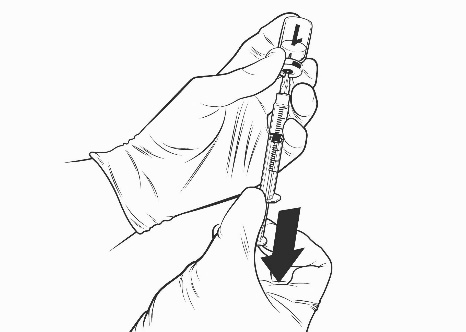
- Inserire un ago sterile nella siringa preriempita e inserire l’ago nel flaconcino del vaccino. L’ago consigliato è quello da 23 gauge.
- Dirigere il flusso del solvente verso il lato del flaconcino spingendo lentamente lo stantuffo per ridurre la possibilità che si formino bolle.
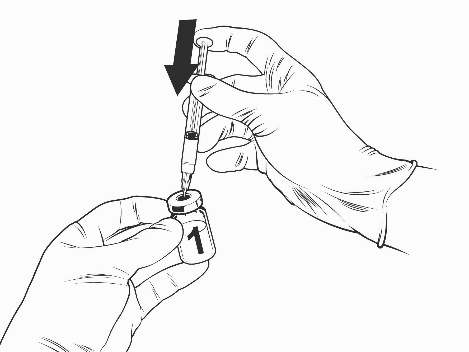
Flaconcino del vaccino liofilizzato
- Rilasciare il dito dallo stantuffo e, posizionando il tutto su una superficie piana, ruotare delicatamente il flaconcino in entrambe le direzioni con l’ago della siringa attaccato.
- NON AGITARE. Potrebbero formarsi schiuma e bolle nel prodotto ricostituito.
- Lasciare che il flaconcino e la siringa attaccata riposino per un po’ fino a quando la soluzione diventa limpida. Questo richiede circa 30-60 secondi.
Dopo la ricostituzione, la soluzione risultante deve essere limpida, da incolore a giallo pallido e
praticamente priva di particelle estranee. Gettare via il vaccino in presenza di particolato e/o se
presenta alterazioni della colorazione.
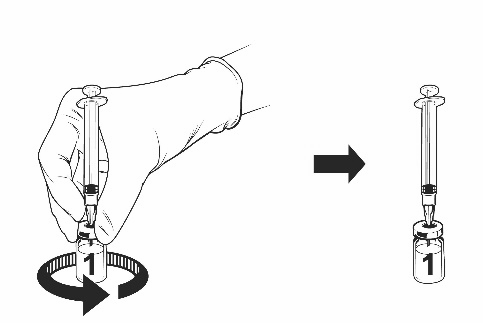
Vaccino ricostituito
- Aspirare l’intero volume della soluzione ricostituita di Qdenga con la stessa siringa fino a quando una bolla d’aria appare nella siringa.
- Rimuovere l’ago della siringa dal flaconcino.
- Tenere la siringa con l’ago rivolto verso l’alto, picchiettare il lato della siringa per far salire in alto le bolle d’aria, gettare via l’ago attaccato e sostituirlo con un nuovo ago sterile, espellere le bolle d’aria fino a quando una piccola goccia di liquido si forma sulla punta dell’ago. L’ago consigliato è quello da 25 gauge di 16 mm.
- Qdenga è pronto per essere somministrato mediante iniezione sottocutanea.
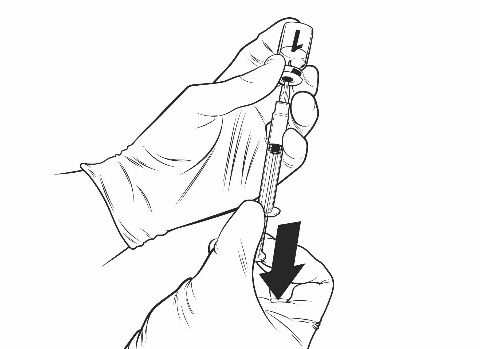
Vaccino ricostituito
Qdenga deve essere somministrato immediatamente dopo la ricostituzione. La stabilità chimica e
fisica in uso è stata dimostrata per 2 ore a temperatura ambiente (fino a 32,5 °C) dal momento della
ricostituzione del flaconcino del vaccino. Dopo questo periodo di tempo, il vaccino deve essere
smaltito. Non riporlo in frigorifero. Dal punto di vista microbiologico, Qdenga deve essere utilizzato
immediatamente. Se non viene utilizzato immediatamente, i tempi e le condizioni di conservazione
durante l’uso sono responsabilità dell’utilizzatore.
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità
alla normativa locale vigente.
ALLEGATO IV
CONCLUSIONI SCIENTIFICHE E MOTIVAZIONI PER LA VARIAZIONE DEI TERMINI
DELL’AUTORIZZAZIONE/DELLE AUTORIZZAZIONI ALL’IMMISSIONE IN
COMMERCIO
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) dei Rapporti periodici di
aggiornamento sulla sicurezza ( Periodic Safety Update Report, PSUR) per il vaccino tetravalente
contro la dengue (vivo, attenuato) [virus dengue, sierotipo 2, che esprime proteine di superficie,
virus dengue, sierotipo 1, vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di
superficie, virus dengue, sierotipo 3, vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine
di superficie, virus dengue, sierotipo 4, vivo, attenuato/virus dengue, sierotipo 2, vivo, attenuato],
le conclusioni scientifiche del PRAC sono le seguenti:
Alla luce dei dati disponibili su trombocitopenia e petecchia provenienti da studi clinici, dalla
letteratura e da segnalazioni spontanee, inclusa in alcuni casi una stretta relazione temporale, e alla
luce di un meccanismo d’azione plausibile, il PRAC ritiene che ci sia almeno una ragionevole
possibilità di relazione causale tra vaccino tetravalente contro la dengue (vivo, attenuato) [virus
dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo 1, vivo,
attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo 3,
vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo
4, vivo, attenuato/virus dengue, sierotipo 2, vivo, attenuato] e trombocitopenia e petecchia . Il
PRAC ha concluso che le informazioni del prodotto devono essere modificate di conseguenza.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
( Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione del PRAC.
Motivazioni per la variazione dei termini dell’autorizzazione/delle autorizzazioni
all’immissione in commercio
Sulla base delle conclusioni scientifiche relative al vaccino tetravalente contro la dengue (vivo,
attenuato) [virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo 1,
vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo
3, vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue,
sierotipo 4, vivo, attenuato/virus dengue, sierotipo 2, vivo, attenuato] il CHMP ritiene che il
rapporto beneficio/rischio dei medicinali contenenti il vaccino tetravalente contro la dengue (vivo,
attenuato) [virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo 1,
vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue, sierotipo
3, vivo, attenuato/virus dengue, sierotipo 2, che esprime proteine di superficie, virus dengue,
sierotipo 4, vivo, attenuato/virus dengue, sierotipo 2, vivo, attenuato] rimane invariato fatte salve le
modifiche proposte alle informazioni del prodotto.
Il CHMP raccomanda la variazione dei termini dell’autorizzazione/delle autorizzazioni
all’immissione in commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a QDENGAForma farmaceutica: Polvere e solvente per soluzione iniettabile, 0.5 mlPrincipio attivo: respiratory syncytial virus vaccinesProduttore: PFIZER EUROPE MA EEIGPrescrizione richiestaForma farmaceutica: Polvere e sospensione per sospensione iniettabile, 0,5 mlPrincipio attivo: respiratory syncytial virus vaccinesProduttore: GLAXOSMITHKLINE BIOLOGICALS S.A.Prescrizione non richiestaForma farmaceutica: Sospensione iniettabile, 0,5 MLPrincipio attivo: smallpox and monkeypox vaccinesProduttore: BAVARIAN NORDIC A/SPrescrizione non richiesta
Medici online per QDENGA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di QDENGA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.






