
SKYTROFA

Come usare SKYTROFA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- Skytrofa 3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 3,6 mg, polvere e solvente per soluzione iniettabile in cartuccia, 4,3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 5,2 mg, polvere e solvente per soluzione iniettabile in cartuccia, 6,3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 7,6 mg, polvere e solvente per soluzione iniettabile in cartuccia, 9,1 mg, polvere e solvente per soluzione iniettabile in cartuccia
- Cos’è Skytrofa e a cosa serve
- Cosa lei o suo(a) figlio(a) deve sapere prima di usare Skytrofa
- Come usare Skytrofa
- Possibili effetti indesiderati
- Come conservare Skytrofa
- Contenuto della confezione e altre informazioni
- Controllo e montaggio di cartuccia e ago
- Accensione dell’autoiniettore
- Inserimento della cartuccia
- Attesa durante la miscelazione
- Rotazione in alto e in basso dell’autoiniettore
- Completamento della miscelazione
- Controllo della soluzione miscelata
- Preparazione per l’iniezione
- Iniezione del medicinale
- Rimozione della cartuccia
- Smaltimento di cartuccia e ago
- Conservazione dell’autoiniettore
Skytrofa 3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 3,6 mg, polvere e solvente per soluzione iniettabile in cartuccia, 4,3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 5,2 mg, polvere e solvente per soluzione iniettabile in cartuccia, 6,3 mg, polvere e solvente per soluzione iniettabile in cartuccia, 7,6 mg, polvere e solvente per soluzione iniettabile in cartuccia, 9,1 mg, polvere e solvente per soluzione iniettabile in cartuccia
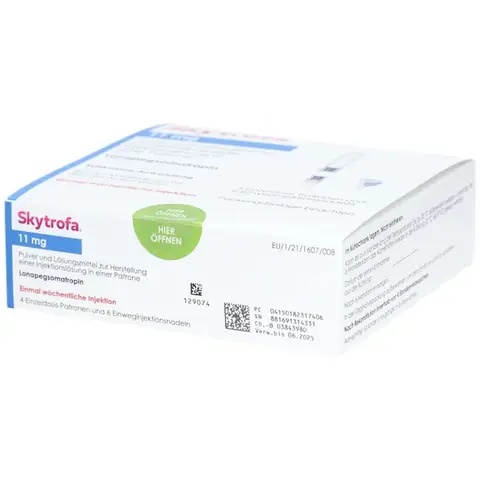
Skytrofa 11 mg, polvere e solvente per soluzione iniettabile in cartuccia
Skytrofa 13,3 mg, polvere e solvente per soluzione iniettabile in cartuccia
lonapegsomatropina
Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di
nuove informazioni sulla sicurezza. Lei può contribuire segnalando qualsiasi effetto indesiderato
riscontrato durante l’assunzione di questo medicinale. Vedere la fine del paragrafo 4 per le
informazioni su come segnalare gli effetti indesiderati.
Legga attentamente questo foglio prima di usare questo medicinale per lei o per suo(a) figlio(a)
perché contiene importanti informazioni per lei o per suo(a) figlio(a).
₋ Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
₋ Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
₋ Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i
sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
₋ Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si
rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio
- 1. Cos’è Skytrofa e a cosa serve
- 2. Cosa lei o suo(a) figlio(a) deve sapere prima di usare Skytrofa
- 3. Come usare Skytrofa
- 4. Possibili effetti indesiderati
- 5. Come conservare Skytrofa
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Skytrofa e a cosa serve
Skytrofa è un medicinale che contiene il principio attivo lonapegsomatropina. Questa sostanza può
essere convertita dal corpo in somatropina, nota anche come ormone somatotropo umano (hGH).
Somatropina è necessaria per la crescita di ossa e muscoli e aiuta il corpo a sviluppare la giusta
quantità di grasso e tessuti muscolari.
Skytrofa viene utilizzato per trattare bambini e adolescenti, di età compresa fra i 3 e i 18 anni, che non
sono cresciuti adeguatamente perché il loro corpo non produce, o non produce abbastanza, ormone
somatotropo. I medici definiscono questo disturbo deficit di ormone somatotropo (GHD). Dopo
l’iniezione, Skytrofa viene convertito lentamente in somatropina, che fornisce l’ormone somatotropo
mancante.
2. Cosa lei o suo(a) figlio(a) deve sapere prima di usare Skytrofa
Non usi Skytrofa
- se èallergicoa lonapegsomatropina o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6)
- se haun tumore (cancro)in crescita. Prima di iniziare il trattamento con Skytrofa, deve aver concluso il suo trattamento antitumorale e i tumori devono essere inattivi
- se di recente hasubito un intervento di chirurgia a cuore aperto o di chirurgia addominale o un trauma accidentale multiplo oppure ha sofferto di insufficienza respiratoria acuta
- se il medico le detto che le parti delle ossa che crescono e aumentano l’altezza (piastre di crescita o epifisi) si sono chiuse e hanno smesso di crescere
Se una qualsiasi di queste situazioni la riguarda, lo comunichi al medico prima di iniziare il
trattamento.
Avvertenze e precauzioni
Si rivolga al medico, al farmacista o all’infermiere prima di usare Skytrofa. È molto importante
comunicare quanto segue:
- se in precedenza ha avuto un tumore intracranico, un medico la esaminerà regolarmente, durante il trattamento, per rilevare eventuali recidive del tumore o di qualsiasi altro cancro;
- se sviluppa una forte cefalea, visione disturbata, vomito o incapacità a coordinare imovimenti volontari dei muscoli (atassia), soprattutto nelle prime settimane di trattamento, informi immediatamente il medico. Questi potrebbero essere segni di un aumento della pressione nel cranio (pressione intracranica). Vedere paragrafo 4, possibili effetti indesiderati;
- se presenta diabete mellito, livelli elevati di zucchero nel sangue(intolleranza al glucosio) o fattori di rischio aggiuntivi per il diabete, può essere necessario controllare periodicamente la glicemia ed eventualmente regolare la dose del medicinale per il diabete;
- se sta ricevendo un trattamento con corticosteroidi per l’insufficienza renale, si rivolga al medico, in quanto può essere necessario regolare periodicamente la dose di steroidi;
- se sta ricevendo un trattamento con ormoni tiroideio deve iniziare la terapia sostitutiva con ormoni tiroidei, il medico eseguirà periodicamente il test della funzione tiroidea e potrebbe essere necessario regolare la dose;
- se, quando cammina, avverte un dolore persistente all’anca o al ginocchio o se inizia a zoppicare durante il trattamento con ormone somatotropo, informi il medico. Questi potrebbero essere sintomi di un disturbo che interessa l’osso della coscia (femore) quando si inserisce nell’anca (epifisiolisi o scivolamento della testa femorale) e che si verifica con maggiore frequenza nei bambini trattati con ormone somatotropo. Questi sintomi potrebbero essere provocati anche dalla perdita di tessuto osseo a causa di insufficiente apporto di sangue (osteonecrosi), che è stata segnalata in pazienti trattati con altri prodotti a base di ormone della crescita. Si rivolga al medico se avverte dolore persistente a qualsiasi articolazione;
- se nota una curva laterale nella sua colonna vertebrale(scoliosi), deve farsi controllare spesso dal medico;
- se avverte mal di stomaco(dolori alla pancia) in via di peggioramento, informi il medico. Il medico potrebbe sottoporla al test della pancreatite, che è un’infiammazione di un organo denominato pancreas. Vedere paragrafo 4, possibili effetti indesiderati;
- se presenta segni e sintomi di un’ improvvisa reazione allergica grave(ad es. difficoltà nella respirazione, gonfiore del viso, della bocca o della lingua, battito cardiaco accelerato, orticaria, eruzione cutanea, febbre), deve rivolgersi tempestivamente a un medico.
- se soffre della sindrome di Prader-Willi, non deve ricevere il trattamento con Skytrofa, a meno che non abbia anche il deficit di ormone somatotropo. Skytrofa non è stato studiato nei soggetti con la sindrome di Prader-Willi, pertanto la sua efficacia come trattamento di questo disturbo è sconosciuta;
- un piccolo numero di pazienti che ha ricevuto la sostituzione con ormone somatotropo ha sviluppato un tipo di cancro del sangue e del midollo osseo(leucemia). Tuttavia, non è stato dimostrato che il trattamento con ormone somatotropo causi il cancro;
- se ha riscontrato complicanze immediate dopo un intervento di chirurgia a cuore aperto o di chirurgia addominale, un violento incidente (trauma) o una malattia critica acuta qualel’insufficienza respiratoria acuta;
- se è una paziente che assume contraccettivi orali o una terapia ormonale sostitutiva conestrogeni, può essere necessario aumentare la dose di Skytrofa. Se lei o suo(a) figlio(a) interrompe l’uso di estrogeni orali, può essere necessario ridurre la dose di Skytrofa.
Altri medicinali e Skytrofa
Informi il medico, il farmacista o l’infermiere se sta usando, ha recentemente usato o potrebbe usare
qualsiasi altro medicinale.
In particolare, informi il medico se sta assumendo o ha recentemente assunto uno qualsiasi dei
seguenti medicinali:
- insulina o qualsiasi altro medicinale per trattare il diabete mellito
- trattamenti con ormoni tiroidei quali levotiroxina
- compresse contenenti estrogeni, incluse compresse per la terapia estrogenica sostitutiva o per la contraccezione
- steroidi o ormoni sintetici surrenali (corticosteroidi o glucocorticoidi)
- medicinali per trattare l’epilessia o le convulsioni (crisi convulsive) - medicinali contro le crisi convulsive (anticonvulsivanti) quali carbamazepina
- ciclosporina (medicinale immunosoppressivo) - un medicinale per sopprimere il sistema immunitario
- teofillina, un medicinale utilizzato per trattare l’asma e altre malattie polmonari croniche
Il medico può dover regolare la dose di questi medicinali o la dose di Skytrofa.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza o se sta allattando con latte
materno chieda consiglio al medico prima di prendere questo medicinale.
Gravidanza
Se è in grado di avere figli, non deve utilizzare Skytrofa a meno che non stia usando anche una
contraccezione affidabile. I dati relativi all’uso di Skytrofa in donne in gravidanza non esistono.
Skytrofa non deve essere usato durante la gravidanza. Questo perché non si sa se potrebbe danneggiare
il bambino non ancora nato. Se è in corso una gravidanza, se sospetta o sta pianificando una
gravidanza, informi il medico. Se dovesse iniziare una gravidanza durante il trattamento, informi
immediatamente il medico.
Allattamento
Non è noto se Skytrofa possa passare nel latte materno. Tuttavia, poiché lonapegsomatropina non
viene assorbita per bocca, è improbabile che determini effetti avversi sul lattante. Se sta allattando o
intende farlo, chieda consiglio al medico riguardo all’uso di Skytrofa. Skytrofa può essere usato
durante l’allattamento su rigorosa indicazione.
Guida di veicoli e utilizzo di macchinari
Skytrofa non compromette la capacità di guidare veicoli o di usare macchinari.
3. Come usare Skytrofa
Questo medicinale verrà prescritto solo da un medico che sia esperto nel trattamento con ormone
somatotropo e che abbia confermato la diagnosi.
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico. Se ha dubbi consulti il
medico. Il medico le mostrerà come usare Skytrofa.
Skytrofa viene somministrato come iniezione sotto pelle (iniezione sottocutanea). Ciò significa che
viene iniettato mediante un ago corto nel tessuto grasso sotto la pelle dell’addome, del gluteo o della
coscia. È importante cambiare il punto in cui viene praticata l’iniezione ogni settimana, onde evitare di
danneggiare la pelle. All’inizio del trattamento, il medico o l’infermiere le comunicheranno la dose
giusta e le mostreranno come praticare l’iniezione.
Dose raccomandata
Il medico stabilirà la dose di Skytrofa in base al peso corporeo in chilogrammi. Poiché
lonapegsomatropina viene convertita in somatropina nell’organismo, le dosi di Skytrofa vengono
descritte in base alla quantità di somatropina che produce. La dosa raccomandata di Skytrofa è pari
a 0,24 mg di somatropina per chilogrammo di peso corporeo, somministrata una volta alla settimana.
Se sta passando dalla terapia giornaliera con somatropina a Skytrofa una volta alla settimana, il
medico le dirà di attendere almeno 8 ore tra la dose finale di somatropina una volta al giorno e la
prima dose di Skytrofa. La dose raccomandata può essere ridotta in base alla dose giornaliera
precedente di somatropina.
Quando usare Skytrofa
Deve sottoporsi a un’iniezione di Skytrofa una volta alla settimana, lo stesso giorno ogni settimana, in
qualsiasi ora della giornata.
Se necessario, può modificare il giorno dell’iniezione settimanale. Skytrofa può essere
somministrato 2 giorni prima o 2 giorni dopo il giorno pianificato. Devono essere trascorsi
almeno 5 giorni dall’ultima iniezione nel giorno abituale e la prima dose nel nuovo giorno pianificato.
Dopo aver scelto un nuovo giorno di somministrazione, continui a eseguire l’iniezione in quel giorno
ogni settimana. Se ha dubbi su come procedere, si rivolga al medico.
Preparazione e somministrazione
Prima di usare il medicinale, legga le “Istruzioni per l’uso” alla fine di questo foglio.
Skytrofa viene fornito in una cartuccia a due camere contenente sia il medicinale (polvere) che un
solvente (liquido). Deve essere utilizzato con gli aghi forniti. Per le iniezioni le occorre anche Skytrofa
Auto-Injector. Skytrofa Auto-Injector viene fornito separatamente.
La polvere e il solvente verranno miscelati in una soluzione iniettabile da Skytrofa Auto-Injector.
Dopo la miscelazione, la soluzione è pronta per l’uso ed è possibile iniettare il medicinale sotto la
pelle utilizzando Skytrofa Auto-Injector.
Legga le istruzioni per l’uso fornite con Skytrofa Auto-Injector.
Se lei o suo(a) figlio(a) usa più Skytrofa di quanto deve
Se ha utilizzato per le iniezioni una quantità di Skytrofa superiore al previsto, chieda consiglio al
medico. Se le iniezioni contengono troppo Skytrofa, il livello di zucchero nel sangue può ridursi
eccessivamente e, più tardi, diventare troppo elevato. Il sovradosaggio a lungo termine potrebbe
causare una crescita irregolare.
Se lei o suo(a) figlio(a) dimentica di usare Skytrofa
Se salta la dose settimanale o è in ritardo di 1 o 2 giorni: pratichi l’iniezione oggi, quindi nel giorno
abituale la settimana successiva. Se il ritardo è di 3 giorni o più: tralasci la dose saltata e riprenda le
iniezioni nel successivo giorno di dosaggio abituale. Mantenga un intervallo di almeno 5 giorni fra
un’iniezione e un’altra.
Se lei o suo(a) figlio(a) interrompe il trattamento con Skytrofa
Non interrompa l’uso di Skytrofa senza rivolgersi al medico. Se interrompe l’assunzione di Skytrofa
troppo presto, la velocità di crescita potrebbe diminuire e l’altezza finale potrebbe essere inferiore a
quella che si raggiungerebbe completando l’intero ciclo di trattamento.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Effetti indesiderati molto comuni(possono riguardare più di 1 persona su 10)
- Mal di testa
Effetti indesiderati comuni(possono riguardare fino a 1 persona su 10)
- Bassi livelli dell’ormone tiroxina osservati negli esami del sangue (ipotiroidismo secondario)
- Dolore articolare (artralgia)
- Reazioni in sede di iniezione. La pelle intorno all’area dell’iniezione può diventare disomogenea o grumosa, ma ciò non dovrebbe verificarsi se si pratica l’iniezione ogni volta in un punto diverso.
Effetti indesiderati non comuni(possono riguardare fino a 1 persona su 100)
- Improvvisa reazione allergica grave, incluso angioedema (rapido gonfiore delle mucose o della pelle, che può verificarsi nel viso, nella bocca, nella lingua, nell’addome o nelle braccia e nelle gambe)
- Una riduzione nei livelli dell’ormone cortisolo osservati negli esami del sangue
- Rigidezza delle articolazioni (artrite)
- Un’aumentata curva laterale della colonna vertebrale (scoliosi)
- Dolori di crescita
- Aumento di volume mammario nei maschi
Frequenza non nota(non può essere definita sulla base dei dati disponibili)
I seguenti effetti indesiderati sono stati osservati con altri medicinali contenenti ormone somatotropo.
- Leucemia
- Diabete mellito di tipo 2
- Aumento di pressione del liquido che circonda il cervello (che causa sintomi quali un’intensa cefalea, disturbi visivi e vomito)
- Intorpidimento/formicolio
- Dolore muscolare
- Gonfiore della parte inferiore delle gambe e dei piedi e/o delle braccia e delle mani
- Gonfiore del viso
- Eruzione cutanea
- Sensazione di prurito
- Orticaria
Se un effetto indesiderato qualsiasi si aggrava, informi il medico o il farmacista.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista o all’infermiere. Può inoltre segnalare gli effetti indesiderati direttamente
tramite il sistema nazionale di segnalazione riportato nell’ . Segnalando gli effetti
indesiderati può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Skytrofa
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola dopo Scad.
Conservare in frigorifero (2 °C – 8 °C). Non congelare. Conservare nella confezione originale per
proteggere il medicinale dalla luce.
Skytrofa può essere estratto dal frigorifero e conservato a temperature fino a 30 °C per un periodo
massimo di 6 mesi. Durante questi 6 mesi, il medicinale può essere refrigerato nuovamente (2 °C
- 8 °C). Riporti sulla scatola la data in cui Skytrofa è stato rimosso per la prima volta dal frigorifero.
Elimini il medicinale 6 mesi dopo la data in cui lo ha conservato per la prima volta all’esterno del
frigorifero.
La polvere è di un colore fra il bianco e il bianco avorio e il solvente è una soluzione trasparente
incolore.
La soluzione miscelata è incolore e trasparente. La soluzione a volte può contenere bolle d’aria. È un
fatto normale. Non usi questo medicinale se nota particelle visibili nella soluzione miscelata.
Esegua l’iniezione immediatamente dopo aver miscelato la polvere e il solvente mediante Skytrofa
Auto-Injector. Se la soluzione miscelata non può essere utilizzata subito, dovrà usarla entro 4 ore.
Quando esaurisce una cartuccia con ago, deve provvedere a smaltirla con cura in un contenitore
idoneo.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare il medicinale che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Skytrofa
Il principio attivo è lonapegsomatropina.
Le cartucce sono disponibili in 9 livelli di dosaggio:
Skytrofa 3 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 3 mg di somatropina (equivalenti a 8,6 mg di
lonapegsomatropina [polvere]) e 0,279 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 11 mg/mL.
Skytrofa 3,6 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 3,6 mg di somatropina (equivalenti a 10,3 mg di
lonapegsomatropina [polvere]) e 0,329 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 11 mg/mL.
Skytrofa 4,3 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 4,3 mg di somatropina (equivalenti a 12,3 mg di
lonapegsomatropina [polvere]) e 0,388 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 11 mg/mL.
Skytrofa 5,2 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 5,2 mg di somatropina (equivalenti a 14,8 mg di
lonapegsomatropina [polvere]) e 0,464 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 11 mg/mL.
Skytrofa 6,3 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 6,3 mg di somatropina (equivalenti a 18 mg di
lonapegsomatropina [polvere]) e 0,285 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 22 mg/mL.
Skytrofa 7,6 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 7,6 mg di somatropina (equivalenti a 21,7 mg di
lonapegsomatropina [polvere]) e 0,338 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 22 mg/mL.
Skytrofa 9,1 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 9,1 mg di somatropina (equivalenti a 25,9 mg di
lonapegsomatropina [polvere]) e 0,4 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 22 mg/mL.
Skytrofa 11 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 11 mg di somatropina (equivalenti a 31,4 mg di
lonapegsomatropina [polvere]) e 0,479 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 22 mg/mL.
Skytrofa 13,3 mg, polvere e solvente per soluzione iniettabile (iniezione) in cartuccia
Ogni cartuccia a due camere contiene 13,3 mg di somatropina (equivalenti a 37,9 mg di
lonapegsomatropina [polvere]) e 0,574 mL di solvente (liquido). Dopo la miscelazione, la
concentrazione di somatropina è pari a 22 mg/mL.
₋ Gli altri componenti di questo medicinale (per tutti i dosaggi) sono:
Polvere: acido succinico, trealosio diidrato, trometamolo
Solvente: acqua per iniezioni
Descrizione dell’aspetto di Skytrofa e contenuto della confezione
Skytrofa contiene il medicinale in polvere insieme a un solvente con cui realizzare una soluzione
iniettabile, all’interno di una cartuccia a due camere, contenente la polvere in una camera e il solvente
nell’altra.
La polvere è di un colore fra il bianco e il bianco avorio e il solvente è una soluzione trasparente
incolore. Una volta che la polvere e il solvente sono stati miscelati in una soluzione iniettabile,
quest’ultima è incolore e trasparente.
Ogni confezione di Skytrofa contiene 4 cartucce a due camere monouso, confezionate in singoli
blister, e 6 aghi per iniezione usa e getta (due aghi di riserva). Ogni cartuccia è dotata di un’etichetta
specifica, a cui sono assegnati nastri di codifica bicolore utilizzati solo da Skytrofa Auto-Injector allo
scopo di selezionare le impostazioni di miscelazione appropriate. I colori corrispondenti ai dosaggi
sono riportati sulla scatola e sulla lamina del blister e devono essere utilizzati per distinguere i singoli
dosaggi.
I colori corrispondenti ai dosaggi sulla scatola e sul blister indicano il dosaggio del suo medicinale
Skytrofa:
Skytrofa è stato progettato per l’uso con gli aghi per iniezione forniti e con Skytrofa Auto-Injector.
Skytrofa Auto-Injector non è incluso nella confezione e viene fornito separatamente. Le istruzioni per
l’uso di Skytrofa Auto-Injector sono contenute nella confezione di tale dispositivo.
| i Colori dei dosaggi sulla scatola/sul blister | Dosaggio | Etichetta bicolore della cartuccia (basso/alto) |
| Albicocca chiaro | 3 mg | Gialla/verde |
| z Ciano | 3,6 mg | Gialla/ciano |
| Grigio scuro | 4,3 mg | Gialla/rosa |
| n Giallo | 5,2 mg | Verde/rosa |
| Arancione | 6,3 mg | Ciano/gialla |
| e Viola scuro | 7,6 mg | Ciano/rosa |
| g Marrone dorato | 9,1 mg | Rosa/gialla |
| Blu scuro | 11 mg | Rosa/verde |
| Rosso scuro | 13,3 mg | Rosa/ciano |
Titolare dell’autorizzazione all’immissione in commercio
Ascendis Pharma Endocrinology Division A/S
Tuborg Boulevard 12
DK-2900 Hellerup
Danimarca
Produttore
Ascendis Pharma A/S
Tuborg Boulevard 12
DK-2900 Hellerup
Danimarca
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
per i medicinali, https://www.ema.europa.eu .
Istruzioni per l’uso
La presente guida è concepita per aiutarla a preparare, miscelare ed eseguire l’iniezione del medicinale
Skytrofa.
Queste istruzioni sono suddivise in 5 fasi
Introduzione ai componenti del medicinale suo o di suo(a) figlio(a)
Preparazione del medicinale suo o di suo(a) figlio(a)
Miscelazione del medicinale suo o di suo(a) figlio(a)
Iniezione del medicinale suo o di suo(a) figlio(a)
Dopo l’iniezione del medicinale suo o di suo(a) figlio(a)
Se in qualsiasi momento lei o suo(a) figlio(a) ha bisogno di aiuto, contatti il medico, il farmacista
o l’infermiere.
Cosa deve sapere prima di iniziare
- Si lavi e si asciughi sempre le mani.
- È necessario utilizzare una nuova cartuccia per ogni iniezione.
- È necessario utilizzare un nuovo ago per ogni iniezione. Nonriutilizzi l’ago.
- Nonusi questo medicinale una volta superata la data di scadenza stampata dopo “Scad./EXP” sulla scatola esterna e sulla confezione della cartuccia oppure 6 mesi dopo la data in cui è stato rimosso per la prima volta dalla refrigerazione (a seconda di ciò che accade prima).
- Nonusi questo medicinale se nota che contiene particelle visibili.
- La cartuccia e l’ago sono monouso e sono stati progettati per essere utilizzati solo con Skytrofa Auto-Injector [di seguito denominato “autoiniettore”].
Introduzione ai componenti del medicinale Skytrofa suo o di suo(a) figlio(a)
Skytrofa è costituito da una polvere e un solvente per soluzione iniettabile in una cartuccia. Ogni
confezione contiene 4 cartucce monouso e 6 aghi per iniezione usa e getta. La cartuccia contiene la
polvere del medicinale e il solvente con cui miscelare la polvere.
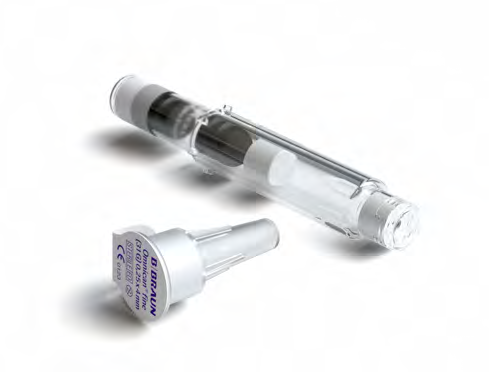
Cartuccia a due camere
Solvente
Polvere
Ago per iniezione
Per le iniezioni le occorre anche Skytrofa Auto-Injector. Tale dispositivo non è incluso nella
confezione di Skytrofa e viene fornito in una confezione separata. Legga anche le istruzioni per l’uso
fornite con Skytrofa Auto-Injector.
Preparazione del medicinale suo o di suo(a) figlio(a)
Se conserva il medicinale in frigorifero, lo estragga 15 minuti prima dell’uso.
1. Controllo e montaggio di cartuccia e ago
- Estrarre la confezione della cartuccia.
- Controllare la data di scadenza e il dosaggio sulla confezione della cartuccia.
- Nonutilizzare se è stata superata la data di scadenza stampata dopo “EXP”.
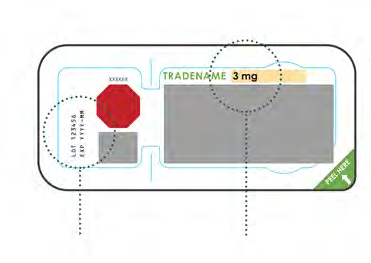
Data di scadenza Dosaggio
- Aprire la confezione della cartuccia fino al segno STOP rosso. In questo modo il connettore arancione rimarrà nella confezione della cartuccia. Per fissare la posizione del tappo della cartuccia durante il trasporto, viene applicato un connettore arancione alla cartuccia nel blister.
- Sollevare la cartuccia ed estrarla dalla confezione.
- Se sulla cartuccia è ancora presente un connettore arancione, rimuoverlo estraendolo direttamente e gettarlo.
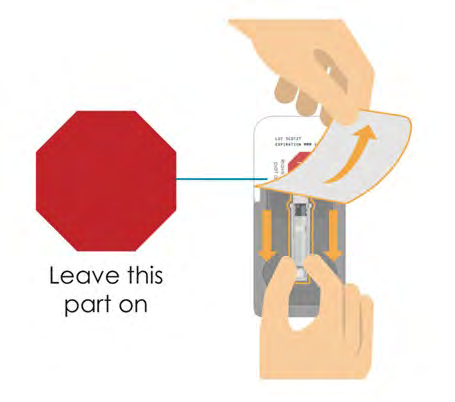
STOP
Lasciare
questa parte
in posizione
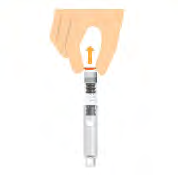
- Estrarre un ago nuovo. Se la carta protettiva non è sigillata completamente o appare rotta, nonutilizzare.
- Rimuovere la carta protettiva.

2. Accensione dell’autoiniettore
- Per accendere l’autoiniettore, premere e rilasciare il pulsante verde.
- Si avvertono 2segnali acustici intensi , l’icona della batteria si illumina e la parte superiore verde inizia a lampeggiare.
| c o |







3. Inserimento della cartuccia
- Inserire la cartuccia nella parte superiore verde lampeggiante.

- Premere con un dito sulla cartuccia finché non scatta in posizione con un clic. La parte superiore verde smette di lampeggiare, l’icona di miscelazione verde si illumina e l’icona della batteria si spegne.


Miscelazione del medicinale suo o di suo(a) figlio(a)
4. Attesa durante la miscelazione
- Attendere da 4 a 8 minuti che l’autoiniettore misceli il medicinale.
- Osservare la graduale accensione della barra di avanzamento.
- Attendere finché non si avvertono 2segnali acustici intensi e l’intera barra di avanzamento non inizia a lampeggiare.
| m a c o |

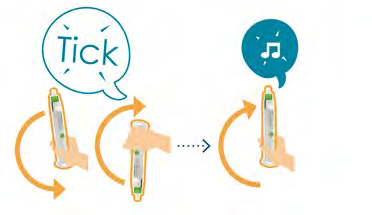
5. Rotazione in alto e in basso dell’autoiniettore
- Ruotare l’autoiniettore verso l’alto e verso il basso. Un ticchettio conferma la rotazione corretta.
- Ruotare da 5 a 10 volte finché non si avvertono 2segnali acustici intensi e la barra di avanzamento, eccetto l’elemento superiore, non si illumina.
6. Completamento della miscelazione
Iniezione del medicinale suo o di suo(a) figlio(a)
7. Controllo della soluzione miscelata
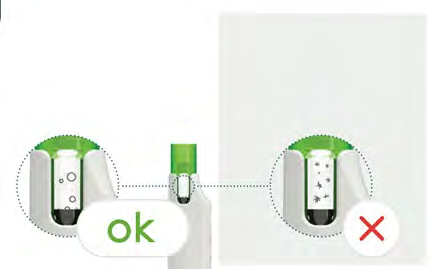
- La soluzione è stata miscelata correttamente se risulta incolore e trasparente (la presenza di bolle d’aria è accettabile).
- Nonutilizzare la soluzione se presenta particelle visibili. Se vi sono particelle visibili, premere il pulsante verde per 3 secondi e rimuovere la cartuccia.
| a r m a c o |
 | d e l F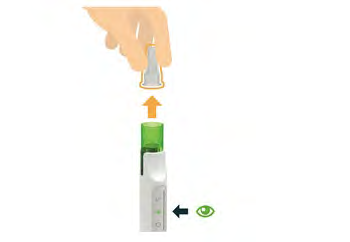 |
OK
8. Preparazione per l’iniezione
- Scegliere la sede di iniezione: stomaco, cosce o glutei. Cambiare sede di iniezione ogni settimana.
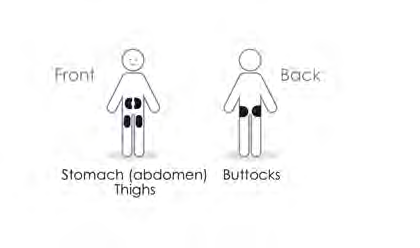
| a c o |
| F a r m |
9. Iniezione del medicinale
| a d e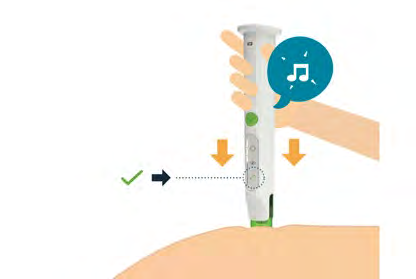 |
i l a
|  |
Dopo l’iniezione del medicinale suo o di suo(a) figlio(a)
10. Rimozione della cartuccia
- Premere la copertura dell’ago sulla parte superiore verde lampeggiante.
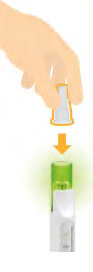
- Premere la copertura dell’ago verso il basso per rilasciare la cartuccia.


- Rimuovere la cartuccia usata.
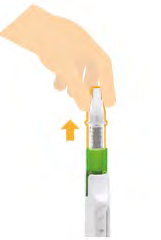
11. Smaltimento di cartuccia e ago
a i z
|  |
La dose settimanale richiede 2 cartucce?
- Eseguire la seconda iniezione ripetendo i passaggi da 1 a 11 con una cartuccia e un ago nuovi.
12. Conservazione dell’autoiniettore
| l F a r m |
ALLEGATO IV
CONCLUSIONI SCIENTIFICHE E MOTIVAZIONI PER LA VARIAZIONE DEI TERMINI
DELL’AUTORIZZAZIONE/DELLE AUTORIZZAZIONI ALL’IMMISSIONE IN
COMMERCIO
Conclusioni scientifiche
Tenendo conto della valutazione del Comitato per la valutazione dei rischi in farmacovigilanza
( Pharmacovigilance and Risk Assessment Committee, PRAC) dei Rapporti periodici di aggiornamento
sulla sicurezza ( Periodic Safety Update Report, PSUR) per la lonapegsomatropina , le conclusioni
scientifiche del PRAC sono le seguenti:
Alla luce dei dati disponibili sul rischio di osteonecrosi in associazione al trattamento con ormone
della crescita dalla letteratura e dalle segnalazioni spontanee, il PRAC considera l’osteonecrosi un
potenziale rischio del trattamento con lonapegsomatropina, tenendo anche in considerazione il fatto
che il rischio di osteonecrosi (talvolta come malattia di Legg-Calve-Perthes) è già stato riflesso nelle
informazioni sul prodotto per alcuni altri medicinali contenenti l’ormone della crescita. Il relatore del
PRAC ha concluso che le informazioni sul prodotto dei medicinali contenenti lonapegsomatropina
devono essere modificate di conseguenza.
Avendo esaminato la raccomandazione del PRAC, il Comitato dei medicinali per uso umano
( Committee for Human Medicinal Products, CHMP) concorda con le relative conclusioni generali e
con le motivazioni della raccomandazione.
Motivazioni per la variazione dei termini dell’autorizzazione/delle autorizzazioni all’immissione
in commercio
Sulla base delle conclusioni scientifiche su lonapegsomatropina, il CHMP ritiene che il rapporto
beneficio/rischio del medicinale contenente/dei medicinali contenenti lonapegsomatropina sia
invariato fatte salve le modifiche proposte alle informazioni del prodotto.
Il CHMP raccomanda di variare i termini dell’autorizzazione/delle autorizzazioni all’immissione in
commercio.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a SKYTROFAForma farmaceutica: Polvere e solvente per soluzione iniettabile, 5,3 MGPrincipio attivo: somatropinProduttore: PFIZER ITALIA S.R.L.Prescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 6 MGPrincipio attivo: somatropinProduttore: ELI LILLY ITALIA S.P.A.Prescrizione richiestaForma farmaceutica: Soluzione iniettabile, 10 MG/MLPrincipio attivo: mecaserminProduttore: ESTEVE PHARMACEUTICALS SAPrescrizione richiesta
Medici online per SKYTROFA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di SKYTROFA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.










