
RECOMBINATE

Come usare RECOMBINATE
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
- Recombinate 250 UI/5 ml polvere e solvente per soluzione iniettabile, 500 UI/5 ml polvere e solvente per soluzione iniettabile, 1000 UI/5 ml polvere e solvente per soluzione iniettabile
- Cos’è Recombinate e a cosa serve
- Cosa deve sapere prima di usare Recombinate
- Come usare Recombinate
- Possibili effetti indesiderati
- Come conservare Recombinate
- Contenuto della confezione e altre informazioni
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA
- FORMA FARMACEUTICA
- 2 Posologia e modo di somministrazione
- 3 Controindicazioni
- 4 Avvertenze speciali e precauzioni di impiego
- 5 Interazioni con altri medicinali ed altre forme di interazione
- 6 Fertilità, gravidanza e allattamento
- 7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
- 8 Effetti indesiderati
- 9 Sovradosaggio
- 2 Proprietà farmacocinetiche
- 3 Dati preclinici di sicurezza
- 2 Incompatibilità
- 3 Periodo di validità
- 4 Precauzioni particolari per la conservazione
- 5 Natura e contenuto del contenitore
- 6 Precauzioni particolari per lo smaltimento e la manipolazione
- TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- DATA DELLA PRIMA AUTORIZZAZIONE / RINNOVO DELL’AUTORIZZAZIONE
- DATA DI REVISIONE DEL TESTO
- Recombinate 250 UI/10 ml polvere e solvente per soluzione iniettabile, 500 UI/10 ml polvere e solvente per soluzione iniettabile, 1000 UI/10 ml polvere e solvente per soluzione iniettabile
- Cos’è Recombinate e a cosa serve
- Cosa deve sapere prima di usare Recombinate
- Come usare Recombinate
- Possibili effetti indesiderati
- Come conservare Recombinate
- Contenuto della confezione e altre informazioni
- DENOMINAZIONE DEL MEDICINALE
- COMPOSIZIONE QUALITATIVA E QUANTITATIVA
- FORMA FARMACEUTICA
- 2 Posologia e modo di somministrazione
- 3 Controindicazioni
- 4 Avvertenze speciali e precauzioni di impiego
- 5 Interazioni con altri medicinali ed altre forme di interazione
- 6 Fertilità, gravidanza e allattamento
- 7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
- 8 Effetti indesiderati
- 9 Sovradosaggio
- 2 Proprietà farmacocinetiche
- 3 Dati preclinici di sicurezza
- 2 Incompatibilità
- 3 Periodo di validità
- 4 Precauzioni particolari per la conservazione
- 5 Natura e contenuto del contenitore
- 6 Precauzioni particolari per lo smaltimento e la manipolazione
- TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
- DATA DELLA PRIMA AUTORIZZAZIONE / RINNOVO DELL’AUTORIZZAZIONE
- DATA DI REVISIONE DEL TESTO
Recombinate 250 UI/5 ml polvere e solvente per soluzione iniettabile, 500 UI/5 ml polvere e solvente per soluzione iniettabile, 1000 UI/5 ml polvere e solvente per soluzione iniettabile
octocog alfa (fattore VIII ricombinante della coagulazione)
Legga attentamente questo foglio prima di usare questo medicinaleperché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista o all’infermiere.
Contenuto di questo foglio:
- 1. Cos’è Recombinate e a che cosa serve
- 2. Cosa deve sapere prima di usare Recombinate
- 3. Come usare Recombinate
- 4. Possibili effetti indesiderati
- 5. Come conservare Recombinate
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Recombinate e a cosa serve
Recombinate appartiene ad un gruppo farmacoterapeutico denominato fattore VIII della coagulazione
del sangue.
Recombinate viene usato in pazienti con emofilia A (deficit congenito di fattore VIII) per:
- prevenzione di emorragie
- trattamento di emorragie (es. emorragie muscolari, orali, emorragie sul sito chirurgico)
Recombinate non contiene fattore di von Willebrand e pertanto non è indicato nella malattia di von
Willebrand (un particolare disordine della coagulazione del sangue).
2. Cosa deve sapere prima di usare Recombinate
Non usi Recombinate
- Se è allergico a octocog alfa, alle proteine murine, bovine o di criceto o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6). In caso di dubbi, si rivolga al medico.
Avvertenze e precauzioni
In caso di reazioni allergiche:
- Esiste una rara possibilità di avere una reazione anafilattica (una reazione allergica grave e improvvisa) verso Recombinate. È necessario saper riconoscere i segni precoci di reazioni allergiche quali esantema, orticaria, pomfi, prurito generalizzato, edema delle labbra e della lingua, difficoltà respiratoria, dispnea, oppressione al petto, sensazione generale di malessere e vertigini. Questi sintomi possono costituire un segno precoce di shock anafilattico, le cui manifestazioni possono anche includere un’estrema sensazione di vertigine, perdita della coscienza ed estrema difficoltà a respirare.
- In caso di insorgenza di uno qualunque di questi sintomi, è necessario interrompere immediatamente l’infusione. Per i sintomi gravi, inclusa la difficoltà respiratoria e svenimenti (o sensazione di mancamento), è necessario un pronto trattamento di emergenza.
Quando è necessario eseguire il monitoraggio:
- Il medico può ritenere opportuno eseguire dei test per assicurare che la sua attuale dose sia sufficiente per raggiungere e mantenere adeguati livelli di fattore VIII. Questo è particolarmente importante in caso di interventi chirurgici maggiori. In caso di emorragie persistenti:
- La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono che il trattamento agisca correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per verificare lo sviluppo di questi inibitori. Se Recombinate non mantiene sotto controllo l’emorragia sua o di suo figlio, informi il medico immediatamente.
Altri medicinali e Recombinate
Non sono state osservate interazioni sfavorevoli con altri medicinali.
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Gravidanza e allattamento
Non esistono esperienze circa l’uso di Recombinate durante la gravidanza o l’allattamento, dal
momento che l’emofilia A è una condizione rara fra le donne. Pertanto, informi il medico in caso di
gravidanza o di allattamento. Il medico deciderà se Recombinate può essere utilizzato durante la
gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
Non sono stati riscontrati effetti sulla capacità di guidare o di usare macchinari.
Recombinate contiene sodio
Questo medicinale contiene 35 mg (1,5 mmol) di sodio (componente principale del sale da cucina) per
ogni flaconcino da 250 UI, 500 UI e 1000 UI. Questo equivale all’1,8% dell’assunzione massima
giornaliera raccomandata di 2 g di sodio per un adulto. Bisogna tenerne conto in caso di pazienti
sottoposti a dieta iposodica.
3. Come usare Recombinate
Usi questo medicinale seguendo sempre esattamente le istruzioni di un medico esperto nella cura di
pazienti con emofilia A.
Dosaggio per la profilassi anti-emorragica
Nel caso in cui lei usi Recombinate per la prevenzione (profilassi) di emorragie, il medico calcolerà la
dose per lei e gliela comunicherà. Il medico stabilirà la dose in base alle sue particolari
esigenze. Normalmente la dose è di 20-40 UI di octocog alfa per chilogrammo di peso corporeo,
somministrate a intervalli di 2 - 3 giorni. Tuttavia, in alcuni casi, soprattutto per i pazienti più giovani,
possono essere necessari intervalli più brevi o dosi più elevate.
Nel caso in cui supponga che l’effetto di Recombinate sia insufficiente, è necessario che ne parli con il
medico.
Dosaggio per il trattamento delle emorragie
Nel caso in cui lei usi Recombinate per il trattamento di episodi emorragici, il medico calcolerà la dose
adattandola alle sue particolari esigenze per mezzo della seguente formula:
UI necessarie = peso corporeo (chilogrammo) x aumento desiderato di fattore VIII (% del normale) x
0,5
La seguente tabella fornisce una guida per i livelli minimi di fattore VIII nel sangue. Nel caso degli
eventi emorragici elencati, l'attività di fattore VIII non deve scendere al di sotto del livello riportato (in
% del normale) durante il periodo corrispondente.
In certe circostanze possono essere necessarie quantità maggiori rispetto a quelle calcolate, soprattutto
in caso di inibitore a basso titolo.
| Grado dell’emorragia/Tipo di procedura chirurgica | Picco di attività di AHF richiesta nel sangue dopo infusione (% del normale o UI/dL di plasma) | m Frequenza delle infusioni r |
| Grado dell’emorragia Emartro allo stato iniziale o emorragia muscolare o orale Emartro più esteso; emorragia muscolare o ematoma Emorragie a rischio per la vita, quali emorragie intracraniche, emorragie della gola o emorragie addominali gravi |
| a F Infondere ogni 12 - 24 ore da uno a tre giorni fino a che l’episodio l emorragico sia risolto (sulla base del dolore) o si sia giunti a guarigione Ripetere l’infusione ogni 12 - 24 ore, di norma per tre giorni o più fino a scomparsa del dolore o a recupero funzionale Ripetere l’infusione ogni 8 - 24 ore fino a remissione del rischio |
| Chirurgia Tipo di intervento Chirurgia minore, incluse le estrazioni dentali a Chirurgia maggiore i | a i l a
| Una singola infusione, più terapia antifibrinolitica orale, entro un’ora dall’intervento è sufficiente nel 70% circa dei casi. Ogni 24 ore, per almeno 1 giorno, fino alla guarigione della ferita. Ripetere l’infusione ogni 8 - 24 ore in relazione allo stato di guarigione della ferita. |
Uso nei bambini
Recombinate risulta idoneo per essere utilizzato sia negli adulti, sia nei bambini di tutte le età, inclusi i
neonati. Le raccomandazioni sul dosaggio per il trattamento delle emorragie sopra menzionate sono le
stesse per adulti e bambini. Per la profilassi delle emorragie (prevenzione), in alcuni casi possono
essere necessari intervalli di dosaggio più brevi o dosi maggiori rispetto alla dose normale di 20-40 UI
di fattore VIII per Kg di peso corporeo ad intervalli di 2-3 giorni.
Monitoraggio eseguito dal medico
Il medico eseguirà adeguati test di laboratorio per assicurarsi che siano stati raggiunti adeguati livelli
di fattore VIII. Questo è particolarmente importante in caso di interventi chirurgici maggiori.
Pazienti con inibitori del fattore VIII
Se il livello plasmatico di fattore VIII non raggiunge i livelli attesi, o se l’emorragia non è
adeguatamente controllata a seguito dell’aumento della dose, si deve sospettare la presenza di inibitori
del fattore VIII. La presenza di inibitori del fattore VIII verrà controllata dal medico.
In caso di avvenuto sviluppo di inibitori del fattore VIII, possono essere necessarie quantità maggiori
di Recombinate per controllare un’emorragia. Se questa dose non è in grado di controllare l’emorragia,
il medico può prendere in considerazione l’utilizzo di un altro prodotto. Non aumenti la dose totale di
Recombinate per controllare l’emorragia senza aver prima consultato il medico.
Modo e via di somministrazione
Recombinate viene somministrato in vena (per via endovenosa) dopo aver preparato la soluzione con
il solvente contenuto nella confezione:
- per iniezione da parte del medico o dell’infermiere
- per infusione da parte del medico o dell’infermiere
La velocità di somministrazione deve essere determinata sulla base del livello di benessere del
paziente. Il preparato può essere somministrato fino ad una velocità massima di 10 ml al minuto.
Frequenza delle somministrazioni
Il medico deciderà e le comunicherà la frequenza delle somministrazioni di Recombinate, in base
all’efficacia nel suo caso personale.
Durata del trattamento
In genere la terapia sostitutiva con Recombinate è un trattamento che dura tutta la vita.
Se usa più Recombinate di quanto deve
- Non sono stati riportati sintomi da sovradosaggio con il fattore VIII della coagulazione ricombinante. In caso di dubbi, consulti il medico.
Se dimentica di usare Recombinate
- Non prenda una dose doppia per compensare la dimenticanza di una singola dose.
- Proceda immediatamente con la successiva normale somministrazione e continui a intervalli regolari come consigliato dal medico.
Se interrompe il trattamento con Recombinate
Non interrompa l’uso di Recombinate senza aver consultato il medico a causa della possibile
insorgenza di episodi emorragici a rischio per la vita.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Durante l’utilizzo di questo prodotto sono stati riportati i seguenti effetti indesiderati: nausea, vomito,
dolore addominale, vampate, lieve affaticamento, vertigini, sensazione generale di malessere, cefalea,
esantema cutaneo transitorio (rossore cutaneo), ematoma, reazioni sul sito di iniezione, sudorazione,
brividi, tremori, febbre, dolore alle gambe, mani e piedi freddi, sensazione di formicolio alle mani o ai
piedi, mal di gola, infezioni dell’orecchio, fallimento dei test sull’udito, epistassi e pallore.
Raramente sono stati riferiti eventi avversi da ipersensibilità inclusi: orticaria generalizzata e prurito
(esantema cutaneo con prurito grave e formazione di pomfi), esantema, difficoltà respiratoria, tosse,
dolore o senso di costrizione toracica, respiro sibilante, bassa pressione sanguigna (ipotensione),
perdita di coscienza, rapido battito cardiaco, gravi reazioni da ipersensibilità che possono causare
difficoltà a deglutire e/o respirare, gonfiore e arrossamento del volto e/o delle mani (anafilassi).
In caso di reazioni allergiche o anafilattiche è necessario interrompere immediatamente
l’iniezione/infusione e contattare il medico.
Per i bambini non trattati in precedenza con medicinali a base di fattore VIII, la formazione di
anticorpi inibitori (vedere paragrafo 2) può essere molto comune (più di 1 paziente su 10); tuttavia, nei
pazienti che hanno ricevuto un precedente trattamento con fattore VIII (più di 150 giorni di
trattamento) il rischio è non comune (meno di 1 paziente su 100). Se ciò accade il suo medicinale o
quello di suo figlio potrebbe smettere di agire correttamente e lei o suo figlio potreste riscontrare
un’emorragia persistente. Se ciò accade, contatti il medico immediatamente.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico, al farmacista, o all’infermiere.
Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione
avverse .
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Recombinate
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Conservare in frigorifero (2 C - 8 C).
- Non congelare.
- Conservare nell’imballaggio esterno per proteggere il medicinale dalla luce.
- Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola. La data di scadenza è riportata sulla scatola dopo l’abbreviazione “Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese. Durante il periodo di validità può conservare il prodotto a 15°C-25°C prima di usarlo per un massimo di sei mesi. Non lo ricollochi in frigorifero dopo conservazione a 15°C-25°C. Dopo la ricostituzione Recombinate deve essere somministrato a temperatura ambiente entro tre ore.
Conservazione dopo la ricostituzione
- Questo prodotto deve essere utilizzato una sola volta. Usare il prodotto entro tre ore dalla sua ricostituzione.
- Non refrigerare la soluzione dopo la ricostituzione. Non utilizzi Recombinate se la soluzione presenta depositi o è torbida. Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Recombinate
- Il principio attivo è octocog alfa, fattore VIII della coagulazione ricombinante 50 UI/ml, 100 UI/ml o 200 UI/ml. Il prodotto si presenta in tre dosaggi: 250 UI, 500 UI o 1000 UI (Unità Internazionali) per flaconcino di principio attivo.
- Gli altri componenti sono
- per la polvere: albumina umana, sodio cloruro, istidina, macrogol 3350, calcio cloruro diidrato, acido cloridrico (per l’aggiustamento del pH) e sodio idrossido (per l’aggiustamento del pH).
- per il solvente: acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Recombinate e contenuto della confezione
Recombinate si presenta come polvere e solvente per soluzione iniettabile ed è una polvere friabile di
colore bianco o bianco sporco. Dopo ricostituzione, la soluzione è limpida, incolore e priva di
particelle estranee. Il solvente (acqua sterile per preparazioni iniettabili) è un liquido limpido ed
incolore.
La confezione contiene un flaconcino da 250 UI o 500 UI o 1000 UI di polvere, un flaconcino di
solvente da 5 ml, un dispositivo per la ricostituzione (BAXJECT II), una siringa sterile in plastica
monouso, un miniset sterile per infusione, 2 batuffoli di cotone imbevuti di alcol e 2 cerotti.
In alternativa a Baxject II può essere fornito un dispositivo per la ricostituzione con ago comprendente
un ago sterile a due vie (per trasferire il solvente nel flaconcino di Recombinate), un ago filtro sterile
(per trasferire la soluzione ricostituita nella siringa).
Confezione da 1 unità.
Titolare dell’autorizzazione all’immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67, A-1221 Vienna
Rappresentante per l’Italia:
Takeda Italia S.p.A.
Tel. +39 06 502601
Produttore
Baxalta Belgium Manufacturing SA
Bd. René Branquart 80, B-7860 Lessines,
Belgio
Questo medicinale è autorizzato negli Stati Membri dell’Area Economica Europea con le
seguenti denominazioni:
Belgio: Recombinate 250 (500, 1000) UI/5 ml
Recombinate 250 (500, 1000) UI/10 ml
Bulgaria Recombinate 250 (500, 1000) IU/5 ml
Cipro: Recombinate 250 (500, 1000) IU
Germania: Recombinate Antihämophilie Faktor (rekombinant) 1000
Grecia: Recombinate 250 (500, 1000) IU
Lituania: Recombinate 250 (500, 1000) IU/5 ml
Malta: Recombinate 250 (500, 1000) IU
Paesi Bassi: Recombinate 250 (500, 1000) IE/5 ml
Recombinate 250 (500, 1000) IE/10 ml
Estonia: Recombinate 250 (500, 1000) IU/5 ml
Irlanda: Recombinate 250 (500, 1000) IU
Italia: Recombinate 250 (500, 1000) UI/5 ml
Recombinate 250 (500, 1000) UI/10 ml
Lettonia: Recombinate 250 (500, 1000) UI/ 5 ml
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE
Recombinate 250 UI/5 ml polvere e solvente per soluzione iniettabile
Recombinate 500 UI/5 ml polvere e solvente per soluzione iniettabile
Recombinate 1000 UI/5 ml polvere e solvente per soluzione iniettabile
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Octocog alfa 50 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 5 ml contiene 250 UI di octocog alfa
Recombinate 250 UI/5 ml contiene nominalmente 250 UI di octocog alfa, fattore VIII ricombinante
della coagulazione, in ciascun flaconcino.
Il prodotto contiene approssimativamente 50 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione, dopo ricostituzione con 5 ml di acqua sterile per preparazioni iniettabili.
Octocog alfa 100 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 5 ml contiene 500 UI di octocog alfa
Recombinate 500 UI/5 ml contiene nominalmente 500 UI di octocog alfa, fattore VIII ricombinante
della coagulazione, in ciascun flaconcino.
Il prodotto contiene approssimativamente 100 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione, dopo ricostituzione con 5 ml di acqua sterile per preparazioni iniettabili.
Octocog alfa 200 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 5 ml contiene 1000 UI di octocog alfa
Recombinate 1000 UI/5 ml contiene nominalmente 1000 UI di octocog alfa, fattore VIII ricombinante
della coagulazione, in ciascun flaconcino.
Il prodotto contiene approssimativamente 200 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione, dopo ricostituzione con 5 ml di acqua sterile per preparazioni iniettabili.
L’attività viene determinata utilizzando il test cromogenico della Farmacopea Europea rispetto allo
Standard Mega FDA calibrato secondo lo Standard WHO. L'attività specifica di Recombinate è di
circa 4000 – 8000 UI/mg di proteine.
Recombinate contiene fattore VIII ricombinante della coagulazione (INN: octocog alfa). Octocog alfa
(fattore VIII ricombinante della coagulazione) è una proteina purificata composta da 2332 aminoacidi.
Ha una sequenza di aminoacidi comparabile a quella del fattore VIII e modifiche post-traduzionali
simili alla molecola di derivazione plasmatica. Il fattore VIII ricombinante della coagulazione è una
glicoproteina espressa da cellule di mammifero prodotte mediante metodi di bioingegneria ottenute
dalla linea cellulare dell'ovaio di criceto cinese.
Eccipienti con effetto noto:
Ciascun flaconcino contiene 35 mg (1,5 mmol) di sodio.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Polvere e solvente per soluzione iniettabile.
Polvere friabile da bianca a bianco sporco. Il solvente (acqua sterile per preparazioni iniettabili) è un
liquido limpido e incolore.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Trattamento e profilassi delle emorragie in pazienti con emofilia A (deficienza congenita di Fattore
VIII).
Questo prodotto non contiene fattore di von Willebrand e pertanto non è indicato nella malattia di von
Willebrand.
Recombinate è indicato per tutti i gruppi di età, dai neonati agli adulti.
4.2 Posologia e modo di somministrazione
Il trattamento deve essere supervisionato da un medico con esperienza nel trattamento dell’emofilia.
Monitoraggio del trattamento
Nel corso del trattamento, si raccomanda una determinazione appropriata dei livelli di fattore VIII per
stabilire la dose da somministrare e la frequenza alla quale ripetere le infusioni. La risposta dei singoli
pazienti al fattore VIII può variare, con conseguenti emivite e recuperi differenti. La dose basata sul
peso corporeo può richiedere un aggiustamento nei pazienti sottopeso o in sovrappeso. In particolare
nel caso di interventi chirurgici maggiori è indispensabile un puntuale monitoraggio della terapia
sostitutiva mediante analisi della coagulazione (attività del fattore VIII plasmatico).
Posologia
Il dosaggio e la durata della terapia sostitutiva dipendono dalla gravità del deficit della funzione
emostatica, dalla localizzazione e dal grado dell’emorragia e dalle condizioni cliniche del paziente.
Il trattamento deve essere eseguito in collaborazione con un medico esperto nei disordini della
coagulazione e con un laboratorio in grado di misurare la concentrazione plasmatica dell'AHF.
Il numero di unità di fattore VIII somministrato viene espresso in Unità Internazionali (UI), riferite
all'attuale standard WHO per i prodotti a base di fattore VIII. L’attività plasmatica del fattore VIII è
espressa sia in percentuale (riferita al plasma umano normale) sia in Unità Internazionali (riferite ad
uno standard internazionale per il fattore VIII plasmatico).
Una Unità Internazionale (UI) di attività di fattore VIII è equivalente alla quantità di fattore VIII
contenuta in 1 ml di plasma umano normale.
Trattamento al bisogno
L’aumento atteso in vivodel livello di picco di Recombinate espresso in UI/dL di plasma o in %
(percentuale) del normale può essere calcolato moltiplicando per due la dose somministrata per kg di
peso corporeo (UI/kg).
Il metodo di calcolo è illustrato nei seguenti esempi:
Aumento % atteso di FVIII = N° di unità somministrate x 2% / UI / kg
peso corporeo (kg)
Esempio per un adulto di 70 kg: 1750 UI x 2% / UI / kg = 50%
70 kg
oppure
Dose richiesta (UI) = peso corporeo (kg) x aumento % desiderato di FVIII
2% / UI /kg
Esempio per un bambino di 40 kg: 40 kg x 70% = 1400 UI
2% / UI / kg
Benché il dosaggio possa essere stimato con il calcolo precedente, si raccomanda fortemente di
eseguire, quando possibile, appropriate analisi di laboratorio comprensive del dosaggio seriale di AHF
sul plasma del paziente ad adeguati intervalli di tempo per assicurarsi che siano stati raggiunti e
mantenuti gli adeguati livelli di AHF. Se nel paziente non viene raggiunto il livello plasmatico di AHF
desiderato, o se l’emorragia non viene controllata dopo somministrazione di una dose adeguata, si
deve sospettare la presenza di un inibitore. Con appropriati esami di laboratorio la presenza di un
inibitore può essere evidenziata e quantificata in termini di Unità Internazionali AHF neutralizzate da
1 ml di plasma (Unità Bethesda) o dal volume totale, stimato, del plasma. Se l’inibitore è presente in
quantità inferiori alle 10 Unità Bethesda per ml, la somministrazione di ulteriore AHF può
neutralizzare l'inibitore. Pertanto, la somministrazione di ulteriori Unità Internazionali di AHF deve
portare al risultato previsto. In questi casi è necessario il controllo dei livelli di AHF con analisi di
laboratorio. Livelli di inibitore superiori alle 10 Unità Bethesda per ml possono rendere impossibile o
impraticabile il controllo dell’emostasi con AHF a causa dei dosaggi troppo elevati richiesti.
Lo schema posologico seguente riportato nella Tabella I può essere usato come guida per gli adulti e
per i bambini. La quantità da somministrare e la frequenza delle infusioni devono essere sempre
rivolte all’efficacia clinica nei singoli casi.
A seconda dei casi e secondo il giudizio del medico, Recombinate può essere somministrato anche per
la profilassi (a breve o lungo termine) delle emorragie.
Nel caso dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto del
livello di attività plasmatica dato (in <% del normale>
seguente può essere utilizzata come guida per la definizione del dosaggio negli episodi di
sanguinamento e negli interventi chirurgici:
Tabella I: Schema del dosaggio
| Emorragia | n | |
| Grado dell’emorragia | a Picco di attività di AHF i richiesta nel sangue dopo l infusione (% del normale o UI/dL di plasma) | Frequenza di infusione |
| Emartro allo stato iniziale, emorragia muscolare o orale | a
| Iniziare a infondere, ogni 12 - 24 ore, da uno a tre giorni fino a che l’episodio emorragico sia risolto (sulla base del dolore) o si sia giunti a guarigione |
| a Emartro più esteso; i emorragia muscolare o z ematoma |
| Ripetere l’infusione ogni 12 - 24 ore, di norma per tre giorni o più fino a scomparsa del dolore e a recupero funzionale |
| n Emorragie a rischio per la vita, quali emorragie intracraniche, e emorragie della gola, emorragie addominali gravi |
| Ripetere l’infusione ogni 8 - 24 ore fino a remissione del rischio |
I dati riportati rappresentano i picchi di attività di AHF in pazienti con l’attesa emivita media di
Fattore VIII. Se considerata necessaria, l’attività di picco deve essere misurata entro mezz’ora dalla
somministrazione. In pazienti con emivite del Fattore VIII relativamente brevi, può rendersi necessario
aumentare il dosaggio e/o la frequenza della somministrazione.
Ciascun flaconcino di Recombinate riporta in etichetta l’attività del Fattore Antiemofilico
Ricombinante (Recombinate) espressa in UI per flaconcino.
La determinazione dell’attività si riferisce allo Standard Internazionale del WHO per i concentrati di
Fattore VIII:C. Gli studi effettuati hanno evidenziato che, per determinare con precisione questi livelli
di attività, il test per la determinazione dell’attività deve essere effettuato usando provette e pipette di
plastica ed impiegando un substrato contenente livelli normali di Fattore von Willebrand.
Profilassi
Per la profilassi anti-emorragica a lungo termine in pazienti affetti da grave emofilia A, le dosi normali
sono da 20 - 40 UI di fattore VIII per kg di peso corporeo a intervalli di 2 - 3 giorni.
I pazienti devono essere monitorati per lo sviluppo di inibitori del fattore VIII. In caso di mancato
raggiungimento dei livelli previsti di attività di fattore VIII nel plasma, o se non è possibile controllare
l’episodio emorragico con una dose appropriata, deve esere effettuato un test per determinare
l’eventuale presenza di un inibitore del fattore VIII. Nei pazienti con livelli elevati di inibitore, la
terapia a base di fattore VIII può non risultare efficace e pertanto devono essere prese in
considerazione altre opzioni terapeutiche. Il trattamento di tali pazienti deve essere affidato a medici
esperti nella cura di pazienti con emofilia.
Vedere anche paragrafo 4.4.
Popolazione pediatrica
Recombinate risulta idoneo per essere utilizzato in bambini di tutte le età, inclusi i neonati (studi sulla
sicurezza ed efficacia sono stati effettuati sia in bambini già trattati in precedenza che in bambini non
trattati in precedenza: vedere paragrafo 5.1). Per il trattamento a richiesta, il dosaggio nei pazienti
pediatrici non differisce da quello per i pazienti adulti. Per la profilassi a lungo termine delle
emorragie nei pazienti con emofilia A grave, in alcuni casi possono essere necessari intervalli di
dosaggio più brevi o dosi maggiori rispetto alla dose normale di 20-40 UI di fattore VIII per Kg di
peso corporeo ad intervalli di 2-3 giorni.
Modo di somministrazione
La preparazione deve essere somministrata per via endovenosa dopo ricostituzione con il solvente
fornito (vedere paragrafo 6.6). Il prodotto ricostituito non deve essere refrigerato. Si raccomanda di
somministrare Recombinate a temperatura ambiente non oltre 3 ore dalla ricostituzione. La velocità di
somministrazione deve essere tale da assicurare il benessere del paziente, fino ad un massimo di
10 ml/minuto. Prima e durante la somministrazione di Recombinate, devono essere controllate le
pulsazioni del paziente. Nel caso si verificasse un aumento significativo, la diminuzione della velocità
di infusione o la temporanea sospensione dell’iniezione fanno di norma cessare rapidamente la
sintomatologia (vedere i paragrafi 4.4 e 4.8).
| Chirurgia | o | |
| Tipo di intervento | ||
| Chirurgia minore, incluse le estrazioni dentali |
| c Una singola infusione, più terapia a antifibrinolitica orale, entro un’ora dall’intervento è sufficiente nel 70% m circa dei casi. Ogni 24 ore, per almeno 1 giorno, fino alla guarigione della ferita. |
| Chirurgia maggiore |
| r Ripetere l’infusione ogni 8 - 24 ore a in relazione allo stato di guarigione della ferita. |
Per le istruzioni sulla ricostituzione del medicinale prima della somministrazione, vedere paragrafo
- 6.6.
4.3 Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Nota
reazione allergica alle proteine bovine, murine o di criceto.
4.4 Avvertenze speciali e precauzioni di impiego
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Ipersensibilità
Sono stati riportati casi di gravi reazioni allergiche a Recombinate. Pazienti con nota ipersensibilità
alle proteine murine, bovine o di criceto devono essere trattati con cautela. I pazienti devono essere
informati circa i sintomi precoci delle reazioni da ipersensibilità che comprendono orticaria, orticaria
generalizzata, senso di costrizione toracica, respiro sibilante, ipotensione ed anafilassi. In caso di
insorgenza di una reazione allergica o anafilattica, si deve sospendere immediatamente l’iniezione o
l’infusione. In caso di shock, deve essere attuato il trattamento medico standard per lo shock.
Inibitori
La formazione di anticorpi neutralizzanti (inibitori) verso il fattore VIII rappresenta una complicanza
nota nel trattamento di soggetti affetti da emofilia A. Tali inibitori sono generalmente
immunoglobuline IgG dirette contro l’attività procoagulante del fattore VIII, e sono quantificate in
Unità Bethesda (UB) per ml di plasma per mezzo del saggio modificato. Il rischio di sviluppare
inibitori è correlato alla severità della malattia e al tempo di esposizione al fattore VIII, essendo
maggiore entro i primi 50 giorni di esposizione, ma persiste per tutta la vita nonostante si tratti di un
rischio non comune.
La rilevanza clinica dello sviluppo di inibitori dipenderà dal titolo dell’inibitore: gli inibitori a basso
titolo presenti temporaneamente o che rimarranno costantemente a basso titolo incideranno meno sul
rischio di risposta clinica insufficiente rispetto agli inibitori ad alto titolo.
In generale, tutti i pazienti trattati con prodotti a base di fattore VIII della coagulazione devono essere
attentamente monitorati per lo sviluppo di inibitori mediante appropriate osservazioni cliniche ed
esami di laboratorio. Se non si ottengono i livelli plasmatici di attività del fattore VIII attesi, o se
l'emorragia non è controllata con una dose adeguata, deve essere eseguito un esame al fine di
determinare se siano presenti inibitori del fattore VIII. Nei pazienti con livelli elevati di inibitore, la
terapia con fattore VIII potrebbe non essere efficace e devono essere prese in considerazione altre
soluzioni terapeutiche. La gestione di questi pazienti deve essere affidata a medici con esperienza nel
trattamento dell’emofilia e con gli inibitori del fattore VIII.
Eventi cardiovascolari
Nei pazienti con fattori di rischio cardiovascolare esistenti, la terapia sostitutiva con FVIII può
incrementare il rischio cardiovascolare.
Complicanze correlate al catetere
Qualora sia necessario un dispositivo di accesso venoso centrale (CVAD), deve essere tenuto in
considerazione il rischio di complicanze correlate al CVAD incluse infezioni locali, batteriemia e
trombosi in corrispondenza del sito del catetere.
Popolazione pediatrica
Le avvertenze e le precauzioni per l’uso nei pazienti pediatrici non differiscono da quelle per i pazienti
adulti.
Questo medicinale contiene 35 mg (1,5 mmol) di sodio per ogni flaconcino da 250 UI, 500 UI e
1000 UI, equivalente all’1,8% dell’assunzione massima giornaliera raccomandata dall’OMS che
corrisponde a 2 g di sodio per un adulto. Bisogna tenerne conto in caso di pazienti sottoposti a dieta
iposodica.
4.5 Interazioni con altri medicinali ed altre forme di interazione
Non sono stati effettuati studi di interazione.
4.6 Fertilità, gravidanza e allattamento
Non sono stati eseguiti studi sulla riproduzione animale con fattore VIII. Considerando che l’emofilia
A nelle donne è un evento raro, non sono disponibili dati sperimentali circa l’impiego di fattore VIII in
gravidanza o durante l’allattamento al seno. Il fattore VIII deve essere pertanto somministrato durante
la gravidanza e l’allattamento al seno solo se chiaramente indicato.
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Non sono stati osservati effetti sulla capacità di guidare veicoli o di usare macchinari.
4.8 Effetti indesiderati
Tabella riassuntiva delle reazioni avverse
La tabella successiva elenca le reazioni avverse segnalate da rapporti spontanei e da studi clinici.
La tabella presentata di seguito è stata stilata sulla base della classificazione MedDRA per sistemi e
organi (SOC e Preferred Term).
La frequenza è stata valutata secondo i seguenti criteri: molto comune ( 1/10), comune ( 1/100,
<1/10), non comune ( 1/1.000, < 1/100), raro ( 1/10.000, < 1/1.000), molto raro (<1/10.000) non nota
(la frequenza non può essere definita sulla base dei dati disponibili).
| Classificazione per sistemi e organi secondo MedDRA | a Frequenza t | Termine MedDRA preferito |
| I Infezioni ed infestazioni | non comune | Infezione dell’orecchio |
| Patologie del sistema emolinfopoietico | non comune (PTPs)1 molto comune (PUPs)1 | Inibizione del Fattore VIII 1 |
| a Disturbi del sistema i immunitario | non nota | Reazione anafilattica Ipersensibilità2 |
| z Patologie del sistema nervoso n e | non comune | Capogiri Tremore |
| non nota | Perdita di coscienza Sincope Cefalea Parestesia | |
| g Patologie cardiache | non nota | Cianosi Tachicardia |
| Patologie vascolari | non comune | Epistassi o Vampate Ematoma c Ipotensione Pallore a Sensazione di freddo alle estremità |
| Patologie respiratorie, toraciche e mediastiniche | non comune | Dolore faringolaringeo |
| non nota | m Dispnea Tosse Respiro sibilante | |
| Patologie gastrointestinali | non comune | r Nausea |
| non nota | a Vomito Dolore addominale | |
| Patologie della cute e del tessuto sottocutaneo | non comune l | F Iperidrosi Prurito Esantema Esantema maculo-papuloso |
| e non nota d | Angioedema Orticaria Esfoliazione cutanea Eritema | |
| Patologie del sistema muscoloscheletrico e del tessuto connettivo | non comune a | Dolore alle estremità |
| Patologie sistemiche e condizioni relative alla sede di somministrazione | comune | Brividi |
| n non comune | Sensazione di affaticamento Piressia | |
| a i non nota l | Malessere Reazioni al sito di iniezione Dolore toracico Senso di costrizione toracica | |
| Esami diagnostici | a non comune t | Test di stimolazione acustica anomali |
La frequenza si basa su studi condotti con tutti i prodotti a base di fattore VIII che hanno incluso
pazienti con emofilia A grave. PTPs = pazienti trattati in precedenza, PUPs = pazienti non trattati in
precedenza.
Segni precoci di reazioni da ipersensibilità sono ad esempio orticaria, dispnea, tosse, senso di
costrizione toracica, respiro sibilante, anafilassi, esantema, ipotensione, prurito, brividi, vampate,
piressia, cianosi, tachicardia, vomito, sincope, cefalea. Si raccomanda di usare cautela nei pazienti con
note reazioni allergiche verso i costituenti del preparato (vedere paragrafi 4.3. e 4.4.).
Descrizione delle reazioni avverse selezionate
Lo sviluppo di anticorpi neutralizzanti (inibitori) può verificarsi in pazienti affetti da emofilia A trattati
con fattore VIII, incluso Recombinate. L’eventuale presenza di inibitori si manifesterà come
un’insufficiente risposta clinica. In tali casi, si raccomanda di contattare un centro emofilia
specializzato.
Popolazione pediatrica
Durante gli studi clinici non sono state notate differenze età-specifiche per le reazioni avverse, ad
eccezione dello sviluppo di inibitori nei pazienti pediatrici precedentemente non trattati (PUPs).
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale
è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del
medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse . .
4.9 Sovradosaggio
Non sono noti sintomi da sovradosaggio.
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: antiemorragici: fattore VIII della coagulazione del sangue. Codice
ATC: B02BD02.
Il complesso fattore VIII / fattore di von Willebrand è composto da due molecole (fattore VIII e fattore
di von Willebrand) con differenti funzioni fisiologiche.
Quando viene infuso in un paziente emofilico, il fattore VIII si lega in circolo al fattore di von
Willebrand.
Il fattore VIII attivato agisce come co-fattore del fattore IX attivato, accelerando la conversione del
fattore X a fattore X attivato; questo converte la protrombina in trombina che, a sua volta, converte il
fibrinogeno in fibrina dando così luogo ad un coagulo. L’emofilia A è un disordine ereditario della
coagulazione del sangue legato al sesso dovuto a riduzione dei livelli di fattore VIII:C e determina
vaste emorragie a carico di articolazioni, muscoli o organi interni, sia spontanee che accidentali o
causate da traumi chirurgici. La terapia sostitutiva consente l’aumento dei livelli plasmatici di fattore
VIII permettendo quindi la correzione temporanea del deficit del fattore e la correzione delle tendenze
emorragiche.
Si segnala che il tasso di sanguinamento annualizzato (ABR) non è comparabile tra diversi concentrati
di fattore e tra studi clinici diversi.
Popolazione pediatrica
Recombinate è stato studiato in 71 bambini non trattati in precedenza (PUPs), la cui età media al
momento della prima infusione di Recombinate era di 10 mesi (range: 2 giorni – 50 mesi). Il prodotto
è risultato ben tollerato e non associato a significativi effetti avversi a breve termine. La sua efficacia
clinica è stata comparabile a quella di altre molecole di FVIII a catena integra sia nel trattamento di
emorragie acute che per la profilassi chirurgica (10 soggetti erano stati sottoposti a interventi
chirurgici). Il follow-up a lungo termine dei soggetti ha rivelato un’incidenza di eventi avversi
correlati al prodotto di 0,86/1.000 infusioni, di cui nessuno grave o a rischio per la vita.
5.2 Proprietà farmacocinetiche
Studi farmacocinetici in 69 pazienti già trattati in precedenza hanno dimostrato che l’emivita media di
Recombinate circolante è pari a 14,6 4,9 ore (n = 67), valore che non presenta una differenza
statisticamente significativa rispetto a quello relativo all’HemofilM, Fattore Antiemofilico (Umano)
ottenuto da plasma (pdAHF), la cui emivita media è di 14,7 5,1 ore (n = 61). Il reale recupero
rispetto al baseline osservato con Recombinate dopo infusione di una dose di 50 UI/kg è stato di 123,9
± 47,7 UI/dL (n = 23), che è significativamente più elevato del reale recupero rispetto al baseline
osservato con l’HemofilM pari a 101,7 31,6 UI/dL (n = 61). Tuttavia il rapporto calcolato fra
recupero reale ed atteso (cioè un incremento del 2% dell’attività del Fattore VIII per 1 UI di rAHF /kg
di peso corporeo) con Recombinate (121,2 48,9%) è simile a quello dell’HemofilM (123,4 16,4%).
Un totale di 494 studi sul recupero è stato ottenuto su 68 pazienti precedentemente non trattati.
Duecentododici studi sul recupero sono stati eseguiti quando i pazienti erano in trattamento per episodi
emorragici con un reale recupero medio ± DS di 70,0 ± 37,9 UI/dL (N = 208, essendo stati omessi
dall’analisi quattro recuperi perché i valori erano al di fuori dell’intervallo di riferimento). L’alta
variabilità è dovuta all’ampio range dei reali dosaggi somministrati, da 13,8 a 103,2 UI/kg (media ±
DS di 36,0 ± 16,2 e mediana di 30,2 UI/kg). Tenendo conto dei dosaggi variabili, è stato calcolato il
rapporto fra recupero reale e predetto che è risultato pari ad una media del 1,0 ± 0,3.
Un totale di 68 studi sul recupero è stato eseguito quando i pazienti ricevevano successive infusioni
per il trattamento continuato di episodi emorragici preesistenti. Il reale livello di recupero del FVIII è
stato corretto per il livello di FVIII preinfusione. Il reale recupero medio DS è risultato 88,6 38,2
UI/dL (N = 66, con due recuperi omessi dall’analisi perché i valori erano al di fuori dell’intervallo di
riferimento). Nuovamente l’ampio range delle dosi realmente somministrate, da 18,5 a 85,7 UI/kg
(media DS di 38,6 15,9 e mediana di 32,1 UI/kg) ha avuto come risultato una sostanziale
variazione dei livelli di recupero osservati. Il rapporto medio DS fra recupero reale e predetto è stato
di 1,0 0,3 con una mediana di 1,0.
Un totale di 214 studi sul recupero è stato eseguito quando i pazienti erano stabilizzati con un recupero
reale medio di 71,6 29,7 UI/dL (N = 209, con cinque recuperi omessi dall’analisi perché i valori
erano al di fuori dell’intervallo di riferimento). I dosaggi somministrati variavano da 10,4 a 68,1 UI/kg
(media DS di 38,0 12,7 e mediana di 36,1 UI/kg). Il rapporto medio DS fra recupero reale e
predetto è stato di 1,0 0,3.
5.3 Dati preclinici di sicurezza
Recombinate agisce come il Fattore VIII endogeno. Dosaggi varie volte superiori a quelli
raccomandati nell’uomo per kg di peso corporeo non hanno mostrato effetti tossici in test su animali
da laboratorio. Recombinate è stato saggiato per la mutagenicità sia in vitroa dosaggi notevolmente
superiori al tasso plasmatico di AHF sia in vivoa dosi fino a 10 volte la dose massima suggerita per la
clinica senza causare mutazioni inverse, aberrazioni cromosomiche, o un aumento dei micronuclei in
eritrociti policromatici di midollo osseo.
Poiché l’esperienza clinica non fornisce alcuna evidenza di effetti cancerogeni e mutagenici, non è
stato considerato necessario effettuare studi a lungo termine per valutare la potenziale cancerogenicità
nell’animale.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Polvere:
Albumina umana
Sodio cloruro
Istidina
Macrogol 3350
Calcio cloruro diidrato
Acido cloridrico (per l’aggiustamento del pH)
Sodio idrossido (per l’aggiustamento del pH)
Solvente:
Acqua per preparazioni iniettabili
6.2 Incompatibilità
In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri medicinali.
Si deve utilizzare esclusivamente il set di infusione contenuto nella confezione in quanto il trattamento
può fallire a causa dell'assorbimento del fattore VIII della coagulazione umano alle superfici interne di
alcuni dispositivi per infusione.
6.3 Periodo di validità
3 anni. Dopo la ricostituzione Recombinate non deve essere refrigerato e deve essere somministrato
entro tre ore.
6.4 Precauzioni particolari per la conservazione
Conservare in frigorifero (2°C – 8°C).
Non congelare.
Conservare nell’imballaggio esterno per proteggere il medicinale dalla luce.
Entro il periodo di validità il medicinale può essere conservato fino a sei mesi a 15°C - 25°C prima
dell'uso.
Non refrigerare nuovamente dopo conservazione a 15-25°C.
Per le condizioni di conservazione dopo la ricostituzione del medicinale, vedere paragrafo 6.3.
6.5 Natura e contenuto del contenitore
Una confezione contiene un flaconcino di polvere, un flaconcino con 5 ml di solvente (entrambi di
vetro di tipo I con tappi di gomma) e un dispositivo per la ricostituzione (BAXJECT II) + una siringa
sterile monouso in plastica + un miniset sterile per infusione + 2 batuffoli di cotone imbevuti di alcool
+ due cerotti.
In alternativa a BAXJECT II la confezione può contenere un dispositivo munito di ago per la
ricostituzione comprendente un ago sterile a due vie (per trasferire il solvente nel flaconcino di
Recombinate), un ago filtro sterile (per trasferire la soluzione ricostituita nella siringa).
Confezione da 1 unità.
6.6 Precauzioni particolari per lo smaltimento e la manipolazione
Il preparato deve essere somministrato per via endovenosa dopo ricostituzione con l’acqua sterile per
preparazioni iniettabili contenuta nella confezione. Si deve usare la siringa monouso in plastica inclusa
nella confezione.
- Usare entro 3 ore dalla ricostituzione.
- Non refrigerare dopo ricostituzione.
- Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
- La soluzione deve apparire limpida o leggermente opalescente. Non utilizzare soluzioni torbide o con depositi. Prima della somministrazione, i prodotti ricostituiti devono essere controllati visivamente per rilevare eventuali particelle o colorazione anomala.
- Non usare nel caso in cui il prodotto, il suo sistema sterile di barriera, o il suo confezionamento siano danneggiati o mostrino qualsiasi segno di deterioramento.
| o Ricostituzione: Usare una tecnica asettica | |
| Ricostituzione con BAXJECT II | c Ricostituzione con aghi |
    | a
|
| o Somministrazione: Usare una tecnica asettica | |
Si raccomanda di iniziare la somministrazione non oltre le tre ore dalla ricostituzione. Il prodotto ricostituito non deve essere refrigerato. Prima della somministrazione i prodotti per uso parenterale devono essere sottoposti a ispezione visiva per rilevare eventuali particelle o colorazioni anomale, se la soluzione ed il contenitore lo permettono. Per Recombinate è accettabile una colorazione da incolore a leggermente giallastra.
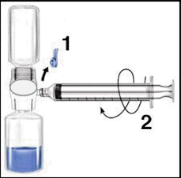 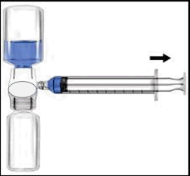 | c Si raccomanda di iniziare la somministrazione non oltre le tre ore dalla ricostituzione. Il prodotto a ricostituito non deve essere refrigerato. Prima della somministrazione i prodotti per uso m parenterale devono essere sottoposti a ispezione visiva per rilevare eventuali particelle o colorazioni anomale, se la soluzione ed il contenitore lo permettono. Per Recombinate è r accettabile una colorazione da incolore a a leggermente giallastra. F
|
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Baxalta Innovations GmbH
Industriestrasse 67, A-1221 Vienna
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n° 028687046: “250 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687073 “250 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
AIC n° 028687059 “500 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687085 “500 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
AIC n° 028687061 “1000 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687097 “1000 U.I./5 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
9. DATA DELLA PRIMA AUTORIZZAZIONE / RINNOVO DELL’AUTORIZZAZIONE
Data della prima autorizzazione: 23 ottobre 2013
Data del rinnovo dell’autorizzazione: 9 aprile 2018
10. DATA DI REVISIONE DEL TESTO
Recombinate 250 UI/10 ml polvere e solvente per soluzione iniettabile, 500 UI/10 ml polvere e solvente per soluzione iniettabile, 1000 UI/10 ml polvere e solvente per soluzione iniettabile
Octocog alfa (fattore VIII ricombinante della coagulazione)
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista o all’infermiere.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista o all’infermiere.
Contenuto di questo foglio:
- 1. Cos’è Recombinate e a che cosa serve
- 2. Cosa deve sapere prima di usare Recombinate
- 3. Come usare Recombinate
- 4. Possibili effetti indesiderati
- 5. Come conservare Recombinate
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Recombinate e a cosa serve
Recombinate appartiene ad un gruppo farmacoterapeutico denominato fattore VIII della coagulazione
del sangue.
Recombinate viene usato in pazienti con emofilia A (deficit congenito di fattore VIII) per:
- prevenzione di emorragie
- trattamento di emorragie (es. emorragie muscolari, orali, emorragie sul sito chirurgico)
Recombinate non contiene fattore di von Willebrand e pertanto non è indicato nella malattia di von
Willebrand (un particolare disordine della coagulazione del sangue).
2. Cosa deve sapere prima di usare Recombinate
Non usi Recombinate
- Se è allergico a octocog alfa, alle proteine murine, bovine o di criceto o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6). In caso di dubbi, si rivolga al medico.
Avvertenze e precauzioni
In caso di reazioni allergiche:
- Esiste una rara possibilità di avere una reazione anafilattica (una reazione allergica grave e improvvisa) verso Recombinate. È necessario saper riconoscere i segni precoci di reazioni allergiche quali esantema, orticaria, pomfi, prurito generalizzato, edema delle labbra e della lingua, difficoltà respiratoria, dispnea, oppressione al petto, sensazione generale di malessere e vertigini. Questi sintomi possono costituire un segno precoce di shock anafilattico, le cui manifestazioni possono anche includere un’estrema sensazione di vertigine, perdita della coscienza ed estrema difficoltà a respirare.
- In caso di insorgenza di uno qualunque di questi sintomi, è necessario interrompere immediatamente l’infusione. Per i sintomi gravi, inclusa la difficoltà respiratoria e svenimenti (o sensazione di mancamento), è necessario un pronto trattamento di emergenza.
Quando è necessario eseguire il monitoraggio:
- Il medico può ritenere opportuno eseguire dei test per assicurare che la sua attuale dose sia sufficiente per raggiungere e mantenere adeguati livelli di fattore VIII. Questo è particolarmente importante in caso di interventi chirurgici maggiori. In caso di emorragie persistenti:
- La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per verificare lo sviluppo di questi inibitori. Se Recombinate non mantiene sotto controllo l’emorragia sua o di suo figlio, informi il medico immediatamente.
Altri medicinali e Recombinate
Non sono state osservate interazioni sfavorevoli con altri medicinali.
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere
qualsiasi altro medicinale.
Gravidanza e allattamento
Non esistono esperienze circa l'uso di Recombinate durante la gravidanza o l'allattamento, dal
momento che l'emofilia A è una condizione rara fra le donne. Pertanto, informi il medico in caso di
gravidanza o di allattamento. Il medico deciderà se Recombinate può essere utilizzato durante la
gravidanza e l’allattamento.
Guida di veicoli e utilizzo di macchinari
Non sono stati riscontrati effetti sulla capacità di guidare o di usare macchinari.
Recombinate contiene sodio
Questo medicinale contiene 35 mg (1,5 mmol) di sodio (componente principale del sale da cucina) per
ogni flaconcino da 250 UI, 500 UI e 1000 UI. Questo equivale all’1,8% dell’assunzione massima
giornaliera raccomandata di 2 g di sodio per un adulto. Bisogna tenerne conto in caso di pazienti
sottoposti a dieta iposodica.
3. Come usare Recombinate
Usi sempre Recombinate seguendo esattamente le istruzioni di un medico esperto nella cura di
pazienti con emofilia A.
Dosaggio per la profilassi anti-emorragica
Nel caso in cui lei usi Recombinate per la prevenzione (profilassi) di emorragie, il medico calcolerà la
dose per lei e gliela comunicherà. Il medico stabilirà la dose in base alle sue particolari esigenze.
Normalmente la dose è di 20-40 UI di octocog alfa per chilogrammo di peso corporeo, somministrate
a intervalli di 2 - 3 giorni. Tuttavia, in alcuni casi, soprattutto per i pazienti più giovani, possono essere
necessari intervalli più brevi o dosi più elevate.
Nel caso in cui supponga che l’effetto di Recombinate sia insufficiente, è necessario che ne parli con il
medico.
Dosaggio per il trattamento delle emorragie
Nel caso in cui lei usi Recombinate per il trattamento di episodi emorragici, il medico calcolerà la dose
adattandola alle sue particolari esigenze per mezzo della seguente formula:
UI necessarie = peso corporeo (chilogrammo) x aumento desiderato di fattore VIII (% del normale) x
0,5
La seguente tabella fornisce una guida per i livelli minimi di fattore VIII nel sangue. Nel caso degli
eventi emorragici elencati, l'attività di fattore VIII non deve scendere al di sotto del livello riportato (in
% del normale) durante il periodo corrispondente.
In certe circostanze possono essere necessarie quantità maggiori rispetto a quelle calcolate, soprattutto
in caso di inibitore a basso titolo.
| Grado dell’emorragia/Tipo di procedura chirurgica | Picco di attività di AHF richiesta nel sangue dopo infusione (% del normale o UI/dL di plasma) | a Frequenza delle infusioni m |
| Grado dell’emorragia Emartro allo stato iniziale; emorragia muscolare o orale Emartro più esteso; emorragia muscolare o ematoma Emorragie a rischio per la vita, quali emorragie intracraniche, emorragie della gola o emorragie addominali gravi |
| r a Infondere ogni 12 - 24 ore da uno a tre giorni fino a che l’episodio F emorragico sia risolto (sulla base del dolore) o si sia giunti a guarigione Ripetere l’infusione ogni 12 - 24 ore, l di norma per tre giorni o più fino a e scomparsa del dolore o a recupero funzionale Ripetere l’infusione ogni 8 - 24 ore fino a remissione del rischio |
| Chirurgia Tipo di intervento Chirurgia minore, incluse le estrazioni dentali Chirurgia maggiore | n a i 30-60 l a t I 80 -100 (pre e post intervento) | Una singola infusione, più terapia antifibrinolitica orale, entro un’ora dall’intervento è sufficiente nel 70% circa dei casi. Ogni 24 ore, per almeno 1 giorno, fino alla guarigione della ferita. Ripetere l’infusione ogni 8 - 24 ore in relazione allo stato di guarigione della ferita. |
Uso nei bambini
Recombinate risulta idoneo per essere utilizzato sia negli adulti, sia nei bambini di tutte le età, inclusi i
neonati. Le raccomandazioni sul dosaggio per il trattamento delle emorragie sopra menzionate sono le
stesse per adulti e bambini. Per la profilassi delle emorragie (prevenzione), in alcuni casi possono
essere necessari intervalli di dosaggio più brevi o dosi maggiori rispetto alla dose normale di 20-40 UI
di fattore VIII per Kg di peso corporeo ad intervalli di 2-3 giorni.
Monitoraggio eseguito dal medico
Il medico eseguirà adeguati test di laboratorio per assicurarsi che siano stati raggiunti adeguati livelli
di fattore VIII. Questo è particolarmente importante in caso di interventi chirurgici maggiori.
Pazienti con inibitori del fattore VIII
Se il livello plasmatico di fattore VIII non raggiunge i livelli desiderati, o se l’emorragia non è
adeguatamente controllata a seguito dell’aumento della dose, si deve sospettare la presenza di inibitori
del fattore VIII. La presenza di inibitori del fattore VIII verrà controllata dal medico.
In caso di avvenuto sviluppo di inibitori del fattore VIII, possono essere necessarie quantità maggiori
di Recombinate per controllare un’emorragia. Se questa dose non è in grado di controllare l’emorragia,
il medico può prendere in considerazione l’utilizzo di un altro prodotto. Non aumenti la dose totale di
Recombinate per controllare l’emorragia senza aver prima consultato il medico.
Modo e via di somministrazione
Recombinate viene somministrato in vena (per via endovenosa) dopo aver preparato la soluzione con
il solvente contenuto nella confezione:
- per iniezione da parte del medico o dell’infermiere
- per infusione da parte del medico o dell’infermiere.
La velocità di somministrazione deve essere determinata sulla base del livello di benessere del
paziente. Il preparato può essere somministrato fino ad una velocità massima di 10 ml al minuto.
Frequenza delle somministrazioni
Il medico deciderà e le comunicherà la frequenza delle somministrazioni di Recombinate, in base
all’efficacia nel suo caso personale.
Durata del trattamento
In genere la terapia sostitutiva con Recombinate è un trattamento che dura tutta la vita.
Se usa più Recombinate di quanto deve
- Non sono stati riportati sintomi da sovradosaggio con il fattore VIII della coagulazione ricombinante. In caso di dubbi, consulti il medico.
Se dimentica di usare Recombinate
- Non prenda una dose doppia per compensare la dimenticanza di una singola dose.
- Proceda immediatamente con la successiva normale somministrazione e continui a intervalli regolari come consigliato dal medico.
Se interrompe il trattamento con Recombinate
Non interrompa l’uso di Recombinate senza aver consultato il medico a causa della possibile
insorgenza di episodi emorragici a rischio per la vita.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista o
all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Durante l’utilizzo di questo prodotto sono stati riportati i seguenti effetti indesiderati: nausea, vomito,
dolore addominale, vampate, lieve affaticamento, vertigini, sensazione generale di malessere, cefalea,
esantema cutaneo transitorio (rossore cutaneo), ematoma, reazioni sul sito di iniezione, sudorazione,
brividi, tremori, febbre, dolore alle gambe, mani e piedi freddi, sensazione di formicolio alle mani e ai
piedi, mal di gola, infezioni dell’orecchio, fallimento dei test sull’udito, epistassi e pallore.
Raramente sono stati riferiti eventi avversi da ipersensibilità inclusi: orticaria generalizzata e prurito
(esantema cutaneo con prurito grave e formazione di pomfi), esantema, difficoltà respiratoria, tosse,
dolore o senso di costrizione toracica, respiro sibilante, bassa pressione sanguigna (ipotensione),
perdita di coscienza, rapido battito cardiaco, gravi reazioni da ipersensibilità che possono causare
difficoltà a deglutire e/o respirare, gonfiore e arrossamento del volto e/o delle mani (anafilassi).
In caso di reazioni allergiche o anafilattiche è necessario interrompere immediatamente
l’iniezione/infusione e contattare il medico.
Per i bambini non trattati in precedenza con medicinali a base di fattore VIII, la formazione di
anticorpi inibitori (vedere paragrafo 2) può essere molto comune (più di 1 paziente su 10); tuttavia, nei
pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di
trattamento) il rischio è non comune (meno di 1 paziente su 100). Se ciò accade il suo medicinale o
quello di suo figlio potrebbe smettere di agire correttamente e lei o suo figlio potreste riscontrare
un’emorragia persistente. Se ciò accade, contatti il medico immediatamente.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse .
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza
di questo medicinale.
5. Come conservare Recombinate
- Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
- Conservare in frigorifero (2 C - 8 C).
- Non congelare.
- Conservare nell’imballaggio esterno per proteggere il medicinale dalla luce.
- Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta e sulla scatola. La data di scadenza è riportata sulla scatola dopo l’abbreviazione “Scad.”. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Durante il periodo di validità può conservare il prodotto a 15°C-25°C prima di usarlo per un massimo
di sei mesi. Non lo ricollochi in frigorifero dopo conservazione a 15°C-25°C. Dopo la ricostituzione
Recombinate deve essere somministrato a temperatura ambiente entro tre ore.
Conservazione dopo la ricostituzione
- Questo prodotto deve essere utilizzato una sola volta. Usare il prodotto entro tre ore dalla sua ricostituzione.
- Non refrigerare la soluzione dopo la ricostituzione. Non utilizzi Recombinate se la soluzione presenta depositi o è torbida. Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Recombinate
- Il principio attivo è octocog alfa, fattore VIII della coagulazione ricombinante 25 UI/ml, 50 UI/ml o 100 UI/ml. Il prodotto si presenta in tre dosaggi: 250 UI, 500 UI o 1000 UI (Unità Internazionali) per flaconcino di principio attivo.
- Gli altri componenti sono
- per la polvere: albumina umana, sodio cloruro, istidina, macrogol 3350, calcio cloruro diidrato, acido cloridrico (per l’aggiustamento del pH) e sodio idrossido (per l’aggiustamento del pH).
- Per il solvente: acqua per preparazioni iniettabili.
Descrizione dell’aspetto di Recombinate e contenuto della confezione
Recombinate si presenta come polvere e solvente per soluzione iniettabile ed è una polvere friabile di
colore bianco o bianco sporco. Dopo ricostituzione, la soluzione è limpida, incolore e priva di
particelle estranee. Il solvente (acqua sterile per preparazioni iniettabili) è un liquido limpido ed
incolore.
La confezione contiene un flaconcino da 250 UI o 500 UI o 1000 UI di polvere, un flaconcino di
solvente da 10 ml, un dispositivo per la ricostituzione (BAXJECT II), una siringa sterile in plastica
monouso, un miniset sterile per infusione, 2 batuffoli di cotone imbevuti di alcol e 2 cerotti.
In alternativa a Baxject II può essere fornito un dispositivo per la ricostituzione con ago comprendente
un ago sterile a due vie (per trasferire il solvente nel flaconcino di Recombinate), un ago filtro sterile
(per trasferire la soluzione ricostituita nella siringa).
Confezione da 1 unità
Titolare dell’autorizzazione all’immissione in commercio
Baxalta Innovations GmbH
Industriestrasse 67, A-1221 Vienna
Rappresentante per l’Italia:
Takeda Italia S.p.A.
Tel. +39 06 502601
Produttore
Baxalta Belgium Manufacturing SA
Bd. René Branquart 80, B-7860 Lessines,
Belgio
Questo medicinale è autorizzato negli Stati Membri dell’Area Economica Europea con le
seguenti denominazioni:
Belgio: Recombinate 250 (500, 1000) UI/10 ml
Recombinate 250 (500, 1000) UI/5 ml
Bulgaria: Recombinate 500 IU/5 ml
Cipro: Recombinate 250 (500, 1000) IU
Estonia: Recombinate 250 (500, 1000) IU/5 ml
Germania: Recombinate Antihämophilie Factor (rekombinant) 1000
Grecia: Recombinate 250 (500, 1000) IU
Lituania: Recombinate 250 (500, 1000) IU/10 ml
Malta: Recombinate 250 (500, 1000) IU
Paesi Bassi: Recombinate 250 (500, 1000) IE/10 ml
Recombinate 250 (500, 1000) IE/5 ml
Irlanda: Recombinate 250 (500, 1000) IU
Italia: Recombinate 250 (500, 1000) UI/10 ml
Recombinate 250 (500, 1000) UI/5 mlLettonia: Recombinate 250
(500, 1000) UI/5 ml
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE
Recombinate 250 UI/10 ml polvere e solvente per soluzione iniettabile
Recombinate 500 UI/10 ml polvere e solvente per soluzione iniettabile
Recombinate 1000 UI/10 ml polvere e solvente per soluzione iniettabile
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Octocog alfa 25 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 10 ml contiene 250 UI di octocog alfa
Recombinate 250 UI/10 ml contiene nominalmente 250 UI di octocog alfa, fattore VIII ricombinante
della coagulazione, in ciascun flaconcino.
Il prodotto contiene approssimativamente 25 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione, dopo ricostituzione con 10 ml di acqua sterile per preparazioni iniettabili.
Octocog alfa 50 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 10 ml contiene 500 UI di octocog alfa
Recombinate 500 UI/10 ml contiene nominalmente 500 UI di octocog alfa, fattore VIII ricombinante
della coagulazione, in ciascun flaconcino.
Il prodotto contiene approssimativamente 50 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione, dopo ricostituzione con 10 ml di acqua sterile per preparazioni iniettabili.
Octocog alfa 100 UI per ml di soluzione ricostituita
Dopo ricostituzione: Un flaconcino da 10 ml contiene 1000 UI di octocog alfa
Recombinate 1000 UI/10 ml contiene nominalmente 1000 UI di octocog alfa, fattore VIII
ricombinante della coagulazione in ciascun flaconcino.
Il prodotto contiene approssimativamente 100 UI/ml di octocog alfa, fattore VIII ricombinante della
coagulazione dopo ricostituzione con 10 ml di acqua sterile per preparazioni iniettabili.
Il titolo viene determinato utilizzando il test cromogenico della Farmacopea Europea rispetto allo
Standard Mega FDA calibrato secondo lo Standard WHO. L'attività specifica di Recombinate è di
circa 4000 – 8000 UI/mg di proteine.
Recombinate contiene fattore VIII ricombinante della coagulazione (INN: octocog alfa). Octocog alfa
(fattore VIII ricombinante della coagulazione) è una proteina purificata composta da 2332 aminoacidi.
Ha una sequenza di aminoacidi comparabile a quella del fattore VIII e modifiche post-traduzionali
simili alla molecola di derivazione plasmatica. Il fattore VIII ricombinante della coagulazione è una
glicoproteina espressa da cellule di mammifero prodotte mediante metodi di bioingegneria ottenute
dalla linea cellulare dell’ovaio di criceto cinese.
Eccipienti con effetto noto:
Ciascun flaconcino contiene 35 mg (1,5 mmol) di sodio.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Polvere e solvente per soluzione iniettabile.
Polvere friabile da bianca a bianco sporco. Il solvente (acqua per preparazioni iniettabili) è un liquido
limpido e incolore.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Trattamento e profilassi delle emorragie in pazienti con emofilia A (deficienza congenita di Fattore
VIII).
Questo prodotto non contiene fattore di von Willebrand e pertanto non è indicato nella malattia di von
Willebrand.
Recombinate è indicato per tutti i gruppi di età, dai neonati agli adulti.
4.2 Posologia e modo di somministrazione
Il trattamento deve essere supervisionato da un medico con esperienza nel trattamento dell’emofilia.
Monitoraggio del trattamento
Nel corso del trattamento, si raccomanda una determinazione appropriata dei livelli di fattore VIII per
stabilire la dose da somministrare e la frequenza alla quale ripetere le infusioni. La risposta dei singoli
pazienti al fattore VIII può variare, con conseguenti emivite e recuperi differenti. La dose basata sul
peso corporeo può richiedere un aggiustamento nei pazienti sottopeso o in sovrappeso. In particolare
nel caso di interventi chirurgici maggiori è indispensabile un puntuale monitoraggio della terapia
sostitutiva mediante analisi della coagulazione (attività del fattore VIII plasmatico).
Posologia
Il dosaggio e la durata della terapia sostitutiva dipendono dalla gravità del deficit della funzione
emostatica, dalla localizzazione e dal grado dell’emorragia e dalle condizioni cliniche del paziente.
Il trattamento deve essere eseguito in collaborazione con un medico esperto nei disordini della
coagulazione e con un laboratorio in grado di misurare la concentrazione plasmatica dell'AHF.
Il numero di unità di fattore VIII somministrato viene espresso in Unità Internazionali (UI), riferite
all'attuale standard WHO per i prodotti a base di fattore VIII. L’attività plasmatica del fattore VIII è
espressa sia in percentuale (riferita al plasma umano normale) sia in Unità Internazionali (riferite ad
uno standard internazionale per il fattore VIII plasmatico).
Una Unità Internazionale (UI) di attività di fattore VIII è equivalente alla quantità di fattore VIII
contenuta in 1 ml di plasma umano normale.
Trattamento al bisogno
L’aumento atteso in vivodel livello di picco di Recombinate espresso in UI/dL di plasma o in %
(percentuale) del normale può essere calcolato moltiplicando per due la dose somministrata per kg di
peso corporeo (UI/kg).
Il metodo di calcolo è illustrato nei seguenti esempi:
Aumento % atteso di FVIII = N° di unità somministrate x 2% / UI / kg
peso corporeo (kg)
Esempio per un adulto di 70 kg: 1750 UI x 2% / UI / kg = 50%
70 kg
oppure
Dose richiesta (UI) = peso corporeo (kg) x aumento % desiderato di FVIII
2% / UI /kg
Esempio per un bambino di 40 kg: 40 kg x 70% = 1400 UI
2% / UI / kg
Benché il dosaggio possa essere stimato con il calcolo precedente, si raccomanda fortemente di
eseguire, quando possibile, appropriate analisi di laboratorio comprensive del dosaggio seriale di AHF
sul plasma del paziente ad adeguati intervalli di tempo per assicurarsi che siano stati raggiunti e
mantenuti gli adeguati livelli di AHF. Se nel paziente non viene raggiunto il livello plasmatico di AHF
desiderato, o se l’emorragia non viene controllata dopo somministrazione di una dose adeguata, si
deve sospettare la presenza di un inibitore. Con appropriati esami di laboratorio la presenza di un
inibitore può essere evidenziata e quantificata in termini di Unità Internazionali AHF neutralizzate da
1 ml di plasma (Unità Bethesda) o dal volume totale, stimato, del plasma. Se l’inibitore è presente in
quantità inferiori alle 10 Unità Bethesda per ml, la somministrazione di ulteriore AHF può
neutralizzare l'inibitore. Pertanto, la somministrazione di ulteriori Unità Internazionali di AHF deve
portare al risultato previsto. In questi casi è necessario il controllo dei livelli di AHF con analisi di
laboratorio. Livelli di inibitore superiori alle 10 Unità Bethesda per ml possono rendere impossibile o
impraticabile il controllo dell’emostasi con AHF a causa dei dosaggi troppo elevati richiesti.
Lo schema posologico seguente riportato nella Tabella I può essere usato come guida per gli adulti e
per i bambini. La quantità da somministrare e la frequenza delle infusioni devono essere sempre rivolte
all’efficacia clinica nei singoli casi.
A seconda dei casi e secondo il giudizio del medico, Recombinate può essere somministrato anche per
la profilassi (a breve o lungo termine) delle emorragie.
Nel caso dei seguenti eventi emorragici, l’attività del fattore VIII non deve scendere al di sotto del
livello di attività plasmatica dato (in <% del normale>
seguente può essere utilizzata come guida per la definizione del dosaggio negli episodi di
sanguinamento e negli interventi chirurgici:
Tabella I: Schema del dosaggio
| Emorragia | a | |
| Grado dell’emorragia | n Picco di attività di AHF a richiesta nel sangue dopo infusione (% del normale o UI/dL di plasma) | Frequenza di infusione |
| Emartro allo stato iniziale; emorragia muscolare o orale | i l
| Iniziare a infondere, ogni 12 - 24 ore, da uno a tre giorni fino a che l’episodio emorragico sia risolto (sulla base del dolore) o si sia giunti a guarigione |
| Emartro più esteso; a emorragia muscolare o ematoma | I 30 -60 | Ripetere l’infusione ogni 12 - 24 ore, di norma per tre giorni o più fino a scomparsa del dolore e a recupero funzionale |
| i z Emorragie a rischio per la vita, quali emorragie intracraniche, n emorragie della gola o emorragie addominali gravi |
| Ripetere l’infusione ogni 8 - 24 ore fino a remissione del rischio |
| e Chirurgia | ||
| g Tipo di intervento | ||
| A Chirurgia minore, incluse le estrazioni dentali | 30-60 | Una singola infusione, più terapia antifibrinolitica orale, entro un’ora dall’intervento è sufficiente nel 70% circa dei casi. Ogni 24 ore, per almeno 1 giorno, fino alla guarigione della ferita. |
| Chirurgia maggiore | 80 -100 (pre e post intervento) | Ripetere l’infusione ogni 8 - 24 ore in relazione allo stato di guarigione della ferita. |
I dati riportati rappresentano i picchi di attività di AHF in pazienti con l’attesa emivita media di Fattore
VIII. Se considerata necessaria, l’attività di picco deve essere misurata entro mezz’ora dalla
somministrazione. In pazienti con emivite del Fattore VIII relativamente brevi, può rendersi necessario
aumentare il dosaggio e/o la frequenza della somministrazione.
Ciascun flaconcino di Recombinate riporta in etichetta l’attività del Fattore Antiemofilico
Ricombinante (Recombinate) espressa in UI per flaconcino.
La determinazione del titolo si riferisce allo Standard Internazionale del WHO per i concentrati di
Fattore VIII:C. Gli studi effettuati hanno evidenziato che, per determinare con precisione questi livelli
di attività, il test per la determinazione dell’attività deve essere effettuato usando provette e pipette di
plastica ed impiegando un substrato contenente livelli normali di Fattore von Willebrand.
Profilassi
Per la profilassi anti-emorragica a lungo termine in pazienti affetti da grave emofilia A, le dosi normali
sono da 20 - 40 UI di fattore VIII per kg di peso corporeo a intervalli di 2 - 3 giorni.
I pazienti devono essere monitorati per lo sviluppo di inibitori del fattore VIII. In caso di mancato
raggiungimento dei livelli previsti di attività di fattore VIII nel plasma, o se non è possibile controllare
l’episodio emorragico con una dose appropriata, deve essere effettuato un test per determinare
l’eventuale presenza di un inibitore del fattore VIII. Nei pazienti con livelli elevati di inibitore, la
terapia a base di fattore VIII può non risultare efficace e pertanto devono essere prese in
considerazione altre opzioni terapeutiche. Il trattamento di tali pazienti deve essere affidato a medici
esperti nella cura di pazienti con emofilia.
Vedere anche paragrafo 4.4.
Popolazione pediatrica
Recombinate risulta idoneo per essere utilizzato in bambini di tutte le età, inclusi i neonati (studi sulla
sicurezza ed efficacia sono stati effettuati sia in bambini già trattati in precedenza che in bambini non
trattati in precedenza: vedere paragrafo 5.1). Per il trattamento a richiesta, il dosaggio nei pazienti
pediatrici non differisce da quello per i pazienti adulti. Per la profilassi a lungo termine delle emorragie
nei pazienti con emofilia A grave, in alcuni casi possono essere necessari intervalli di dosaggio più
brevi o dosi maggiori rispetto alla dose normale di 20-40 UI di fattore VIII per Kg di peso corporeo ad
intervalli di 2-3 giorni.
Modo di somministrazione
La preparazione deve essere somministrata per via endovenosa dopo ricostituzione con il solvente
fornito (vedere paragrafo 6.6). Il prodotto ricostituito non deve essere refrigerato. Si raccomanda di
somministrare Recombinate a temperatura ambiente non oltre 3 ore dalla ricostituzione. La velocità di
somministrazione deve essere tale da assicurare il benessere del paziente, fino ad un massimo di
10 ml/minuto. Prima e durante la somministrazione di Recombinate, devono essere controllate le
pulsazioni del paziente. Nel caso si verificasse un aumento significativo, la diminuzione della velocità
di infusione o la temporanea sospensione dell’iniezione fanno di norma cessare rapidamente la
sintomatologia (vedere i paragrafi 4.4 e 4.8).
Per le istruzioni sulla ricostituzione del medicinale prima della somministrazione, vedere paragrafo
- 6.6.
4.3 Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Nota
reazione allergica alle proteine bovine, murine o di criceto.
4.4 Avvertenze speciali e precauzioni di impiego
Tracciabilità
Al fine di migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del
medicinale somministrato devono essere chiaramente registrati.
Ipersensibilità
Sono stati riportati casi di gravi reazioni allergiche a Recombinate. Pazienti con nota ipersensibilità
alle proteine murine, bovine o di criceto devono essere trattati con cautela. I pazienti devono essere
informati circa i sintomi precoci delle reazioni da ipersensibilità che comprendono orticaria, orticaria
generalizzata, senso di costrizione toracica, respiro sibilante, ipotensione ed anafilassi. In caso di
insorgenza di una reazione allergica o anafilattica, si deve sospendere immediatamente l’iniezione o
l’infusione. In caso di shock, deve essere attuato il trattamento medico standard per lo shock,
Inibitori
La formazione di anticorpi neutralizzanti (inibitori) verso il fattore VIII rappresenta una complicanza
nota nel trattamento di soggetti affetti da emofilia A. Tali inibitori sono generalmente
immunoglobuline IgG dirette contro l’attività procoagulante del fattore VIII, e sono quantificate in
Unità Bethesda (UB) per ml di plasma per mezzo del saggio modificato. Il rischio di sviluppare
inibitori è correlato alla severità della malattia e al tempo di esposizione al fattore VIII, essendo
maggiore entro i primi 50 giorni di esposizione, ma persiste per tutta la vita nonostante si tratti di un
rischio non comune.
La rilevanza clinica dello sviluppo di inibitori dipenderà dal titolo dell’inibitore: gli inibitori a basso
titolo presenti temporaneamente o che rimarranno costantemente a basso titolo incideranno meno sul
rischio di risposta clinica insufficiente rispetto agli inibitori ad alto titolo.
In generale, tutti i pazienti trattati con prodotti a base di fattore VIII della coagulazione devono essere
attentamente monitorati per lo sviluppo di inibitori mediante appropriate osservazioni cliniche ed
esami di laboratorio. Se non si ottengono i livelli plasmatici di attività del fattore VIII attesi, o se
l'emorragia non è controllata con una dose adeguata, deve essere eseguito un esame al fine di
determinare se siano presenti inibitori del fattore VIII. Nei pazienti con livelli elevati di inibitore, la
terapia con fattore VIII potrebbe non essere efficace e devono essere prese in considerazione altre
soluzioni terapeutiche. La gestione di questi pazienti deve essere affidata a medici con esperienza nel
trattamento dell’emofilia e con gli inibitori del fattore VIII.
Eventi cardiovascolari
Nei pazienti con fattori di rischio cardiovascolare esistenti, la terapia sostitutiva con FVIII può
incrementare il rischio cardiovascolare.
Complicanze correlate al catetere
Qualora sia necessario un dispositivo di accesso venoso centrale (CVAD), deve essere tenuto in
considerazione il rischio di complicanze correlate al CVAD incluse infezioni locali, batteriemia e
trombosi in corrispondenza del sito del catetere.
Popolazione pediatrica
Le avvertenze e le precauzioni per l’uso nei pazienti pediatrici non differiscono da quelle per i pazienti
adulti.
Questo medicinale contiene 35 mg (1,5 mmol) di sodio per ogni flaconcino da 250 UI, 500 UI e
1000 UI, equivalente all’1,8% dell’assunzione massima giornaliera raccomandata dall’OMS che
corrisponde a 2 g di sodio per un adulto. Bisogna tenerne conto in caso di pazienti sottoposti a dieta
iposodica.
4.5 Interazioni con altri medicinali ed altre forme di interazione
Non sono stati effettuati studi di interazione.
4.6 Fertilità, gravidanza e allattamento
Non sono stati eseguiti studi sulla riproduzione animale con fattore VIII. Considerando che l’emofilia
A nelle donne è un evento raro, non sono disponibili dati sperimentali circa l’impiego di fattore VIII in
gravidanza o durante l’allattamento al seno. Il fattore VIII deve essere pertanto somministrato durante
la gravidanza e l’allattamento al seno solo se chiaramente indicato.
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Non sono stati osservati effetti sulla capacità di guidare veicoli o di usare macchinari.
4.8 Effetti indesiderati
Tabella riassuntiva delle reazioni avverse
La tabella successiva elenca le reazioni avverse segnalate da rapporti spontanei e da studi clinici.
La tabella presentata di seguito è stata stilata sulla base della classificazione MedDRA per sistemi e
organi (SOC e Preferred Term).
La frequenza è stata valutata secondo i seguenti criteri: molto comune ( 1/10), comune ( 1/100,
<1/10), non comune ( 1/1.000, < 1/100), raro ( 1/10.000, < 1/1.000), molto raro (<1/10.000) non nota
(la frequenza non può essere definita sulla base dei dati disponibili).
| Classificazione per sistemi e organi secondo MedDRA | d Frequenza | Termine MedDRA preferito |
| Infezioni ed infestazioni | a non comune | Infezione dell’orecchio |
| Patologie del sistema emolinfopoietico | n non comune (PTPs)1 molto comune (PUPs)1 | Inibizione del Fattore VIII 1 |
| Disturbi del sistema immunitario | a non nota | Reazione anafilattica Ipersensibilità2 |
| Patologie del sistema nervoso | i non comune l | Capogiri Tremore |
| a non nota t | Perdita di coscienza Sincope Cefalea Parestesia | |
| Patologie cardiache | I non nota | Cianosi Tachicardia |
| a Patologie vascolari i z n | non comune | Epistassi Vampate Ematoma Ipotensione Pallore Sensazione di freddo alle estremità |
| e Patologie respiratorie, toraciche g e mediastiniche | non comune | Dolore faringolaringeo |
| non nota | Dispnea Tosse Respiro sibilante | |
| A Patologie gastrointestinali | non comune | Nausea |
| non nota | Vomito Dolore addominale |
| Patologie della cute e del tessuto sottocutaneo | non comune | Iperidrosi Prurito o Esantema Esantema maculo-papuloso |
| non nota | c Angioedema Orticaria a Esfoliazione cutanea Eritema | |
| Patologie del sistema muscoloscheletrico e del tessuto connettivo | non comune | m Dolore alle estremità |
| Patologie sistemiche e condizioni relative alla sede di somministrazione | comune | Brividi |
| non comune | r Sensazione di affaticamento a Piressia | |
| non nota | F Malessere Reazioni al sito di iniezione Dolore toracico Senso di costrizione toracica | |
| Esami diagnostici | l e non comune | Test di stimolazione acustica anomali |
La frequenza si basa su studi condotti con tutti i prodotti a base di fattore VIII che hanno incluso
pazienti con emofilia A grave. PTPs = pazienti trattati in precedenza, PUPs = pazienti non trattati in
precedenza.
Segni precoci di reazioni da ipersensibilità sono ad esempio orticaria, dispnea, tosse, senso di
costrizione toracica, respiro sibilante, anafilassi, esantema, ipotensione, prurito, brividi, vampate,
piressia, cianosi, tachicardia, vomito, sincope, cefalea. Si raccomanda di usare cautela nei pazienti con
note reazioni allergiche verso i costituenti del preparato (vedere paragrafi 4.3. e 4.4.).
Descrizione delle reazioni avverse selezionate
Lo sviluppo di anticorpi neutralizzanti (inibitori) può verificarsi in pazienti affetti da emofilia A trattati
con fattore VIII, incluso Recombinate. L’eventuale presenza di inibitori si manifesterà come
un’insufficiente risposta clinica. In tali casi, si raccomanda di contattare un centro emofilia
specializzato.
Popolazione pediatrica
Durante gli studi clinici non sono state notate differenze età-specifiche tra le reazioni avverse, ad
eccezione dello sviluppo di inibitori nei pazienti pediatrici precedentemente non trattati (PUPs).
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale
è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del
medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse .
4.9 Sovradosaggio
Non sono noti sintomi da sovradosaggio.
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: antiemorragici: fattore VIII della coagulazione del sangue. Codice
ATC: B02BD02.
Il complesso fattore VIII / fattore di von Willebrand è composto da due molecole (fattore VIII e fattore
di von Willebrand) con differenti funzioni fisiologiche.
Quando viene infuso in un paziente emofilico, il fattore VIII si lega in circolo al fattore di von
Willebrand.
Il fattore VIII attivato agisce come co-fattore del fattore IX attivato, accelerando la conversione del
fattore X a fattore X attivato; questo converte la protrombina in trombina che, a sua volta, converte il
fibrinogeno in fibrina dando così luogo ad un coagulo. L’emofilia A è un disordine ereditario della
coagulazione del sangue legato al sesso dovuto a riduzione dei livelli di fattore VIII:C e determina
vaste emorragie a carico di articolazioni, muscoli o organi interni, sia spontanee che accidentali o
causate da traumi chirurgici. La terapia sostitutiva consente l’aumento dei livelli plasmatici di fattore
VIII permettendo quindi la correzione temporanea del deficit del fattore e la correzione delle tendenze
emorragiche.
Si segnala che il tasso di sanguinamento annualizzato (ABR) non è comparabile tra diversi concentrati
di fattore e tra studi clinici diversi.
Popolazione pediatrica
Recombinate è stato studiato in 71 bambini non trattati in precedenza (PUPs), la cui età media al
momento della prima infusione di Recombinate era di 10 mesi (range: 2 giorni – 50 mesi). Il prodotto
è risultato ben tollerato e non associato a significativi effetti avversi a breve termine. La sua efficacia
clinica è stata comparabile a quella di altre molecole di FVIII a catena integra sia nel trattamento di
emorragie acute che per la profilassi chirurgica (10 soggetti erano stati sottoposti a interventi
chirurgici). Il follow-up a lungo termine dei soggetti ha rivelato un’incidenza di eventi avversi correlati
al prodotto di 0,86/1.000 infusioni, di cui nessuno grave o a rischio per la vita.
5.2 Proprietà farmacocinetiche
Studi farmacocinetici in 69 pazienti già trattati in precedenza hanno dimostrato che l’emivita media di
Recombinate circolante è pari a 14,6 4,9 ore (n = 67), valore che non presenta una differenza
statisticamente significativa rispetto a quello relativo all’HemofilM, Fattore Antiemofilico (Umano)
ottenuto da plasma (pdAHF) la cui emivita media è di 14,7 5,1 ore (n = 61). Il reale recupero rispetto
al baseline osservato con Recombinate dopo infusione di una dose di 50 UI/kg è stato di 123,9 ± 47,7
UI/dL (n = 23), che è significativamente più elevato del reale recupero rispetto al baseline osservato
con l’HemofilM pari a 101,7 31,6 UI/dL (n = 61). Tuttavia il rapporto calcolato fra recupero reale ed
atteso (cioè un incremento del 2% dell’attività del Fattore VIII per 1 UI di rAHF /kg di peso corporeo)
con Recombinate (121,2 48,9%) è simile a quello dell’HemofilM (123,4 16,4%).
Un totale di 494 studi sul recupero è stato ottenuto su 68 pazienti precedentemente non trattati.
Duecentododici studi sul recupero sono stati eseguiti quando i pazienti erano in trattamento per episodi
emorragici con un reale recupero medio ± DS di 70,0 ± 37,9 UI/dL (N = 208, essendo stati omessi
dall’analisi quattro recuperi perché i valori erano al di fuori dell’intervallo di riferimento). L’alta
variabilità è dovuta all’ampio range dei reali dosaggi somministrati, da 13,8 a 103,2 UI/kg (media ±
DS di 36,0 ± 16,2 e mediana di 30,2 UI/kg). Tenendo conto dei dosaggi variabili, è stato calcolato il
rapporto fra recupero reale e predetto che è risultato pari ad una media del 1,0 ± 0,3.
Un totale di 68 studi sul recupero è stato eseguito quando i pazienti ricevevano successive infusioni
per il trattamento continuato di episodi emorragici preesistenti. Il reale livello di recupero del FVIII è
stato corretto per il livello di FVIII preinfusione. Il reale recupero medio DS è risultato 88,6 38,2
UI/dL (N = 66, con due recuperi omessi dall’analisi perché i valori erano al di fuori dell’intervallo di
riferimento). Nuovamente l’ampio range delle dosi realmente somministrate, da 18,5 a 85,7 UI/kg
(media DS di 38,6 15,9 e mediana di 32,1 UI/kg) ha avuto come risultato una sostanziale
variazione dei livelli di recupero osservati. Il rapporto medio DS fra recupero reale e predetto è stato
di 1,0 0,3 con una mediana di 1,0.
Un totale di 214 studi sul recupero è stato eseguito quando i pazienti erano stabilizzati con un recupero
reale medio di 71,6 29,7 UI/dL (N = 209, con cinque recuperi omessi dall’analisi perché i valori
erano al di fuori dell’intervallo di riferimento). I dosaggi somministrati variavano da 10,4 a 68,1 UI/kg
(media DS di 38,0 12,7 e mediana di 36,1 UI/kg). Il rapporto medio DS fra recupero reale e
predetto è stato di 1,0 0,3.
5.3 Dati preclinici di sicurezza
Recombinate agisce come il Fattore VIII endogeno. Dosaggi varie volte superiori a quelli
raccomandati nell’uomo per kg di peso corporeo non hanno mostrato effetti tossici in test su animali
da laboratorio. Recombinate è stato saggiato per la mutagenicità sia in vitroa dosaggi notevolmente
superiori al tasso plasmatico di AHF sia in vivoa dosi fino a 10 volte la dose massima suggerita per la
clinica senza causare mutazioni inverse, aberrazioni cromosomiche, o un aumento dei micronuclei in
eritrociti policromatici di midollo osseo.
Poiché l’esperienza clinica non fornisce alcuna evidenza di effetti cancerogeni e mutagenici, non è
stato considerato necessario effettuare studi a lungo termine per valutare la potenziale cancerogenicità
nell’animale.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Polvere:
Albumina umana
Sodio cloruro
Istidina
Macrogol 3350
Calcio cloruro diidrato
Acido cloridrico (per l’aggiustamento del pH)
Sodio idrossido (per l’aggiustamento del pH)
Solvente:
Acqua per preparazioni iniettabili
6.2 Incompatibilità
In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri medicinali.
Si deve utilizzare esclusivamente il set di infusione contenuto nella confezione in quanto il trattamento
può fallire a causa dell'assorbimento del fattore VIII della coagulazione umano alle superfici interne di
alcuni dispositivi per infusione.
6.3 Periodo di validità
3 anni. Dopo la ricostituzione Recombinate non deve essere refrigerato e deve essere somministrato
entro tre ore.
6.4 Precauzioni particolari per la conservazione
Conservare in frigorifero (2°C – 8°C).
Non congelare.
Conservare nell’imballaggio esterno per proteggere il medicinale dalla luce.
Entro il periodo di validità il medicinale può essere conservato fino a sei mesi a 15°C - 25°C prima
dell'uso.
Non refrigerare nuovamente dopo conservazione a 15-25°C.
Per le condizioni di conservazione dopo la ricostituzione del medicinale, vedere paragrafo 6.3.
6.5 Natura e contenuto del contenitore
Una confezione contiene un flaconcino di polvere, un flaconcino con 10 ml di solvente (entrambi di
vetro di tipo I con tappi di gomma) e un dispositivo per la ricostituzione (BAXJECT II) + una siringa
sterile monouso in plastica + un miniset sterile per infusione + 2 batuffoli di cotone imbevuti di alcool
+ due cerotti.
In alternativa a BAXJECT II la confezione può contenere un dispositivo munito di ago per la
ricostituzione comprendente un ago sterile a due vie (per trasferire il solvente nel flaconcino di
Recombinate), un ago filtro sterile (per trasferire la soluzione ricostituita nella siringa).
Confezione da 1 unità.
6.6 Precauzioni particolari per lo smaltimento e la manipolazione
Il preparato deve essere somministrato per via endovenosa dopo ricostituzione con l'acqua sterile per
preparazioni iniettabili contenuta nella confezione. Si deve usare la siringa monouso in plastica inclusa
nella confezione.
- Usare entro 3 ore dalla ricostituzione.
- Non refrigerare dopo ricostituzione.
- Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
- La soluzione deve apparire limpida o leggermente opalescente. Non utilizzare soluzioni torbide o con depositi. Prima della somministrazione, i prodotti ricostituiti devono essere controllati visivamente per rilevare eventuali particelle o colorazione anomala.
- Non usare nel caso in cui il prodotto, il suo sistema sterile di barriera, o il suo confezionamento siano danneggiati o mostrino qualsiasi segno di deterioramento.
| i l Ricostituzione: Usare una tecnica asettica | |
| a Ricostituzione con BAXJECT II | Ricostituzione con aghi |
t I
|
|
superiore del dispositivo. Inserire il puntale in plastica bianco attraverso il tappo del Recombinate. Il solvente verrà aspirato nel flaconcino sottovuoto di Recombinate (Fig. c).
    | successivamente rimuovere l’ago dal flaconcino di Recombinate. Agitare o delicatamente fino al discioglimento di tutto il materiale. Assicurarsi che Recombinate sia c completamente disciolto, altrimenti la sostanza attiva sarà rimossa dall’ago filtro. a m r a F |
| Somministrazione: Usare una tecnica asettica | |
Si raccomanda di iniziare la somministrazione non oltre le tre ore dalla ricostituzione. Il prodotto ricostituito non deve essere refrigerato. Prima della somministrazione i prodotti per uso parenterale devono essere sottoposti a ispezione visiva per rilevare eventuali particelle o colorazioni anomale, se la soluzione ed il contenitore lo permettono. Per Recombinate è accettabile una colorazione da incolore a leggermente giallastra.
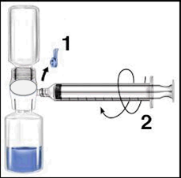 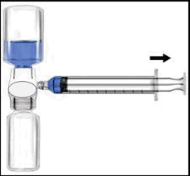 | o Si raccomanda di iniziare la somministrazione non c oltre le tre ore dalla ricostituzione. Il prodotto ricostituito non deve essere refrigerato. Prima a della somministrazione i prodotti per uso parenterale devono essere sottoposti a ispezione m visiva per rilevare eventuali particelle o colorazioni anomale, se la soluzione ed il contenitore lo permettono. Per Recombinate è accettabile una colorazione da incolore a r leggermente giallastra. a
|
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Baxalta Innovations GmbH - Industriestrasse 67, A-1221 Vienna
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AIC n° 028687010 – “250 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687022 - “500 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687034 - “1000 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione senza ago
AIC n° 028687109 - “250 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
AIC n° 028687111 - “500 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
AIC n° 028687123 - “1000 U.I./10 ml polvere e solvente per soluzione iniettabile” 1 flaconcino polvere
+ 1 flaconcino solvente con dispositivo di ricostituzione con ago a doppia punta + ago filtro
9. DATA DELLA PRIMA AUTORIZZAZIONE / RINNOVO DELL’AUTORIZZAZIONE
Data della prima autorizzazione: 12 maggio 1993
Data del rinnovo più recente: 17 maggio 2010
10. DATA DI REVISIONE DEL TESTO
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a RECOMBINATEForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: BAXALTA INNOVATIONS GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 1000 UIPrincipio attivo: coagulation factor VIIIProduttore: CSL BEHRING GMBHPrescrizione richiesta
Medici online per RECOMBINATE
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di RECOMBINATE — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














