
EMOWIL

Come usare EMOWIL
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleContenuto del foglietto illustrativo
EMOWIL 500 UI/10 ml Polvere e solvente per soluzione per infusione, 1000 UI/10 ml Polvere e solvente per soluzione per infusione
Fattore VIII della coagulazione del plasma umano
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per Lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per Lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista.
Contenuto di questo foglio:
- 1. Che cos'è EMOWIL e a cosa serve
- 2. Cosa deve sapere prima di usare EMOWIL
- 3. Come usare EMOWIL
- 4. Possibili effetti indesiderati
- 5. Come conservare EMOWIL
- 6. Contenuto della confezione e altre informazioni
1. Che cos’è EMOWIL e a cosa serve
EMOWIL è una soluzione di fattore VIII della coagulazione del sangue derivato da plasma umano. Il fattore
VIII è una proteina che ha un’azione antiemorragica.
EMOWIL si usa nella terapia di:
emorragie in pazienti affetti da una deficienza ereditaria dell’attività del fattore VIII della coagulazione
(emofilia A);
emorragie in pazienti con una deficienza dell’attività di fattore VIII della coagulazione secondaria ad
altre malattie;
pazienti affetti da malattia di von Willebrand;
pazienti emofilici che hanno sviluppato degli anticorpi contro il fattore VIII (inibitori).
2. Cosa deve sapere prima di usare EMOWIL
Non usi EMOWIL
- se è allergico al fattore VIII umano della coagulazione o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico prima di usare EMOWIL.
Reazione allergica
Sono possibili reazioni di ipersensibilità di tipo allergico con EMOWIL.
EMOWIL contiene tracce di proteine umane diverse dal fattore VIII. Se durante la somministrazione del
prodotto lei nota qualcuno dei sintomi elencati di seguito deve interrompere immediatamente la
somministrazione di EMOWIL e contattare il suo medico perché questi sintomi potrebbero essere i primi
segni di una reazione allergica. I sintomi che si possono manifestare sono: orticaria generalizzata, senso di
costrizione toracica, respiro sibilante, abbassamento della pressione del sangue e reazione allergica anche
grave (shock anafilattico).
Nel caso di shock devono essere messi in atto i trattamenti medici standard per lo shock.
Inibitori
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento con
tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al trattamento
di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per verificare lo sviluppo
di questi inibitori. Se EMOWIL non mantiene sotto controllo l’emorragia sua o di suo figlio, informi il
medico immediatamente.
Eventi cardiovascolari
Nei pazienti che presentano fattori di rischio cardiovascolare, la terapia sostitutiva con FVIII
può aumentare il rischio cardiovascolare.
Complicanze legate all’uso di catetere
Se per Lei è indicato l’uso di un dispositivo di accesso venoso centrale, deve essere considerato il rischio di
complicanze legate al dispositivo, incluse infezioni locali, batteriemia e trombosi nel sito del catetere.
Sicurezza virale
Quando i medicinali sono preparati da sangue o plasma umano, sono messe in atto specifiche misure per
prevenire la trasmissione di infezioni ai pazienti. Queste misure includono:
- un’attenta selezione dei donatori di sangue e di plasma per assicurare che i donatori potenzialmente infetti vengano esclusi;
- il controllo di ogni donazione e pool (insieme di più donazioni) di plasma per evidenziare eventuali presenze di virus/infezioni;
- l’introduzione nei processi di lavorazione del sangue e del plasma di alcuni passaggi capaci di inattivare o rimuovere i virus.
Nonostante queste misure, quando si somministrano specialità medicinali preparate da sangue o plasma
umano la possibilità di trasmissione di agenti infettivi non può essere totalmente esclusa. Ciò vale anche per
virus, o altri tipi di agenti infettivi, emergenti o sconosciuti. Le misure prese sono considerate efficaci per i
virus con involucro lipidico come il virus dell’immunodeficienza umana (HIV), il virus dell’epatite B
(HBV), il virus dell’epatite C (HCV) ed il virus privo di involucro lipidico dell’epatite A (HAV). Le misure
prese possono avere un effetto limitato contro i virus senza involucro lipidico come il parvovirus B19.
L’infezione da parvovirus B19 può essere grave in gravidanza (infezione fetale) ed in individui il cui sistema
immunitario è depresso o che hanno alcuni tipi di anemia (es. anemia falciforme o anemia emolitica).
È fortemente consigliato che ogni volta che Lei riceve una dose di EMOWIL, sia il nome che il numero di
lotto del prodotto siano registrati, in modo tale da mantenere la tracciabilità del lotto utilizzato.
Il suo medico può consigliarle di prendere in considerazione una vaccinazione contro l’epatite A e B se lei
riceve regolarmente/ripetutamente fattore VIII della coagulazione derivato da plasma umano.
Bambini
Non sono disponibili dati specifici sulla popolazione pediatrica.
Altri medicinali e EMOWIL
Informi il medico o il farmacista se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi
altro medicinale.
Non sono state riportate interazioni fra prodotti a base di fattore VIII della coagulazione umano ed altri
prodotti medicinali.
Gravidanza, allattamento e fertilità
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte
materno chieda consiglio al medico o al farmacista prima di prendere questo medicinale.
Non sono stati condotti studi sulla riproduzione animale con fattore VIII. In base al raro manifestarsi
dell’emofilia A nelle donne, non sono disponibili dati sull’uso del fattore VIII durante la gravidanza e
l’allattamento. Quindi, il fattore VIII deve essere usato durante la gravidanza e l’allattamento solo se
chiaramente indicato.
Guida di veicoli e utilizzo di macchinari
EMOWIL non ha effetto sulla capacità di guidare e di usare macchinari.
EMOWIL contiene sodio
Questo medicinale contiene fino ad un massimo di 41 mg di sodio (componente principale del sale da
cucina) per il flaconcino da 10 ml.
Questo equivale al 2,05% dell'assunzione massima giornaliera raccomandata con la dieta di un adulto.
3. Come usare EMOWIL
Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha dubbi
consulti il medico o il farmacista.
La dose raccomandata e la durata della terapia sostitutiva dipendono dalla gravità della deficienza di fattore
VIII, dalla localizzazione ed entità dell'emorragia e dalla Sua condizione clinica.
Il prodotto deve essere somministrato per via endovenosa, per iniezione o infusione lenta.
La velocità di infusione deve essere valutata sulla base delle Sue caratteristiche individuali.
EMOWIL non deve essere mescolato con altri prodotti medicinali.
Trattamento su richiesta
La quantità di medicinale e la frequenza delle somministrazioni che Lei deve ricevere devono essere stabilite
in base alla sua risposta clinica.
Trattamento di prevenzione
Se Lei è affetto da una grave emofilia A e necessita di un trattamento di prevenzione a lungo termine delle
emorragie le dosi usuali sono da 20 a 40 UI (Unità Internazionali) di fattore VIII per Kg di peso corporeo a
intervalli di 2 – 3 giorni. In alcuni casi, Se Lei è giovane, possono essere necessari intervalli terapeutici più
brevi o dosi più elevate.
Lei deve essere attentamente controllato per il possibile sviluppo di inibitori del fattore VIII mediante
opportune osservazioni cliniche ed esami di laboratorio.
Durante il corso del trattamento, è richiesta una valutazione appropriata dei livelli di fattore VIII per regolare
la dose e la frequenza delle infusioni ripetute. In particolare nel caso di grandi interventi chirurgici è
indispensabile che la Sua terapia sia controllata tramite l’esecuzione di esami (analisi) della coagulazione
(attività plasmatica del fattore VIII).
Devono essere usati solo i dispositivi per l’iniezione/infusione acclusi alla confezione, in quanto si può avere
un fallimento del trattamento perché una parte del fattore VIII può rimanere sulle pareti di alcuni dispositivi.
Si raccomanda nel caso dell'iniezione endovenosa un tempo di somministrazione compreso tra 3 e 5 minuti,
controllare il polso e interrompere o diminuire la velocità d'iniezione se la frequenza del polso aumenta.
Uso nei bambini
La sicurezza e l’efficacia di EMOWIL nei bambini di età inferiore ai 6 anni non sono state ancora stabilite.
Ricostituzione della polvere con il solvente:
- 1. portare il flaconcino della polvere e del solvente a temperatura ambiente;
- 2. tale temperatura deve essere mantenuta durante l’intero processo di ricostituzione (al massimo 10 minuti);
- 3. togliere le capsule di protezione dei flaconcini di polvere e di solvente;
- 4. pulire con alcool le superfici dei tappi dei due flaconcini;
- 5. aprire la confezione del dispositivo togliendo la parte superiore; fare attenzione a non toccare l’interno (fig. A);
- 6. non rimuovere il dispositivo dalla confezione;
- 7. capovolgere la scatola del dispositivo ed inserire il puntale in plastica attraverso il tappo del flaconcino di solvente in modo che la parte blu del dispositivo sia collegata al flaconcino del solvente (fig. B);
- 8. afferrare il bordo della scatola del dispositivo e sfilarla liberando il dispositivo senza toccarlo (fig. C);
- 9. assicurarsi che il flaconcino contenente la polvere sia posizionato su un piano d’appoggio sicuro; capovolgere il sistema in modo che il flaconcino del solvente si venga a trovare sopra il dispositivo; spingere l’adattatore trasparente sul tappo del flaconcino contenente la polvere in modo che il puntale in plastica attraversi il tappo del flaconcino della polvere; il solvente verrà automaticamente aspirato all’interno del flaconcino di polvere (fig. D);
- 10. dopo il trasferimento del solvente, svitare la parte blu del sistema di trasferimento con attaccato il flaconcino del solvente e rimuoverlo (fig. E);
- 11. far ruotare delicatamente il flaconcino fino a che la polvere non sarà interamente disciolta. Non agitare vigorosamente il flaconcino per evitare la formazione di schiuma (fig. F).
Verificare che la polvere sia completamente disciolta altrimenti si ha una perdita di attività del prodotto.
fig. A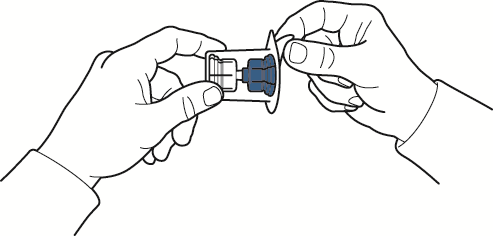 | o fig. B c a m r a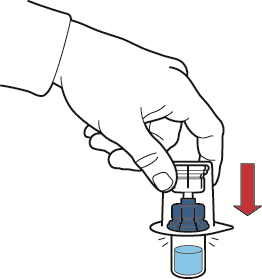 |
fig. C n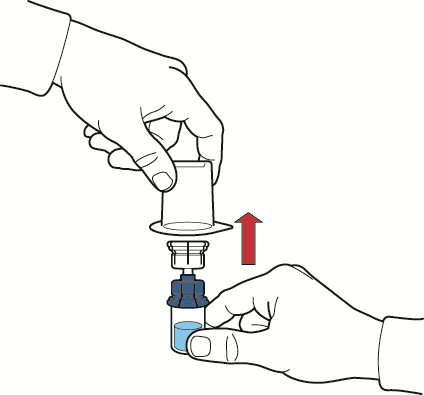 | F fig. D l e d a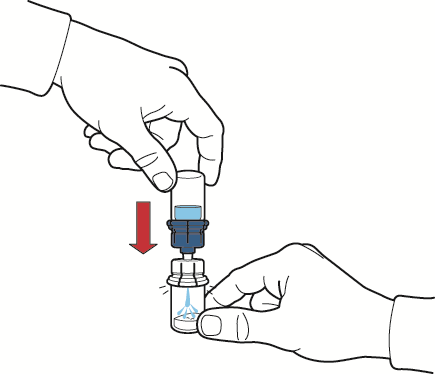 |
a fig. E i l a t I a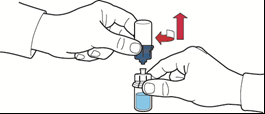 | fig. F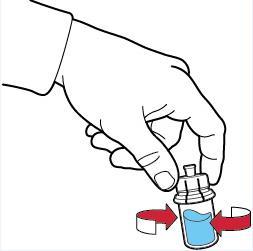 |
.
Somministrazione della soluzione
Il medicinale ricostituito deve essere ispezionato visivamente prima della somministrazione per individuare
corpuscoli o alterazioni cromatiche. La soluzione deve essere limpida o leggermente opalescente. Non usare
soluzioni torbide o che presentano depositi.
- 1. Riempire d’aria la siringa tirando indietro lo stantuffo, collegarla al dispositivo ed iniettare l’aria nel flaconcino della polvere contenente la soluzione ricostituita (fig. G);
- 2. tenendo fermo lo stantuffo, capovolgere il sistema in modo che il flaconcino della polvere con la soluzione ricostituita si venga a trovare sopra il dispositivo ed aspirare il concentrato nella siringa tirando indietro lo stantuffo lentamente (fig. H);
- 3. scollegare la siringa ruotandola in senso antiorario;
- 4. ispezionare visivamente la soluzione nella siringa, che dovrà presentarsi limpida o leggermente opalescente e priva di corpuscoli;
- 5. collegare l’ago a farfalla alla siringa ed infondere od iniettare lentamente per via endovenosa.
fig. G n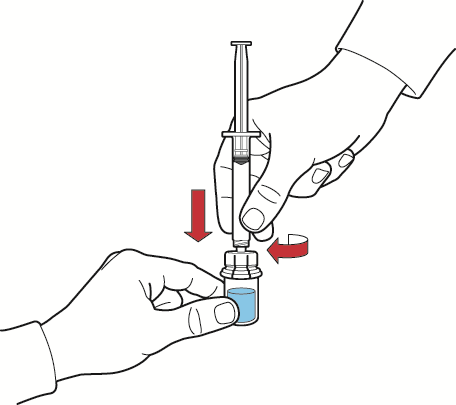 | a fig. H F l e d a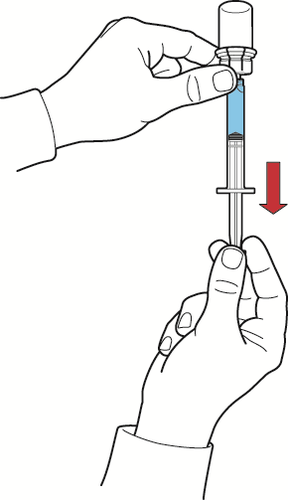 |
Una volta che i flaconcini sono stati aperti, il contenuto deve essere usato immediatamente.
La soluzione ricostituita e trasferita nella siringa deve essere somministrata immediatamente.
Il contenuto del flaconcino deve essere adoperato in un’unica somministrazione.
Non usare dopo la data di scadenza riportata sull'etichetta.
Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla
normativa locale vigente.
Se usa più EMOWIL di quanto deve
Le conseguenze di un uso eccessivo del prodotto non sono note.
In caso di ingestione/assunzione accidentale di una dose eccessiva di EMOWIL, avverta immediatamente il
medico o si rivolga al più vicino ospedale.
Se ha qualsiasi dubbio sull’uso di EMOWIL, si rivolga al medico o al farmacista.
Maggiori informazioni in merito al dosaggio ed alla durata della terapia sono inserite alla fine del
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati, sebbene non tutte le persone li
manifestino.
Se si presenta uno di questi effetti indesiderati, contatti immediatamente il medico o si rivolga al più
vicino ospedale:
- Reazioni allergiche (ipersensibilità) gravi: rapida insorgenza di gonfiore delle mucose e della regione del volto e della bocca (angioedema). Tale effetto indesiderato è stato osservato raramente e in alcuni casi può portare a gravi reazioni allergiche acute (fino allo shock anafilattico).
- Sviluppo di anticorpi neutralizzanti diretti contro il fattore VIII (inibitori). La presenza di questi inibitori si manifesta come una insufficiente risposta alla terapia. In tali casi, è consigliabile contattare un centro specializzato nel trattamento dell’emofilia.
Altri effetti indesiderati:
- Altre reazioni allergiche (ipersensibilità) possono comprendere: sensazione di bruciore e dolore pungente in sede di infusione; brividi, rossore, eruzione cutanea in tutto il corpo (orticaria generalizzata), ponfi; mal di testa (cefalea); abbassamento della pressione del sangue (ipotensione), irrequietezza, battito cardiaco accelerato (tachicardia), senso di costrizione toracica, respiro sibilante; stato di sonnolenza (letargia); nausea, vomito; formicolio (parestesie). Questi effetti indesiderati sono stati osservati raramente e in alcuni casi possono portare a gravi reazioni allergiche acute (fino allo shock anafilattico).
- È stata anche osservata febbre.
Per i bambini non trattati in precedenza con medicinali a base di fattore VIII, la formazione di anticorpi
inibitori (vedere paragrafo 2) può essere molto comune (più di 1 paziente su 10); tuttavia, nei pazienti che
hanno ricevuto un trattamento precedente con il fattore VIII (più di 150 giorni di trattamento) il rischio è non
comune (meno di 1 paziente su 100). Se ciò accade il medicinale suo o di suo figlio potrebbe smettere di
agire correttamente e lei o suo figlio potreste riscontrare un’emorragia persistente. Se ciò accade, deve
contattare il medico immediatamente.
Effetti indesiderati aggiuntivi nei bambini
Sebbene non siano disponibili dati specifici per la popolazione pediatrica, i pochi dati pubblicati relativi a
studi di efficacia e sicurezza non hanno dimostrato differenze significative tra adulti e bambini affetti dalla
medesima patologia.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al
medico o al farmacista. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema
nazionale di segnalazione all’indirizzo https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse .
Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di
questo medicinale.
Per informazioni sulla sicurezza riguardo agli agenti trasmissibili vedere il punto 2 “ Cosa deve sapere prima
di usare EMOWIL”.
5. Come conservare EMOWIL
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini. Non usi questo medicinale dopo la
data di scadenza che è riportata sull’etichetta e sull’imballaggio esterno dopo “Scad.”. La data di scadenza si
riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 C - 8 C). Non congelare. Tenere il flaconcino nell’imballaggio esterno, per
proteggerlo dalla luce.
Una volta che il contenitore per l'infusione è stato aperto, il contenuto deve essere usato immediatamente. Il
contenuto del flaconcino deve essere utilizzato in una unica somministrazione.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare
i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene EMOWIL
Il principio attivo è il fattore VIII della coagulazione del plasma umano.
| d EMOWIL 500 UI/10 ml | EMOWIL 1000 UI/10 ml | |
| fattore VIII della coagulazione del plasma umano | 500 UI/flaconcino | 1000 UI/ flaconcino |
| fattore VIII della coagulazione del plasma umano ricostituito con acqua per preparazioni iniettabili | a 50 UI/ ml (500 UI/10 ml) | 100 UI/ ml (1000 UI/10 ml) |
| volume solvente | n 10 ml | 10 ml |
L’attività specifica di EMOWIL è circa 80 UI/mg di proteine.
Prodotto da plasma di donatori umani.
Questa preparazione contiene fattore di von Willebrand 400 UI/1000 UI di fattore VIII umano .
Gli altri componenti sono: sodio cloruro, sodio citrato tribasico, glicina, calcio cloruro (eccipienti).
Il flaconcino di solvente contiene acqua per preparazioni iniettabili.
Descrizione dell’aspetto di EMOWIL e contenuto della confezione
Polvere e solvente per soluzione per infusione.
Dopo la ricostituzione la soluzione può contenere pochi piccoli filamenti o particelle.
Il prodotto medicinale ricostituito (disciolto) deve essere ispezionato visivamente prima della
somministrazione per individuare particelle in sospensione o colorazione anormale. La soluzione deve essere
limpida o leggermente opalescente. Non usi EMOWIL se nota che la soluzione è torbida o ha dei depositi.
La confezione di EMOWIL contiene un flaconcino di polvere, un flaconcino di solvente con cui viene
preparata la soluzione da somministrare e un set sterile e apirogeno, monouso, costituito da un dispositivo
per la ricostituzione, da una siringa per iniezione e da un ago a farfalla con tubicino in PVC.
Titolare dell’autorizzazione all’immissione in commercio
Kedrion S.p.A. – Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca).
Produttore
Kedrion S.p.A. – 55027 Bolognana, Gallicano (Lucca).
------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Monitoraggio del trattamento
Durante il corso del trattamento, è richiesta una determinazione appropriata dei livelli di fattore VIII per
regolare la dose da somministrare e la frequenza di ripetizione delle infusioni. La risposta al fattore VIII può
variare nei singoli pazienti, mostrando emivite e recuperi differenti. Il dosaggio calcolato in base al peso
corporeo può richiedere un aggiustamento nei pazienti sottopeso o sovrappeso.
In particolare nel caso di grandi interventi chirurgici è indispensabile controllare precisamente la terapia
sostitutiva per mezzo di analisi della coagulazione (attività plasmatica del fattore VIII).
Quando si utilizza un test di coagulazione in vitro “one-stage” basato sul tempo di tromboplastina (aPTT) per
la determinazione dell’attività del fattore VIII nei campioni ematici dei pazienti, i risultati dell’attività del
fattore VIII plasmatico possono essere influenzati in maniera significativa sia dal tipo di reagente aPTT che
dallo standard di riferimento utilizzato nel test. Inoltre, possono esserci discrepanze significative tra i risultati
del test ottenuti con un test di coagulazione “one-stage” basato sul aPTT e il test cromogenico secondo
Farmacopea Europea. Ciò è importante in particolar modo quando si cambiano il laboratorio e/o i reagenti
utilizzati nel test.
Dosaggio
Il dosaggio e la durata della terapia sostitutiva dipendono dalla gravità della deficienza di fattore VIII, dalla
localizzazione ed entità dell'emorragia e dalla condizione clinica del paziente.
Il numero di unità di fattore VIII somministrate è espresso in Unità Internazionali (UI), che sono correlate
allo standard attuale dell’OMS per prodotti del fattore VIII. L’attività del fattore VIII nel plasma è espressa o
come percentuale (relativa al plasma umano normale) o in Unità Internazionali (relative ad uno standard
internazionale per il fattore VIII plasmatico).
L'attività di una Unità Internazionale di fattore VIII è equivalente alla quantità di fattore VIII contenuta in un
millilitro di plasma umano normale.
Trattamento su richiesta
Il calcolo della dose di fattore VIII necessaria si basa sulla osservazione empirica che 1 Unità Internazionale
(UI) di fattore VIII per Kg di peso corporeo aumenta l'attività del fattore VIII plasmatico da 1,5% a 2%
dell’attività normale. La dose necessaria viene determinata usando la seguente formula:
Unità necessarie = peso corporeo (Kg) x aumento desiderato di fattore VIII (%) (UI/dl) x reciproco del
recupero osservato
La quantità da somministrare e la frequenza delle applicazioni devono essere sempre guidate dall'efficacia
clinica del singolo caso.
Nel caso dei seguenti eventi emorragici, l'attività del fattore VIII nel periodo corrispondente non deve
scendere al di sotto del dato livello di attività plasmatica (in % del normale). La seguente tabella può essere
usata come riferimento in episodi emorragici e chirurgici:
| Grado di emorragia/ Tipo di procedura chirurgica | Livello di fattore VIII necessario (%) (UI/dl) | a m Frequenza delle dosi (ore)/ Durata della terapia (giorni) |
| Emorragia Emartro precoce, emorragia muscolare o emorragia orale Emartro più estesa, emorragia muscolare o ematoma Emorragie a rischio di vita |
| r a Ripetere da 12 a 24 ore. Almeno 1 giorno, finché l'episodio emorragico F indicato dal dolore è risolto o si è raggiunta la guarigione. Ripetere l’infusione ogni 12 - 24 ore l per 3 – 4 giorni o più, finché il dolore e e l’invalidità grave sono passati. d Ripetere l’infusione da 8 a 24 ore finché il sintomo è passato. |
| Chirurgia Chirurgia minore incluse estrazioni dentarie | a
| Ogni 24 ore, almeno 1 giorno, fino alla guarigione. |
| Chirurgia maggiore | a
| Ripetere l’infusione da 8 a 24 ore fino ad una adeguata guarigione della ferita, poi terapia per almeno altri 7 giorni per mantenere un’attività di fattore VIII da 30% a 60% (30 UI/dl
|
Profilassi
Per la profilassi a lungo termine delle emorragie in pazienti con grave emofilia A le dosi usuali sono da 20 a
40 UI di fattore VIII per kg di peso corporeo a intervalli di 2 – 3 giorni. In alcuni casi, specialmente per i
pazienti più giovani, possono essere necessari intervalli terapeutici più brevi o dosi più elevate.
Popolazione pediatrica
La sicurezza e l’efficacia di EMOWIL nei bambini di età inferiore ai 6 anni non sono state ancora stabilite.
Metodo di somministrazione
Uso endovenoso, per iniezione o infusione lenta.
Si raccomanda nel caso dell'iniezione endovenosa un tempo di somministrazione compreso tra 3 e 5 minuti,
controllando il polso del paziente e interrompendo o diminuendo la velocità d'iniezione se la frequenza del
polso aumenta.
La velocità di infusione deve essere valutata per ogni singolo paziente
Sciogliere la polvere come descritto nella sezione “ 3. Come usare EMOWIL” al paragrafo “ Istruzioni per un
uso corretto”.
Inibitori
In generale, tutti i pazienti trattati con prodotti a base di fattore VIII della coagulazione devono essere
attentamente controllati per lo sviluppo di inibitori mediante appropriata osservazione clinica ed esami di
laboratorio. Se i livelli di attività plasmatica di fattore VIII attesi non sono raggiunti, o se l’emorragia non è
controllata con una dose appropriata, deve essere eseguito un esame per la presenza di inibitori del fattore
VIII. In pazienti con alti livelli di inibitore, la terapia con fattore VIII può non essere efficace ed altre opzioni
terapeutiche devono essere prese in considerazione. Il trattamento di tali pazienti deve essere diretto da un
medico con esperienza nel trattamento dell’emofilia e degli inibitori del fattore VIII.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a EMOWILForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: BAXALTA INNOVATIONS GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 1000 UIPrincipio attivo: coagulation factor VIIIProduttore: CSL BEHRING GMBHPrescrizione richiesta
Medici online per EMOWIL
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di EMOWIL — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.














