
VIHUMA

Come usare VIHUMA
Tradotto con IA
Questa pagina fornisce informazioni generali e non sostituisce la consultazione di un medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Rivolgiti ai servizi di emergenza se i sintomi sono gravi.
Mostra originaleVihuma 250 UI polvere e solvente per soluzione iniettabile, 500 UI polvere e solvente per soluzione iniettabile, 1.000 UI polvere e solvente per soluzione iniettabile, 2.000 UI polvere e solvente per soluzione iniettabile, 2.500 UI polvere e solvente per soluzione iniettabile, 3.000 UI polvere e solvente per soluzione iniettabile, 4.000 UI polvere e solvente per soluzione iniettabile
simoctocog alfa (fattore VIII della coagulazione umano ricombinante)
Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico.
- Questo medicinale è stato prescritto soltanto per lei. Non lo dia ad altre persone, anche se i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Vedere paragrafo 4.
Contenuto di questo foglio:
- 1. Cos’è Vihuma e a cosa serve
- 2. Cosa deve sapere prima di usare Vihuma
- 3. Come usare Vihuma
- 4. Possibili effetti indesiderati
- 5. Come conservare Vihuma
- 6. Contenuto della confezione e altre informazioni
1. Cos’è Vihuma e a cosa serve
Vihuma contiene come principio attivo il fattore VIII della coagulazione umano ricombinante
(chiamato anche simoctocog alfa). Il fattore VIII è necessario affinché il sangue possa formare coaguli
e si interrompa il sanguinamento. Nei pazienti affetti da emofilia A (deficit congenito del fattore VIII),
il fattore VIII è assente o non svolge correttamente le proprie funzioni.
Vihuma sostituisce il fattore VIII mancante così che il sangue possa coagulare normalmente e può
essere usato in tutte le fasce di età per trattare e prevenire le emorragie (sanguinamenti) nei pazienti
con emofilia A.
2. Cosa deve sapere prima di usare Vihuma
Non usi Vihuma
- se è allergico al principio attivo simoctocog alfa o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6). Nel caso in cui non ne fosse certo, si rivolga al medico.
Avvertenze e precauzioni
Si rivolga al medico prima di usare Vihuma.
Vi è una rara possibilità che lei possa manifestare anafilassi (una grave e improvvisa reazione
allergica) a Vihuma. Lei deve conoscere i primi segni delle reazioni allergiche elencati nel paragrafo 4
“Reazioni allergiche”.
Qualora si manifestasse uno qualsiasi di questi sintomi, interrompa immediatamente l’iniezione e si
rivolga al medico.
La formazione di inibitori (anticorpi) è una complicanza nota che può verificarsi durante il trattamento
con tutti i medicinali a base di fattore VIII. Gli inibitori, soprattutto a livelli elevati, impediscono al
trattamento di agire correttamente e lei o suo figlio sarete sottoposti a un attento monitoraggio per
verificare lo sviluppo di questi inibitori. Se Vihuma non mantiene sotto controllo l’emorragia sua o di
suo figlio, informi il medico immediatamente.
Eventi cardiovascolari
In pazienti con esistenti fattori di rischio cardiovascolare, la terapia sostitutiva con il fattore VIII può
aumentare il rischio cardiovascolare.
Complicazioni correlate a catetere
Se è necessario ricorrere a un dispositivo di accesso venoso centrale (CVAD), si deve prendere in
considerazione il rischio di complicazioni collegate al CVAD tra cui infezioni locali, presenza di
batteri nel sangue e trombosi a carico del sito di cateterizzazione.
Tracciabilità
È importante conservare il numero di lotto di Vihuma assunto.
Di conseguenza, ogni volta che riceve una nuova confezione di Vihuma, annoti la data e il numero di
lotto (che è riportato sulla confezione dopo {Lotto}) e conservi questa informazione in un luogo sicuro.
Altri medicinali e Vihuma
Informi il medico se sta usando, ha recentemente usato o potrebbe usare qualsiasi altro medicinale.
Gravidanza e allattamento
Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con
latte materno chieda consiglio al medico prima di usare questo medicinale.
Guida di veicoli e utilizzo di macchinari
Vihuma non altera la capacità di guidare veicoli e di usare macchinari.
Vihuma contiene sodio
Questo medicinale contiene 18,4 mg di sodio (componente principale del sale da cucina) per
flaconcino. Questo equivale allo 0,92% dell'assunzione massima giornaliera raccomandata con la dieta
di un adulto.
3. Come usare Vihuma
Il trattamento con Vihuma sarà iniziato da un medico esperto nella cura di pazienti affetti da emofilia
- A. Usi questo medicinale seguendo sempre esattamente le istruzioni del medico o dell’infermiere. Se ha dubbi consulti il medico o l’infermiere.
Vihuma è solitamente iniettato in vena (via endovenosa) dal medico o da un infermiere. Anche lei o
qualcun altro può provvedere alla somministrazione di Vihuma mediante iniezione, ma ciò solo dopo
un addestramento adeguato.
Il medico calcolerà la dose di Vihuma (in unità internazionali = UI) sulla base delle sue condizioni
cliniche e del suo peso corporeo, e sulla base dell’uso previsto del medicinale (prevenzione o
trattamento di emorragie). Quante volte le sarà necessario provvedere all’iniezione dipende dal grado
di efficacia che Vihuma ha su di lei. Normalmente, la terapia dell’emofilia A va proseguita a vita.
Prevenzione delle emorragie
La dose consueta di Vihuma è di 20-40 UI per kg di peso corporeo, somministrate ogni 2-3 giorni.
Tuttavia, in alcuni casi, soprattutto nei pazienti più giovani, possono essere necessarie più iniezioni o
dosi più elevate.
Trattamento delle emorragie
La dose di Vihuma è calcolata sulla base del suo peso corporeo e delle concentrazioni di fattore VIII
da raggiungere. Le concentrazioni target di fattore VIII dipendono dalla gravità e dall’ubicazione
dell’emorragia.
Se ha l’impressione che Vihuma non funzioni abbastanza bene, ne parli con il medico. Il medico
eseguirà le analisi di laboratorio adeguate per sincerarsi che le concentrazioni di fattore VIII siano
sufficienti. Ciò è di particolare importanza nel caso in cui lei si dovesse sottoporre a un intervento
chirurgico maggiore.
Pazienti che sviluppano inibitori del fattore VIII
Se il fattore VIII non riesce a raggiungere le concentrazioni previste con Vihuma o se l’emorragia non
è adeguatamente controllata, ciò può essere dovuto allo sviluppo di inibitori del fattore VIII. Il medico
provvederà ai controlli del caso. Lei può avere bisogno di una dose di Vihuma più alta o di un prodotto
diverso per controllare l’emorragia. Non aumenti la dose totale di Vihuma per controllare gli episodi
emorragici senza aver consultato il medico.
Uso nei bambini e negli adolescenti
La modalità d’uso di Vihuma nei bambini e negli adolescenti non è diversa dalla modalità prevista per
gli adulti. Poiché i medicinali a base di fattore VIII possono dover essere somministrati con maggiore
frequenza nei bambini e negli adolescenti, può rendersi necessario l’uso di un dispositivo di accesso
venoso centrale (CVAD). Un CVAD è un connettore esterno che consente di somministrare medicinali
nel flusso sanguigno senza dover praticare l’iniezione attraverso la pelle.
Se usa più Vihuma di quanto deve
Non sono stati segnalati sintomi da sovradosaggio. Se ha iniettato più Vihuma di quanto deve, ne
informi il medico.
Se dimentica di usare Vihuma
Non prenda una dose doppia per compensare la dimenticanza della dose. Procedere immediatamente
alla dose successiva e continuare come consigliato dal medico.
Se interrompe il trattamento con Vihuma
Non interrompa il trattamento con Vihuma senza aver consultato il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o all’infermiere.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone
li manifestino.
Smetta immediatamente di usare questo medicinale e si rivolga urgentemente a un medico se:
- nota sintomi di una reazione allergicaLe reazioni allergiche possono includere eruzione cutanea, orticaria (eruzione cutanea pruriginosa), inclusa orticaria generalizzata, gonfiore delle labbra o della lingua, fiato corto, respiro sibilante, costrizione toracica, vomito, irrequietezza, pressione sanguigna bassa e capogiri. Questi possono essere sintomi precoci di uno shock anafilattico. Se si verificano reazioni allergiche gravi e improvvise (anafilattiche) (molto rare: possono interessare 1 utilizzatore su 10.000), l’iniezione deve essere interrotta immediatamente, e deve contattare subito il medico. I sintomi gravi richiedono un trattamento d’emergenza tempestivo.
- nota che il medicinale smette di agire correttamente (l’emorragia non viene arrestata odiventa frequente)Per i bambini e gli adolescenti non trattati in precedenza con medicinali a base di fattore VIII, la formazione di anticorpi inibitori (vedere paragrafo 2) può essere molto comune (più di 1 paziente su 10).
Tuttavia, nei pazienti che hanno ricevuto un trattamento precedente con il fattore VIII (più di
150 giorni di trattamento) il rischio è non comune (meno di 1 paziente su 100). Se ciò accade,
il medicinale suo o di suo figlio può smettere di agire correttamente e lei o suo figlio potete
riscontrare un’emorragia persistente. Se ciò accade, deve contattare il medico
immediatamente.
Effetti indesiderati comuni possono interessare fino a 1 utilizzatore su 10
Ipersensibilità, febbre.
Effetti indesiderati non comuni possono interessare fino a 1 utilizzatore su 100
Formicolio o torpore (parestesia), mal di testa, capogiri, vertigini, dispnea, bocca secca, mal di
schiena, infiammazione del sito di iniezione, dolore del sito di iniezione, una vaga sensazione di
disagio fisico (malessere), anemia emorragica, anemia, dolore al torace, positività agli anticorpi non
neutralizzanti (nei pazienti trattati in precedenza).
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga
al medico. Può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di
segnalazione riportato nell’allegato V . Segnalando gli effetti indesiderati può contribuire a fornire
maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Vihuma
Conservi questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che è riportata sull’etichetta della scatola e del
flaconcino dopo EXP. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Conservare in frigorifero (2 °C – 8 °C). Non congelare. Conservare il flaconcino nella confezione
originale per proteggere il medicinale dalla luce.
Prima che Vihuma polvere sia sciolto nel solvente, può essere conservato a temperatura ambiente (fino
a 25°C) per un periodo di tempo non superiore a 1 mese. Registri l’inizio del periodo di conservazione
di Vihuma a temperatura ambiente sulla confezione. Non conservi nuovamente Vihuma in frigorifero
dopo averlo conservato a temperatura ambiente.
Usi la soluzione immediatamente dopo averla ricostituita.
Non usi il medicinale se nota segni visibili di deterioramento del sigillo anti-manomissione
dell’imballaggio, in particolare della siringa e/o del flaconcino.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come
eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni
Cosa contiene Vihuma
Polvere:
- Il principio attivo è fattore VIII della coagulazione umano ricombinante (simoctocog alfa). Ciascun flaconcino di polvere contiene 250, 500, 1.000, 2.000, 2.500, 3.000 o 4.000 UI di simoctocog alfa.
- Ogni soluzione ricostituita contiene circa 100, 200, 400, 800, 1.000, 1.200 o 1.600 UI/mL di simoctocog alfa.
- Gli altri componenti sono saccarosio, sodio cloruro, calcio cloruro biidrato, arginina cloridrato, sodio citrato biidrato, poloxamer 188. Vedere paragrafo 2, "Vihuma contiene sodio".
Solvente:
Acqua per preparazioni iniettabili
Descrizione dell’aspetto di Vihuma e contenuto della confezione
Vihuma viene fornito come polvere e solvente per soluzione iniettabile. È una polvere di colore da
bianco ad avorio in un flaconcino di vetro. Il solvente è acqua per preparazioni iniettabili in una
siringa di vetro preriempita.
Dopo la ricostituzione, la soluzione è limpida, incolore e priva di particelle estranee.
Ogni confezione di Vihuma contiene:
- 1 flaconcino di polvere con 250, 500, 1.000, 2.000, 2.500, 3.000 o 4.000 UI di simoctocog alfa.
- 1 siringa preriempita con 2,5 mL di acqua per preparazioni iniettabili
- 1 adattatore per flaconcino
- 1 ago a farfalla
- 2 tamponi monouso imbevuti di alcol
Titolare dell’autorizzazione all’immissione in commercio e produttore
Octapharma AB, Lars Forssells gata 23, 112 75 Stockholm, Svezia
Per ulteriori informazioni su questo medicinale, contatti il rappresentante locale del titolare
dell’autorizzazione all’immissione in commercio:
België/Belgique/Belgien
Biotest AG (Germany)
Tél/Tel: +49 6103 801-0
Lietuva
Biotest AG (Germany)
Tel: +49 6103 801-0
България
Biotest AG (Germany)
Teл.: +49 6103 801-0
Luxembourg/Luxemburg
Biotest AG (Germany)
Tél/Tel: +49 6103 801-0
Česká republika
Biotest AG (Germany)
Tel: +49 6103 801-0
Magyarország
Biotest AG (Germany)
Tel: +49 6103 801-0
Danmark
Biotest AG (Germany)
Tlf: +49 6103 801-0
Malta
Biotest AG (Germany)
Tel: +49 6103 801-0
Deutschland
Biotest AG (Germany)
Tel: +49 6103 801-0
Nederland
Biotest AG (Germany)
Tel: +49 6103 801-0
Eesti
Biotest AG (Germany)
Tel: +49 6103 801-0
Norge
Biotest AG (Germany)
Tlf: +49 6103 801-0
Ελλάδα
Biotest AG (Germany)
Τηλ: +49 6103 801-0
Österreich
Biotest Austria GmbH
Tel: +43 1 545 15 61-0
España
Biotest AG (Germany)
Tel: +49 6103 801-0
Polska
Biotest AG (Germany)
Tel: +49 6103 801-0
France
Biotest AG (Germany)
Portugal
Biotest AG (Germany)
Tél: +49 6103 801-0 Tel: +49 6103 801-0
Hrvatska
Biotest AG (Germany)
Tél: +49 6103 801-0
România
Biotest AG (Germany)
Tel: +49 6103 801-0
Ireland
Biotest AG (Germany)
Tel: +49 6103 801-0
Slovenija
Biotest AG (Germany)
Tel: +49 6103 801-0
Ísland
Biotest AG (Germany)
Sími: +49 6103 801-0
Slovenská republika
Biotest AG (Germany)
Tel: +49 6103 801-0
Italia
Biotest AG (Germany)
Tel: +49 6103 801-0
Suomi/Finland
Biotest AG (Germany)
Puh/Tel: +49 6103 801-0
Κύπρος
Biotest AG (Germany)
Τηλ: +49 6103 801-0
Sverige
Biotest AG (Germany)
Tel: +49 6103 801-0
Latvija
Biotest AG (Germany)
Tel: +49 6103 801-0
United Kingdom (Northern Ireland)
Biotest AG (Germany)
Tel: +49 6103 801-0
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea
dei medicinali: http://www.ema.europa.eu .
---------------------------------------------------------------------------------------------------------------------------
Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari:
Trattamento al bisogno
La quantità da somministrare e la frequenza di somministrazione devono essere sempre orientate
all’efficacia clinica nei singoli casi.
Nel caso degli eventi emorragici seguenti, l’attività del fattore VIII non deve calare al di sotto del
livello di attività plasmatica indicato (in % del normale o UI/dL) nel periodo corrispondente. La
tabella qui di seguito è utilizzabile per guidare il dosaggio negli episodi di sanguinamento e negli
interventi chirurgici.
Grado dell’emorragia/
Tipo di procedura chirurgica
Livello di fattore VIIIFrequenza delle dosi (ore)/ Durata
necessario (%)della terapia (giorni)
(UI/dL)
Emorragia
Emartro in fase iniziale,
emorragia muscolare o
emorragia orale
20-40 Ripetere ogni 12-24 ore per almeno
1 giorno, finché l’episodio emorragico
nella misura indicata dal dolore non si
risolve o non si giunge a guarigione.
Emartro più esteso, emorragia
muscolare o ematoma
30-60 Ripetere l’infusione ogni 12-24 ore per
3-4 giorni o più, finché il dolore e la
disabilità acuta non si risolvono.
Emorragie potenzialmente
fatali
60-100 Ripetere l’infusione ogni 8-24 ore
finché la minaccia non scompare.
Intervento chirurgico
Intervento chirurgico minore
tra cui estrazione dentaria
30-60 Ogni 24 ore, per almeno 1 giorno,
finché non si giunge a guarigione.
Ripetere l’infusione ogni 8–24 ore
finché non si raggiunge un’adeguata
guarigione della ferita, quindi terapia
per almeno 7 giorni per mantenere
un’attività del fattore VIII del 30-60%
(UI/dL).
Intervento chirurgico maggiore 80-100
(pre- e postoperatorio)
ISTRUZIONI PER LA PREPARAZIONE E LA SOMMINISTRAZIONE
- 1. Lasciare che la siringa con il solvente (acqua per preparazioni iniettabili) e la polvere nel flaconcino chiuso raggiungano la temperatura ambiente. È possibile farlo tenendoli fra le mani finché non ne avranno raggiunto lo stesso grado di calore. Non riscaldare il flaconcino e la siringa preriempita in nessun altro modo. Questa temperatura va mantenuta durante la ricostituzione.
- 2. Rimuovere la capsula di chiusura a strappo dal flaconcino della polvere esponendo la parte centrale del tappo in gomma. Non rimuovere il tappo grigio o l’anello metallico attorno alla parte superiore del flaconcino.
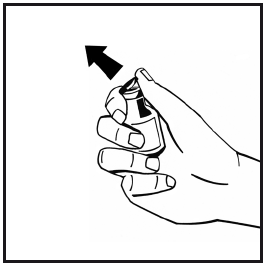
- 3. Strofinare la parte superiore del flaconcino con un tampone monouso imbevuto di alcol. Lasciare che l’alcol si asciughi.
- 4. Togliere il rivestimento in carta dalla confezione dell’adattatore per flaconcino. Lasciare l’adattatore nella confezione.
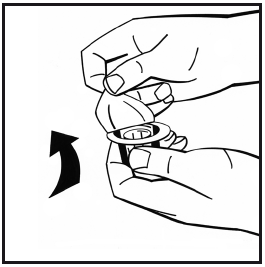
- 5. Collocare il flaconcino di polvere su una superficie piana e tenerlo fermo. Prendere la confezione dell’adattatore e collocare l’adattatore per flaconcino sul centro del tappo in gomma del flaconcino di polvere. Spingere energicamente la confezione dell’adattatore finché la punta dell’adattatore non penetra nel tappo in gomma. L’adattatore si aggancia sul flaconcino quando ciò avviene.
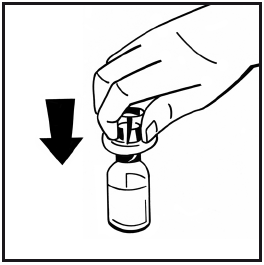
- 6. Togliere il rivestimento in carta dalla confezione della siringa preriempita. Afferrare lo stantuffo all’estremità e non toccare il corpo della siringa. Avvitare l’estremità filettata dello stantuffo sullo stantuffo della siringa con il solvente girando lo stantuffo in senso orario finché non si incontra una lieve resistenza.
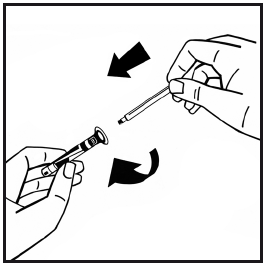
- 7. Togliere la punta di plastica anti-manomissione dall’altra estremità della siringa con il solvente staccando la perforazione della capsula di chiusura. Non toccare l’interno della capsula di chiusura o la punta della siringa.
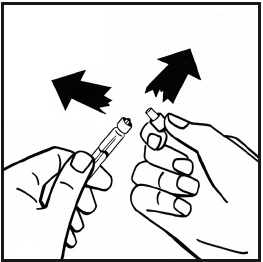
- 8. Togliere la confezione dell’adattatore dalla parte superiore del flaconcino e gettarla.
- 9. Unire saldamente la siringa con il solvente all’adattatore per flaconcino girando in senso orario finché non si incontra resistenza.
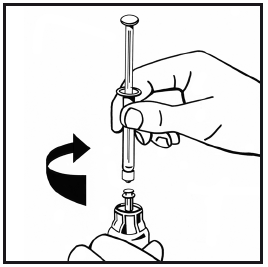
- 10. Iniettare lentamente tutto il solvente nel flaconcino della polvere abbassando lo stantuffo.
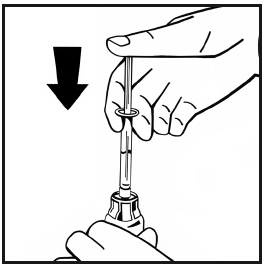
- 11. Senza rimuovere la siringa, muovere o girare delicatamente il flaconcino qualche volta con movimento circolare per sciogliere la polvere. Non agitare. Aspettare finché la polvere non si sarà sciolta del tutto.
- 12. Prima di procedere alla somministrazione, controllare se la soluzione finale contiene particelle. La soluzione deve essere limpida e incolore, pressoché priva di particelle visibili. Non usare soluzioni torbide o che presentano depositi.
- 13. Capovolgere il flaconcino fissato alla siringa e aspirare lentamente la soluzione finale nella siringa. Assicurarsi che l’intero contenuto del flaconcino sia trasferito nella siringa.
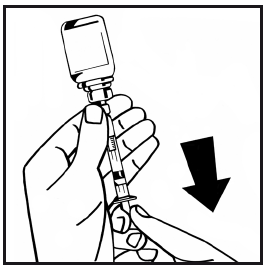
- 14. Svitare la siringa riempita dall’adattatore per flaconcino girando il flaconcino in senso antiorario e gettare il flaconcino vuoto.
- 15. Ora la soluzione è pronta e deve essere usata immediatamente. Non refrigerare.
- 16. Pulire il sito di iniezione scelto con uno dei tamponi imbevuti di alcol forniti in dotazione.
- 17. Fissare alla siringa il set per infusione fornito. Inserire l’ago dell’infusione nella vena scelta come è stato mostrato. Se è stato usato un laccio emostatico per agevolare l’individuazione della vena, questo va tolto prima di iniziare a iniettare la soluzione. Non permettere al sangue di refluire nella siringa, altrimenti potrebbe coagulare e bloccare la siringa, impedendo l’iniezione della dose corretta.
- 18. Iniettare la soluzione nella vena con una bassa velocità di infusione, non superiore a 4 mL al minuto.
Se si usa più di un flaconcino di polvere per un trattamento è possibile riutilizzare lo stesso ago del set
per infusione. L’adattatore per flaconcino e la siringa sono monouso.
- Paese di registrazione
- Principio attivo
- Prescrizione richiestaSì
- Produttore
- Queste informazioni sono solo a scopo informativo e non costituiscono un parere medico. Consulta sempre un medico prima di assumere qualsiasi medicinale. Oladoctor non è responsabile delle decisioni mediche basate su questo contenuto.
- Alternative a VIHUMAForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: TAKEDA MANUFACTURING AUSTRIA AGPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 250 UIPrincipio attivo: coagulation factor VIIIProduttore: BAXALTA INNOVATIONS GMBHPrescrizione richiestaForma farmaceutica: Polvere e solvente per soluzione iniettabile, 1000 UIPrincipio attivo: coagulation factor VIIIProduttore: CSL BEHRING GMBHPrescrizione richiesta
Medici online per VIHUMA
Valutazione del dosaggio, effetti indesiderati, interazioni, controindicazioni e rinnovo della prescrizione di VIHUMA — soggetto a valutazione medica e alle normative locali.
Domande frequenti

Rimani aggiornato su Oladoctor
Novità su nuovi servizi, aggiornamenti del prodotto e contenuti utili per i pazienti.









